Manganèse
Le manganèse (symbole Mn) est un élément chimique possédant un seul isotope stable, et dont le numéro atomique est 25. Sous forme de corps simple, le manganèse est un métal de transition, dont le solide grisâtre existe sous quatre variétés allotropiques. Plus d'une quinzaine de millions de tonnes de cet élément sont produits chaque année, pour être utilisé dans l'industrie ou l'agriculture. Dans l'industrie, le manganèse sert principalement d'élément d'alliage aux métaux ferreux ou non-ferreux, et contribue à améliorer les propriétés, mais également à produire du dioxyde de manganèse pour divers usages. En agriculture, en raison de son rôle d'oligo-élément, le manganèse est utilisé pour enrichir les sols qui en manquent. Bien qu'il soit nécessaire à l'être humain, il peut devenir toxique s'il dépasse certains seuils dans le corps.
_sulfate_close-up.jpg.webp)
| Manganèse | |||||||||||
 Fragments de manganèse pur (99,9 %), raffinés par électrolyse, à côté d'un cube d'1 cm³ | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Mn | ||||||||||
| Nom | Manganèse | ||||||||||
| Numéro atomique | 25 | ||||||||||
| Groupe | 7 | ||||||||||
| Période | 4e période | ||||||||||
| Bloc | Bloc d | ||||||||||
| Famille d'éléments | Métal de transition | ||||||||||
| Configuration électronique | [Ar] 3d5 4s2 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 13, 2 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 54,938 044 ± 0,000 003 u[1] | ||||||||||
| Rayon atomique (calc) | 140 pm (161 pm) | ||||||||||
| Rayon de covalence | 139 ± 5 pm (bas spin)[2] |
||||||||||
| Rayon de van der Waals | 126 pm | ||||||||||
| État d’oxydation | +7, +6, +4, +2, +3 | ||||||||||
| Électronégativité (Pauling) | 1,55 | ||||||||||
| Oxyde | Acide fort | ||||||||||
| Énergies d’ionisation[1] | |||||||||||
| 1re : 7,434 02 eV | 2e : 15,640 0 eV | ||||||||||
| 3e : 33,668 eV | 4e : 51,2 eV | ||||||||||
| 5e : 72,4 eV | 6e : 95,6 eV | ||||||||||
| 7e : 119,203 eV | 8e : 194,5 eV | ||||||||||
| 9e : 221,8 eV | 10e : 248,3 eV | ||||||||||
| 11e : 286,0 eV | 12e : 314,4 eV | ||||||||||
| 13e : 343,6 eV | 14e : 403,0 eV | ||||||||||
| 15e : 435,163 eV | 16e : 1 134,7 eV | ||||||||||
| 17e : 1 224 eV | 18e : 1 317 eV | ||||||||||
| 19e : 1 437 eV | 20e : 1 539 eV | ||||||||||
| 21e : 1 644 eV | 22e : 1 788 eV | ||||||||||
| 23e : 1 879,9 eV | 24e : 8 140,6 eV | ||||||||||
| 25e : 8 571,94 eV | |||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | solide | ||||||||||
| Masse volumique | 7,21 à 7,44 g·cm-3[1] | ||||||||||
| Système cristallin | Cubique centré | ||||||||||
| Dureté (Mohs) | 6 | ||||||||||
| Couleur | Blanc argenté | ||||||||||
| Point de fusion | 1 246 °C[1] | ||||||||||
| Point d’ébullition | 2 061 °C[1] | ||||||||||
| Énergie de fusion | 12,05 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 226 kJ·mol-1 | ||||||||||
| Volume molaire | 7,35×10-6 m3·mol-1 | ||||||||||
| Pression de vapeur | 121 Pa à 1 243,85 °C | ||||||||||
| Vitesse du son | 5 150 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 480 J·kg-1·K-1 | ||||||||||
| Conductivité électrique | 0,695×106 S·m-1 | ||||||||||
| Conductivité thermique | 7,82 W·m-1·K-1 | ||||||||||
| Divers | |||||||||||
| No CAS | |||||||||||
| No ECHA | 100.028.277 | ||||||||||
| No CE | 231-105-1 | ||||||||||
| Précautions | |||||||||||
| SGH[3] | |||||||||||
État pulvérulent : Danger |
|||||||||||
| SIMDUT[4] | |||||||||||
 D2A, |
|||||||||||
| Transport[5] | |||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Histoire
Étymologie et désignations
En 1831, l'ouvrage de chimie de Berzélius est à l'origine de l'introduction de l'adjectif manganeux, pour qualifier le composé MnO, le chlorure de manganèse MnCl2 qui obtient un usage en teinture pour composer le bistre de manganèse, le sulfate de manganèse MnSO4 et plus tard l'ensemble des composés de Mn(II)[6]. En 1840, le dictionnaire de l'Académie française accepte les adjectifs manganésifère qualifiant ce qui contient du manganèse et manganique, ainsi que le mot manganate, correspondant à l'anhydride manganique MnO3 et aux sels de l'acide correspondant inconnu, déjà familiers aux chimistes, comme le trisulfate de manganèse, Mn(SO4)3. L'adjectif manganique sert à qualifier les composés de Mn de valence VI.
Il semble toutefois que les adjectifs manganésé, signifiant mêlé de manganèse, et manganésien, ou contenant du Mn, cité dans le dictionnaire Larousse soient déjà communs dans les laboratoires de minéralogie et de chimie avant 1870.

Les dictionnaires Larousse attestent des mots manganine et manganite en 1873, puis du mot permanganite et de l'adjectif correspondant permanganate en 1874. Le mot manganite, outre le sens minéralogique d'oxyde naturel hydraté de manganèse de couleur gris-noir à noire, désigne des oxydes doubles de MnO2 et d'un autre sesquioxyde métallique, voire des sels dérivés de MnO2. La manganine change de genre en 1922, devenant le manganin, sans changer de signification : il correspond à l'alliage de 82 à 83 % de cuivre, de 13 à 15 % manganèse et le reste de nickel, marque en nom déposé d'un matériau métallique, par exemple sous forme de fil de manganin(e) utilisé pour les résistances ou bobinages électriques[7].


L'anhydride permanganique Mn2O7 peut réagir avec un alcali en présence d'un oxydant fort, nitrate ou chlorate, pour produire les permanganates alcalins. Le permanganate de potassium est un oxydant énergique déjà employé au laboratoire en 1874. Il est l'oxydant de la manganimétrie en analyse volumétrique, par exemple des eaux souillées. Il s'impose aussi en médecine comme désinfectant puissant, par exemple pour le lavage des mains (sic) et des plaies. Un usage antiseptique spécifique s'impose, pour soigner les maladies vénériennes, en particulier la gonorrhée qui fait alors des ravages. Enfin, l'industrie remplace parfois les manganates alcalins par les permanganates, également puissants décolorants des matières organiques. Son emploi se généralise dans le traitement des éponges végétales, ainsi que les pâtes à papier. Les permanganates de potassium et de calcium sont aussi utilisés dans la désinfection de l'eau[8].
Les préfixes mangano- ou manganoso- sont respectivement utilisés en chimie inorganique et organique pour signaler la présence de manganèse dans la structure chimique. Ainsi se justifie parfois a posteriori la manganocalcite ou carbonate de manganèse, la manganostibite ou antimoniate de fer et de manganèse, la manganowolframite ou tungstate naturel de Mn, la manganolite ou silicate naturel de manganèse, la manganopectolite ou pectolite de manganèse à teneur variable en anion calcium, les composés manganoso-ammoniques ou sels d'oxyde manganeux et d'ammoniaque, etc. Il existe toutefois des appellations qui persistent souvent pour des raisons phonétiques, le manganagraphite ou silicate naturel hydraté de manganèse, la manganapatite ou phosphate naturel de chaux manganésifère (de l'ordre de 6 %), la « manganamphibole » qui est une rhodonite à forte teneur en Mn.
Chronologie des découvertes et usages
La minéralogie et la chimie suédoise ont révélé l'élément « manganèse » dans la magnésie noire ou « magnesia nigra » en latin, soit le dioxyde de manganèse ou le minéral naturel pyrolusite de formule chimique MnO2[9] - [Mindat 3]. Ce composé minéral bien connu dans l'Antiquité prend sa dénomination de la cité lydienne de Magnésie du Sipyle, qui en faisait commerce[Note 1].
Le chimiste Bergman lance les études sur la magnésie noire où il soupçonne un élément inconnu, son étudiant Carl Wilhelm Scheele est le premier chimiste à reconnaître que le « manganèse » est un élément chimique singulier, en utilisant la magnésie noire pour générer des gaz oxydants, l'oxygène en 1773 et le chlore en 1774, le gaz oxygène étant dénommé plus tard par Lavoisier. Scheele laisse son collègue, le chimiste préparateur Johan Gottlieb Gahn, isoler le corps simple manganèse métal pur en 1774 par réduction du dioxyde de manganèse en creuset avec du carbone[10]. Klaproth qui reproduit sa préparation lui donne en 1808 un nom latin « magnesium » et allemand das Magnesium (sic) de manière éphémère, alors que Humphrey Davy avait appelé magnium l'élément et corps simple magnésium actuels[Note 2]. Le chimiste français Guyton de Morveau lui donne finalement dans sa nomenclature des éléments d'inspiration lavoisienne le nom de manganèse en 1785, en prenant un mot français manganèse, désignant depuis la fin du XVIe siècle pour les hommes de l'art la magnésie noire[11]. Ce dernier faisant référence au mot italien ou vénitien manganese désignant également la magnésie noire, probablement issu du latin médiéval manganesa ou manganesia nigra, après altération de magnesia nigra, à moins qu'il s'agisse d'un codage dialectal des verriers médiévaux de l'île de Murano.

Les propriétés magnétiques de la pyrolusite par ailleurs le plus souvent intimement associée à l'oxyde de fer ou magnétite étaient déjà connues, le terme gréco-latin de genre masculin magnes, magnetis, le plus souvent magnetem ou magnes lapis de même origine, désigne également l'aimant, « pierre de magnésie » ou « pierre d'aimant », qui manifeste une force ou puissance, alors que le terme féminin magnes(ia) affublé d'un qualificatif désigne une matière particulière. La magnesia nigra, ce corps pigment minéral noir, inséré naturellement ou artificiellement dans les argiles ou les ocres, est d'ailleurs utilisé depuis la Préhistoire dans les peintures de plus de 17 000 ans[12]. Les Égyptiens et les Romains utilisaient des composés de manganèse dans la fabrication du verre, pour colorer ou décolorer celui-ci. La magnésie noire, ce composé de dioxyde de manganèse naturel assez commun, était et est toujours employée pour blanchir le verre, car les coulées de verre sont souvent verdies par les ions ferreux. Le terme de minéralogie « pyrolusite » rappelle ce savoir-faire vitrier antique, car il signifie en grec « ce qui se dissout (et agit) par le feu ». MnO2 est un oxydant des ions ferreux Fe2+ en ions ferriques Fe3+, laissant un verre incolore à brun selon la concentration. Ce dioxyde de manganèse utilisé dans les verreries était dénommé « savon des verriers », puisqu'il servait à blanchir un verre plus ou moins assombri, opacifié ou noirci[13].
On a trouvé du manganèse dans les minerais de fer utilisés par d'anciens peuples grecs, notamment les Lacédémoniens ou Spartiates. Il semble plausible que l'exceptionnelle dureté de l'acier spartiate proviennent de la production régulée d'un alliage fer-manganèse. Les hommes de l'art, depuis l'Antiquité, sans connaissance chimique moderne des corps minéraux, savent utiliser la magnésie noire ou oxyde de manganèse naturel en tant que « fondant actif ». Minerais de fer et oxydes de manganèse donnent par réduction au charbon de bois divers composés ferromanganèses, employables pour fabriquer des lames de fer à couche d'acier ou des bronzes spécifiques après coulée avec le cuivre.
Au XIe siècle, des textes arabes signalent que l'ajout de magnesia nigra dans la production d’aciers fondus en creuset en augmentait la résistance (acier de Damas)[14].
Au XVIIe siècle, le chimiste allemand Johann Rudolf Glauber réussit à produire le permanganate. Dans la première moitié du XVIIIe, le dioxyde de manganèse était utilisé pour la fabrication du chlore. Au XIXe siècle, il s'agit d'un oxydant commun dans les laboratoires et dans l'industrie. Il sert à préparer à l'échelle industrielle les gaz oxygène ou chlore, ainsi que les chlorures décolorants comme l'eau de Javel, l'eau de Labarraque ou encore le chlorure de calcium, avant le procédé solvay[Note 3].
Vers le début du XIXe siècle, des scientifiques commencèrent à étudier l'utilisation du manganèse dans la fabrication de l'acier, et obtinrent des brevets. En 1816, on remarqua qu'ajouter du manganèse au fer le durcissait sans le rendre plus cassant. En 1858, le premier procédé de fabrication de l’acier (procédé Bessemer) lance l'utilisation du manganèse en métallurgie, en suivant les techniques mises au point par Robert F. Mushet. En effet, le manganèse bloque sous forme de scories le soufre des mauvais minerais de fer. La moindre trace de sulfure de fer, fléau pour les anciens forgerons, rend l'acier cassant. Le manganèse bloque aussi le gaz oxygène dissous dans les coulées des procédés modernes, et la formation facile du dioxyde de manganèse évite la formation malvenue des poches d'air, c'est-à-dire les boursouflures au refroidissement des coulées[15]. Les alliages à base de fer, manganèse et carbone, à cassure miroitante, nommés Spiegeleisen en langue technique allemande (littéralement « fer à miroir » ou « miroir/fer »), puis vers 1890 par abréviation « spiegel » en langue technique internationale, désigne la fonte spéculaire du procédé Bessemer.
Au début de la Belle Époque, l'acier au manganèse, très dur, résistant à l'abrasion, s'impose durablement pour l'usage des rails de chemins de fer alors qu'une grande proportion des hélices de navire est moulée avec des alliages de cuivre et de ferromanganèse et que se développent, selon le même principe et pour des applications similaires, les « bronzes au manganèse ».
Le chimiste français Gabriel Bertrand, à la suite du chimiste-naturaliste Hikorokuro Yoshida, spécialiste nippon de l'arbre à laque remarque que le manganèse à faible dose joue un rôle d'engrais catalytique pour les plantes cultivées, favorisant l'assimilation des engrais[16]. Ce chimiste et biologiste français, par ailleurs à l'origine de la notion d'oligo-éléments, ouvre la voie à l'agrochimie et aux cultures intensives[17].

Le dioxyde de manganèse est utilisé précocement comme dépolarisant entourant la cathode de la pile sèche de Georges Leclanché. La cathode des batteries alcalines ou piles alcalines classiques, initialement à anode de zinc, mise au point par une équipe autour de Lewis Urry et amélioré par celles de Samuel Ruben ou de Karl Kordesch au cours de ce dernier siècle, est préparée à partir de dioxyde de manganèse et de poudre de carbone. Le dioxyde de manganèse ainsi élaboré se retrouve dans les piles et batteries au lithium mise au point à la fin du XXe siècle.
Caractéristiques de l'atome
Le manganèse est un élément du groupe VII et de la période IV, du milieu de la première série des métaux dits « de transition ». Le groupe du manganèse comprend pour les chimistes le manganèse, le technétium, le rhénium et, accessoirement, le transactinide synthétique radioactif bohrium[18] - [19].
Isotopes
Le manganèse possède 26 isotopes artificiels connus de nombre de masse variant entre 44 et 69, et sept isomères nucléaires. Un seul de ces isotopes, 55Mn, est stable et représente la totalité du manganèse naturel, faisant du manganèse un élément monoisotopique et également un élément mononucléidique. Sa masse atomique standard est donc la masse isotopique de 55Mn : 54,938 045(5) u.
Configuration électronique
La structure électronique de l'atome de manganèse, soit [Ar] 4s2 3d5, justifie un état d'oxydation maximal égal à 7 ou VII[20]. Dans la nature, les états II et III (ce dernier stabilisé sous forme de complexes) sont les plus communs. Le manganèse, prenant 1,55 comme valeur d'électronégativité de Pauling, est l'élément le plus électropositif et aussi le plus abondant de ce septième groupe secondaire, il est beaucoup plus réactif que le rhénium, de même que dans leurs groupes respectifs, c'est-à-dire le sixième et le huitième, le chrome et le fer le sont du tungstène et de l'osmium. Le technétium, un des premiers éléments produit par l'être humain, est quasi inexistant naturellement.
Propriétés du métal pur ou allié
Caractéristiques cristallographiques du métal pur

Le manganèse Mn est un solide grisâtre ou gris-blanchâtre, un métal dur gris-blanc ou grisâtre brillant qui ressemble au fer. Les atomes dont le rayon sphérique avoisine 1,4 Å constituent un cristal de système réticulaire cubique centré, de paramètre de maille 6,28 Å. C'est un métal clair de densité 7,2 à 7,44 (pur), avec une dureté Mohs de l'ordre de 5 à 6 ½, très cassant et fragile. Ce corps simple métal existe sous quatre formes allotropiques ou variétés cubiques, le Mnα de densité 7,44 le plus commun stable jusqu'à 742 °C avant de se transformer en Mnβ, forme classique de plus faible densité 7,29 obtenue par aluminothermie, puis de suite en Mnγ à 742 °C et en Mnδ après 1 160 °C. Ces transformations de structures cristallochimiques sont réversibles. Les dépôts de métal Mn par électrolyse laisse essentiellement une phase Mnγ de densité minimale 7,18 qui se transforme rapidement au repos à température ambiante en Mnα[21].
| Variétés allotropiques | Mnα[22] | Mnβ[23] | Mnγ[24] | Mnδ[24] |
|---|---|---|---|---|
| Structure cristalline | 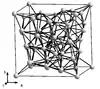 | 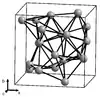 | 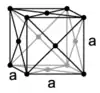 | 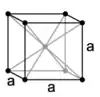 |
| Système cristallin | cubique | cubique | cubique | cubique |
| Nombre de coordination | 16+16+13+12 | 14+12 | 12 | 8 |
| Groupe d'espace | I43m | P4132 | Fm3m | Im3m |
| Paramètre de maille a (pm) | 891,1 | 631,5 | 386,3 | 308,1 |
| Nombre d'atomes par maille élémentaire | 58 | 20 | 4 | 2 |
| Masse volumique calculée (g/cm3 théorique) | 7,463 | 7,24 | 6,33 | 6,238 |
Propriétés physico-chimiques du métal pur
Le manganèse est moins fusible que le fer en atmosphère inerte, il fond sans difficulté vers 1 246 °C, et bout vers 2 061 °C[25]. L'oxydation ou « attaque par l'oxygène » est très lente à température ambiante. Mais, chauffé à l'air, il est facilement oxydé, il brûle, l'oxydation vive ou « combustion » laissant du tétraoxyde de manganèse Mn3O4. La poudre fine de manganèse s'enflamme spontanément à l'air à température ambiante. En masse, il peut s'oxyder d'ailleurs à l'air en donnant du dioxyde de manganèse MnO2[26].
Le manganèse est antiferromagnétique, il n'est ferromagnétique qu'après un traitement spécifique. Le premier potentiel d'ionisation s'élève à 7,434 V. Le métal et ses ions les plus communs sont paramagnétiques[27]. La conductivité électrique est 4 % IACS, c'est-à-dire définie par rapport à celle du cuivre pur.
Il est attaqué aisément par les acides dilués, et même par l'acide acétique. Dans ce cas, le métal libère des cations divalents Mn2+ suivant le potentiel de réaction d'équilibre électrochimique réversible.
- Mn2+ + 2 e− == Mn0 manganèse métal ε0 = −1,18 V
L'attaque par l'acide nitrique concentré libère l'équivalent de cations tétravalents ou MnO2. Il se dissout dans les acides en produisant un dégagement d'hydrogène. Il réduit les acides oxydants, par exemple l'acide sulfurique en acide sulfureux[28] - [29].

Le corps simple manganèse métal décompose très lentement l'eau déjà à froid, en libérant de l'hydrogène. Il décompose l'eau à 100 °C. Dans des conditions souvent difficiles à maîtriser, des poussières de manganèse finement divisé, en réalité après la formation superficielle de dioxyde de manganèse naissant, catalyse la décomposition de l'eau oxygénée ou peroxyde d'hydrogène en solution aqueuse.
Le corps simple manganèse n'est pas protégé par une couche d'oxydes[30]. Il réagit avec la plupart des corps métalloïdes. Il faut noter qu'à température ordinaire, la réactivité reste faible. Mais la réactivité s'accroît par chauffage et devient facile à hautes températures. Par exemple, ses combinaisons avec l'oxygène, le soufre, l'antimoine, les corps halogènes sont aisées. C'est pourquoi le manganèse ôte les impuretés dans divers procédés de la métallurgie du fer[31].
Le manganèse réagit avec l'azote vers 1 200 °C en laissant le nitrure de manganèse Mn5N3[28].
Alliages à forte teneur en Mn
Certains alliages Fe Mn, avec éventuellement du silicium (Si) et/ou du chrome (Cr), ont des propriétés superélastiques[32]. D'autres alliages, tels que Ni0,52 Mn0,24 Ga0,24, sont à mémoire de forme ferromagnétique.
Les alliages de manganèse et de titane servent pour les moulages d'acier. Les alliages de Mn avec le Ni sont intéressants pour leur malléabilité.
Chimie et composés
Mis à part l'état métal 0, les états d'oxydation les plus communs sont +2, +3, +4, +6 et +7, bien que tous les états entre +1 et +7 soient observés avec -1 et -3[33].
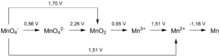
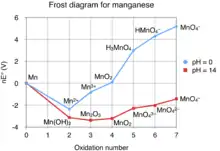
Un grand nombre des composés du manganèse sont colorés. De l'état d'oxydation 2 à 7, on peut citer le dichlorure de manganèse MnIICl2 rose, le trifluorure MnIIIF3 rouge, le dioxyde précipité MnIVO2 brun, l'ion manganite MnVO43− bleu, l'ion manganate MnVIO42− vert et enfin l'ion permanganate MnVIIO4− violet. La solubilité des oxydes, surtout les plus bas, est assez semblable pour les éléments Mn, Cr et Fe. Ce n'est pas un hasard si le géochimiste rencontre souvent ensemble les éléments fer et manganèse.
Les oxydes et éventuels oxanions de manganèse sont d'autant plus acides et oxydants que leur état d'oxydation est élevé. Comme ils sont aussi encore plus oxydants en milieu acide, au fur et à mesure de l'élévation de leurs degrés d'oxydation, ils sont plus faciles à produire en milieu basique.
Chimie de base
L'état de valence 0 est représenté par le corps simple métal Mn et les composés carbonylés, voire des singuliers complexes de coordination, comme K6[Mn(CN)6] • 2 NH3 instable et très réducteur.

Rare, le cation monovalent Mn+ n'est présent que stabilisé sous forme complexe à l'état de solide. Le cation Mn2+ est rose très pâle, peu acide, sans propriétés réductrices, difficile à oxyder en solution aqueuse, et souvent en compétition avec le Mg2+ dans les systèmes biologiques[34]. L'action des alcalis, par exemple l'hydroxyde de potassium (KOH) ou le carbonate de potassium (K2CO3) en solution aqueuse, permet d'obtenir un précipité d'hydroxyde de manganèse (Mn(OH)2), ce composé basique donnant après séchage à l'air ambiant ou par chauffage modéré l'oxyde de manganèse (MnO), autre corps basique[35].
- Mn2+aq + 2 OH−anion hydroxyle → Mn(OH)2 précipité gélatineux rose → MnOprécipité brun + H2O
_oxide.JPG.webp)
_reactions.JPG.webp)
L'action des sulfures alcalins, tels que Na2S ou K2S, forme des précipités de sulfures blancs rosés dans les solutions neutres.
Les sels manganeux anhydres, très souvent obtenus par chauffage, sont généralement blancs alors que les sels correspondants hydratés, incorporant l'eau de cristallisation, sont roses. L'analogie est souvent évidente avec les ions divalents Fe2+, Co2+, Ni2+, Cu2+ et Zn2+.
Des anions complexes sont formés avec l'anion phosphate MnPO42−, oxalate Mn(C2O4)22−, tartrate Mn(C4H2O6)22−, EDTA Mn(EDTA)22−, cyanure Mn(CN)3− ou encore Mn(CN)64− à la couleur brun-vert, etc. Les complexes de coordination de Mn2+ servent souvent de point de départ pour obtenir des complexes de Mn(I) et Mn(III), respectivement par réduction par le zinc et par oxydation à l'air.
Le cation Mn3+ est rouge et instable. Cet oxydant faible, mais assez puisant pour dégager l'oxygène de l'eau, se dismute facilement en milieu acide en Mn2+ et MnO2, il s'hydrolyse dans l'eau en Mn3O4.
- Mn3+ aq + e− == Mn2+ aq ε0 = 1,51 V
Si on prend la réaction d'électrode en milieu aqueux acide, soit
- MnO2 solide + H3O+ anion hydronium + e− == Mn3+ aq + H2O eau ε0 = 0,95 V
Le bilan confirme l'absence de chimie de Mn3+ en solution aqueuse.
- 2 Mn3+ aq + 2 H2O == Mn2+ aq + MnO2 + 4 H3O+ Δε0 = 0,56 V
À noter que l'état d'oxydation III du manganèse est stable à l'état solide. Ainsi en milieu alcalin ou basique, l'oxydation du dihydroxyde de manganèse donne l'ancien oxyde manganique Mn2O3, à la fois basique et stable.
- Mn(OH)2 aq + ½ O2 gaz dioxygène → Mn2O3 solide + 2 H2O
Le cation Mn3+ n'existe véritablement sous forme stable qu'à l'état de complexes. Ainsi l'anion complexe Mn(PO4)23− violet, Mn(CN)63− rouge, MnF52− rouge foncé, Mn(C2O4)23− rouge foncé, [MnCl4]−, etc., ou encore avec l'acétylacétone Mn(C5H8O2)3. Le complexe Mn3+-dioxalate Mn(C2O4)23− est instable à la chaleur, il se décompose vers 60 °C, ce qui explique pourquoi les dosages aux permanganates à l'oxalate doivent être réalisés à chaud[18].
Le cation Mn4+ n'existe pas en solution acide, c'est un acide fort représenté par MnO2, oxyde amphotère, composé non stœchiométrique stable, le plus souvent déficient en oxygène, observable sous forme de poudre brun-noir ou brun foncé. Voici les réactions électrochimiques de base, d'abord de l'oxydant puissant en milieu acide (1), puis celle du réducteur potentiel en solution basique (2).
- MnO2 solide + 4 H3O+ anion hydronium + 2 e− == Mn2+ aq + 6 H2O eau ε0 = 1,23 V (1)
- MnO2 solide + 2 H2O + 2 e− == Mn(OH)2 aq + 2 OH− anion hydroxyle ε0 = −0,5 V (2)
Le cation tétravalent est ainsi surtout représenté par des ions complexes, jaunes comme Mn(CN)84− ou MnF62−, rouge foncé comme MnCl62−.
L'ion manganite bleu MnVO43−, rare, n'existe qu'en milieu basique fort, type soude fondue. Il se dismute en milieu moins basique en MnO42− et l'inévitable MnO2. Ce cation est aussi qualifié par influence de la chimie allemande ou anglo-saxonne hypomanganate.
L'ion manganate vert MnVIO42−, quasi inexistant en solution aqueuse, n'apparaît qu'en milieu très basique. À noter que le trioxyde MnO3 n'existe pas à l'état libre. Il se dismute facilement en milieu moins basique en ion permanganate MnO4− et l'inévitable MnO2. Par exemple en reprenant une masse basique fondue par de l'eau légèrement acide (dilution et acidification) :
- 3 MnO42− + 4 H3O+ aqueux anion hydronium → 2 MnO4−aq permanganate violet + MnO2 précipité brun-noir + 6 H2O eau Δε0 ~ 1,7 V[Note 4]
On peut obtenir le manganate de potassium K2MnO4 en chauffant du dioxyde de manganèse avec un mélange de nitrate de potassium et d'hydroxyde de potassium. C'est un solide vert clair, soluble dans l'eau, mais uniquement stable en milieu basique. Les manganates ressemblent fortement aux chromates et aux ferrates (en), mais avec une stabilité intermédiaire, les ferrates étant les moins bien stabilisés.

Les composés de manganèse à état +7 ou VII sont de puissants agents oxydants, très acides, comme le permanganate de potassium KMnO4 qui oxyde lentement l'eau en dioxygène ou l'heptoxyde de dimanganèse Mn2O7, produit liquide à partir de permanganate de potassium et d'oléum sulfurique, très instable, aux propriétés oxydantes spectaculaires.
L'ion permanganate MnO4− montre une couleur violette sombre, intense et indicatrice, bien connue des chimistes. Ses sels, agents oxydants, sont solubles, ce qui explique l'intérêt en chimie analytique et préparatoire, notamment avec des « solutions fraîches » pour la manganimétrie. L'acide permanganique HMnO4, découvert par Mitscherlich figure parmi les acides connus les plus forts. Il suffit de chauffer le permanganate de potassium vers 240 °C pour qu'il se décompose avec dégagement de gaz oxygène en laissant du dioxyde de manganèse et de l'oxyde de potassium.
Les multiples cations manganèse, susceptibles de nombreuses réactions d'oxydoréduction et d'être stabilisés à l'état de complexes, réagissent avec l'anion sulfure. Les deux cations les plus stables, préférés par les chimistes pour les expériences ou méthodes d'analyse, sont Mn2+ et MnO4−. Les potentiels normaux en milieu acide des couples MnO2solide/MnO4− et Mn2+aqueux/MnO4− sont respectivement de l'ordre de +1,69 V et +1,50 V.
- MnO4−aq + 8 H3O+ + 5 e− == Mn2+aq + 12 H2O ε0 = 1,51 V

Les réactions spécifiques d'identification des cations manganeux Mn2+ restent trivialement leurs oxydations soit par le moyen des persulfates (en présence d'ion argent Ag+ comme catalyseurs permettant de conduire l'oxydation au-delà de l'état IV ou MnO2) soit par l'action à chaud du dioxyde de plomb PbO2 en milieu d'acide nitrique concentré, c'est-à-dire la réaction de Crum.
Voici respectivement les réactions d'identification décrites :
- 2 Mn2+ aqueux + 5 S2O82− aq persulfate + 24 H2O eau → 2 MnO4−aq permanganate violet + 10 SO42− aq sulfate + 16 H3O+ ;
- 2 Mn2+ aq + 5 PbO2 solide noir + 4 H3O+ → 2 MnO4−aq permanganate violet + 5 Pb2+ aq + 6 H2O eau.
Le cation permanganate peut à l'inverse être réduit en cation manganeux en milieu aqueux acide par de nombreux réducteurs (Fe(II), eau oxygénée, gaz hydrogène sulfuré, anions chlorure à chaud, bromure, iodure, tartrate à chaud, etc.). Mais il peut aussi oxyder en milieu aqueux neutre ou basique de nombreuses substances organiques, comme l'anion formiate en anion carbonate, l'éthanol à chaud en aldéhyde ou acétate.
La fusion alcaline oxydante dans un creuset réfractaire par exemple en porcelaine d'un composé de manganèse quelconque, avec une partie de nitrate de sodium et quatre parties de carbonate de soude pour une partie du composé de manganèse, conduit après refroidissement à l'apparition d'une couleur verte dans le mélange résiduel, indiquant la présence d'anion manganate ou de manganate alcalin. C'est une technique ancienne de vérification en verrerie.
- MnSO4 sulfate de Mn par exemple + 2 Na2CO3 soude des Anciens + 2 Na2NO3 nitrate de sodium → Na2MnO4 manganate de sodium vert + Na2SO4 sulfate de sodium + 2 NaNO2 nitrite de sodium + 2 CO2 gaz carbonique dégagé
Les étudiants chimistes la simplifiaient autrefois couramment au laboratoire en chauffant, de la poudre de carbonate de sodium légèrement arrosée ou imprégnée de solutions d'ions manganeux, au chalumeau réglé en flamme oxydante. Ils obtenaient un petit amas de manganate de sodium, soluble dans l'eau, ce qui la faisait verdir ostensiblement. Pour détecter, dans les fers carburés, l'existence de manganèse, à une teneur massique atteignant 1/10000e, le chimiste Boussingault appliquait une technique de détection qualitative mise au point par son collègue allemand Heinrich Rose, il chauffait les sels obtenu par dissolution complète de ces matériaux ferreux avec l'acide nitrique HNO3 et l'oxyde puce de plomb PbO2, afin d'observer la formation d'une coloration pourpre intense de permanganate.
Principaux composés
Voici les principaux composés à base de manganèse[36] :
_oxide_.JPG.webp)
- oxydes de manganèse :
- oxyde de manganèse(II) MnO ou minéral manganosite gris sombre ou parfois vert émeraude[Mindat 4]. Il s'agit d'un oxyde basique et ionique,
- oxyde de manganèse mixte (II et III) Mn3O4, oxyde mixte semblable à Fe3O4, « oxyde salin » de manganèse ou hausmannite.
- oxyde de manganèse(III) Mn2O3, sesquioxyde de manganèse ou oxyde manganique vert ou rose. Il s'agit d'un oxyde basique et ionique,
- dioxyde de manganèse MnO2 tétragonal, noir, ou le minéral pyrolusite, sans oublier la variété minérale polianite plus globuleuse[Mindat 5],
- dioxyde de manganèse hydraté MnO2 • H2O corps brun, obtenu par précipitation du cation manganeux oxydé lentement en milieu basique par le peroxyde d'hydrogène, le persulfate de sodium, le brome liquide,
- trioxyde de manganèse et de lanthane, LaMnO3, dénommé manganite de lanthane mais avec Mn au degré d'oxydation III, parfois dopé au strontium ;
- oxyhydroxydes de manganèse :
- hydroxydes de manganèse :
- hydroxyde de manganèse Mn(OH)2, corps blanchâtre qui brunit lentement exposé à l'air et à la lumière, et se transforme en hydrates de MnO2 et Mn3O4. Il correspond au minéral pyrochroïte, de maille trigonale[Mindat 6] ;
- oxysels où Mn apparaît dans l'oxoanion :
- manganate de sodium Na2MnO4,
- manganate de potassium K2MnO4,
- acide permanganique HMnO4,
- permanganate de sodium NaMnO4,
- permanganate de potassium KMnO4,
- permanganate d'ammonium NH4MnO4,
- permanganate d'argent AgMnO4,
- permanganate de calcium Ca(MnO4)2,
- permanganate de baryum Ba(MnO4)2 ;
- sulfures de manganèse :
- sulfure de manganèse(II) MnS amorphe vert ou cubique noir, ce dernier corps correspondant à l'alabandite[Mindat 7],
- sulfure de manganèse(II) polyhydraté MnS • n H2O rose chair, obtenu par précipitation du cation manganeux par le sulfure d'ammonium en milieu aqueux neutre,
- sulfure de manganèse(IV) MnS2 cubique noir ;
- séléniures de manganèse ;
- tellurures de manganèse ;
- carbures de manganèse :
- Mn3C ;

- siliciures de manganèse :
- disiliciure de manganèse MnSi2 ;
- nitrures de manganèse :
- Mn5N3 ;
 Difluorure de manganèse.
Difluorure de manganèse.
- Mn5N3 ;
- phosphures de manganèse :
_chloride_tetrahydrate.jpg.webp)
- halogénures de manganèse(II) :
- (di)fluorure de manganèse MnF2,
- chlorure de manganèse MnCl2 aux cristaux roses, déliquescent, monoclinique, cubique ou simplement trigonal, correspondant au minéral scacchite[Mindat 8],
- tétrahydrate de chlorure de manganèse(II) MnCl2 • 4 H2O, forme commerciale,
- bromure de manganèse MnBr2 α monoclinique,
- bromure de manganèse MnBr2 β orthorhombique,
- iodure de manganèse MnI2,
- tétrahydrate de iodure de manganèse MnI2 • 4 H2O ;
- halogénures de manganèse(III) :
- (tri)fluorure de manganèse MnF3,
- (tri)chlorure de manganèse MnCl3 ;
- halogénures de manganèse(IV) :
- perfluorure de manganèse MnF4,
- perchlorure de manganèse MnCl4 vert, soluble dans l'eau, dans l'alcool à 95° et dans l'éthyl-éther ;
- arséniates de manganèse :
- Mn3(AsO4)2, composé très peu soluble (pKs~28,7) ;
-carbonate-sample.jpg.webp)
- carbonates de manganèse :
- carbonate de manganèse(II) MnCO3, corps solide blanc qui brunit à l'air, en se transformant en MnO2 et CO2 (même réaction dans l'eau à ébullition). Il s'agit du minéral « diallogite » ou rhodochrosite ;
- molybdate de manganèse :
- MnMoO4 ;
- nitrates de manganèse :
- hexahydrate de nitrate de manganèse Mn(NO3)2 • 6 H2O rose rouge, soluble dans l'alcool à 95° ;

- phosphates de manganèse :
- hydrogénophosphate de manganèse MnHPO4,
- trihydrate de hydrogénophosphate de manganèse MnHPO4 • 3 H2O,
- pyrophosphate de manganèse Mn2P2O7,
- Mn3(PO4)2, composé blanc très peu soluble dans l'eau (pKs~22), mais soluble dans les acides forts et l'acide acétique,
- phosphate double d'ammonium et de manganèse hydraté MnNH4PO4 • H2O, corps rose pâle ;
- silicate de manganèse :
- MnSiO2
-sulfate-tetrahydrate-sample.jpg.webp)
- sulfates de manganèse :
- sulfate de manganèse(II) MnSO4 blanc anhydre, rose hydraté, très soluble dans l'eau,
- monohydrate de sulfate de manganèse(II) MnSO4 • H2O rouge clair ou rose monoclinique, correspondant à la szmikite[Mindat 9],
- dihydrate de sulfate de manganèse(II) MnSO4 • 2 H2O,
- trihydrate de sulfate de manganèse(II) MnSO4 • 3 H2O,
- tétrahydrate de sulfate de manganèse(II) MnSO4 • 4 H2O forme commerciale, rosé monoclinique ou rhomboédrique,
- pentahydrate de sulfate de manganèse(II) MnSO4 • 5 H2O,
- hexahydrate de sulfate de manganèse(II) MnSO4 • 6 H2O,
- heptahydrate de sulfate de manganèse(II) MnSO4 • 7 H2O rouge,
- sulfate de manganèse(III) ou sulfate manganique Mn2(SO4)3 cristal vert, déliquescent, assez instable, hydrolysable dans l'eau (très soluble dans l'eau froide, se décomposant dans l'eau chaude) ;
- thionate de manganèse :
- dithionate de manganèse(II) MnS2O6 ;
- titanates de manganèse :
- MnTiO3 ;
- tungstates de manganèse :
- MnWO4 ou minéral hübnérite, pôle manganésé de la wolframite ;
- acétates de manganèse :
- Mn(CH3CO2)2,
- tétrahydrate d'acétate de manganèse(II) Mn(CH3CO2)2 • 4 H2O ;
-acetylacetonat.JPG.webp)
- oxalates de manganèse :
- Mn(C2O4), composé peu soluble (pKs~15) ;
- tartrates de manganèse :
- tartrate potassique de Mn K2Mn(C4H2O6)2 ;
- orotates de manganèse :
- cyanures de manganèse :
- Mn(CN)2 brun,
- KMn(CN)3 vert,
- ferrocyanure de Mn(II) Mn2Fe(CN)6,
_ferrocyanide.jpg.webp)
- ferricyanure de manganèse ;
_ferricyanide.jpg.webp)
- dérivés carbonyles :
- Mn2CO10 ;
- dérivés nitrosocarbonyles ;
- composés organométalliques de type manganocène :
- bis(cyclopentadiényl)manganèse ou manganocène officiel,
- (Méthylcyclopentadiényl)manganèse tricarbonyle ou MMT ;
- complexes de porphyrine ou phtallocyanine ;
- métalloenzymes de Mn :
Analyse
Le manganèse colore en violet les perles de borax placées dans la flamme oxydante. L'analyse quantitative précipite l'ion manganeux sous forme de phosphate mixte d'ammonium et de manganèse NH4MnIIPO4 grâce à un mélange de chlorure d'ammonium NH4Cl, et de phosphate d'ammonium NH4PO4 dans l'ammoniaque. La calcination du précipité permet d'obtenir le diphosphate de manganèse Mn(PO4)2, qui permet, par son pesage à froid, de déterminer la teneur en manganèse de l'échantillon initial.


Les échantillons contenant du manganèse, généralement sous forme de matière minérale solide, de sels dissous en milieu aqueux, de diverses particules de corps composés ou de colloïdes, peuvent être étudiés par spectrométrie d'absorption ou spectrométrie d'émission atomique.
La solubilisation des particules et des colloïdes en milieu acide, suivie d'un traitement au persulfate d'ammonium, pour obtenir des ions permanganate solubles, est une voie classique. Une analyse colorimétrique ou spectrophotométrique basée sur certaines absorbances fortes dans le domaine visible et ultraviolet permet un dosage par étalonnage. Une concentration par précipitation ou coagulation sous forme d'un composé insoluble de manganèse, puis filtration est parfois nécessaire. La spectrométrie de masse, l'analyse par activation de neutron ou la fluorescence X sont aussi des techniques pratiques informant sur la teneur globale en Mn, mais qui n'apportent aucune connaissance précise de l'état de l'oxydation.

D'autres techniques analytiques sophistiquées, parfois électrochimiques, sont nécessaires, souvent en couplage ou triade, et adaptées au type d'échantillons[37]. L'analyse chimique représente une voie ancienne, distinguant les ions de diverses valences[38]. Le manganèse fait partie globalement du groupe du sulfure d'ammonium, assez pléthorique, dont le réactif collecteur est (NH4)2S en présence d'ammoniaque. Précisément le manganèse a sa place dans le sous-groupe du zinc, dont les cations précipitent par action du mélange réactif collecteur précédent, avec des précipités toutefois solubles dans un excès de réactif[Note 5].
La présence d'autres ions, comme le fer, peut perturber les méthodes chimiques, par exemple la méthode à la formaldoxime.
Usages
Elément d'addition

Près de 90 % de la production de manganèse est utilisée comme élément d'addition pour la préparation d'alliages ferreux et non-ferreux.
Alliages ferreux
Souvent utilisé dans les fontes et les aciers, le manganèse est un élément d'addition permettant d'obtenir des propriétés mécaniques améliorées[39] - [40] - [41]. Des teneurs de 8 à 15 % de manganèse peuvent augmenter notablement la résitance en traction du matériau, sa dureté et sa résistance à d'éventuels chocs violents[42]. De tels alliages possèdent une résistance élevée contre la corrosion et sont amagnétiques. Le manganèse est ainsi présent dans les aciers des rails et notamment des aiguillages, de l'outillage, des roulements, du mobiliers de sécurité, des socs de charrues, des aciers à outils, etc.
Ce type d'acier est également utilisé pour les barreaux et pour les portes de prisons (en le limant, l'alliage se durcit). Des plaques d'acier au manganèse de différentes épaisseurs, autrefois présents dans les casques lourds des soldats[43], par exemple les modèle 1951 ou modèle 1978 français ou les blindages, ou aujourd'hui encore dans les casques de sécurité d'ouvriers du bâtiment, sont communément utilisées pour les mobiliers de sécurité au niveau de la protection antiperçage des parties sensibles.
L'acier de Hadfield à 12 ou 13 % en masse de manganèse durcit sous la contrainte, sous les chocs répétés, et résiste bien à l'usure.
Les aciers au manganèse sont améliorés par l'adjonction de nickel pour les usages aux basses températures. Les aciers spéciaux au manganèse à 0,3 % de carbone sont employés pour le formage à froid. Ce sont aussi des aciers de moulage, comme les aciers austénitiques au manganèse. Les aciers au carbone-manganèse sont aptes à la trempe superficielle. Les aciers au manganèse chrome, ou au manganèse bore sont des aciers de cémentation. Les aciers au bore et manganèse sont des aciers typiques de boulonnerie, alors que les aciers au manganèse et nickel sont préférés pour les chaînes. Les aciers moyennement carbonés au Mn et Mo, servent à fabriquer les tubes pour des structures légères et résistantes, comme les cadres de vélo de course en Reynolds 531. Les aciers bas carbone au Mn, Cr type staballoys servent à fabriquer des tiges inoxydables, comme les tiges des plates-formes de forage.
Alliages non-ferreux
Il l'est aussi dans les alliages légers d'aluminium, souvent avec le chrome, et les divers bronzes au manganèse, qui font briller les hélices de bateau. Le manganèse, peu soluble dans l'aluminium, augmente la résistance des alliages d'aluminium et les propriétés frottantes (tribologie) de l'alliage contre les aciers. L'addition de manganèse — à raison de 5 à 15 % — augmente la résistance à la corrosion, par exemple pour des hélices, des gouvernails qui doivent résister à l'eau de mer.
Le manganèse permet d'obtenir des alliages d'aluminium à rigidité renforcée, par exemple des boîtes cylindriques pour boissons[31]. On retrouve aussi ces alliages résistants à la rupture dans l'industrie automobile.
Il est aussi présent dans les bronzes ou cuproalliages. On le retrouve de manière fréquente dans les alliages de métaux non ferreux d'aluminium (Al), cuivre (Cu), zinc (Zn) et étain (Sn), à usage industriel[44]. On peut citer le laiton au manganèse résistant à l'eau de mer, autrefois commun dans l'industrie navale.
L'alliage manganine Cu 84 % Mn 12 % Ni 4 % montre à la fois une résistivité très faible de l'ordre de 0,45 × 10−6 Ω m et une variation linéaire de celle-ci sous des pressions très élevées. L'introduction de Mn permet ainsi de fabriquer des résistances électriques calibrées ou standard, des thermocouples électriques, des dispositifs magnétiques. Ainsi des manomètres électriques garantissent à des températures élevées la haute précision de mesures de pression de l'ordre de 30 × 106 hPa[31].
L'alliage constantan à base de Cu 55 % Ni 44 % Mn 1 % avec Zn et Sn présente une résistivité quasi stable, de l'ordre de 50 × 10−8 Ω m à 20 °C[45] - [Note 6].
Soudure
La poudre de manganèse est utilisée en soudure, par exemple à l'arc à l'électrode enrobée à haute température.
Dioxyde de manganèse
Le dioxyde de manganèse MnO2 est un agent d'oxydation et de désulfuration du fer et des aciers. Il permet le brunissage des aciers, tels ceux des canons de fusils, des tubes et pièces d'artillerie. Le dioxyde de manganèse, en combinaison avec d'autres oxydes par frittage, permet de produire des aimants céramiques[31]. Il est utilisé pour les soudures. Il sert parfois à la déferrisation.

Il s'agit du dépolarisant historique de la pile Leclanché, ou aujourd'hui des pile salines. L'électrode centrale (positive) de cette pile est garnie de dioxyde de manganèse (MnO2) ou de composés électrochimiques à couches beaucoup plus sophistiqués (mais assez similaire pour le non-spécialistes) qui jouent le rôle de stockage et de régulation électrochimiques. Le chlorure de manganèse (II) est un électrolyte des piles et batteries.
La chimie du manganèse utilise le dioxyde comme matière première de base. Il peut servir à la fabrication des permanganates par fusion alcaline oxydante, il est aussi largement utilisé en chimie organique et dans la fabrication technique de l'uranium, en tant qu'oxydant. C'est un catalyseur en chimie. Son action catalytique dans la décomposition du chlorate de potassium appliqué à la préparation ancienne de l'oxygène s'explique par de multiples composés intermédiaires. C'est un siccatif pour peintures, vernis et encres d'imprimerie. L'acétate de manganèse est un agent de mordançage dans le textile. Le chlorure de manganèse (II) est un agent siccatif de l'huile de lin. Le permanganate de potassium est un agent d'oxydation de nombreuses réactions en chimie organique.


Le dioxyde de manganèse est aussi un pigment de couleur pour verre minéraux, dans les glaçures de céramiques comme les faïences, les porcelaines et dans les émaux. Dans l'industrie verrière, l'addition de dioxyde de manganèse permet à faible dose le blanchiment des verres, et à plus forte dose leurs colorations violette ou améthyste, brune ou noire[31]. La couleur dépend du mode de préparation et de la composition du verre. La teinte du verre est due à des ions métalliques et à des métaux dispersés à l’état d'amas colloïdal. À noter que la couleur violette spécifique de l'améthyste, une variété de quartz teinté, est également due à la présence de fines traces ou particules de composés de manganèse.
À l'œil nu, il s'agit pourtant d'un pigment noir. Une couleur brun foncé ou noire des céramiques ou entre autres des pierres et des dalles préfabriqués peut s'expliquer par l'addition de dioxyde de manganèse généralement en combinaison avec d'autres oxydes métalliques tels que ceux du fer(II) et du chrome. Les briqueteries sont ainsi de grandes consommatrices de dioxyde de manganèse. On colore également certains types de briques avec du dioxyde de manganèse, ainsi que les tuiles pour leur rendre une couleur noire.
Autres composés

La famille du sulfate de manganèse est une des matières premières pour l'électrolyse industrielle du manganèse métal. Cet ancien sous-produit de l'industrie de l'aniline, pigment de teinture et de tissus, permet aussi de préparer des verres rouges et des vernis minéraux. Le silicate de manganèse est un pigment rouge géranium pour la teinture des verres et les vernis minéraux. Le carbonate de manganèse est un pigment blanc pour peinture[31]. Les composés de pigments de manganèse se retrouvent parmi les matériaux des beaux-arts : le bleu et le violet de manganèse servent notamment en peinture.
Le chlorure de manganèse(II) est un désinfectant, ainsi que le permanganate de potassium[31]. Le carbonate de manganèse est utilisé à faible dose en médication biocatalytique[46].
Le décacarbonyle de dimanganèse est un additif anti-détonant des essences[31]. Il est aussi utilisé en chimie macromoléculaire.
Agriculture et élevage
Le manganèse est un oligo-élément très important du monde végétal, en particulier il est présent sous forme de sels plus ou moins solubles dans les engrais utilisables en culture des légumes et des agrumes. Pour compenser un manque de manganèse, on ajoute outre les engrais aux terres par exemple du sulfate de manganèse (MnSO4) ou de l'acétate de manganèse Mn(CH3COO)2, à moins qu'il ne soient présent dans les mélanges pesticides (fongicides à base de manganèse)[47]. Le sulfate de manganèse est aussi un fongicide et un additif pour aliment pour bétail.
Dans le monde vivant le manganèse semble jouer un rôle assez semblable à celui du fer. Il est parfois considéré comme le deuxième micronutriment des cultures végétales après le fer[48].
Agriculture
Le manganèse est un élément trace typique des sols. Il est le plus souvent disponible pour des pH de sols compris entre 4 et 8. Il est aussi présent dans les sols sous forme d'oxydes insolubles, qui sont surtout formés par l'action complexe de bactéries en milieu alcalin[49]. La teneur des sols agricoles en Mn et celle des différents végétaux qui y croissent sont assez variables.

Faiblement assimilable par les plantes, mais aussi assimilable par voie foliaire dans certaines conditions[50], c'est un oligoélément qui interfère avec le microbiote du sol[51] et qui est impliqué dans l'activation des enzymes, en lien avec le fer (par exemple dans le processus de synthèse de la chlorophylle). Un déficit en Mn peut induire (chez le blé par exemple) une diminution de la taille, du nombre et de la fertilité des grains de pollen[52].
Une carence de manganèse dans les sols cultivés n'est pas rare. Elle a souvent des origines multifactorielles et peut être aggravée par des chaulages massifs (comme sur certains sols bretons riches en matière organique mais acides des années 1980 : le manganèse est généralement complexé dans des composés organiques, or ces composés deviennent insolubles si le pH s'accroît, en particulier par la présence disséminée de lait de chaux. Le manganèse assimilable, piégé, n'est alors plus assez disponible pour couvrir les exigences des cultures intenses[53]. Les régions agricoles concernées par une carence en Mn ont appris à pratiquer un chaulage à effet modéré[54].
Les cultures exportent du manganèse, elles ont un besoin régulier d'environ 400 à 500 g de Mn par hectare. En agriculture intensive, la pulvérisation de solution aqueuse à 0,5 ou 1,5 % en masse de sulfate de manganèse peut s'imposer, ou de manière anticipée la répartition modérée de scories Thomas à 2 ou 4 % en masse de Mn (pour ce dernier choix, l'action alcalinisante ou alcaline des scories rend peu ou lentement mobilisable le manganèse). Il existe depuis les années d'entre-deux-guerres en agriculture productiviste une préconisation d'utilisation des oxydes, chlorures et carbonates de manganèse pour favoriser l'assimilation des engrais par les plantes[55].
Inversement au-delà de certains seuils (qui dépendent aussi des espèces ou variétés, et du pH du sol) le manganèse présente une toxicité pour les végétaux. Ces seuils peuvent être atteints sur certains sols manganésifères naturels (ou des friches industriels)[56].
Élevage
Le manganèse est un activateur ou cofacteur d'enzymes (type carboxylase, peptidases ou phosphatases) présent dans les tissus vivants des animaux. Il joue un rôle crucial dans la formation du squelette, ainsi que dans le développement et le fonctionnement de l'appareil génital. Il est en particulier indispensable au niveau du lobe antérieur de l'hypophyse, qui permet la stimulation de la production d'hormones sexuelles[57].
Dans le cas des bovins, une carence implique un retard de croissance et de la maturité sexuelle des veaux et génisses, ainsi que des troubles de la reproduction des adultes. Une carence faible cause souvent des raideurs dans la démarche des bovins adultes, souvent au niveau du jarret droit, et surtout pour les vaches une diminution sensible de la production de lait[58]. Les jeunes bovins nécessitent 60 mg/kg de matière sèche et par jour, l'exigence est diminuée de moitié chez les bovins adultes.
Pour les volailless, il existe des maladies de l'ossification spécifique, si la teneur des aliments est trop faible en Mn, le maintien du phosphore et du calcium dans le régime explique différents symptômes, à l'origine du pérosis ou déformation des pattes des poussins. Les poussins nécessitent 55 mg/kg de matière sèche et par jour alors que les poules requièrent seulement 35 mg[59].
Le régime des porcs doit assurer 40 mg/kg de matière sèche et par jour. Une carence implique des troubles typiques de croissance des os longs et une déformation caractéristique des pattes de devant. La reproduction des truies est perturbée, elles sont souvent victimes de chaleurs irrégulières et d'avortement[58].
Biologie et toxicologie
À faible dose, le manganèse est un bioélément reconnu du monde végétal et animal. Cet oligoélément, à des doses de l'ordre du milligramme par jour (au maximum 5 mg/j pour un homme adulte), est essentiel pour les enzymes du corps. Les dérivés du manganèse sont toxiques à fortes doses. Dès 10 mg/j, le manganèse est un neurotoxique létal. Les poussières de manganèse doivent être surveillées en milieu industriel, avec une limite autorisée des teneurs en élément Mn à moins de 5 mg/m3. En effet, absorbées en excès, elles causent de graves désordres du métabolisme et du système nerveux, nommés la folie du manganèse, succession de spasmes et d'états de langueur, qui, de manière similaire à la maladie de Parkinson mais avec des psychoses hallucinatoires, conduise à la paralysie au stade ultime[60]. L'ensemble des pathologies causées par cet élément se nomme manganisme.
Oligo-élément
Le manganèse est un oligo-élément (nécessaire à l'être humain pour survivre) ; la carence en manganèse (moins de 2 à 3 mg/j pour un adulte moyen), conduit — selon le modèle animal — à des troubles de la reproduction pour les deux sexes, des malformations osseuses, des dépigmentations, une ataxie et une altération du système nerveux central.
Le manganèse est cofacteur de nombreuses enzymes (glycosyltransférase, pyruvate carboxylase, GTP oxaloacétate carboxylase, isocitrate déshydrogénase, malique déshydrogénase, arginine synthétase, glutamine synthétase) intervenant dans des processus métaboliques variés. Il est particulièrement présent dans le métabolisme des hydrates de carbone et la synthèse des mucopolysaccharides. C'est aussi un métal essentiel pour la synthèse d'enzymes (Mn-SOD) participant à la lutte contre le stress oxydant et qui préviennent des dommages causés par les radicaux libres. Il participe aussi à la synthèse de la vitamine E et à l'efficacité de la vitamine B1 (thiamine). Cet activateur de l'oxygène moléculaire joue un rôle dans le fonctionnement de métalloprotéines telles que la superoxyde dismutase[61].
De nombreux systèmes enzymatiques qui utilisent le magnésium peuvent fonctionner avec le manganèse, mais avec des caractéristiques enzymatiques (Km, Vmax) modifiées. Il peut parfois aussi remplacer le Zinc dans d'autres enzymes[62].
Présence dans les écosystèmes
Ce métal est un élément chimique naturel assez commun (il compose 0,1 % de la croûte terrestre) et omniprésent dans l'environnement[47]. Il est présent dans de nombreux types de roches et sédiments, dans le sol et dans l'eau[63]. L'érosion des sols est la principale sources naturelles d’émission de manganèse vers l'air, les pluies et le sol, devant les embruns marins, les incendies de forêt, les émissions de poussière volcanique et les transferts par les végétaux[47].
Des sources anthropiques directes existent depuis la révolution industrielle dans les secteurs des mines et de l'industrie métallurgique (exploitation minière, du traitement des minéraux, puis production de manganèse mais aussi de ses alliages, d'acier et de fer)[47].
Le lessivage par les pluies des zones industrielles où il est extrait, raffiné, utilisé ou recyclé en est une autre source (notamment en cas de drainage minier acide, de même pour le lessivage de la nécromasse en contenant (tissus animaux ou végétaux, dont feuilles mortes, fumiers, etc.). On en trouve aussi dans les excréments humains et d'animaux. Selon l'OMS, « la combustion de combustibles fossiles[64], et, dans une moindre mesure, les émissions provenant de la combustion des additifs de carburants ». Cet élément n'étant pas biodégradable ni dégradable aux échelles humaines de temps, on le retrouve en quantité significative dans les eaux usées, les boues d'épuration[47].
Air
Dans l'air, sa concentration est normalement très faible et elle le reste dans les régions peu anthropisées (environ 0,5 à 14 ng/m3 d'air en moyenne), pour nettement augmenter dans les zones rurales (40 ng/m3 en moyenne), et plus encore en zone urbaine (65 à 166 ng/m3 en moyenne[65]) avec des taux parfois très élevés dans les régions industrielles (jusqu'à 8 000 ng/m3)[47] ou près d'autoroutes très passantes[66]. Près des fonderies, les taux de manganèse atteignent 200 à 300 ng/m3 pour dépasser 500 ng/m3 près des industries de ferro- et silicomanganèse[47].
Il peut être inhalé sous forme de composés volatils ou ingéré sous forme de poussières dans certaines contextes industriels (usines métallurgiques, mines…).
Eau
Dans l'eau le taux de manganèse varie beaucoup selon le contexte géologique, de 10 à 10 000 µg/L (mais rarement au-dessus de 1 000 µg/L et presque toujours sous les 200 µg/L[47]. Des concentrations de quelques μg/L peuvent tacher les textiles et engendrer des goûts, des couleurs et des odeurs trop facilement perceptibles. Un traitement d'épuration, en fixant le manganèse sous forme solide, s'impose souvent. De l'eau contenant une sur-concentration inhabituelle de sels de manganèse, le plus souvent d'origine naturelle, est appelée « eau noire » dans le jargon des physicochimistes de terrain.

Dans le milieu aquatique ses deux formes principales sont Mn (II) et Mn (IV), avec un mouvement entre ces deux formes, contrôlé par le contexte abiotique ou microbien[67] plus ou moins oxydoréducteur[47]. Dans l'eau, la chimie de l'environnement du manganèse est principalement régie par le pH et les conditions redox du milieu ; Mn (II) dominant quand le pH et le potentiel redox sont bas et au profit d'une proportion croissante de manganèse colloïdal oxy-hydroxydes à un pH supérieur à 5,5 (dans les eaux non dystrophes[47]. À la limite sédiment-eau[68], et dans le sédiment les facteurs chimiques qui contrôlent la forme chimique du manganèse sont le taux d'oxygène de l'eau sus-jacente, et la pénétration de cet oxygène dans le sédiment, ainsi que la quantité de carbone organique benthique[47]. L'anthropisation des milieux a modifié ces conditions (avec les pluies acides et l'acidification des océans, et une tendance générale à l'eutrophisation et au colmatage et à l'eutrophisation des sédiments devenant plus souvent anoxiques)[47].
Sédiments et sols
Dans le sédiment, on peut fréquemment trouver des teneurs maximales de 410 à 6 700 mg/kg de poids sec dans les cours d'eau. Ces concentrations parfois importantes et excessives sont atteintes localement (par exemple jusqu'à 13 400 mg/kg (en poids sec) au fond d'un lac urbain recevant des eaux de ruissellement de zones industrielles et résidentielles, et des retombées aéroportées à partir de terrils anciens. Des taux de 100 à 1 000 mg/kg (poids sec) sont cités pour la zone intertidale et les sédiments du nord de l'Adriatique. En mer Baltique, des charges sèches de 3550 à 8 960 mg/kg (poids sec) ont été signalées sur la fraction supérieure du sédiment ; ces concentrations de manganèse anormalement élevées seraient dues à l'activité sidérurgique et ses dérivés de ferromanganèse véhiculé finalement dans les concrétions et charges fluviales jusqu'à cette mer intérieure, à faible capacité de renouvellement des eaux.

Dans le sol, les teneurs varient déjà selon les variations du substrat géologique ou la « pollution naturelle » par les eaux et vents poussiéreux, le « fond géochimique naturel » ou niveau en Mn global pouvant varier de moins de 1 à 4 000 mg/kg de sol (poids sec), avec des valeurs moyennes de 300 à 600 mg/kg de sol (poids sec)[69]. À teneur égale, le manganèse développe plus d'effets toxiques dans les sols naturellement acides ou acidifiés[70].
Dans les sols véritablement pollués par des activités humaines (friches industrielles, dépôts agrochimiques…), les champignons peuvent le (re)concentrer et l'exporter sous forme soluble par leur réseau de mycélium vers le réseau trophique, ce qui n'exclut pas le transport par les animaux consommateurs de champignons vivants (limace ou écureuil par exemple), la fixation par les végétaux receveurs ou la dégradation en retour de la nécromasse, terme ultime de la biomasse[71].

Aliments
Dans l'alimentation humaine, il est trouvé à l'état de traces parfois conséquentes, principalement dans le germe de blé et le pain complet, le seigle, les flocons d'avoine, le riz complet, la mélasse, les noix, amandes et noisettes, la noix de coco séchée, le cacao ou le chocolat noir, les moules, coquilles saint-Jacques et les huîtres, de nombreux poissons comme la truite et le brochet, les lentilles cuites ou le quinoa, les pois chiches, le soja, l'avocat, les haricots verts, les épinards, les légumes à feuilles vertes, les fruits frais comme les mûres, framboises, fraises, ananas, l'huile d'olive, le jaune d'œuf, ou encore les pignons de pin, le thé, le sirop d'érable, les bananes séchées, les châtaignes crues, les herbes de Provence et divers épices comme le gingembre moulu, la cardamone, le clou de girofle, la cannelle[72], etc.
Présence dans les organismes
Ce métal est un oligoélément pour les plantes (leur besoin en manganèse varie de 10 à 50 mg/kg de tissu). Il est cependant facilement bioconcentré et bioaccumulé par de nombreux organismes aquatiques (avec un facteur de concentration de 2 000 à 20 000 pour les végétaux supérieurs marins et d'eau douce, de 2 500 à 6 300 pour le phytoplancton, de 300 à 5 500 pour macroalgues marines, de 800 à 830 pour les moules de la zone intertidale et de 35 à 930 pour les poissons[47].
À la fin du XXe siècle, la teneur moyenne en manganèse des organismes aquatiques (crustacés[73], mollusques, poissons) est d'environ 10 μg/g (en poids frais)[74], mais dans l'eau sa bioaccumulation et concentration dans le réseau trophique augmente avec la température, mais elle décroît avec l'augmentation du pH et la salinité[47].
Selon les données et études disponibles :
- ce métal est facilement bioconcentré et bioaccumulé par de nombreux organismes aquatiques (avec un facteur de concentration de 2000 à 20000 pour les végétaux supérieurs marins et d'eau douce, de 2500 à 6300 pour le phytoplancton, 300-5500 pour macroalgues marines, 800-830 pour les moules de la zone intertidale, et de 35 à 930 pour les poissons[47] ;
- les invertébrés aquatiques et les poissons l'absorbent plus, et de manière significative quand la température augmente et que le pH diminue (deux tendances qui s'exacerbent dans le cadre de la crise écologique. Face à ces deux facteurs, l'oxygène dissous n'a alors aucun effet significatif. De plus, l'absorption du manganèse augmente quand la salinité de l'eau diminue[47] (or la fonte des glaciers et des calottes polaires est une source d'eau douce supplémentaire significative dans certaines parties de l'océan d'enjeu majeur pour les ressources halieutiques)[47] ;
- à la fin du XXe siècle, la teneur moyenne en manganèse des organismes aquatiques (crustacés, mollusques, poissons) est d'environ 10 μg/g (en poids frais)[74], mais dans l'eau sa bioaccumulation et concentration dans le réseau trophique augmente avec la température, décroit avec l'augmentation du pH[47].
Toxicité
Chez l'adulte humain en bonne santé, 3 à 5 % du Mn ingéré est absorbé lors du passage du bol alimentaire dans l'intestin et passe dans le sang. Ce qui n'est pas utilisé par le métabolisme normal est ensuite rapidement éliminé par le foie qui l’excrète dans la bile qui le renvoie vers l'intestin d'où il sera évacué via les excréments[75].
Une autre partie, solubilisée en voie aqueuse, est retrouvée dans l'urine[76].
Cependant ingéré au-delà de quelques mg/j, il devient — selon le modèle animal et les données issues de la médecine du travail — neurotoxique, induisant des troubles éventuellement graves et irréversibles du système nerveux et neuromoteur[77] - [78]. Des rapports de cas individuels ou en séries d'intoxication sont régulièrement faits depuis 1837[78]. Une étude canadienne a conclu que dans l'eau potable, il peut nuire aux performances cognitives et au développement intellectuel de l'enfant[79] - [80]. Les troubles neurodégénératifs qu'il induit sont irréversibles (évoquant une maladie de Parkinson idiopathique[81]. Selon Takser et al. (2003), « Bien qu'il existe un risque d'accumulation de Mn dans le fœtus lors de la grossesse, peu d'informations existent sur les effets du développement de l'exposition de bas niveau de l'environnement chez l'Homme »[81], mais les données disponibles « suggèrent que l'exposition environnementale au Mn in utero pourrait affecter le début du développement psychomoteur » chez le nouveau-né[81].
La zone de limite de sécurité définie en France par l'ancienne Afssa, devenue Anses est de 4,2 à 10 mg/j, la dernière étant la limite de sécurité[82].
L'inhalation d'aérosols de dioxyde de manganèse est également dangereuse pour les voies pulmonaires[83], y compris chez les soudeurs[78].
En cas d'exposition professionnelle ou environnementale et avant même l'apparition des manifestations cliniques d'une intoxication aiguë ou chronique, des tests de comportement neurologiques, neuropsychologique et neurophysiologique peuvent révéler de premiers signes de neurotoxicité du manganèse. Ils mettent en évidence un ralentissement des fonctions motrices, avec augmentation des tremblements, vitesse réduite de réponse neuromusculaire, de possibles déficit des sens olfactif et de la mémoire, des déficits intellectuels et des changements d'humeur[84]. Selon les chercheurs Mergler et Baldwin, si plusieurs études ont suggéré une relation dose-effet, d'autres n'ont pas trouvé de relation claire entre une exposition au manganèse déterminée par des estimations et sa possible incorporation qui est détecté de manière externe par les résultats de tests neurologiques et ensuite mesurée concrètement par les diverses teneurs dans le sang, l'urine ou les cheveux, qui peuvent traduire comme pour le plomb dans le cadre du saturnisme une imprégnation plus ancienne, notamment chez les enfants vivant près de zones à risques de contamination par le manganèse, notamment les zones minières ou industrielles)[85] - [86].
Le (méthylcyclopentadiényl)manganèse tricarbonyle autrefois associé au plomb dans les carburants, puis encore utilisé comme antidétonant dans l'essence mais à moindre dose en raison de sa toxicité, également utilisé comme fongicide, pourrait être une source d'exposition à ne pas négliger selon Mergler& Baldwin (il était en diminution aux États-Unis, mais alors que son utilisation progressait dans les pays pauvres)[87].
Les mécanismes biochimiques sous-jacents à la toxicité du manganèse commencent à être mieux compris. On sait qu'il existe des susceptibilités individuelles au moins en partie d'origine génétique[88], et que le processus toxique impliquent l'auto-oxydation de la dopamine et une production de radicaux libres qui induiront ultérieurement des lésions neuronales[88]. Le manganèse pourrait aussi être un perturbateur endocrinien, car les analyses faites en médecine du travail montrent qu'un faible niveau d'exposition aux oxydes de manganèse en milieu industriel suffit à induire un changement dans la répartition de la Prolactine sérique qu'on trouve aussi à des taux plus élevés chez les travailleurs exposés par rapport à des témoins appariés, et ces valeurs anormalement élevées persistent dans le temps chez ces travailleurs[88]. D'autres marqueurs biochimiques ont fait l'objet d'évaluations, et un modèle dose-réponse d'après le Mn urinaire considéré comme marqueur d'exposition conclu à une dose de référence faible (0,4 µg de Mn par litre d'urine), « ce qui impliquerait que l'exposition environnementale au manganèse peut contribuer à des taux de prolactine sérique anormalement élevée dans la population générale »[88].
Alors que l'on constate une forte progression de la maladie de Parkinson (500 000 à 1,5 million de cas par an aux États-Unis), les médecins doivent mieux considérer l'exposition au manganèse lors du diagnostic différentiel[78]. A priori, le médecin du travail peut contribuer à limiter l'exposition à ce métal et par suite ses effets néfastes sur santé au travail[78].
Écotoxicité
« La plupart des essais de toxicité a été réalisée à l'aide de manganèse ionique » et l'écotoxicité globale reste assez mal cernée. On sait encore peu de choses sur la toxicité aquatique des formes colloïdale, particulaires, nanoparticulaire et complexées du manganèse[47] (ces trois dernières formes étant cependant généralement considérées comme moins toxiques à doses équivalentes[47]).
Il est possible de modéliser le comportement du manganèse dans l'environnement par le manganèse 54[89]. Mais ces informations indicatrices de son suivi et de sa localisation ne résolvent nullement l'évaluation écotoxicologique qui est compliquée par :
- le fait que le seuil critique varie considérablement selon les espèces mais aussi parfois selon les cultivars ou les sous-populations de l'espèce considérée[47] ;
- le fait qu'il agit en synergie avec d'autres éléments (la silice par exemple[90]), et/ou d'autres toxiques, positivement ou négativement selon les cas[47].
Comme le manganèse est un oligoélément, des effets toxiques apparaissent dans deux situations :
- carence : d'une part en cas de carence (qui peut être facilité dans les sols calcaires, en particulier s'ils sont engorgés et riches en matière organique[47]) ;
- excès : c'est-à-dire au-dessus de seuils de concentration mais qui varient selon les espèces ou des susceptibilités génétiques individuelles ou propres à une sous-populations.
De plus, pour une même présente environnementales, les effets négatifs apparaissent à des doses plus faibles, et avec une cinétique environnementale (mobilité dans les sols et sédiment notamment) accélérée dans les milieux anaérobies et acides, car ils rendent ce métal nettement plus biodisponibilité (sol) (à partir des oxydes)[47]. Sa mobilité semble très liée à son degré d'oxydation (qui dépend du pH ; avec un transfert rapide en milieux acide et ralenti rapidement au-dessus d'un pH 7) :- le manganèse se montre par exemple inhibiteur ou toxique à des doses infimes pour certaines levures : l'ajout d'une dose aussi faible que 2 ppb de ferrocyanure de manganèse à la mélasse de betterave (déchet ou sous-produit de l'industrie sucrière) utilisée comme substrat de fermentation acide (pour produire de l'acide citrique via sa décomposition par une levure ; Aspergillus niger (souche CNRC A-1-233) suffit à entraîner une chute de 10 % du rendement en acide. Cet ajout produit aussi un changement dans la morphologie de la levure stressée (qui passe d'une forme en granule à une forme filamenteuse). Des ajouts encore plus faibles (0,4 à 2 ppb) suffisent à produire l'agglomération des levures (réaction de stress a priori), tandis que des ajouts plus importants (2 à 100 ppb) entraînent des baisses des rendements plus élevées.
Le rendement obtenu à 100 ppb chute à 25 % de celui obtenue à 1 ppb ou moins. En laboratoire, aucun des autres métaux testés (Al3+, Ca2+, Co2+, Cu2+, Fe2+, Mg2+, Ni2+, Zn2 +) n'a cet effet, ni n'a même visiblement changé la morphologie de la levure. Et seuls Al3+, Fe2+ et Zn2+, mais à des concentrations relativement plus élevées (5-25 ppm), ont produit une réduction de la production d'acide. En outre, l'effet néfaste du manganèse sur la croissance et la production d'acide n'a pas été affecté par l'addition de ces autres métaux[91], - il se montre toxique à des doses assez faibles de l'ordre du mg/L pour certaines algues (ex[47] : diatomée marine Ditylum brightwellii[Note 7] ou l'algue d'eau douce Scenedesmus quadricauda[Note 8],
- au-delà de sa dose d'oligoélément, il peut causer aux plantes des chloroses marginales, des lésions nécrotiques et un développement inégal des feuilles. « Chez les plantes vivrières, la présence de manganèse à des concentrations toxiques est également très variable, avec des valeurs critiques qui vont de 100 à 5 000 mg/kg »[47],
- il affecte la survie des daphnies (Daphnia magna) à des doses très variables selon la dureté de l'eau : selon l'OMS, « les tests toxicologiques pratiqués sur des invertébrés aquatiques mettent en évidence des valeurs de la CL50 ou de la CE50 à 48 h allant de 0,8 mg/L (Daphnia magna) à 1 389 mg/L (Crangonyx pseudogracilis), les valeurs les plus faibles de la CL50 étant observées dans des eaux de faible dureté (25 mg de carbonate de calcium par litre) »[92],
- une exposition à 0,01 mg/L durant sept jours diminue significativement le taux d'éclosion de larves de crabe jaune (Cancer anthonyi)[47],
- les poissons y présentent une sensibilité très différente selon les espèces (la larve du saumon Coho y est beaucoup plus vulnérable que celle du poisson chat Heteropneustes fossilis)[47]. Surtout si l'acidité augmente (pH inférieur à 5), à des doses inférieures à 0,5 à 1 mg/L le manganèse peut tuer les œufs ou alevins de truites[93] - [94]. Une maladie de la coquille du crabe bleu (Callinectes sapidus) a été attribuée à une pollution par le manganèse, qui par ailleurs se dépose sur les branchies de la langoustine Nephrops norvegicus en les colorant en brun ou noir (dans des zones hypoxiques du sud-est du Kattegat (en mer Baltique au large de la Suède)[47],
- de manière générale, la dureté de l'eau et la présence d'agents chélateurs diminuent l'écotoxicité du manganèse[47],
- de manière générale, en eau douce, 1 mg/L suffit à causer des effets toxiques sur les organismes aquatiques« Une valeur d'orientation générale pour la protection de 95 % des espèces avec 50 % de confiance a été proposée à 0,2 mg de manganèse/L pour les eaux douces »[47]. Cette valeur est de 0,3 mg/L pour le milieu marin[95].
- le manganèse se montre par exemple inhibiteur ou toxique à des doses infimes pour certaines levures : l'ajout d'une dose aussi faible que 2 ppb de ferrocyanure de manganèse à la mélasse de betterave (déchet ou sous-produit de l'industrie sucrière) utilisée comme substrat de fermentation acide (pour produire de l'acide citrique via sa décomposition par une levure ; Aspergillus niger (souche CNRC A-1-233) suffit à entraîner une chute de 10 % du rendement en acide. Cet ajout produit aussi un changement dans la morphologie de la levure stressée (qui passe d'une forme en granule à une forme filamenteuse). Des ajouts encore plus faibles (0,4 à 2 ppb) suffisent à produire l'agglomération des levures (réaction de stress a priori), tandis que des ajouts plus importants (2 à 100 ppb) entraînent des baisses des rendements plus élevées.
Radiotoxicité
Le manganèse a 29 isotopes radioactifs. Ils vont du 44Mn au 67Mn. Ils semblent quasi absents dans la nature (bruit de fond indétectable) mais peuvent être bioconcentrés et bioaccumulés par exemple par les bryophytes aquatiques (Fontinalis, Cinclidotus et Platyhypnidium, avec un facteur de concentration de 15 000 à 25 000 (exprimé par rapport au poids frais) selon Beaugelin-Seiller, 1994 cité par IRSN, 2001) croissant en zone d'influence de rejets liquides radioactifs d'installations nucléaires.
Les plus importants des radioisotopes (pour les rejets et applications industrielles ou de laboratoire) seraient :
- le 54Mn utilisé comme radiotraceur β+ et gamma utilisé par l'industrie minière et métallurgie. Sa période radioactive est de 312,5 j, pour une activité massique de 2,87 × 1014 Bq/g[96]. Il est facilement dosé par spectrométrie gamma (835 keV) ;
- le 56Mn qui est un émetteur β− et gamma, avec comme émission(s) principale(s) par désintégration : 2 848 keV (100 % de rendement d'émission) en rayonnement bêta et 847 keV (98,9 %) en rayonnement gamma[96]. C'est un isotope à courte période radioactive (2,5 heures) et utilisé comme radiotraceur en biologie[97].
Tous deux sont produits par les centrales nucléaires ; c'est un produit d'activation du fer stable des structures des réacteurs nucléaires (réaction n, p sur le 54Fe), entrainé dans l'environnement à la suite de la corrosion des métaux, et sous forme particulaire dans le flux neutronique du réacteur. Au début des années 2000, on estimait que le radio-manganèse représentait 1 à 2 % de l’activité gamma totale (hors tritium) rejetée sous forme liquide par le parc électronucléaire EDF, soit de l’ordre de 1 GBq/an[98].
En usines de retraitement, il « provient des assemblages combustibles sur lesquels se fixent des produits d’activation, sous forme d’oxydes. Lors de l’opération de dissolution du combustible, le manganèse est remis en solution. L’activité rejetée en 54Mn se présente essentiellement sous forme liquide, elle s’élevait à 12 GBq en 1999 pour l’usine de La Hague (Van der Stricht et Janssens, 2001 cités par IRSN, 2001) et à 20 GBq en 2002 pour l’usine de Sellafield (BNFL, 2003 cités par IRSN 2001) ».
Selon l'IRSN, « les paramètres radioécologiques caractérisant son transfert au long de la chaîne sol → plante → aliment sont assez bien connus (par exemple étudiés chez les truites[99] - [100], mais non chez les bivalves filtreurs, pourtant jugés intéressant comme biorévélateur de la contamination d'un milieu[101]), contrairement au transfert foliaire, quasiment non étudié pour cet élément »[74]. Ils semblent très variables selon les espèces et peut-être certains cofacteurs. Les effets radiotoxiques de ses isotopes radioactifs restent mal connus, mais l'IRSN en 2001 a publié une fiche sur le 54Mn (émetteur β−)[74]. Chez l'animal et l'être humain, on peut supposer qu'ils interfèrent avec le métabolisme, car le manganèse est un élément essentiel (à faible dose), dont pour « la minéralisation osseuse, le métabolisme énergétique, la synthèse et l’activation d’enzymes, notamment les métallo-enzymes (superoxyde dismutase mitochondriale, pyruvate carboxylase, arginase du rein, etc.), la protection cellulaire contre les radicaux libres, etc. (ATSDR, 2000, cité par IRSN 2001), avec des teneurs plus élevées dans la mélanine et dans le foie, pancréas, reins et autres organes riches en mitochondries. L'incorporation du manganèse semble se faire surtout via l'ingestion puis diffusion via le sang, lié aux protéines plasmatique (albumine, transferrines) »[102].
Occurrence terrestre et gisements
Le manganèse est le troisième métal de transition, le plus abondant dans la croûte terrestre, après le fer et le titane. Le clarke est de l'ordre de 1 000 à 850 g/t dans la croûte terrestre, les valeurs estimées sont nettement plus élevées, entre 1 500 et 1 600 g/t, dans les granitoïdes et plus faibles, entre 400 et 500 g/t, dans les roches magmatiques basiques[103]. Il s'agit d'un élément moyennement abondant[104].
Le manganèse apparaît également, et en particulier à l'état de composés de Mn hydratés associés à des micro-grains de quartz, d'argiles et de feldspath, dans ce que l'on appelle des « nodules polymétalliques » sur le fond du plancher de l'océan[105]. Les nodules les plus intéressants économiquement ont une granulométrie de l'ordre de 8 cm de diamètre moyen et peuvent contenir en moyenne 30 % en masse de composés de Mn. L'eau de structure est souvent en proportion équivalente ou supérieure en masse. Ces nodules comprennent aussi contenir du fer, du nickel, du cobalt, du cuivre, du zinc, du molybdène, du titane, du cérium parfois à raison de 1,5 à 50 %, mais le plus souvent en faibles teneurs. Quelques aires abyssales du Pacifique supporteraient environ 120 000 kg/km2 de manganèse et les réserves de minerais manganifères virtuellement regroupées pourraient dépasser trente milliards de tonnes[106]. Mais l'exploitation est délicate du fait et de la granulométrie centimétrique et de la profondeur des dépôts, et non sans conséquence sur la biodiversité des fonds océaniques[107].

Les nodules d'oxydes métalliques à base de Fe et Mn proviennent à l'origine de l'érosion de dépôts primaires de silicates de manganèse. Ils peuvent aussi provenir de façon plus récente de la corrosion d'acier des navires ou des installations anthropiques[108].
.JPG.webp)
L'élément manganèse se retrouve dans de nombreux silicates, par substitution avec l'ion ferreux, soit dans divers oxydes. Le manganèse passe facilement en solution, il peut ensuite précipiter et se concentrer dans des roches sédimentaires chimiques, comme les minerais oolithiques à gangue calcaire, les minerais à gangue siliceuse ou dolomitique, ou les nodules polymétalliques déjà décrits.
La pyrolusite MnO2 quadratique et la rhodochrosite MnCO3 c'est-à-dire le « manganspath » ou dialogite des anciens chimistes ou minéralogiste, la rhodonite CaMn4(Si5O15), la braunite Mn7SiO12, voire la manganite MnO(OH) monoclinique en aiguilles présentant des macles noires à brunes et la hausmannite Mn3O4 des filons hydrothermaux et des roches sédimentaires oolithiques sont des minéraux communs[Mindat 10]. L'acerdèse Mn2O3 • H2O, la braunite et l'hausmannite peuvent être communes dans certains sols. L'alabandite ou autrefois alabandine est un sulfure de manganèse cubique MnS.

Il existe d'énormes gisements d'oxydes de manganèse non cristallins accompagnant parfois la pyrolusite, ils sont nommés d'un terme générique : le « wad » (en)[109] - [Mindat 11].
Le manganèse natif a été mis en évidence à l'échelle micrométrique par une équipe géologique russe en 2001, mais la validation de l'étude, il est vrai délicate sur ces échantillons très rares, a été rejetée par l'association internationale de minéralogie[Mindat 12]. Les nombreux minéraux du manganèse, sous forme de composés chimiques de manganèse, sont surtout associés en pratique aux minerais de fer ou, à défaut, aux diverses roches contenant en quantité non négligeable du fer et du chrome. L'eau ferrugineuse peut exceptionnellement contenir une concentration maximale de divers anions manganèse de 0,5 g/l[28].
Minerais et extractions minières, réserves

Les minerais les plus abondants sont des oxydes de manganèse[39] : la pyrolusite MnO2, l'ancien psilomélane [(Ba,H2O)2Mn5O10], le groupe des cryptomélanes ou de la coronadite, des hydroxydes ou oxyhydroxydes produits d'altération, comme des mélanges de vernadite, birnessite ou encore des carbonates comme la rhodochrosite (MnCO3)[Mindat 14]. Ils sont trouvés dans des gisements « stratiformes syngénétiques, sédimentaires ou hydrothermaux-sédimentaires (surtout en milieu détritique, mais aussi en milieu carbonaté) ou volcano-sédimentaires, résultant d’une précipitation chimique en milieu aqueux, sous conditions physico-chimiques favorables ».
Avant le milieu du XIXe siècle, en France, les minerais exploités qui correspondent à un grand nombre de minéraux, en particulier oxydes, hydroxydes, oxyhydroxydes, silicates, etc., de manganèse insérés dans des roches se nomment communément sous une dénomination générique la manganèse. Les mines du secteur de Périgueux, de Saint-Martin… en Dordogne, sont actives sous l'Ancien Régime : la manganèse s'y dénommait « pierre de Périgueux ». Les divisions minéralogiques sous le Consulat et l'Empire signalent en particulier les départements producteurs de Sâone-et-Loire (secteur minier réputé de Romanèche, près de Mâcon), de la Loire, du Bas-Rhin (Dambach), de la Sarre (mine de Kreslenich, canton de Wadern), du Gard (mine cévenole de Saint-Jean de Gardonenque) et du Périgord[110].
La période de la Restauration relance les investigations minières. La manganèse est à nouveau exploitée à partir de 1817 à Saint-Martin-de-Fressengeas, puis à Milhac-de-Nontron de 1833 à 1841 et à Saint-Pardoux-la-Rivière de 1840 à 1912[111]. De 1823 à 1949 (date de la fermeture de la production minière métropolitaine de Saint-Prix en Saône-et-Loire), la France n’a produit selon le bureau de recherches géologiques et minières « qu’environ 0,875 Mt de minerai à des teneurs inférieures à 50 % Mn »[39]. La plupart des gîtes y sont modestes et isolés. Les ressources rentables et exploitables sont situés au Sud, dans les Pyrénées, les Corbières, dans la montagne Noire et sur les bords nord/nord-est du Massif central[39]. Le minerai y est par exemple exploité dans le district de Las Cabesses en Ariège par le second producteur de manganèse français (avec 0,195 Mt de minerai extrait de à ), un autre site (gîtes plus dispersés résultant de minéralisations lenticulaires à basse teneur enfouies dans les couches mésozoïques de grès, argiles du Permo-Trias et du Lias basal sont par exemple exploités à Chaillac dans l’Indre.
Le minerai est rarement présent sous forme de gros filons, hormis à Romanèche en Saône-et-Loire, qui fut le premier producteur français, avec 0,435 Mt de minerai extrait de à [39]. Quelques mines (une dizaine) de taille modeste ont opéré ailleurs (Pyrénées, Montagne Noire, Corbières, Morvan) au XIXe et début du XXe siècles, produisant de 2 000 à 28 000 t de minerai au total par gisement.
La presque totalité du minerai extrait sert à fabriquer à la fin du XXe siècle des ferroalliages à partir de ferromanganèse carburé ou ferromanganèse affiné, et/ou du silico-manganèse de composition approchée en Mn 65 à 68 %, Si de 16 à 21 %, C de 1,5 à 2 %[39] - [44].
Production et économie
Le manganèse relativement abondant figure à la quatrième place des métaux usuels de nos sociétés modernes, après le fer, l'aluminium et le cuivre[112].
Techniques de production
Les divers oxydes de manganèse peuvent être réduits par le carbone ou charbon au four électrique. Mais le corps simple contient beaucoup de traces d'impuretés à base de carbone. L'aluminothermie, c'est-à-dire la réaction avec de la poudre d'aluminium, est aussi une technique ancienne, déjà décrite par les cours de chimie de Louis Troost. Ainsi la réduction fortement exothermique de MnO2 à défaut de celle de Mn3O4 permet d'obtenir le corps simple métal.
- 3 MnO2 solide + 4 Al poudre métallique → 3 Mn manganèse β + 2 Al2O3 alumine = −1 791 kJ/mol
On peut aussi réduire le chlorure de manganèse MnCl2 par le métal sodium. Le carbonate de manganèse chauffé au rouge blanc dans un creuset de chaux (entouré de chaux vive) ou en creuset réfractaire peut être réduit par le charbon actif.

On peut préparer le manganèse métallique industriellement à partir d'une solution de sulfate de Mn(II) et d'acide sulfurique bimolaire, en imposant une tension de 4,5 V avec une intensité de courant avoisinant 35 000 ampères. Outre MnSO4, l'électrolyse de MnCl2 est aussi une technique connue.
Le raffinage du manganèse métal s'est développé avec les emplois chimiques ou électrotechniques réclamant une pureté plus grande. Le métal pur est longtemps resté l'objet d'une production assez dérisoire, de l'ordre de quelques %, en comparaison de la production ultra-majoritaire de ferromanganèses, à base de 30 à 80 % en masse de manganèse, pour la sidérurgie, autrefois à partir de hauts-fourneaux remplis de coke et de minerais mixtes de Fe et Mn. Différents de ces derniers composés intermédiaires, mais également obtenus par réduction des minerais de manganèse avec le carbone, les spiegels n'ont qu'une teneur inférieure à 30 % en masse de Mn.

Production mondiale
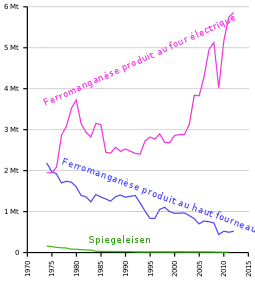
Au début des années 1990, les principaux pays producteurs étaient, essentiellement pour les minerais à faibles teneurs, la Russie et ses anciens voisins de la CEI, le Kazakhstan et Ukraine, la Chine et l'Inde et surtout, pour les minerais à fortes teneurs, l'Afrique du Sud, le Gabon, le Brésil, et l'Australie[113] - [114]. La production mondiale annuelle de minerai de manganèse était estimée à trente millions de tonnes au début de la décennie. Les grands exportateurs étaient alors le Gabon, le Brésil, l'Australie et l'Ukraine. En 1990, les plus grands importateurs étaient le Japon, la Chine et la France.
Dès les années 1980, le marché des ferroalliages, matériaux intermédiaires recherchés par les groupes sidérurgiques pour la fabrication de l'acier et ses dérivés techniques, est accaparé par les producteurs de manganèse. Des accords de transferts technologiques s'établissent entre pays industrialisés et pays producteurs de minerais. Ainsi pour assurer à long terme un leadership, le puissant groupe minier d'Afrique du Sud, Samancor, s'associe à un consortium de groupes nippons, en particulier les divisions Ferralloys de Japan metal & Chemical & Mitsui et de Mizuschina & Ferroalloys industries Sumitomo.
Le ferromanganèse est de plus en plus majoritairement produit en four électrique à arc et de moins en moins selon les procédés le plus souvent anciens en haut-fourneau.
Production(s) pour l'année 2013 en millions de tonnes d'équivalent manganèse, répartie(s) entre les principaux pays miniers producteurs, avec leurs éventuelles réserves minières estimées de manganèse[115] :
| Pays | Production minière en équivalent Mn (Mt) |
% mondial | Réserves estimées (Mt) | |
|---|---|---|---|---|
| 1 | Afrique du Sud | 4,3 | 25,4 | 150 |
| 2 | Chine | 3 | 17,7 | 44 |
| 3 | Australie | 2,975 | 17,6 | 97 |
| 4 | Gabon | 1,967 | 11,6 | 24 |
| 5 | Brésil | 1,12 | 6,6 | 54 |
| 6 | Inde | 0,92 | 5,4 | 49 |
| 7 | Ghana | 0,533 | 3,2 | - |
| 8 | Malaisie | 0,43 | 2,5 | - |
| 9 | Kazakhstan | 0,39 | 2,3 | 5 |
| 10 | Ukraine | 0,3 | 1,8 | 140 |
| Total monde | 16,9 | 100 | 570 | |
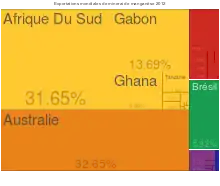
En 2015, presque 46 millions de tonnes de minerais manganésés ont été extraites dans le monde, pour produire l'équivalent de 15,3 millions de tonnes de manganèse[116].
En France, les ressources seraient de l'ordre de 150 à 160 000 t de minerai[39]. L'industrie française est aujourd'hui importatrice de minerai provenant du Gabon principalement, le pays faute de mines ne produit quasiment pas de manganèse, mais la société Eramet figure parmi les premières entreprises minières pour l'extraction du Mn.
Commerce
En 2014, la France est nette importatrice de manganèse, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 220 €[117].
Notes et références
Notes
- Il se peut aussi qu'à l'origine que ce soit aussi une caractéristique de l'antique et prospère cité de Ionie, Magnésie du Méandre, disparue plus précocement. La Magnésie désignait une région naturelle d'Asie Mineure riche en aimants naturels. L'Ionie est une région côtière, la Lydie est à l'intérieur des terres. La petite région de Magnésie du Sipyle a laissé son nom à la province turque de Manisa ou à sa ville centre Manisa.
- Ici il y a une confusion possible de la magnésie noire ou oxyde de manganèse MnO2 avec la « magnésie blanche » ou oxyde de magnésium MgO ou son dérivé hydrolysé, l'hydroxyde de magnésium Mg(OH)2 que l'on trouvait en abondance sous forme initiale de magnésite, giobertite ou pinolite… dans un nome de Thessalie. Ce district antique de Magnésie en Thessalie, cet ancien petit royaume de forgerons réputés serait à l'origine des cités déjà nommées de Ionie ou de Lydie ou encore d'une ancienne petite cité homonyme dans le Péloponnèse, plus tard contrôlé par la cité lacédémonienne de Sparte. La magnésie blanche attesté en français vers 1762 se nomme en latin médiéval magnesia, terme qui provient également du latin magnes lapis ou « pierre de magnésie ».
- Les « manganates alcalins » sont obtenus par calcination à l'air en coupelle d'argent de poudre de dioxyde de manganèse et d'un alcali caustique. Le manganate de sodium est alors le corps central de la préparation industrielle d'oxygène par le procédé de Maréchal et Tessié du Motay, breveté en 1865. Le manganate de sodium est chauffé à 500 °C pour libérer de l'oxygène, mais aussi un mélange de dioxyde de manganèse et de soude, ce dernier résidu servant par chauffage à l'air et à 350 °C à obtenir par recyclage le manganate de sodium.
- Les deux demi-réactions théoriques s'écrivent respectivement :
- MnO42−aq + 4 H3O+ + 2 e− == MnO2 solide + 2 H2O ε0 = 2,26 V
- MnO42−aq == MnO4− solide + e− ε0 = 0,56 V.
- Ce sous-groupe comprend les cinq éléments-types Zn, Co, Mn, Ni, Mn et Fe(II) ou fer ferreux.
- La composition peut aussi être Cu 54 % Ni 44 % Mn 1 % Fe 0,5 % avec des chouïas de Zn et Sn.
- CE50 à cinq jours (basée sur l’inhibition de la croissance) = 1,5 mg/L.
- CE50 à douze jours (basée sur la réduction totale de la chlorophylle) = 1,9 mg/L.
Références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832-2838 (DOI 10.1039/b801115j)
- SIGMA-ALDRICH
- « Maganèse élémentaire » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Entrée « Manganese, Powder » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 11 février 2010 (JavaScript nécessaire)
- Par exemple, lire pour ce sous-chapitre le Dictionnaire étymologique et historique du français et Grand Dictionnaire Larousse du XXe siècle. L'étude lexicologique inclut aussi la consultation du Grand Robert.
- Grand Dictionnaire Larousse du XXe siècle.
- Le Grand Dictionnaire Larousse du XXe siècle présente ces usages.
- Le terme de magnésie noire est aussi très souvent réservé à un minéral produit d'altération de la pyrolusite, la manganite MnO(OH) ou à des dérivés similaires. Ce dernier corps minéral cité, souvent en aiguilles, était dénommé autrefois « acerdèse » à l'instar d'autres oxyhydroxydes d'aspects similaires.
- D. N. Trifonov et V. D. Trifonov, Chemical Elements: How They Were Discovered, édition Mir de 1982 trad. du russe par O.A. Glebov et I.V. Poluyan, 1984. En particulier chapitre IV.
- Faucherre 2011 donne les rudiments de la découverte de l'élément. Cette dénomination française de « manganèse », synonyme de magnésie noire, plus tard abrégée en mangane, est attestée en 1578 par les écrits de Vigenère sur l'empire ottoman ou sa traduction des « Tableaux de Philostrate ». Ces données sont assez communes, que ce soient dans le Trésor de la langue française, à l'entrée manganèse, ou les multiples éditions de Dictionnaire étymologique et historique du français de Albert Dauzat, Jean Dubois, Henri Mitterand. La nomenclature française serait à l'origine du latin scientifique manganesium, qui, abrégé en allemand technique, donne le mot neutre das Mangan.
- Chalmin 2003.
- Il s'agit d'une appellation technique, popularisé dans les vieux dictionnaires encyclopédiques Larousse, le Grand Robert ou par exemple de nombreux sites techniques sur le verre
- Le Coze, J. (2013), Mines d’acier, magnesia nigra–le manganèse dans les aciers, depuis quand ?, Matériaux & Techniques, 101(4), 404 (résumé).
- Luft 1997. Comme le rappelle dans les usages Faucherre 2011, cet emploi ancien de désulfuration, de désoxygénation ou de recarburation tend à disparaître dans le haut fourneau. Ces traitements purificateurs laissaient ainsi MnO2 et MnS dans les scories sidérurgiques.
- J. S. Mac Hargue, The role of manganese in plants, Journal of American Chemical Society, 44, 1922, p. 1592-1598.
- Selon cet éminent chercheur en 1937, le manganèse figure à l'état de traces significatives dans un grand nombre d'organismes vivants, avec les autres « oligo-éléments » que sont le fluor, le brome, l'iode, le bore, l'arsenic, le silicium, le fer, le zinc, le cuivre, le nickel, le cobalt, le manganèse, l'aluminium, le plomb, l'étain, le molybdène, le vanadium et le titane.
- Lee 1979.
- Pour l'extension succincte du groupe à la chimie nucléaire, Breuer 2000.
- Courte présentation du Mn par le National Laboratory de Los Alamos.
- Faucherre 2011, chap. 2, propriétés.
- J. A. Oberteuffer et J. A. Ibers, A refinement of the atomic and thermal parameters of α-manganese from a single crystal, dans Acta Crystallographica, 1970, B26, S. 1499–1504, DOI 10.1107/S0567740870004399.
- C. B. Shoemaker, D. P. Shoemaker, T. E. Hopkins et S. Yindepit, Refinement of the structure of β-manganese and of a related phase in the Mn-Ni-Si system, dans Acta Crystallographica, B34, 1978, S. 3573–3576, DOI 10.1107/S0567740878011620.
- R. G. W. Wykhoff, Crystal structures, 1963, 1, S. 7–83.
- les données qualitatives de chimie descriptive sur ce métal sont assez bien connues depuis le milieu du XIXe siècle, par exemple dans les éditions successives du « cours précis de chimie » de Louis Troost, élève de Sainte-Claire Deville. Par contre, les données quantitatives sont peu précises du fait de l'impureté des préparations du corps simple et de la fiabilité des mesures physiques. Ainsi les températures de transition de phase de premier ordre, comme la fusion et surtout l'ébullition, restent longtemps minorées.
- Présentation chimique sur Futura sciences ou aperçu de la chimie du Mn, cette dernière adaptée de l'ouvrage de A. Earnshaw et Norman Greenwood, Chemistry of the Elements, 2e éd., 1997 (ISBN 978-0-7506-3365-9), en particulier chap. 24 : Manganese, Technetium et Rhénium, p. 1040–1069.
- Ibid.
- Breuer 2000.
- Lire aussi sur la chimie de base l'article Mn sur Encyclopædia Britannica.
- Voilà une différence avec les éléments de la première série des métaux de transition qui le précèdent, soient le scandium, le titane, le vanadium et le chrome. Bruce H. Mahan, op. cit.
- Luft 1997
- Par exemple, Fatma Jemal Ellouze, Modélisation du comportement thermomécanique d'un alliage à mémoire de forme à base de fer type Fe-Mn-Si (thèse), 2009.
- Faucherre 2011. Le chapitre fait référence à un cours de chimie analytique fondé sur le cours de chimie analytique générale de Gaston Charlot, ainsi que ses méthodes qualitatives et quantitatives, appliquées ici à un stade rudimentaire.
- L'absence de propriétés réductrices le distingue des cations Ti2+, V2+ et Cr2+ de la première série. Bruce H. Mahan, op. cit.
- L'ammoniaque précipite de façon incomplète les sels neutres de manganèse, car il se forme des sels doubles solubles. Louis Joseph Troost, op. cit.
- La présentation par tableau des principaux composés avec quelques propriétés physiques et chimiques essentielles, plus pratique pour une simple approche que les articles cumulés du Gmelin et du Beilstein ou encore les Chemical Abstracts, a été popularisée en chimie technique ou génie chimique par le Perry's Chemical Engineers' Handbook bien avant la sixième ou septième édition. Et les ouvrages récapitulatifs de chimie générale en français tels que le Bernard et Busnot (Maurice Bernard et Florent Busnot, Usuel de chimie générale et minérale, Dunod, Paris, 1996, 560 p. (ISBN 2-10-003050-7). Sans détailler les propriétés, la présentation ci-dessous vise à montrer quelques composés incontournables.
- Aperçu des méthodes analytiques
- Par exemple, pour les minerais de Mn, Méthodes d'analyse chimiques par le Bureau de normalisation indien, département métallurgie
- Fiche manganèse du BRGM sur SIGminesFrance.
- Louis Colombier, Guy Henry, Joëlle Pontet, Gérard Fessier, article « Acier - Technologie », Encyclopædia Universalis, 2001. En particulier Chapitre 7. Aciers alliés début en ligne.
- Introduction aux éléments d'addition pour aciers et fontes, § 5.
- Par exemple, courte présentation, sur vatis.be.
- Robert Luft, Dictionnaire des corps purs simples de la chimie, op. cit.
- Faucherre 2011.
- Luft 1997.
- Par exemple, présentation par un fournisseur. On retrouve ces principales propriétés (à titre d'oligoélément en principe) dans le monde du vivant.
- WHO (2005), Manganese and its compounds: environmental aspects, Concise International Chemical Assessment Document – CICAD- 63, World Health Organization, Genève (CH).
- Par exemple, en horticulture sur le site Promix
- (en) Ben Selinger, Chemistry in the Marketplace : 5e éd., Sydney, Harcourt Brace, , 588 p. (ISBN 0-7295-3300-X), en particulier note sur le manganèse et le sol p.
- Ferrandon, M. et Chamel, A. (1986), Étude de quelques aspects du comportement des oligoéléments (Zn, Mn, Fe) fournis par voie foliaire. In Le rôle des oligoéléments en agriculture. Symposium international. 2 (p. 299-308).
- Olaru, D. A. (1920), Rôle du manganèse en agriculture: Son influence sur quelques microbes du sol. JB Baillières et fils.
- Sharma, P. N. (1992), Pollen fertility in manganese-deficient wheat, Tropical agriculture, 69(1), 21-24 (résumé).
- Une faible carence pour les cultures céréalières est déjà visible sur le feuillage, souvent sans gravité. Une carence catastrophique entraîne la disparition de la végétation. Par exemple, voici ce qui est décrit comme un accident en agriculture productiviste par les fiches arvalis ou encore le rôle déterminant du Mn par un fournisseur d'engrais.
- Ce sous-paragraphe « agriculture et élevage » s'inspire du dictionnaire technique Larousse agricole, article sur le manganèse, édition de base 1981 et suivantes.
- Les études en stations expérimentales, puis en champs se placent à la suite des travaux de Gabriel Bertrand et de Winifred Brenchley. Par exemple, J. S. Mac Hargue, Manganese and Plant Growth, Industrial and Engineering Chemistry, 18 (2), 1926, p. 172–175, DOI 10.1021/ie50194a022, première page
- Eba, F., Ondo, J. A., Mba, S. E., Ollui-M Boulou, M. et Omva-Zué, J. (2007), Taux de manganèse accumule dans quelques plantes vivrières cultivées dans la région manganésifère de moanda (Gabon), Journal de la Société Ouest Africaine de Chimie, 23, 69.
- Techniques d'élevage
- Larousse agricole, article sur le manganèse, déjà cité.
- Larousse agricole, 1981, article sur le manganèse, déjà cité.
- Par exemple, une présentation toxicologique. Lire aussi N. Irving Sax, Handbook of dangerous materials, Reinhold Publishing Corporation, New York, 1951, 848 p., entrée Mn, réactualisé dans Dangerous properties of industrial materials, Van Nostrand Reinhold, 6e éd., 1984 (ISBN 978-0442283049).
- Cours de Marc Fontecave sur la chimie des processus biologiques
- (en) Nutrients requirement of beef cattle National research Coucil (U.S.), National Academy Press (1984)
- Adriano D.C. (1986), Trace elements in the terrestrial environment, New York, NY, Springer - Verlag.
- Birge WJ (1978), Aquatic toxicology of trace elements of coal and fly ash. In: Thorp JH, Gibbons JW, eds. Energy and environmental stress in aquatic systems. Augusta, GA, US Department of Energy, p. 219 – 240 (US Department of Energy Symposium Series 48 ; CONF - 771114)
- Bankovitch V, Carrier G, Gagnon C, Normandin L, Kennedy G, Zayed J (2003), Total suspended particulate manganese in ambient air in Montreal 1981 – 2000, Science of the Total Environment, 308(1 – 3):185 – 193.
- Bhuie AK, Roy DN (2001), Deposition of Mn from automotive combustion of methylcyclopentadienyl manganese tricarbonyl beside the major highways in the Greater Toronto Area, Canada. Journal of the Air & Waste Management Association, 51:1288 – 1301.
- Bratina BJ, Stevenson BS, Green WJ, Schmidt TM (1998), Manganese reduction by microbes from oxic regions of the Lake Vanda (Antarctica) water column. Applied an d Environmental Microbiology, 64(10):3791 – 3797
- Balzer W. (1982), On the distribution of iron and manganese at the sediment/water interface: thermodynamic versus kinetic control, Geochimica et Cosmochimica Acta, 46:1153 – 1161.
- Données françaises
- Adams F, Wear JI (1957), Manganese toxicity and soil acidity in relation to crinkle leaf of cotton. Soil Science Society of America Proceedings, 21:305 – 308
- Barcan V.S., Kovnatsky E.F. et Smetannikova M.S. (1998), Absorption of heavy metals in wild berries and edible mushrooms in an area affected by smelter emissions, Water, Air and Soil Pollution, 103(1 – 4):173 – 195.
- Par exemple, quelques aliments riches en Mn avec tableau sur saveurscanada.com, quelques sources alimentaires de base, sur passeportsante.net, en passant par un essai de classement potentiel, sur regivia.com, ou encore note sur le sirop d'érable, sur saveurscanada.com.
- Baden S.P., Eriksson S.P. et Gerhardt L. (1999), Accumulation and elimination kinetics of manganese from different tissues of the Norway lobster Nephrops norvegicus (L.), Aquatic Toxicology, 46(2):127 – 137.
- C. Adam, K. Beaugelin-Seiller IRSN, Fiche intitulée Fiche radionucléide 54Mn et environnement, 2001, mise à jour (cf source Nuclide, 2003)
- Donna Mergler (1999), Neurotoxic Effects of Low Level Exposure to Manganese in Human Populations, Environmental Research, vol. 80, no 2, février 1999, p. 99–102, résumé
- Donna Mergler, op. cit.
- Baden S.P. et Neil D.M. (1998), Accumulation of manganese in the haemolymph, nerve and muscle tissue of Nephrops norvegicus (L.) and its effect on neuromuscular performance, Comparative Biochemistry and Physiology, 119A(1):351 – 359.
- Levy, B. S. et Nassetta, W. J. (2003), Neurologic effects of manganese in humans: a review, International Journal of Occupational and Environmental Health, 9(2), 153-163 (résumé).
- Menezes-Filho JA, Novaes Cde O, Moreira JC, Sarcinelli PN et Mergler D. (2011), Elevated manganese and cognitive performance in school-aged children and their mothers, Environ. Res., janvier 2011 ; 111(1):156-63. Epub 2010 Oct 12.
- « Le manganèse dans l'eau potable nuirait au développement intellectuel des enfants », , sur Futura-sciences.
- Larissa Takser, Donna Mergler, Georgette Hellier, Josiane Sahuquillo, Guy Huel (2003), Manganese, Monoamine Metabolite Levels at Birth, and Child Psychomotor Development, NeuroToxicology, vol. 24, no 4–5, août 2003, p. 667–674, Eighth International Symposium on Neurobehavioral Methods and Effects in Occupational and Environmental Health, Brescia, Italie, 23-26 juin 2002 (résumé).
- Une présentation de base du Mn, sur docteurbonnebouffe.com, corrigée par l'oligoélément Mn, sur eurekasante.vidal.fr.
- Fiche toxicologique Dioxyde de Manganèse, sur le site de l'INRS.
- Mergler, D. et Baldwin, M. (1997), Early manifestations of manganese neurotoxicity in humans : an update. Environmental research, 73(1), 92-100 (résumé).
- Menezes-Filho, J. A., Paes, C. R., de C Pontes, Â. M., Moreira, J. C., Sarcinelli, P. N. et Mergler, D. (2009), High levels of hair manganese in children living in the vicinity of a ferro-manganese alloy production plant, Neurotoxicology, 30(6), 1207-1213.
- Riojas-Rodríguez H, Solís-Vivanco R, Schilmann A, Montes S, Rodríguez S, Ríos C, Rodríguez-Agudelo Y. (2010), Intellectual function in Mexican children living in a mining area and environmentally exposed to manganese Environ Health Perspect. Oct 2010 ; 118(10):1465-70.
- D. Mergler et M. Baldwin (1997).
- Smargiassi, A. et Mutti, A. (1998), Peripheral biomarkers and exposure to manganese, Neurotoxicology, 20(2-3), 401-406 (résumé).
- Fiche radionucléide de l'Institut de radioprotection et de sûreté nucléaire sur le Mn 54 et son environnement
- Bowen J.E. (1972), Manganese – silicon interaction and its effect on growth of Sudangrass, Plant and Soil, 37:577 – 588.
- D. S. Clark, K. Ito et H. Horitsu, Effect of manganese and other heavy metals on submerged citric acid fermentation of molasses, Biotechnology and Bioengineering, vol. 8, no 4, p. 465–471, novembre 1966 (en ligne 2004/02/18), DOI 10.1002/bit.260080402 (résumé).
- Concise International Chemical Assessment Document 63 Manganese and its compounds: Environmental aspects, par le groupe d'expert comprenant P.D. Howe, H.M. Malcolm et S. Dobson, du Centre for Ecology & Hydrology, Monks Wood, Grande Bretagne pour la World Health Organization, op. cit. en bibliographie, en particulier texte p. 59 et tableau p. 20-21.
- Davies P.H. et Brinkman S.F. (1994), Acute and chronic toxicity of manganese to exposed and unexposed rainbow and brown trout, Fort Collins, CO, Colorado Division of Wildlife (Federal Aid Project #F - 243R - 1) [cited in Reimer, 199 9].
- Davies P.H. et Brinkman S.F. (1995), Acute and chronic toxicity of manganese to brown trout (Salmo trutta) in hard water, Fort Collins, CO, Colorado Division of Wildlife (Federal Aid Project #F - 243R - 2) [cited in Reimer, 1999].
- Les propriétés environnementales des éléments traces, par Roger Papp, en particulier note p. 68
- Nuclides.net (2003), Web Based Computation on Radionuclides and their Radiation. Version 1.0. Institute for Transuranium Elements, Joint Research Center, European Commission.
- Kelly et Thorne, 2003 cité par IRSN, 2001.
- D. Florence et Ph. Hartmann, « Les rejets radioactifs des centrales nucléaires et leur impact radiologique », L’évaluation et la surveillance des rejets radioactifs des installations nucléaires, Congrès de la SFR, Strasbourg, (lire en ligne
 [PDF], consulté le )
[PDF], consulté le ) - Garnier-Laplace J, Adam C, Lathuillière T, Baudin JP, Clabaut M (2000), A simple fish physiological model for radioecologists exemplified for 54Mn direct transfer and rainbow trout (Oncorhynchus mykiss W.). J. Environ. Radioactiv. 49 : 35-53.
- Rouleau C., Tjälve H., Gottofrey J. et Pelletier E. (1995), Uptake, distribution and elimination of 54Mn(II) in the brown trout (Salmo trutta), Environ. Toxicol. Chem. 14, 483-490.
- Reilhes O. (1997), Caractérisation de la moule zébrée, Dreissena polymorpha, comme bioindicateur de pollution radioactive, Rapport de DEA Toxicologie de l’Environnement, Univ. de Metz.
- Schäfer U. (2004), Manganèse, dans Elements and their Compounds in the Environment, Éds. Merian, Anke, Ihnat et Stoeppler, 2e éd., Wiley-VCH Weinheim (D), vol. 2, Metals and their Compounds, 901-930.
- Alain Foucault, op. cit.
- « Mn », sur le site UDPPC ou Union des professeurs de physique et de chimie.
- Piper D.Z. (1974), Rare earth elements in ferromanganese nodules and other marine phases, Geochimica et Cosmochimica Acta, 38(7), 1007-1022.
- Présentation des nodules polymétalliques, sur isa.org.
- Communiqué de presse Ifremer, juin 2016
- Comment se forment les nodules polymétalliques de manganèse, OSI Univers, 2017
- Il s'agit à l'origine du black wad désignant des séries d'oxydes naturels hydratés de manganèse selon les géologues anglais. Lire la définition du CNRTL.
- Nicolas Desmarest, Encyclopédie méthodique. Géographie Physique, éditeur H. Agasse, Paris, 1811, en particulier t. IV, 780 p., en particulier p. 231 de l'article France. Les anciennes mines vosgiennes de Gemaingoutte, de Ban-de-Laveline, du Tholy sont déjà abandonnées vers 1800.
- Le secteur de Nontron, bien connu des minéralogistes collectionneurs sur Géowiki
- Introduction facile par la société chimique de France, 2016
- Breuer 2000, en particulier présentation du Mn.
- Micro-Encyclopédie nomade Larousse, 2006.
- « USGS Minerals Information: Manganese », sur minerals.usgs.gov (consulté le )
- Données techniques de la SCF, actualisées pour l'année 2015.
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=26020000 (consulté le ).
Autres références
De Mindat.org :
- « Manganocalcite ».
- « Manganapatite ».
- « Manganite » ou oxyhydroxyde de Mn(III) cubique.
- « Manganosite ».
- « Polianite », variété minérale de la pyrolusite.
- « Pyrochroite ».
- « Alabandite ».
- « Scacchite ».
- « Szmikite ».
- « Hausmannite ».
- « Wad », aspect minéral non spécifique.
- « Manganese ».
- « Manganese Mines ».
- Par exemple, présentation du groupe des cryptomélanes ou de la coronadite, dont les minéraux types sont présents dans les dendrites manganées. Autre présentation de la « vernadite » et de la « birnessite ».
Bibliographie

- Agrawal S.J. et Srivastava A.K. (1980), Haematological responses in a fresh water fish to experimental manganese poisoning, Toxicology, 17(1):97–100.
- Alessio L, Lucchini R (1996), Manganese and manganese compounds. In: Argentesi F, Roi R, Sevilla Marcos JM, eds. Data profiles for selected chemicals and pharmaceuticals 3, 4, 5. Ispra, European Commission, Joint Research Centre.
- Peter William Atkins, Loretta Jones, Leroy Laverman, Principes de Chimie, 6e éd. 2014 révisée, De Boeck supérieur, 1088 p., trad. de l'ouvrage Chemical Principles par André Pousse (ISBN 9782807306387). En particulier p. 713.
- ATSDR (2000), Toxicological profile for manganese (update). Draft for public comment. Atlanta, GA, US Department of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry.
- Baden SP, Eriksson SP et Weeks JM (1995), Uptake, accumulation and regulation of manganese during experimental hypoxia and normoxia by the decapod Nephrops norvegicus (L.). Marine Pollution Bulletin, 31(1–3):93–102.
- Beklemishev MK, Stoyan TA et Dolmanova IF (1997), Sorption-catalytic determination of manganese directly on a paper based chelating sorbent, Analyst, 122:1161.
- Hans Breuer, Atlas de Chimie, La Librairie Générale, coll. « Encyclopédie d'aujourd'hui, La Pochothèque », , 476 p. (ISBN 9782253130222). Trad. de l'ouvrage Atlas zur Chemie, paru initialement en 2 tomes, en 1981, 1983 puis en 2000 aux éditions Deutscher Taschenbuch Verlag de Munich, par Claudine Morin, adaptation-révision sous le contrôle de Martine Meslé-Gribenski, de Philippe Morin et Michèle Sénéchal-Couvercelle . Lire en particulier le « groupe du manganèse », p. 244–247.
- Burnell J.N. (1988), The biochemistry of manganese in plants, dans Graham RD, Hannam RJ, Uren NC, éds., Manganese in soils and plants, Dordrecht, Kluwer Publishers, p. 125–137.
- Émilie Chalmin, Caractérisation des oxydes de manganèse et usage des pigments noirs au paléolithique supérieur (thèse de géologie appliquée, université de Marne-la-Vallée), (lire en ligne).
- Christensen E.R., Scherfig J. et Dixon P.S. (1979), Effects of manganese, copper and lead on Selenastrum capricornutum and Chlorella stigmatophora, Water Research, 13(1):79–92.
- Jacques Faucherre, Bernard Dubois et Gil Michard, « Manganèse », dans Encyclopædia Universalis, (lire en ligne).
- (fr)/(en) Alain Foucault, Jean-François Raoult, Fabrizio Cecca et Bernard Platevoet, Dictionnaire de Géologie, 8e éd., édition Dunod, 2014, 416 p. Avec la simple entrée « manganèse », p. 208.
- Goodenough, J. B., Thackeray, M. M., David, W. I. F. et Bruce, P. G. (1984), Lithium insertion/extraction reactions with manganese oxides, Revue de chimie minérale, 21(4), 435-455 (résumé).
- Howe, P. D., Malcolm, H. M. et Dobson, S. (2004), Manganese and its compounds: environmental aspects / Concise international chemical assessment document [PDF] (ISBN 92 4 153063 4) (ISSN 1020-6167), 70 p., sur le site de l'OMS.
- Hudnell H.K. (1999), Effects from environmental Mn exposures: a review of the evidence from non-occupational exposure studies, Neurotoxicology, avril-juin 1999, 20(2-3):379-97 (résumé).
- Knocke, W. R., Van Benschoten, J. E., Kearney, M. J., Soborski, A. W. et Reckhow, D. A. (1991), Kinetics of manganese and iron oxidation by potassium permanganate and chlorine dioxide. Journal-American Water Works Association, 83(6), 80-87 (résumé).
- John David Lee, Précis de chimie minérale, Paris, Dunod, , 282 p. (ISBN 978-2-04-000916-8). Trad. de la 2e éd. américaine par V. Hérault, en particulier les p. 200-204 sur le groupe du Mn. Voir aussi J.D. Lee, Concise inorganic chemistry, 5e éd., Londres, Chapman and Hall, 1996 ou Wiley India PL, 2008, 1068 p. ou la 4e éd. consultable.
- Robert Luft, Dictionnaire des corps purs simples de la chimie, Nantes, Association Cultures et Techniques, , 392 p. (ISBN 978-2-9510168-3-5). En particulier, l'élément manganèse Mn 25 (paragraphe).
- Bruce H. Mahan (université de Californie, Berkeley), Chimie, Interéditions, 832 p., traduction française de Chemistry par Philibert L'Ecuyer, Marcel Lefrançois (Université Laval Québec) (ISBN 9782729600655). En particulier, « Manganèse », p. 670–673, 658.
- Paul Pascal, Nouveau traité de chimie minérale, Paris, Masson, (réimpr. 1966), 32 vol., « 16. Fluor, chlore, brome, iode, astate, manganèse, technétium, rhénium ; 20.1. Alliages métalliques ; 20.2. Alliages métalliques (suite) ; 20.3 Alliages métalliques (suite) » (BNF 37229023).
- Paulsen, J. M. et Dahn, J. R. (1999), Studies of the layered manganese bronzes, Na2/3 [Mn1-xMx] O2 with M. Solid State Ionics, 126(1-2), 3-24 (résumé).
- Louis Troost, Traité élémentaire de chimie, 6e éd., Paris, 1880, ou 12e éd., 1897 en particulier le manganèse p. 189-193 Texte en ligne 12e éd..
Voir aussi
Articles connexes
- Bleu de manganèse
- Carence en manganèse
- Complexe d'oxydation de l'eau
- Étoile à mercure et manganèse
- Ferromanganèse
- Format des piles et accumulateurs électriques
- Glencore (Glencore Manganèse France)
- Grotte de Lascaux, grotte de Villars, grottes de Gargas
- Intoxication au manganèse
- Isotopes du manganèse
- Mancozèbe
- Manganèse (maladie professionnelle)
- Manganèse peroxydase
- Manganocène
- Marhanets
- Méthode de Winkler
- Oxalate décarboxylase
- Parkérisation
- Pile Leclanché
- Procédé Bessemer
- Superéchange de Kramers et Anderson
- Terre d'ombre
- Z-Stoff
Liens externes
- L'élément manganèse présenté par la Société Chimique de France
- Le manganèse et ses dérivés Fiche INERID 2012
- fiche manganèse du BRGM sur SIGminesFrance
- Rapport BRGM SIGmines sur le Mn
- Les gisements de Mn en France, rapport BRGM 1981
- Rapport BRGM Synthèse bibliographique sur l'élimination du manganèse dans les eaux d'origine minière, mars 2006
- (en) « Technical data for Manganese » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- (en) Article sur l'élément chimique manganèse et sur les usages du Mn ou Manganese processing sur Encyclopædia Britannica
- (en) IMNI ou institut international du manganèse
- (en) Données sur le manganèse du National Center for Biotechnology information
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||



