Calcium
Le calcium est l'élément chimique de numéro atomique 20, de symbole Ca.
| Calcium | |||||||||||
 Calcium métallique | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Ca | ||||||||||
| Nom | Calcium | ||||||||||
| Numéro atomique | 20 | ||||||||||
| Groupe | 2 | ||||||||||
| Période | 4e période | ||||||||||
| Bloc | Bloc s | ||||||||||
| Famille d'éléments | Métal alcalino-terreux | ||||||||||
| Configuration électronique | [Ar] 4s2 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 8, 2 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 40,078 ± 0,004 u[1] | ||||||||||
| Rayon atomique (calc) | 180 pm (194 pm) | ||||||||||
| Rayon de covalence | 176 ± 10 pm[2] | ||||||||||
| Rayon de van der Waals | 197,3 pm | ||||||||||
| État d’oxydation | 2 | ||||||||||
| Électronégativité (Pauling) | 1,00 | ||||||||||
| Oxyde | basique | ||||||||||
| Énergies d’ionisation[3] | |||||||||||
| 1re : 6,113 16 eV | 2e : 11,871 72 eV | ||||||||||
| 3e : 50,913 1 eV | 4e : 67,27 eV | ||||||||||
| 5e : 84,50 eV | 6e : 108,78 eV | ||||||||||
| 7e : 127,2 eV | 8e : 147,24 eV | ||||||||||
| 9e : 188,54 eV | 10e : 211,275 eV | ||||||||||
| 11e : 591,9 eV | 12e : 657,2 eV | ||||||||||
| 13e : 726,6 eV | 14e : 817,6 eV | ||||||||||
| 15e : 894,5 eV | 16e : 974 eV | ||||||||||
| 17e : 1 087 eV | 18e : 1 157,8 eV | ||||||||||
| 19e : 5 128,8 eV | 20e : 5 469,864 eV | ||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | Solide (paramagnétique) | ||||||||||
| Masse volumique | 1,54 g·cm-3 (20 °C)[1] | ||||||||||
| Système cristallin | Cubique à faces centrées | ||||||||||
| Dureté (Mohs) | 1,75 | ||||||||||
| Couleur | Argenté métallique | ||||||||||
| Point de fusion | 842 °C[1] | ||||||||||
| Point d’ébullition | 1 484 °C[1] | ||||||||||
| Énergie de fusion | 8,54 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 153,6 kJ·mol-1 | ||||||||||
| Volume molaire | 26,20×10-6 m3·mol-1 | ||||||||||
| Pression de vapeur | 254 Pa à 838,85 °C | ||||||||||
| Vitesse du son | 3 810 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 632 J·kg-1·K-1 | ||||||||||
| Conductivité électrique | 29,8×106 S·m-1 | ||||||||||
| Conductivité thermique | 201 W·m-1·K-1 | ||||||||||
| Divers | |||||||||||
| No CAS | [4] | ||||||||||
| No ECHA | 100.028.344 | ||||||||||
| No CE | 231-179-5 | ||||||||||
| Précautions | |||||||||||
| SGH[5] - [6] | |||||||||||
  Danger |
|||||||||||
| SIMDUT[7] | |||||||||||
  B6, E, |
|||||||||||
| NFPA 704 | |||||||||||
| Transport[8] | |||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||

C'est un métal alcalino-terreux gris-blanc et assez dur. Il n'existe pas à l'état de corps pur dans la nature. C'est le cinquième élément le plus abondant de la croûte terrestre (plus de 3 %). Il est vital pour de nombreuses espèces : formation des os, des dents et des coquilles (il compose 1 à 2 % du poids du corps humain d'un adulte[9]). Le calcium joue également un rôle très important en physiologie cellulaire, tout en étant un poison cellulaire au-delà d'une certaine dose.
Histoire du calcium
La chaux était déjà préparée par les Romains dès le Ier siècle, mais ce n'est qu'en 1808 que le calcium fut découvert. En apprenant que Jöns Jacob Berzelius et Magnus Martin Pontin (de) avaient préparé un amalgame de calcium par électrolyse de la chaux dans du mercure, Humphry Davy fut capable d'isoler le métal impur.
Isotopes
Le calcium possède 24 isotopes connus de nombre de masse variant entre 34 et 57, mais aucun isomère nucléaire connu. Cinq de ces isotopes sont stables, 40Ca, 42Ca, 43Ca, 44Ca et 46Ca (mais 40Ca et 46Ca sont soupçonnés d'être des radioisotopes à vie extrêmement longue, mais aucune désintégration n'a pour l'instant été observée), et un radioisotope (48Ca) a une demi-vie tellement longue (43×1018 années, soit presque 3 milliards de fois l'âge de l'univers) qu'il est considéré pour les cas pratiques comme stable. Le calcium 40 représente 97 % du calcium naturel.
Caractéristiques notables
Le calcium peut être produit par électrolyse du fluorure de calcium mais plus couramment par réduction sous vide de la chaux (CaO) par de la poudre d'aluminium.
Il brûle avec une flamme jaune-rouge ; exposé à l'air sec il forme une couche protectrice blanche d'oxyde et de nitrure. Il réagit violemment avec l'eau dont il déplace l'hydrogène et forme alors de l'hydroxyde de calcium Ca(OH)2.
Applications physiques du calcium métal
- agent réducteur dans l'extraction d'autres métaux tels que l'uranium, le zirconium, et le thorium ;
- désoxydant, désulfurant ou décarburant pour différents alliages ferreux et non ferreux ;
- utilisé, parfois en association avec le magnésium, pour éliminer le bismuth du plomb (débismuthage) ;
- agent d'alliage utilisé dans la production d'alliages de l'aluminium, du béryllium, du cuivre, du plomb et du magnésium.
Composés
Dans tous ses composés connus le calcium est présent sous la forme du cation Ca2+.
- Aluminate de calcium Ca3(AlO3)2 ou (Al2O3, 3 CaO) : un des composants du clinker, et utilisé pour la confection de mortiers réfractaires ;
- Carbonate de calcium CaCO3, très répandu dans la nature, car c'est le composant de base des roches calcaires ; c'est par calcination du calcaire que l'on obtient la chaux vive ; voir aussi : calcite, aragonite ;
- Carbure de calcium CaC2 (communément appelé carbure ; son hydrolyse produit de l'acétylène) ;
- Halogénures :
- Chlorure de calcium CaCl2 parfois utilisé comme sel de déneigement en remplacement du chlorure de sodium ;
- Fluorure de calcium CaF2 (fluorine) ;
- Iodure de calcium CaI2 ;
- Bromure de calcium CaBr2 ;
- Hypochlorite de calcium Ca(ClO)2 ;
- Nitrate de calcium Ca(NO3)2 ;
- Nitrure de calcium Ca3N2 ;
- Oxydes et hydroxyde :
- Oxyde de calcium CaO (chaux vive),
- Hydroxyde de calcium Ca(OH)2 (chaux éteinte),
- Peroxyde de calcium CaO2 ;
- Phosphates :
- Phosphate de calcium Ca3(PO4)2,
- Hydroxyapatite Ca10(PO4)6(OH)2 Composant des dents et os ;
- Phosphure de calcium Ca3P2 (son hydrolyse produit de la phosphine PH3) ;
- Sulfates :
- Sulfure de calcium CaS.
Le calcium peut aussi s'allier à différents autres métaux. L'alliage calcium-silicium, appelé silico-calcium, est un adjuvant de la préparation de certains aciers.
Dans l'alimentation
Le calcium est de loin l'élément métallique le plus abondant dans le corps (1 à 2 % en masse). Il est majoritairement entreposé dans les os, dont il fait partie intégrante. Il contribue à la formation de ces derniers, ainsi qu'à celle des dents, et au maintien de leur santé. Les mécanismes de maintien d'une concentration plasmatique normale en calcium ionisé se font, si nécessaire, aux dépens du squelette et une diminution trop importante de l'apport calcique aussi bien qu'une augmentation des excrétions entraîne un risque pour le squelette et la santé (ostéoporose chez l'adulte, rachitisme chez l'enfant, exacerbation du risque de saturnisme, etc.).
Le calcium joue aussi un rôle essentiel dans la coagulation sanguine, le maintien de la pression sanguine et la contraction des muscles, dont le cœur, via son importance dans les fonctions neuromusculaires. Il intervient dans le fonctionnement de nombreux processus enzymatiques.
Chez l'humain, il est plus ou moins bioassimilable selon ses formes, selon l'âge et l'état hormonal de la personne, mais aussi en fonction d'inhibiteurs ou de promoteurs de l'assimilation présent dans les aliments, deux facteurs qui sont encore mal compris et font l'objet d'études[10]. Le calcium ionisé ou chélaté (par certains peptides naturellement présent dans certains aliments) semble pouvoir être plus bioassimilable[11].
Importance physiologique
Le calcium intervient dans la formation des os et des dents ; son déficit va donc les affecter (ostéoporose, problèmes de croissance). Son déficit peut provoquer l'apparition de calculs rénaux (le calcium neutralise les oxalates dans le système digestif) et son excès risque d'augmenter le risque cardiovasculaire[12].
De plus, il intervient dans les échanges cellulaires et est, de ce fait, vital. Son taux sanguin (calcémie) est extrêmement régulé, pour éviter des variations fatales à l'organisme. Les hormones impliquées dans cette régulation sont la parathormone et la calcitonine, bien que le rôle « hormonal » de la calcitonine soit discuté étant donné que son augmentation n'entraîne pas de modification sur le métabolisme phospho-calcique. Il serait plus juste de considérer la parathormone et le calcitriol (dérivé de la vitamine D) comme les deux principales hormones du métabolisme phospho-calcique (voir aussi métabolisme du calcium). Le calcium sert aussi à réguler le pH corporel, il est relargué des os lorsqu'il y a une acidification du milieu interne provoquée par une consommation de produit acidifiant (protéines, laits…) et une faible consommation de végétaux, qui ont un effet alcalinisant.
Le risque de cancer du côlon semble diminué par un régime riche en calcium. La majorité des études épidémiologiques indiquent que les gens dont l'alimentation contient le plus de calcium ont moins fréquemment un cancer colorectal. Plus de 25 publications scientifiques montrent que le calcium diminue la cancérogenèse colique chez les rongeurs[13]. Enfin, trois essais cliniques contrôlés montrent que la prise d'un supplément de carbonate de calcium (1 à 2 g/j) diminue la récurrence des polypes de 15 à 30 % chez des volontaires[13] : il semble donc que le calcium prévienne le cancer colorectal.
Le calcium intervient aussi dans la contraction musculaire par l'intermédiaire de l'ion calcium Ca2+. Le calcium est stocké dans le muscle dans des citernes et est libéré sous l'influx nerveux pour activer les molécules d'actine qui vont permettre la contraction musculaire (voir myocyte).
Équilibre calcique
L'équilibre calcique est déterminé par la relation entre les apports calciques d'une part, et l’absorption et l'excrétion du calcium d'autre part. Des variations relativement faibles dans l'absorption et l'excrétion du calcium peuvent neutraliser un apport élevé ou compenser un apport faible[14].
Les besoins nutritionnels en calcium sont ainsi essentiellement déterminés par la balance entre l'efficacité de l'absorption et le taux d'excrétion — l'excrétion se produisant par les voies intestinale (fèces) et rénale (urine), par la desquamation, par la perte des cheveux et celle des ongles. Chez l'adulte le taux d'absorption du calcium via le système digestif doit correspondre à l'ensemble des pertes quotidiennes afin d'assurer la préservation du squelette ; chez l'enfant et l'adolescent un apport supplémentaire est nécessaire pour couvrir les besoins de l'accroissement du squelette[14].
Le métabolisme du calcium est sujet à de considérables variations inter-individuelles, à la fois en ce qui concerne l'absorption et l'excrétion du calcium, pour des raisons qui ne sont pas encore complètement connues mais qui incluent la vitamine D, l'apport en sodium et en protéines, l'âge, la ménopause chez la femme. Voir infra certains de ces facteurs.
Absorption
À de bas niveaux d'apport calcique le calcium est principalement absorbé par transport actif transcellulaire, tandis qu'à de plus hauts niveaux d'apport une proportion de plus en plus importante du calcium est absorbée par simple diffusion paracellulaire. L'absorption varie ainsi en fonction inverse de l'apport calcique, variant de 70 % pour de très bas niveaux d'apport à 35 % environ pour des apports calciques importants.
En tenant compte des pertes calciques incompressibles (selles, urines, desquamation, sueur) le pourcentage net d'absorption (apports moins pertes) est négatif pour de bas niveaux d'apport, devient positif avec l'augmentation des apports, atteint un pic à environ 30 % d'absorption pour un apport quotidien d'environ 400 mg, puis recommence à diminuer pour des apports allant au-delà de ce taux[14].
Excrétion
La part non absorbée du calcium se retrouve principalement dans les selles, accompagnée de la part non absorbée du calcium contenu dans les sucs digestifs[14].
L'excrétion urinaire de calcium est extrêmement sensible aux modifications du taux plasmique de calcium : des diminutions à peine détectables de moins de 2 mg de calcium par litre de plasma sanguin suffisent pour induire une diminution trente fois supérieure de l'excrétion urinaire de calcium. Cette réponse rénale très sensible à la privation de calcium se combine avec la relation inverse entre apport calcique et taux d'absorption pour stabiliser la concentration plasmatique de calcium ionisé (en cohérence avec son importance physiologique) et pour préserver l'équilibre entre les entrées et les pertes calciques. Cependant il existe un niveau incompressible de pertes calciques dans les urines, qui dans le contexte du niveau de consommation en sel et en protéines des pays développés se situe à environ 140 mg/j[14].
En plus des pertes calciques urinaires et fécales, il existe des pertes à travers la desquamation, la chute de cheveux, les ongles. Ces pertes insensibles, difficiles à mesurer, seraient de l'ordre de 40 à 60 mg par jour et ne varient pas avec le niveau d'apport calcique dans l'alimentation[14].
Facteurs nutritionnels affectant les besoins en calcium
Il s'agit principalement du sodium et des protéines animales (qui tous deux augmentent les pertes calciques urinaires), et de la vitamine D du fait de son rôle dans l'homéostasie et l'absorption du calcium[14].
Au bilan, les facteurs alimentaires qui influencent les pertes urinaires de calcium ont une influence majeure sur la balance calcique et pourraient même être de plus grande importance que ceux qui influencent la disponibilité intestinale du calcium ; les pertes urinaires en calcium sont plus importantes dans les alimentations qui contiennent des apports élevés en protéines animales, sulfates, sodium, café, thé et alcool, que dans les régimes alimentaires qui en intègrent des quantités plus faibles[15].
Sodium
Le taux urinaire de calcium (calciurie) est relié à celui du sodium (natriurie) et l'administration de sodium augmente l'excrétion urinaire de calcium, possiblement parce que le sodium entrerait en compétition avec le calcium pour la réabsorption au niveau des tubules rénaux. Les restrictions en sel diminuent la calciurie, donc les besoins nutritionnels en calcium, et inversement la consommation alimentaire de sel augmente ces besoins. S'il est cependant difficile d'en déduire des recommandations nutritionnelles au niveau mondial du fait du manque de données pour beaucoup de pays[14], les études existantes montrent que chaque apport supplémentaire de deux grammes de sel alimentaire entraîne une excrétion urinaire de calcium de 30 à 40 mg en moyenne[15].
Protéines
Il est connu depuis les années 1960 que l'apport alimentaire de protéines –- et particulièrement de protéines animales[16] – augmente l'excrétion urinaire de calcium[14] - [17]. Cela est cohérent avec la constatation faite par ailleurs que la prévalence des fractures de la hanche est liée aux apports en protéines animales[14] - [18]. Il a été trouvé dans une population japonaise que l'excrétion de calcium est significativement corrélée positivement avec l'apport alimentaire de protéines animales, mais pas avec celui de protéines végétales[19]. Inversement, diminuer l'apport en protéines animales diminue les pertes urinaires en calcium[20].
Le mécanisme par lequel les protéines animales influent sur l'excrétion du calcium n'est pas complètement compris. Une augmentation du taux de filtration glomérulaire en réponse aux apports protéiques a été suggéré, mais ne semble pas pouvoir en l'état actuel des connaissances expliquer à lui seul cette constatation[14]. Le mécanisme considéré comme le plus important par la majorité des études est l'effet de la charge acide contenue dans les aliments d'origine animale (due notamment aux acides aminés sulfurés contenus en quantité plus importante dans les protéines animales, et à la concentration plus importante en ions phosphates)[15] - [21], du fait qu'une charge acide est, sur le long terme, compensée entre autres par la fixation des ions H+ par les phosphates acides libérés par le métabolisme phosphocalcique osseux, ceci entraînant la libération conjointe de carbonate de calcium osseux. La complexation dans les tubules rénaux du calcium par les ions sulfates et phosphates relargués par le métabolisme des protéines jouerait également un rôle[14] - [15]. Le taux urinaire de calcium est significativement relié à celui du phosphate urinaire et la plus grande partie du phosphore contenu dans les urines des personnes adoptant un mode d'alimentation occidental provient des aliments d'origine animale ingérés[14]. Cela est également observé pour le sulfate urinaire, même si l'effet est probablement moins important que celui des ions phosphates.
Quoi qu'il en soit, aucune conclusion définitive ne peut encore se dégager de la lecture de la littérature scientifique pour expliquer la corrélation positive entre l'apport en protéines d'origine animale et l'augmentation de la calciurie et de la prévalence des fractures. Nombreux d'ailleurs sont les auteurs à insister sur le besoin d'études complémentaires, malgré des décennies de recherche sur ce point.
Régimes riches en produits végétaux
Des études ont montré que les pertes urinaires en calcium sont plus faibles dans les régimes alimentaires alcalins, riches en légumes et fruits ou en bicarbonates[15] - [22].
Bien qu'il soit considéré dans certaines études que les produits à base de soja ont un taux de phytates élevé pouvant réduire l'absorption du calcium, d'autres études n'ont pas constaté de différence clinique selon que l'alimentation comprenne du lait de vache ou de soja[15].
Les phytates, présents dans l'enveloppe de nombreuses céréales ainsi que dans certaines noix, certaines graines, certains légumes, peuvent former des sels de calcium insolubles dans l'appareil gastro-intestinal[15].
Les oxalates (que l'on peut trouver par exemple dans les épinards, la rhubarbe, les noix, l'oseille) en excès peuvent précipiter le calcium dans l'intestin ; ainsi, s'il a été démontré que la biodisponibilité du calcium des légumes verts pauvres en oxalates (par exemple chou ou brocoli) est supérieure à celle du lait de vache[22], à l'inverse le calcium des épinards ou du cresson est moins bien absorbé[15].
Si ces facteurs ont généralement une faible importance dans les régimes alimentaires[14] - [15], leur importance dans un régime végétalien strict pourrait équilibrer les effets bénéfiques d'une baisse de l'excrétion urinaire du calcium due à un faible apport en protéines animales[17].
Les tanins (tels que ceux du thé) peuvent également former des complexes réduisant l'absorption du calcium.
Lait animal
Le lactose du lait, pris séparément, favorise l'absorption du calcium ; cependant son effet est contrebalancé par celui des protéines animales également contenues dans le lait. Finalement, le lactose du lait contribue peu à l'amélioration de l'absorption en calcium et aucune étude ne montre que le calcium du lait est plus efficacement absorbé que celui de n'importe quel sel de calcium. La proportion absorbée de calcium du lait dépasse rarement 40%[15].
Eaux minérales
Il n'a pas été démontré que le calcium des eaux minérales, sous forme de bicarbonate ou de sulfate, est mieux absorbé que d'autres sources de calcium[15].
Apports recommandés
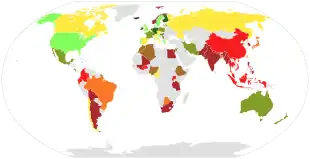
- <400
- 400-500
- 500-600
- 600-700
- 700-800
- 800-900
- 900-1000
- >1000
Les recommandations nutritionnelles de la FAO se basent sur les relations entre l'apport calcique et l'absorption et l'excrétion du calcium, déterminées par une analyse des études existantes. L'équilibre, selon la FAO, est atteint avec un apport quotidien de 520 mg en tenant compte des pertes fécales incompressibles, qui montent à 840 mg en tenant compte des pertes urinaires et celles liées à la desquamation, et à 1 100 mg lorsque les pertes liées à la ménopause sont incluses[14].
La prise en compte des apports alimentaires en protéines animales a un effet majeur sur les besoins nutritionnels en calcium, les deux étant positivement corrélés[14]. Elle contribue également à rapprocher les apports recommandés en calcium des apports calciques réels observés dans une grande partie des populations au niveau mondial. En ce qui concerne le sodium, si les apports en sel dans le régime alimentaire étaient réduits, les besoins en calcium pourraient diminuer à un niveau aussi bas que 450 mg/j. Une meilleure attention portée au taux de vitamine D (par une exposition suffisante au soleil ou par des apports suffisants) pourrait encore diminuer les besoins nutritionnels en calcium[14].
Les apports nutritionnels conseillés sont finalement de 900 mg par jour chez l'adulte[24] qui consomme une alimentation occidentale. Une étude de l'OMS montre que les ANC varient sensiblement entre les pays développés[25]. Parallèlement, les apports journaliers recommandés sont de 800 mg par jour (pour une femme adulte)[26].
Selon l'OMS[27] et la FAO[28], un besoin de calcium beaucoup plus bas (500 mg/jour) est observé chez les personnes ayant une alimentation beaucoup plus végétarienne, qui s'exposent suffisamment au soleil (vitamine D) et qui ont une activité physique non sédentaire. En effet, l'ingestion d'acides aminés soufrés (comme la méthionine) en grandes quantités augmenterait la déperdition de calcium dans les urines. Ces acides aminés soufrés se trouvent en grande quantité dans les viandes, les poissons, les œufs, les charcuteries.
Conséquences d'un excès de calcium
Une étude portant sur une cohorte de population en Suède a mis en évidence une mortalité plus élevée pour les femmes ingérant plus de 1 400 mg de calcium par jour, en particulier sous forme de supplément[29]. Par ailleurs, plusieurs études établissent une corrélation entre une forte ingestion de calcium et une incidence élevée de cancer de la prostate[30].
Présence dans les aliments
Le calcium est présent dans de nombreux aliments de consommation courante.
Les produits laitiers constituent actuellement la principale source de calcium alimentaire (plus des deux tiers des aliments consommés) des pays occidentaux. Le calcium y est présent sous une forme permettant une absorption intestinale de l'ordre de 30 %, mais augmentant l'excrétion urinaire de calcium[20]. Les produits très riches en calcium et en phosphore entraînent une hypercalcémie et hyperphosphatémie temporaires, avec une inhibition de la synthèse de vitamine D.
D'autres aliments contiennent du calcium : eau du robinet, amandes, pistaches, dattes, persil, figues, cresson, cacao, pissenlit, oranges, haricots secs, jaune d'œuf, graines de sésame (tahini), graines de pavot, brocoli, choux, épinard (les légumes à feuilles vertes en général), certains poissons…
Selon la plupart des sources[15] - [31] - [32] - [33] - [34], le calcium du lait est absorbé à environ 30 %.
Pour l'évaluation de la biodisponibilité réelle, il faut aussi tenir compte des facteurs alimentaires qui influencent la perte urinaire du calcium absorbé. Ainsi, l'absorption simultanée de phosphore diminue l'excrétion urinaire de calcium. À l'inverse, les composants « acidogènes » du régime, comme les sulfates (en particulier dans les eaux minérales sulfatées calciques), augmentent la calciurie (élimination de calcium par voie urinaire).
Enfin, la fixation du calcium absorbé dans le tissu osseux (prévenant l'ostéoporose) dépend de nombreux autres facteurs, en particulier hormonaux (voir ci-dessus).
En tant que médicament
L'absorption de calcium sous forme de comprimés permet d'augmenter son apport journalier si ce dernier n'est pas optimal. Il est parfois associé à la prise de vitamine D. L'intérêt d'une supplémentation en calcium chez une personne non dénutrie n'est cependant pas établi : la densité minérale osseuse n'augmente que peu, même si le calcium est associée à la prise de vitamine D et ne progresse plus après un an[35]. Il n'existe, par ailleurs, pas de diminution du risque de fracture[36]. L'effet secondaire le plus noté reste une constipation[37]. Le syndrome des buveurs de lait, dans sa forme moderne, est dû principalement à la consommation de carbonate de calcium : c'est la troisième cause d'hypercalcémie et la seconde cause d'hypercalcémie sévère[38]. Cette supplémentation pourrait être associée avec un risque majoré de maladies cardio-vasculaires[39] - [40], même si cette donnée reste discutée[41] - [42].
Mais les médicaments destinés à l'ostéoporose servent aussi à soigner les maladies telles que l'anorexie ou boulimie afin de subvenir au manque de nutriments équilibrés dans le corps dus à l'absence de ceux-ci du fait des problèmes que cela engendre.
Pour la femme en ménopause et les personnes âgées, les apports journaliers recommandés de calcium sont de 1 200 à 1 500 mg.
Production industrielle
Le calcium est produit par aluminothermie de la chaux, c’est-à-dire une réaction d'oxydo-réduction où la chaux − l’oxyde de calcium CaO − est réduite par l'aluminium dans des fours où l'on établit le vide.
De façon simplifiée :
On introduit dans le four des pastilles formées à partir d'un mélange de chaux et de poudre d'aluminium. Le four est chauffé électriquement ou à l'aide d'un combustible fossile. Le calcium formé au cours de la réaction se dégage sous forme de vapeur, et l'on dispose(dans le circuit d'aspiration établissant le vide dans le four) un condenseur où il vient se déposer. Le résidu de la réaction est de l'aluminate de calcium (combinaison d'alumine et de chaux).
Usages industriels
Ils sont nombreux et parfois anciens. Ainsi depuis la préhistoire le calcium (issu de la craie et transformé par la calcination, de l'hydratation, du frittage, la recarbonatation ou la micronisation…) est présent dans les mortiers, ciments, enduits, pigments, agents fondants, charges minérales, dont comme correcteurs de rhéologie utilisés dans de nombreuses peintures, encres, polymères plastiques et caoutchouc, etc. Des carbonates de calcium (et de magnésium) sont utilisés (calcins) dans l'industrie du verre, de la céramique et dans la production de fonte. Le sucre est purifié par l'Industrie du sucre au moyen d'oxyde de calcium et d'hydroxyde de calcium. L'Industrie papetière utilise le stéarate de calcium comme enduit de couchage pour donner un aspect lisse à la surface des papiers glacés. L'hydroxyde de calcium est un réactif utilisé pour fabriquer industriellement la gélatine.
Plus récemment le calcium, ou des molécules à base de calcium se sont montrés être un bon substitut :
- au plomb ou au cadmium (très toxiques et plus chers) utilisé comme additif du PVC dans les menuiseries PVC.
- au lithium et au cobalt (toxiques, explosif pour le lithium et plus rares) des batteries lithium-ion utilisées dans les téléphones portables et beaucoup d'autres appareils électroniques[43]. L'industrie étudie des prototypes de piles à anodes de calcium remplaçant les piles avec anodes en lithium, mais jusqu'en 2018, l'électrolyte approprié manquait encore. En 2019 à l'Institut Helmholtz d'Ulm (Allemagne), Zhirong Zhao-Karger & al. ont pu associer deux composé de calcium et de fluor, et non seulement ce matériau (un type nouveau de sel de calcium ) se montre meilleur conducteur d'électricité que tous les électrolyte calciques connus jusqu'alors, mais de plus, il le fait avec une tension supérieure à celle des autres électrolytes à base de calcium. On espère pourvoir ainsi produire des batteries peu coûteuses et efficaces pouvant stocker l'électricité issues de sources intermittentes (éoliennes et solaires)[43].
Commerce
La France, en 2014, est nette importatrice de calcium, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 3 700 €[44].
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Trans., , p. 2832-2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, , 87e éd. (ISBN 0849304873), p. 10-202
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- []http://www.sigmaaldrich.com/catalog/ProductDetail.do?lang=en&N4=441872%7CALDRICH&N5=SEARCH_CONCAT_PNO%7CBRAND_KEY&F=SPEC SIGMA-ALDRICH
- « Calcium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Entrée « Calcium » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 février 2010 (JavaScript nécessaire)
- Cashman, K. D. (2002) Calcium intake, calcium bioavailability and bone health. British journal of Nutrition, 87(S2), S169-S177.
- Platel, K., & Srinivasan, K. (2016). Bioavailability of micronutrients from plant foods: an update. Critical reviews in food science and nutrition, 56(10), 1608-1619 (résumé
- Sun, N., Wu, H., Du, M., Tang, Y., Liu, H., Fu, Y., & Zhu, B. (2016) Food protein-derived calcium chelating peptides : A review. Trends in Food Science & Technology, 58, 140-148 (résumé).
- Supplémentation en calcium : risques cardiovasculaires ?, La Revue Prescrire, mars 2013, tome 33, no 353, p. 190-191.
- Chimioprévention
- (en) Rapport FAO/OMS, Human Vitamin and Mineral Requirements, chap. 11 Calcium, 2002
- (en) Léon Guéguen et Alain Pointillart, « The Bioavailability of Dietary Calcium », Journal of the American College of Nutrition, vol. 19, no sup2, , p. 1195-1365 (PMID 10759138) (résumé)
- (en) Jane E Kerstetter, Kimberly O O'Brien et Karl L Insogna, « Dietary protein, calcium metabolism, and skeletal homeostasis revisited », American Journal of Clinical Nutrition, vol. 78, no 3, , p. 5845-5925 (lire en ligne)
- (en) C M Weaver et K L Plawecki, « Dietary calcium: adequacy of a vegetarian diet », American Journal of Clinical Nutrition, vol. 59, no 5, , p. 1238S-1241S (lire en ligne)
- (en) Abelow BJ, Holford TR et Insogna KL, « Cross-cultural association between dietary animal protein and hip fracture: a hypothesis », Calcif Tissue International, vol. 50, no 1, , p. 14-18 (PMID 1739864)
- (en) Itoh R, Nishiyama N et Suyama Y, « Dietary protein intake and urinary excretion of calcium: a cross-sectional study in a healthy Japanese population », American Journal of Clinical Nutrition, vol. 67, no 3, , p. 438-444 (PMID 9497187)
- (en) van Beresteijn, Brussaard et van Schaik, « Relationship between the calcium-to-protein ratio in milk and the urinary calcium excretion in healthy adults--a controlled crossover study », American Journal of Clinical Nutrition, vol. 52, no 1, , p. 142-146 (lire en ligne)
- (en) N M Lewis, M S Marcus, A R Behling et J L Greger, « Calcium supplements and milk: effects on acid-base balance and on retention of calcium, magnesium, and phosphorus », American Journal of Clinical Nutrition, vol. 49, no 3, , p. 527-533 (lire en ligne)
- Position de l’Association américaine de diététique au sujet de l’alimentation végétarienne, J Am Diet Assoc. (Journal de l’Association américaine de diététique), juillet 2009 Volume 109, 2009;109: 1266-1282
- (en) E. M. Balk, G. P. Adam, V. N. Langberg et A. Earley, « Global dietary calcium intake among adults: a systematic review », Osteoporosis International, vol. 28, no 12, , p. 3315–3324 (ISSN 0937-941X et 1433-2965, PMID 29026938, PMCID PMC5684325, DOI 10.1007/s00198-017-4230-x, lire en ligne, consulté le )
- ANC pour le calcium, site de l'ANSES
- (en) Étude de l'OMS (WHO) / FAO sur le calcium dans l'alimentation, dans le monde
- Directive 1990/496, annexe I
- Régime alimentaire, nutrition et prévention des maladies chroniques - Rapport d'une Consultation OMS/FAO d'experts, OMS, Série de Rapports techniques 916, Organisation mondiale de la Santé, 2003.
- (en)Étude de la FAO sur les ANC en calcium dans le monde
- (en)Deaths doubled with high calcium intake plus supplements
- (en)Dairy Products, Calcium Intake, and Risk of Prostate Cancer in the Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial
- Vesanto Melina, Victoria Harrison et Brenda Charbonneau Davis, Devenir végétarien, Éditions de l'Homme,
- A.R. Gaby, Preventing and Reversing Osteoporosis, Prima Publishing,
- Le calcium, diététique en action, vol.12, no 1, printemps 1998.
- Dr Paul Lépine et Danielle Ruelens, La ménopause : aux hormones ou au naturel? Une approche intégrée, Éditions Quebecor,
- Tai V, Leung W, Grey A. Reid IR, Bolland MJ, Calcium intake and bone mineral density: systematic review and meta-analysis, BMJ, 2015;351:h4183
- Bolland ML, Leung W, Tai V et al. Calcium intake and risk of fracture: systematic review, BMJ, 2015;351:h4580
- (en) I. R. Reid, B. Mason, A. Horne, R. Ames, H. E. Reid, U. E. Bava, M. J. Bolland et G. D. Gamble, « Randomized Controlled Trial of Calcium in Healthy Older Women », Am. J. Med., vol. 119, no 9, , p. 777-785 (ISSN 0002-9343, DOI 10.1016/j.amjmed.2006.02.038)
- (en) Picolos MK, Lavis VR, Orlander PR, « Milk-alkali syndrome is a major cause of hypercalcaemia among non-end-stage renal disease (non-ESRD) inpatients », Clin. Endocrinol. (Oxf), vol. 63, no 5, , p. 566–76 (PMID 16268810, DOI 10.1111/j.1365-2265.2005.02383.x)
- (en) M. J. Bolland, P. A. Barber, R. N. Doughty, B. Mason, A. Horne, R. Ames, G. D. Gamble, A. Grey et I. R. Reid, « Vascular events in healthy older women receiving calcium supplementation: randomised controlled trial », BMJ, vol. 336, no 7638, , p. 262-266 (ISSN 0959-8138, DOI 10.1136/bmj.39440.525752.BE)
- (en) M. J. Bolland, A. Avenell, J. A. Baron, A. Grey, G. S. MacLennan, G. D. Gamble et I. R. Reid, « Effect of calcium supplements on risk of myocardial infarction and cardiovascular events: meta-analysis », BMJ, vol. 341, , c3691 (ISSN 0959-8138, DOI 10.1136/bmj.c3691)
- (en) J. Hsia, G. Heiss, H. Ren, M. Allison, N. C. Dolan, P. Greenland, S. R. Heckbert, K. C. Johnson, J. E. Manson, S. Sidney et M. Trevisan, « Calcium/vitamin D supplementation and cardiovascular events », Circulation, vol. 115, , p. 846-854 (ISSN 0009-7322, DOI 10.1161/CIRCULATIONAHA.106.673491)
- Xiao Q1, Murphy RA, Houston DK, Harris TB, Chow WH, Park Y., Dietary and supplemental calcium intake and cardiovascular disease mortality: the National Institutes of Health-AARP diet and health study, JAMA Intern Med. 2013 Apr 22;173(8):639-46, https://www.ncbi.nlm.nih.gov/pubmed/23381719
- How a cheap mineral could make a better battery — and help the planet ; Calcium could replace lithium in batteries that store solar and wind power ; Brève publiée par Nature le 06 septembre 2019
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=28051200 (consulté le )
Voir aussi
Articles connexes
- Antagoniste du calcium
- Calcémie
- Catégorie:Composé du calcium
- Teneur en calcium des aliments
- Macro-élément
- Métabolisme du calcium
- Calcium 48
- Canal calcique
Liens externes
- (en) « Technical data for Calcium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||


