Acide phytique
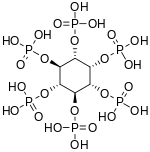
L’acide phytique (ou acide myo-inositol hexaphosphorique, ou hexakisphosphate de myo-inositol) ou IP6, est une molécule de formule brute C6H18O24P6, dont la formule développée est un phosphate d’inositol[2], composé d’un cycle myo-inositol dans lequel chacun de ses groupes hydroxyles OH est monophosphorylé (par un phosphate -O-PO(OH)2). L’acide phytique est abondant dans les végétaux : il se forme pendant la maturation des graines et dans les graines dormantes.
| Acide phytique | ||
| ||
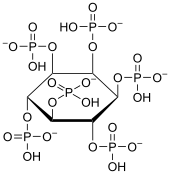 | ||
| Acide phytique, phytate (forme anionique) |
||
| Identification | ||
|---|---|---|
| Nom UICPA | (1R,2S,3r,4R,5S,6s)-cyclohexane-1,2,3,4,5,6-hexayl hexakis[dihydrogen (phosphate)] | |
| Synonymes |
Inositol hexaphosphate |
|
| No CAS | ||
| No ECHA | 100.001.369 | |
| No CE | 201-506-6 | |
| Code ATC | V09 | |
| PubChem | 890 | |
| No E | E391 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C6H18O24P6 [Isomères] |
|
| Masse molaire[1] | 660,035 3 ± 0,013 3 g/mol C 10,92 %, H 2,75 %, O 58,18 %, P 28,16 %, |
|
| Propriétés physiques | ||
| T° fusion | < 25 °C | |
| T° ébullition | 105 °C | |
| Masse volumique | 1,432 g·cm-3 | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Au pH physiologique (de 6-7), les phosphates de l’acide phytique sont partiellement ionisés et l’acide phytique se présente alors naturellement sous une forme anionique, appelée phytate.
Avec les saponines et les lectines, l'acide phytique est considéré comme un antinutriment en raison de sa capacité à former des complexes insolubles avec des micronutriments comme le fer, le magnésium, le zinc et le cuivre et ainsi d’en limiter l’absorption intestinale.
Les anions phytates sont largement répandus dans le royaume végétal. Ils constituent la forme de stockage principale du phosphore et des minéraux dans de nombreux tissus végétaux et particulièrement dans la graine. Lors de la germination de la graine, les phytates sont dégradés, le phosphore est libéré et peut être mobilisé par la plantule en croissance.
La source principale d’acide phytique dans l’alimentation humaine est constituée par les céréales (blé, riz), les pseudo-céréales (sarrasin), les graines de légumineuses (haricot, lentille), les graines oléagineuses et leur huile (tournesol, soja, colza) et les fruits à coque (amande, noix). Les populations des pays développés avec une nourriture plus pauvre en fruits, graines et légumes ont un apport quotidien en acide phytique considérablement plus faible que les populations des pays en voie de développement.
En santé humaine, le phytate consommés par l’homme a une double face[3] :
- dans l'intestin, il est connu depuis longtemps comme un facteur antinutritionnel pouvant inhiber l’absorption des micronutriments (minéraux dont oligo-éléments), ce qui peut éventuellement conduire à des déficiences en calcium, fer, magnésium et zinc ;
- leur côté bénéfique découvert à la fin du XXe siècle, concerne leur activité hypoglycémiante, antioxydantes, anticancéreuse, de prévention des calculs rénaux.
Avec une nutrition déséquilibrée, sa consommation peut conduire à de graves carences en minéraux. Si tous les besoins nutritionnels sont satisfaits, sa consommation permet de bénéficier de son activité antioxydante, anticancéreuse et de prévention des calculs rénaux.
Historique
Les phytates constituent la forme de stockage principale du phosphore chez de nombreuses plantes où il se localisent dans les enveloppes des graines (notamment celles des céréales qui en sont riches) et dans les racines[4]. Ces molécules comprennent six groupes phosphates PO43− qui permettant la chélation de plusieurs cations (principalement Ca2+ et Zn2+, puis Mg2+ et Fe2+ mais possiblement avec l'ensemble des minéraux dont les oligo-éléments)[5]. La formation de complexes insolubles (chélates) avec des sels de calcium, de fer…, permet aux racines et aux graines d'être les principaux sites de réserve de ces minéraux[6]. Les complexes servent également de défenses chimiques contre les herbivores et les omnivores : les sources végétales contenant naturellement ces substances anti-nutritionnelles pouvant séquestrer des minéraux, en réduisent considérablement la biodisponibilité et l'absorption intestinale, ce qui peut générer des carences nutritionnelles, donc une déminéralisation (en) chez les animaux dépourvus de phytases (les ruminants et les oiseaux granivores sont capables de les absorber en raison de la présence de bactéries dans leur système digestif qui produisent ces enzymes)[5]. Cet effet déminéralisant serait un des facteurs explicatifs rendant compte de la diminution croissante de la taille des hommes du Néolithique, de plus de 10 cm[7] - [8]. La fermentation par les humains, qui remonterait au Paléolithique pour la conservation des aliments[9], peut augmenter la biodisponibilité des minéraux, par exemple les formes fermentées du soja (miso, tempe) ou la panification des céréales riches en phytates déminéralisant — orge, millet, amidonnier, engrain, épeautre, froment — grâce à la phytase des lactobacilles du levain qui élimine ces phytates lors du processus fermentaire[10]. La consommation de produits laitiers sous forme de fromage a pu compléter l'alimentation en céréales des premiers agriculteurs, en amenant plus de calcium dont les phytates ralentissent l'absorption[11]. La sélection végétale a depuis permis de réduire la teneur en phytates des sources végétales (d'où la panification sur levure devenue possible alors que le champignon unicellulaire est dépourvu de phytases), de même que l'ajout de phytases microbiennes purifiées aux farines[11]. La supplémentation des régimes alimentaires porcins et avicoles (sous forme solide ou liquide) par des phytases exogènes d'origine bactérienne ou fongique, permet en plus de réduire leurs déjections et les rejets de phosphore dans l'environnement, notamment dans les zones à forte densité d'élevage, qui sont à l'origine du phénomène d'eutrophisation des eaux de surface[12].

Le phytate a été découvert en 1855-56 par un agronome allemand, du nom de T. Hartig[13], quand il a isolé de petites particules rondes, dans diverses graines de plantes, qu’il distingue des grains d’amidon par le test à l’iode. Le terme de « phytine » fut créé à cette occasion pour bien marquer son origine végétale puisqu’on ne la trouvait pas dans les produits animaux. Presque soixante ans plus tard, en 1914, la structure de la molécule est déterminée par RJ Anderson[14] un agrochimiste de New York. Dans les années 1940, les premières expériences physiologiques décrivaient le phytate comme un antinutriment, car il réduisait l'absorption des oligo-éléments, comme le Zn et le Fe (III)[15]. Mais ce n’est que durant la dernière décennie du XXe siècle que les propriétés physiologiques bénéfiques du phytate ont commencé à être étudiées : activité antioxydante, anticancéreuses, de prévention de formation de calculs rénaux, de réduction de l’indice glycémique et de normalisation des niveaux de glucose et de cholestérol.
Sources alimentaires de phytate
L'acide phytique est une forme de stockage du phosphore et des minéraux de la plante et compte pour 60 à 90% du phosphore de la plante[16] - [17].
Le tableau ci-dessous donne les contenus en acide phytique des principaux aliments tels que rassemblés par Schlemmer et al[3], 2009, complétés par quelques autres sources. Les auteurs ont donné pour chaque mesure les références des travaux effectués (plusieurs centaines de références en tout).
| Teneur en acide phytique / phytate des végétaux[3] | ||
| Céréales | ||
| Nom vulgaire | Nom scientifique | Ac. phytique / Phytate g/100g |
|---|---|---|
| Maïs | Zea mays | 0,72 - 2,22 |
| Blé | Triticum sp. | 0,39 - 1,35 |
| Riz | Oryza | 0,06 - 1,08 |
| Orge com. | Hordeum vulgare | 0,38 - 1,16 |
| Avoine | Avena sativa | 0,42 - 1,16 |
| Seigle | Secale cereale | 0,54 – 1,46 |
| Triticale | ×Triticosecale | 0,50 – 1,89 |
| Pseudo-céréales | ||
| Quinoa[18] | Chenopodium quinoa | 1,04 – 2,06 |
| Sarrasin[19] | Fagopyrum esculentum | 3,5 – 3,8 |
| Légumineuses | ||
| Haricot | Phaseolus vulgaris | 0,61 - 2,38 |
| Fève | Vicia faba | 0,51 - 1,77 |
| Pois | Pisum sativum | 0,22 - 1,22 |
| Pois chiche | Cicer arietinum | 0,28 - 1,60 |
| Lentille | Lens culinaris | 0,27 - 1,51 |
| Niébé | Vigna unguiculata | 0,37 - 2,90 |
| Graines oléagineuses | ||
| Soja | Glycine max | 1,0 – 2,22 |
| Lin | Linum usitatissimum | 2,15 – 3,69 |
| Chia[20] | Salvia hispanica | 0,96 – 1,16 |
| Cacahuète | Arachis hypogaea | 0,17 – 4,47 |
| Sésame | Sesamum indicum | 1,44 – 5,36 |
| Colza | Brassica napus | 2,50 |
| Farine de tournesol | Helianthus annuus | 3,9 – 4,3 |
| Fruits à coque | ||
| Amande | Prunus dulcis | 0,35 – 9,42 |
| Noix | Juglans regia | 0,20 – 6,69 |
| Noix Brésil | Bertholletia excelsa | 0,29 – 6,34 |
| Cajou | Anacardium occidentale | 0,19 – 4,98 |
| Pacane | Carya illinoinensis | 0,18 – 4,52 |
| Pistache | Pistacia vera | 0,29 – 2,83 |
| Macadamia | Macadamia integrifolia | 0,15 – 2,62 |
| Noisette | Corylus avellana | 0,23 – 0,92 |
Céréales, pseudo-céréales et graines de légumineuses
La source principale de phytate dans l’alimentation quotidienne est constituée par les céréales et les graines de légumineuses.
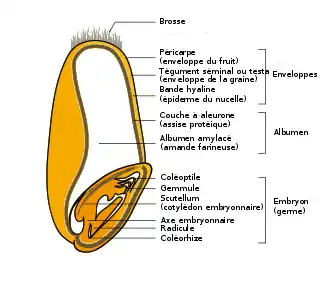
Dans les grains de céréales, le phytate est localisé dans la couche à aleurone de l’albumen et dans l’embryon (ou germe), alors que pour les graines de légumineuses, l’albumen ne persiste pas, et le phytate est dans les cotylédons.
La teneur en acide phytique des céréales est d’environ 1 % du poids sec, dans un intervalle allant de 0,06 jusqu’à 2,2 %. Toutefois les céréales germées et les sons de céréales ont des taux très supérieurs[3] : blé germé 1,14–3,91 % et son de blé 2,1–7,3 %.
Sont ajoutées au tableau de Schlemmer et al[3], deux pseudo-céréales : le quinoa et le sarrasin. Bien qu’elles soient moins étudiées que les céréales, quelques études indiquent que la graine de quinoa a une teneur en acide phytique semblable ou légèrement supérieure à celle des céréales (1,04 à 2,06 g/100g[18]) alors que la graine de sarrasin a une teneur bien supérieure (de 3,5 à 3,8 %[19]).
La teneur en acide phytique des graines de légumineuses va de 0,2 jusqu’à 2,9 % du poids sec.
Graines oléagineuses, fruits à coque
Les graines oléagineuses (soja, lin, chia, etc.), ont une teneur en acide phytique qui va de 1 à 5,4 %. Les oléagineux qui par définition regroupent les plantes dont les graines ou les fruits sont riches en matières grasses peuvent appartenir à la famille des Fabaceae (ou légumineuses, comme le soja, l’arachide, le chia) sans être classées dans la classe précédente des légumineuses tel que le haricot ou le pois dont aucune huile végétale n’est extraite. Les graines de lin et de chia qui sont toutes les deux utilisées pour leurs propriétés laxatives ont des teneurs en acide phytique très différentes : la teneur du lin est deux à trois fois supérieure à celle du chia[20].
Dans les fruits à coque, la teneur en acide phytique va de 0,1 à 9,4 %. Les fruits à coque les plus riches sont les amandes, les noix communes et les noix du Brésil.
Les sources les plus concentrées d'acide phytique sont les huiles végétales[21] - [16] - [22] - [3], les grains complets[n 1] - [23] - [21], les spores[24], et le pollen[24] - [25].
Les teneurs en acide phytique sont données dans un intervalle de variation important. C’est un phénomène commun pour les produits agricoles dont les caractéristiques peuvent varier considérablement selon les cultivars, les conditions de culture, d’environnement et de climat mais aussi la maturité des graines et les variations météorologiques saisonnières. Suivant les sources, les teneurs peuvent être données en acide phytique ou en phytate. Une confusion peut survenir si les teneurs en acide phytique et en phytate sont mélangées dans les tableaux alimentaires[3].
Apport quotidien en acide phytique ou phytate alimentaires
Peu d’études ont porté sur l’apport quotidien moyen en acide phytique ou phytate alimentaires de divers pays. Voici quelques évaluations rassemblées par Schlemmer et al. :
| Apport quotidien moyen en acide phytique ou phytate[3] | |||
| Pays | Sexe, âge, régime | Apport moyen mg/jour | Intervalle mg/jour |
|---|---|---|---|
| Suède | Nourrisson, 6-8 mois, préparation pour nourrisson, bouillie | 26 | 8 - 44 |
| Homme & femme, 35-76 ans, régime occid. | 369 | 230 – 532 | |
| Homme & femme, 35-76 ans, régime végétarien | 1146 | 500-2927 | |
| Inde | Homme & femme, 20-45 ans | 1560 - 2500 | |
| Nigeria | Homme & femme | 2200 | |
Les faibles apports en phytate (200 à 400 mg/j) sont liés à l’alimentation occidentale pauvre en fruits, graines et légumes. Les apports en phytate sont plus importants chez les végétariens européens (1 100 mg/j) ou les Africains (1000 à 2 000 mg/j). Une différence importante s’observe en Chine entre les habitants des zones urbaines (781 mg/j) et rurales (1 342 mg/j)[26] qui ont gardé leur mode d’alimentation traditionnel.
Hydrolyse du phytate dans le tube gastro-intestinal
L’acide phytique peut être dégradé dans le tube gastro-intestinal par des enzymes, nommées phytases, qui hydrolysent l’acide phytique en inositol et 6 acides phosphoriques inorganiques suivant le bilan global
- acide phytique + 6 H2O → inositol + 6 O=P(OH)3
La réaction se fait par étapes, avec production progressive de phosphates d’inositol de moins en moins phosphorylés (et de phosphates inorganiques essentiellement libres), formés par dégradation du phosphate d’inositol IP6 (noté aussi Ins(1,2,3,4,5,6)P6). En outre, il existe des phytases différentes avec des spécificités catalytiques de clivage des groupes phosphates qui produisent différents isomères de pentaphosphates d’inositol.
Il existe quatre sources possibles de phytases[27] :
- les phytases végétales (du blé, riz, soja, maïs) ;
- les phytases microbiennes (levures Aspergillus niger, A. ficuum, Saccharomyces cerevisiae, etc.) ;
- la phytase de la muqueuse de l'intestin grêle (faible chez l’homme) ;
- les phytases microflorales intestinales (visibles principalement dans le gros intestin du porc).
Dans le chyme, masse semi-fluide à la sortie de l'estomac, il faut distinguer la phase liquide de la phase solide, pour différencier les phosphates d’inositol solubles, dégradables et en principe physiologiquement actifs, de ceux qui sont insolubles, non dégradables et probablement physiologiquement inactifs.
Estomac
Chez les patients iléostomisés, une déviation chirurgicale de la partie terminale de l’intestin grêle permet d’observer directement le contenu du tube gastro-intestinal après passage par l’estomac et l’intestin grêle. À la suite de la prise d’aliments riches en phytate et contenant des phytases actives, il est observé une dégradation du phytate de l’ordre de 56 à 66 % au niveau de l’iléon[28]. Mais si les phytases alimentaires sont inactivées par des traitements thermiques ou d’extrusion, la dégradation du phytate diminue.
Des observations plus complètes de l’hydrolyse du phytate ont été menées sur des porcs sur tout le tube digestif - estomac, intestin grêle et gros intestin.
Comme chez les humains, si aucune phytase active n’est présente dans les aliments, il n’y a pas de dégradation de phytate dans l’estomac[29]. Sinon en présence de phytases alimentaires actives, une forte hydrolyse du phytate soluble se produit et des phosphates d’inositol moins phosphorylés sont formés graduellement, comme le pentaphosphate d’inositol DL-Ins(1,2,3,4,5)P5. Deux voies d’hydrolyse du phytate ont été proposées :
- Ins(1,2,3,4,5,6)P6 → L-Ins(1,2,3,4,5)P5 → L-Ins(1,2,3,4)P4 → Ins(1,2,3)P3 → InsP2
- Ins(1,2,3,4,5,6)P6 → L-Ins(1,2,3,4,5)P5 → L-Ins(2,3,4,5)P4 → Ins(2,3,4)P3 → InsP2
La concentration du phytate soluble dans le chyme gastrique diminue, réduisant l’interaction avec les cations métalliques dans le chyme gastrique.
Intestin grêle
Dans l'intestin grêle, la plupart des phosphates d'inositol sont précipités et présents dans la phase solide du chyme. À la sortie de l’estomac, les phytases alimentaires qui arrivent dans le pylore subissent une forte inactivation par la digestion peptidique dans le pylore et par un pH défavorable dans le chyme duodénal (pH 6,5 – 7). La concentration en phosphates d’inositol est plus grande dans l’intestin grêle que dans l’estomac.
Gros intestin
Dans le chyme du gros intestin, les phosphates d’inositol sont presque entièrement présents dans la phase solide avec des concentrations élevées de phytate IP6 et de très faibles concentrations de phosphates d’inositol moins phosphorylés (IP2-IP3-IP4-IP5). Si des phytases actives sont présentes dans l'alimentation, une forte hydrolyse du phytate se produit alors dans l'estomac. Par contre, si les phytases sont inactivées par un traitement particulier de l’aliment, la dégradation du phytate se produit alors principalement dans le gros intestin par les phytases microbiennes.
Fèces
Dans les matières fécales, on observe de très faibles concentrations de phytate ce qui démontre une forte hydrolyse continue du phytate.
La dégradation du phytate dans l'intestin dépend du taux de calcium dans l'alimentation. Comme cela avait déjà été montré chez l'homme par Walker et al. en 1947, Sandberg et al.[30] en 1993 ont trouvé chez les porcs que la dégradation totale du phytate dans l'intestin diminuait au fur et à mesure de l’augmentation de la prise de calcium.
Des études chez l'homme ont montré que 37 à 66% du phytate est dégradé dans l'estomac et l'intestin grêle lorsque l'alimentation est riche en phytases végétales[3].
Si la cuisson et le traitement des aliments ont inactivé en partie les phytases, on peut supposer que le phytate alimentaire est peu dégradé dans l’estomac et l’intestin grêle par les phytases alimentaires. Ce n’est que dans le gros intestin que l’hydrolyse du phytate se produit au moyen des phytases microbiennes. Les phosphates d'inositol hautement phosphorylés, et en particulier l'acide phytique IP6, se lient fortement aux minéraux et oligo-éléments dans les conditions acides du chyme gastrique et forment des complexes solubles. En quittant le milieu acide de l’intestin, ces complexes précipitent dans le milieu neutre de l’intestin, et l’absorption intestinale des micronutriments est alors entravée. Si bien que dans le cas d’une alimentation déséquilibrée, le sujet peut être conduit à des carences.
Ainsi dans l’équilibre bénéfices-risques, pour tirer un bénéfice physiologique optimal du phytate, sa teneur dans la partie supérieure de tube gastro-intestinal doit être faible pour éviter les interactions indésirables avec les micronutriments mais sa teneur doit être élevée pour utiliser son activité antioxydante et anticancéreuse ainsi que sa contribution à la prévention de la formation des calculs rénaux.
Absorption et biodisponibilité du phytate

Sous un pH physiologique (6-7), l’acide phytique avec ses douze groupes hydroxyles OH prend une charge négative (en perdant un H+) sur 8 (ou plus) d’entre eux et devient un phytate très chargé négativement. En raison de cette grande concentration de charges négatives, il a été longtemps supposé que le phytate ne pouvaient franchir la bicouche lipidique des membranes plasmiques.
Toutefois, des études menées depuis quelques décennies ont montré l’existence d’une absorption gastro-intestinale du phytate chez le rat et l’homme. En administrant du phytate radiomarqué à des rats, Sakamoto et al. ont trouvé une large distribution de radioactivité dans le foie, les reins et l’intestin[31]. Par la suite, une étude de Grases et al[32] a montré sur sept sujets humains que la faible concentration de l’acide phytique dans le plasma sanguin lorsqu’ils observaient un régime pauvre en phytate, augmentait et atteignait un maximum après ingestion d’une seule dose de 1,4 g de phytate de sodium. Et après une période de restriction d’un régime pauvre en phytate, les sujets qui suivaient un régime normal en phytate, retrouvaient au bout de seize jours les teneurs normales du plasma et de l’urine en IP6. Cette absorption du phytate dans l’intestin est cependant très faible et ne dépasserait pas quelques pour cent (≦ 2 %).
Influence du phytate sur l’absorption minérale dans l’intestin

(selon PubChem[33])
Les autorités de santé recommandent la consommation de graines oléagineuses, de légumineuses et de fruits à coque en raison de leur apport en vitamines, minéraux, oligo-éléments et fibres alimentaires. Mais ces aliments apportent aussi des phytates qui affectent la biodisponibilité du fer, zinc et du calcium. En effet, en condition physiologique, l’acide phytique apparait sous sa forme anionique, le phytate fortement chargé négativement qui manifeste un grand potentiel à se complexer avec des cations chargés de deux charges positives, comme le fer Fe2+, le zinc Zn2+, le magnésium Mg2+ et le calcium Ca2+. Ces complexes cations-phytates qui sont une forme de stockage du phosphore et des minéraux pour la plante, évitent le lessivage de ces éléments minéraux lors de la première phase de la germination, la prise d'eau ou imbibition (gonflement de la graine)[34]. Les complexes qui sont solubles dans les conditions d’acidité de l’estomac, précipitent quand ils arrivent dans le milieu neutre de l’intestin et deviennent physiologiquement inactifs. Les phytates peuvent aussi former des complexes avec les protéines, les lipides et les glucides[35] - [36]. Il a été montré in vitro que le complexe phytate-protéine a une moindre probabilité d’être digéré par les enzymes protéolytiques et digestives comme la pepsine, la trypsine et la chymotrypsine ainsi que l’amylase[2].
En nutrition
- Absorption du zinc
Une étude[37] portant sur des rats démontre que ceux nourris à la farine complète ont globalement un meilleur apport en minéraux que ceux nourris à la farine blanche : l'acide phytique réduit en effet l'absorption de certains minéraux, mais ceux-ci sont présents en plus grande quantité dans la farine complète.
Une étude[38] réalisée sur des porcs montre un effet comparable entre un ajout de zinc à la ration alimentaire de porcs et un ajout de phytase (une enzyme qui clive le phytate). La phytase a aussi pour effet de réduire le rejet de zinc par les porcs. Ces rejets de minéraux, en particulier le phosphore, participent à l'eutrophisation des milieux. Pour ces raisons (rejets et assimilation) des essais de transgenèse avec des gènes de phytase ont déjà été effectués sur les végétaux et sur les porcs eux-mêmes.
Une étude[39] réalisée sur une population d’enfants iraniens et égyptiens mit en évidence le concept de biodisponibilité du zinc. Les enfants consommant un pain complet élaboré sans levain, mais riche en zinc, souffraient paradoxalement de plus de troubles associés à une carence en zinc (retards de croissance) que ceux consommant un pain blanc, élaboré au levain, mais plus pauvre en zinc : la phytase du levain rend le zinc disponible pour être assimilé.
- Absorption du cuivre, magnésium et fer
Le cuivre: selon une étude[40], l'acide phytique n'a aucun effet sur l'absorption du cuivre. En outre, il ressort de cette étude que la métabolisation du cuivre peut varier sensiblement d'un individu à l'autre, facteur indépendant de la teneur en acide phytique et en fibres. Par ailleurs, l'absorption du cuivre est corrélée à celle du zinc.
Le magnésium : l'inhibition de l'absorption du magnésium est dose-dépendante quant à la quantité d'acide phytique[41].
Le fer : L'acide phytique est un agent chélateur du fer mais le monophytate ferrique contenu dans le son de blé est hautement biodisponible et n'affecte pas l'absorption du fer[42].
- Fermentation alimentaire
Il existe cependant des composants alimentaires qui peuvent contrebalancer l’effet inhibiteur du phytate sur l’absorption des minéraux. Ainsi les acides organiques produits par une fermentation alimentaire neutralisent les effets inhibiteurs du phytate et améliorent l'absorption du zinc en présence de phytate[43]. Le même effet a été signalé pour les protéines alimentaires, où la teneur, le type de protéine ainsi que la teneur en zinc sont importants pour l'amélioration de l'absorption du zinc. Les régimes pauvres en protéines animales entraînent une faible absorption du zinc en présence de phytate et une teneur élevée en calcium augmente l'effet inhibiteur sur la biodisponibilité du zinc en formant du phytate de calcium-zinc. Cependant, un apport insuffisant en zinc est la principale cause de carences en zinc chez l'homme.
- Révolution néolithique
La faible biodisponibilité des minéraux s’est manifestée notamment lors de la « révolution néolithique » : sauf les ruminants (dotés d'un microbiote intestinal possédant un équipement enzymatique original, avec notamment des phytases), les mammifères, hommes inclus, ne peuvent hydrolyser les complexes phytiques. Or, les premières céréales cultivées ont des graines riches en ces composés servant de défense contre les herbivores. Ce facteur a probablement joué un rôle dans la diminution croissante de la taille des hommes du Néolithique, de plus de 10 cm[7], phénomène lié en partie à cause de changements génétiques lorsqu'ils se sont adaptés au réchauffement climatique, mais aussi à leur alimentation : graines des céréales cultivées riches en lectines et en acide phytique déminéralisant, baisse de l'apport protidique animal (liée à la diminution de la chasse au gros gibier et la consommation d'animaux d'élevage plus gras), agressions nutritionnelles (disettes et famines, conséquences des aléas climatiques sur les monocultures et des divers conflits), plus grande exposition aux épidémies (favorisées par la sédentarisation et les carences protéiques)[8].
Applications
- Élimination du plomb toxique
Une étude sur l’homme a porté sur 23 volontaires qui ont ingéré du plomb 203Pb sous forme d’acétate de plomb[44]. L'étude a mis en évidence une réduction considérable de l’absorption du plomb si celui-ci était accompagné d’une alimentation équilibré (avec du calcium, des sels de phosphate et du phytate de céréales) plutôt que pris sans accompagnement et durant une période de jeûne.
- Élimination du fer en excès dans les vins rouges
En œnologie, l’élimination du fer en excès dans les vins rouges se fait à l’aide du phytate de calcium (Ribéreau-Gayon et al.[45], 2004, p. 124-125). Ce sel mixte est peu soluble dans l’eau et il précipite en éliminant l’excès de fer ferrique. Le phytate de calcium est un traitement efficace contre la casse ferrique.
Traitement des aliments pour hydrolyser le phytate
Hydrolyse thermique du phytate
Pour bien cuire des haricots bruns, une température de 110 °C est nécessaire durant une heure et demie, après les avoir laissé tremper toute une nuit. D’après Schlemmer, environ le quart du phytate InsP6 est dégradé en phosphates d’inositol moins phosphorylés InsP5—InsP3. Cependant, la somme totale des phosphates d’inositol InsP6—InsP3 ne décroît pas. Et même à des températures supérieures, les phytates de haricots restent stables.
Hydrolyse par la phytase
Les phytases hydrolysent le phytate InsP6 ainsi que les phosphates d’inositol moins phosphorylés jusqu’à obtenir le myo-inositol. La température optimale d’activité de la phytase des céréales est de 45 °C, avec un pH optimal de 5,0–5,6.
Le trempage dans l’eau des céréales et des graines de légumineuses est souvent utilisé comme un traitement préalable à la germination, à la cuisson ou au maltage.
- Trempage et germination des céréales
Le phytate étant soluble dans l’eau, quand on jette l’eau de trempage, on élimine une partie du phytate.
Il y a une différence marquée d’activité des phytases dans les céréales : l'activité la plus élevée se produisant dans le seigle et la plus faible dans l'avoine. Durant la germination, l’activité des phytases augmente considérablement[46]: 11 fois pour l’orge, 9 fois pour l’avoine, 4,5 fois pour le blé et 2,5 fois pour le seigle. Finalement, après action de catalyse de l’enzyme, la teneur en phytate est réduite de 30 % dans le blé et le seigle, de 17 % dans l'avoine et de 16 % dans l'orge.
- Trempage et germination des légumineuses
Comme les graines de légumineuses sont une source appréciable de protéines, il est important de réduire au mieux la concentration des phytates, pour avoir la meilleure biodisponibilité des protéines et micronutriments.
La germination des légumineuses s’accompagne d’une diminution importante du phytate : 64 % pour le pois chiche, 39 % pour la graine de soja et 37 % pour le haricot mungo[47]. Dans les conditions optimales d’activation des phytases endogènes des haricots noirs (60 °C et pH 6,0), on obtient une réduction de 55 % du phytate IP6 après trempage et cuisson[48].
D’autres études ont donné des baisses moins importantes que celles-ci.
Par contre, un trempage des pois pendant 12 heures, ne réduit le contenu de phytate que de 9 %. La germination à condition d’être assez longue (48 h), permet d’obtenir une réduction du phytate de 67 à 83 %. Pour la graine de quinoa, il a été montré que par le trempage, la germination et la fermentation lactique, on pouvait réduire le contenu en phytate jusqu’à 98 %[49]
- Fermentation panaire au levain
Les deux méthodes principales de panification en France sont la panification « sur levure » basée sur l’addition de levure de boulanger à la pâte faite de farine, eau et sel ; puis la panification « sur levain » dans laquelle interviennent des bactéries lactiques (Lactobacillus) et des levures sauvages. La première méthode permet de faire la baguette, la seconde est plutôt utilisée pour le pain complet.
Une étude comparative des deux méthodes a montré que la panification sur levain est plus efficace que la panification sur levure pour réduire la teneur en phytates du pain de blé entier (avec une réduction du phytate de 62 % pour le pain au levain et de 38 % pour celui à la levure, par rapport à la farine[50]). La raison tient au fait que les bactéries lactiques présentes dans le levain acidifient la pâte au cours de la fermentation. Une température élevée (28 °C) et un pH bas (qui se situe entre 3,4 et 3,7 au bout de quelques heures de fermentation[51] - [52]) sont des conditions favorables à l’activation des phytases.
En principe, plus de phytases, signifie plus de dégradation des phytates IP6-IP5-IP4-IP3 et donc meilleure biodisponibilité des minéraux. C’est ce qu’ont voulu vérifier Lopez, Duclos et al[53] en comparant l’absorption minérale sur trois groupes de rats nourris 1) avec de la farine complète de blé, 2) avec du pain à la levure et 3) avec du pain au levain. Ils ont observé que les phytates sont plus dégradés dans le pain au levain que dans le pain à la levure de boulanger (par rapport à la farine, le pain au levain a une concentration de phytate diminuée de 71 % alors que celle du pain à la levure a diminué de 52 %). Pour les rats, le régime au pain à la levure neutralise les effets délétères de la farine complète de blé sur l’absorption du fer, tandis que le pain au levain améliore au contraire l’absorption du fer. L’absorption du magnésium est aussi améliorée pour les rats consommant le pain au levain par rapport à ceux nourris au pain à la levure ou à la farine. Même chose pour l’absorption du zinc et du cuivre, qui sont maximales pour le régime au pain au levain.
Dans le pain de seigle consommé en Europe orientale, centrale et septentrionale, l'acide phytique est presque totalement dégradé en phosphates d'inositol inférieurs IP3 et en phosphate inorganique libre pendant la fabrication du pain lorsqu'une fermentation longue est utilisée[54].
Cuisson par extrusion
L’extrusion est un processus de courte durée, à haute température et haute pression par lequel on contraint un aliment à traverser une filière le soumettant à des forces de cisaillement élevées. C’est une technique utilisée pour donner une texture croustillante aux céréales « soufflées » pour petit-déjeuner (flakes, pétales, flocons de blé, avoine, riz, sarrasin, etc.), aux graines de légumineuses (soja, pois) pour faire des protéines végétales texturées, aux farines infantiles, aux galettes de type « cracotte », aux galettes de riz soufflé, aux collations (snacks apéritifs), etc.
Pour les céréales (avoine, riz, blé), la cuisson par extrusion ne provoque que de légères diminutions des phosphates d'inositol totaux[55].
Toutefois une étude portant sur le mélange d’une céréale, le sorgho, et d’une légumineuse, le soja, a cherché à déterminer les effets de la variation des paramètres du processus d’extrusion sur le taux d’acide phytique. Les paramètres en question sont : la proportion de soja (10 à 30 %) dans le mélange, la teneur en humidité (12 à 20 % wb) de l’aliment, la température du baril (110 à 150 °C) de l’extrudeuse et la vitesse de sa vis (de 250 à 450 tpm)[56]. Il a été observé que l'extrusion obtenait une réduction optimum de la teneur en acide phytique des mélanges de sorgho-soja atteignant 57 % dans le produit extrudé par rapport à la matière première (pour un mélange contenant 20 % de farine de soja, une humidité de 16 %, une température de 150 °C et vitesse de 350 tpm).
Propriétés pharmacologiques bénéfiques
Le phytate découvert en 1855-56 dont la structure chimique est déterminée en 1914, et les propriétés antinutritionnelles élucidées dans les années 1940, voit enfin ses propriétés pharmacologiques bénéfiques révélées à la fin du XXe siècle, 150 ans après sa découverte.
Prévention des calculs rénaux et d’autres calcifications
Le phytate est un puissant agent de prévention des calcifications dans les fluides biologiques, qui peut être utilisé pour prévenir la formation de calculs rénaux (lithiase rénale)[57]. Il possède en effet une forte activité d’inhibition de la cristallisation des oxalates de calcium ou des phosphates de calcium, deux constituants importants des calculs.
L’effet du phytate sur le développement du calcul urinaire a été étudié sur des rats[58]. Dans les groupes de rats traités au phytate, ou au phytate et zinc, la dissection et l’analyse des reins a montré que le nombre des calcifications sur les pointes papillaires y était significativement réduite, par rapport au groupe témoin traité exclusivement avec de l'éthylène glycol.
En 2004, une étude épidémiologique prospective menée auprès d’une cohorte de 96 245 infirmières pendant huit ans, a examiné l’association entre les facteurs diététiques et les risques de calculs rénaux. L'apport en phytate est clairement associé à un risque réduit de formation de calculs : les femmes du quintile qui consomment le plus de phytate, ont une réduction du risque de 37 % comparé à celle du quintile le plus bas[59]. Une consommation des graines riches en phytate pourrait être un moyen sûr de prévenir la formation de calculs rénaux.
La formation de concrétions calciques dans les voies excrétrices de la salive, appelée lithiase salivaire, est aussi inhibée par le phytate. Il en est de même de la calcification cardiovasculaire[3].
Normalisation des niveaux de glucose et de cholestérol sérique
Dans les conditions physiologiques, l’acide phytique interagit avec les protéines pour former des complexes peu solubles ce qui lui permet d’inhiber l’action des enzymes. Une étude sur les rats a montré[60] que l'ajout de phytate mono-potassique à un régime enrichi en cholestérol pendant six semaines, réduisait significativement le cholestérol total sérique de 32% et les triacylglycérols de 64%.
Cet effet hypocholestérolémiant du phytate pourrait être dû à une augmentation de l’excrétion fécale d’acide biliaire et de lipides et à une réduction de la synthèse hépatique du cholestérol.
Propriétés antioxydantes

L’activité antioxydante du phytate a reçu une explication remarquable. Elle est basée sur la complexation du fer entre trois groupes phosphates en position 1,2,3 voisines. Ces groupes phosphate sont flexibles et lient l'ion fer de telle manière que les six sites de coordination du fer soient occupés par des groupes OH et l'eau liée labile dans la première sphère de coordination du fer est éliminée. La stabilité de ce complexe fer-phytate étant élevée, d’autres ligands avec des affinités moindres ne peuvent interagir avec le fer qui se trouve comme enfermé dans cette « cage »[3].
En présence de phytate, le peroxyde d’hydrogène H2O2 ne peut former un radical hydroxyde HO• via les deux réactions suivantes
- (1) •O2− + Fe3+ = O2 + Fe2+
- (2) Fe2+ + H2O2 = Fe3+ + OH− + HO•
On peut supposer que la structure du phytate mono-ferreux (Fe2+) est similaire à celle du phytate mono-ferrique. Par conséquent, la stabilité des complexes fer-phytate empêche ces réactions d’avoir lieu. Toutefois, l’inhibition de la formation du radical hydroxyde HO• requiert un ratio supérieur à 5:1 de l’acide phytique et du fer.
Sur les 22 chélateurs de fer facilement disponibles étudiés précédemment, seul le phytate semble être l'antioxydant alimentaire le plus efficace et non toxique[2].
Activité anticancéreuse
Au début des années 2000, le phytate IP6 a retenu beaucoup l’attention des chercheurs pour son rôle dans la prévention des cancers et le contrôle de la croissance des tumeurs et de la progression des métastases[61]. Une action anticancéreuse remarquable du phytate a été mise en évidence dans différents modèles expérimentaux comme le cancer du côlon induit chez les rats ou les souris avec différents carcinogènes ainsi que les cancers du sang, du foie, du pancréas, des poumons, de la prostate, etc. Il semble que l’action anticancéreuse de IP6 soit médiée par des phosphates d’inositol moins phosphorylés (IP5, IP4, IP3). L’IP6 administré de manière exogène est rapidement absorbé dans le tube digestif et rapidement absorbé par les cellules malignes.
L'activité anticancéreuse de l'acide phytique est l'une des activités bénéfiques les plus importantes de l'acide phytique bien qu’elle ne soit pas encore comprise[2].
Notes
- Les graines accumulent en effet plus de phosphore qu'elles n'en ont besoin, aussi l'excès est incorporé dans cette molécule.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Kumar V., Sinha A.K., Makkar H.P.S., Becker K., « Dietary roles of phytate and phytase in human nutrition », Food Chemistry, vol. 120, no 4, , p. 945-959 (lire en ligne)
- Ulrich Schlemmer, Wenche Frølich, Rafel M. Prieto, and Felix Grases, « Phytate in foods and significance for humans: Food sources, intake, processing, bioavailability, protective role and analysis », Mol Nutr Food Res, vol. 53 suppl 2, no 2, (lire en ligne)
- (en) F. Hubel, E. Beck, « Maize Root Phytase (Purification, Characterization, and Localization of Enzyme Activity and Its Putative Substrate) », Plant Physiology, vol. 112, no 4, , p. 1429-1436 (DOI 10.1104/pp.112.4.1429).
- (en) J.W. Erdman, « Oilseed phytates: Nutritional implications », Journal of the American Oil Chemists’ Society, vol. 56, no 8, , p. 736-741 (DOI 10.1007/BF02663052).
- (en) Horst Marschner, Mineral Nutrition of Higher Plants, Elsevier Science, , p. 273.
- Thierry Souccar, Le régime préhistorique, comment l'alimentation des origines peut nous sauver des maladies de civilisation, indigène édition, , p. 119.
- Brigitte et Gilles Delluc, Martine Roques, La nutrition préhistorique, Errance, , p. 119.
- (en) Clarence H Patrick, Alcohol, Culture, and Society, Duke University Press, , p. 26-27
- Brigitte et Gilles Delluc, Martine Roques, La nutrition préhistorique, Errance, , p. 119.
- Marc-André Selosse, Jamais seul. Ces microbes qui construisent les plantes, les animaux et les civilisations, Actes Sud Nature, , p. 367
- Abderrazak Marouf, Gérard Tremblin, Abrégé de biochimie appliquée, EDP Sciences, (ISBN 2759819086), p. 390-391
- T. Hartig, « Über das Klebermehl », Bot. Ztg.,
- R. J. Anderson, « A contribution to the chemistry of phytin », J. Biol. Chem., vol. 17, no 2, , p. 171-190 (A CONTRIBUTION TO THE CHEMISTRY OF PHYTIN (sciencedirectassets.com))
- Felix Grases and Antonia Costa-Bauza, « Key Aspects of Myo-Inositol Hexaphosphate (Phytate) and Pathological Calcifications », Molecules, vol. 24, no 24, (lire en ligne)
- Wenche Frølich, Heddie Mejborn et Inge Tetens, « Phytate – a natural component in plant food », sur food.dtu.dk (consulté le )
- « Manipulating the Phytic Acid Content of Rice Grain Toward Improving Micronutrient Bioavailability »
- Marie Herbillon, Le quinoa : intérêt nutritionnel et perspectives pharmaceutiques (thèse), Université de Rouen, UFR sz médecine et pharmacie, (lire en ligne)
- Kathryn Steadman, Monica S Burgoon, Betty A Lewis,..., Ralph Obendorf, « Minerals, phytic acid, tannin and rutin in buckwheat seed milling fractions », Journal of the Science of Food and Agriculture, vol. 81, no 11,
- B. Pereira da Silva, P. Cristine Anunciação et al., « Chemical composition of Brazilian chia seeds grown in different places », Food Chemistry, vol. 221, , p. 1709-1716 (lire en ligne)
- (en) S. Z. Hussain, H. R. Naik, Tehmeena Ahad et Jasia Nissar, « A review phytic acid: As antinutrient or nutraceutical », Journal of Pharmacognosy and Phytochemistry, vol. 6, no 6, , p. 1554–1560 (lire en ligne, consulté le )
- (en) J. W. Erdman, « Oilseed phytates: Nutritional implications », Journal of the American Oil Chemists' Society, vol. 56, no 8, , p. 736–741 (ISSN 1558-9331, DOI 10.1007/BF02663052, lire en ligne, consulté le )
- (en) Kalidas Shetty, Gopinadhan Paliyath, Anthony Pometto, Robert E. Levin, Functional Foods and Biotechnology, CRC Press, , p. 116.
- « Phytic Acid: New Doors Open for a Chelator », The Lancet, originally published as Volume 2, Issue 8560, vol. 330, no 8560, , p. 664–666 (ISSN 0140-6736, DOI 10.1016/S0140-6736(87)92447-0, lire en ligne, consulté le )
- « Antioxidant functions of phytic acid. », https://www.ncbi.nlm.nih.gov/pubmed/2182395,
- Ma, G., Li, Y., Jin, Y., Zhai, F. et al., « Phytate intake and molar ratios of phytate to zinc, iron and calcium in the diets of people in china », Eur. J. Clin. Nutr., vol. 61, , p. 368-374
- Vikas Kumar and Amit K. Sinha, « Chap. 3 General aspects of phytases », dans Carlos Simões Nunes, Vikas Kumar, Enzymes in Human and Animal Nutrition Principles and perspectives, Elsevier Inc., (ISBN 978-0-12-805419-2)
- Sandberg, A. S., Andersson, H., « Effect of dietary phytases on the digestion of phytate in the stomach and small intestine of humans », J. Nutr., vol. 118, , p. 469-473
- Schlemmer, U., Jany, K. D., Berk, A., Schulz, E., Rechkemmer, G., « Degradation of phytate in the gut of pigs – Pathway of gastro-intestinal inositol phosphate hydrolysis and enzymes involved », Arch. Anim. Nutr., vol. 55, , p. 255-280
- Sandberg, A. S., Larsen, T., Sandstr_m, B., « High dietary calcium level decreases colonic phytate degradation in pigs fed a rapeseed diet, », J. Nutr., vol. 123, , p. 559-566
- Sakamoto, K., Vucenik, I., Shamsuddin, A. M., « [3H] Phytic acid (inositol hexaphosphate) is absorbed and distributed to various tissues in rats », J. Nutr., vol. 123, , p. 713-720
- Grases, F., Simonet, B. M., Vucenik, I., Prieto, R. M., « Absorption and excretion of orally administered inositol hexaphosphate (IP6 or phytate) in humans », Biofactors, vol. 15, , p. 53-61
- PubChem, « Calcium phytate » (consulté le )
- Guillaume Jean, Pierre Bergot, Sadasivam Kaushik, Nutrition et alimentation des poissons et crustacés, Quae, , p. 366
- V. Kumar et al., « Dietary roles of phytate and phytase in human nutrition » Food Chemistry, Vol. 120, n° 4, 2010, p. 945‑959
- Sandberg, A. S., Andersson, H., Kivist_, B., Sandstr_m, B., « Extrusion cooking of a high-fibre cereal product. 1. Effects on digestibility and absorption of protein, fat, starch, dietary fibre and phytate in the small intestine », Br. J. Nutr, vol. 55, , p. 245-254
- (en) MA Levrat-Verny et al., Wholewheat flour ensures higher mineral absorption and bioavailability than white wheat flour in rats, Br J Nutr. 1999 Jul;82(1):17-21
- (en) Jondreville, C., R. Hayler and D. Feuerstein (2005). "Replacement of zinc sulphate by microbial phytase for piglets given a maize-soya-bean meal diet." Animal Science 81: 77-83
- (en) Dr A. Prasad (1961). Synthèse in "Zinc Metabolism" (1966)
- (en) JR Turnlund et al., A stable isotope study of copper absorption in young men: effect of phytate and alpha-cellulose, Am J Clin Nutr, Vol 42, 18-23
- (en) T Bohn et al., Phytic acid added to white-wheat bread inhibits fractional apparent magnesium absorption in humans, Am J Clin Nutr. 2004 Mar;79(3):418-23
- E.R. Morris, R. Ellis, Phytate, Wheat Bran, and Bioavailabity of Dietary Iron. In Nutritional Bioavailability of Iron. ACS Symposium Series 203, American Chemical Society, 1982, page 121-141.
- Pabon, M., Lonnerdal, B., « Distribution of iron and its bioavailability from iron-fortified milk and formula », Nutr Res, vol. 13, , p. 103-111
- H M James, M E Hilburn, J A Blair, « Effects of meals and meal times on uptake of lead from the gastrointestinal tract in humans », Hum Toxicol., vol. 4, no 4, , p. 401-407 (DOI 10.1177/096032718500400406.)
- Pascal Ribéreau-Gayon, Y. Glories, A. Maujean, D. Dubourdieu, Traité d’œnologie 2. Chimie du vin, stabilisation et traitement, Dunod, 1998, 2004
- Maria Bartnik, Izabela Szafrańska, « Changes in phytate content and phytase activity during the germination of some cereals », Journal of Cereal Science, vol. 5, no 1, , p. 23-28
- Chitra, U., Singh, U., Rao, P. V., « Phytic acid, in vitro protein digestibility, dietary fiber, and minerals of pulses as influenced by processing methods », Plant Foods Hum. Nutr., vol. 49, , p. 307-316
- Ralf Greiner, Ursula Konietzny, « Improving enzymatic reduction of myo-inositol phosphates with inhibitory effects on mineral absorption in black beans (Phaseolus vulgaris) var. preto) », Journal of Food Processing an Preservation, vol. 23, no 3, , p. 249-261
- Valencia, S., Svanberg, U., Sandberg, A. S., Ruales, J., « Processing of quinoa (Chenopodium quinoa, Willd): Effects on in vitro iron availability and phytate hydrolysis », Int. J. Food Sci. Nutr., vol. 50, , p. 203-211
- H W Lopez, V Krespine, C Guy, A Messager, C Demigne, C Remesy, « Prolonged fermentation of whole wheat sourdough reduces phytate level and increases soluble magnesium », J Agric Food Chem, vol. 49, no 5, (DOI 10.1021/jf001255z)
- Annabelle Vera, Maï Huong Ly-Chatain, Véronique Rigobello, Yann Demarigny, « Description of a French natural wheat sourdough over 10 consecutive days focussing on the lactobacilli present in the microbiota », Antonie Van Leeuwenhoek, vol. 101, no 2,
- K. Aplevicz, P. Ogliari, E. Sant’Anna, « Influence of fermentation time on characteristics of sourdough bread », Brazilian Journal of Pharmaceutical Sciences, vol. 49, no 2, (lire en ligne)
- Hubert W Lopez, Virgile Duclos, C. Coudray, V. Krespine, C. Feillet-Coudray, A. Messager, C. Demigné, C. Rémésy, « Making bread with sourdough improves mineral bioavailability from reconstituted whole wheat flour in rats », Nutrition, vol. 19, no 6,
- Merete M. Nielsen, M. Damstrup, A. Thomsen, S. Rasmussen, Å. Hansen, « Phytase activity and degradation of phytic acid duringrye bread making », Eur Food Res Technol, vol. 225, , p. 173-181
- D G Gualberto, C J Bergman, M Kazemzadeh, C W Weber, « Effect of extrusion processing on the soluble and insoluble fiber, and phytic acid contents of cereal brans », Plant Foods for Human Nutrition, vol. 51,
- Arun Kumar, Indra Mani,... Abhijit Kar, « Effect of extrusion technique on antinutritional factors of sorghum-soya blends », Indian Journal of Agricultural Sciences, vol. 88, no 3,
- F Grases, A Costa-Bauzá, « Phytate (IP6) is a powerful agent for preventing calcifications in biological fluids: usefulness in renal lithiasis treatment », Anticancer Res., vol. 19, no 5A,
- F. Grases, R. Garcia-Gonzalez, J. J. Torres, A. Llobera, « Effects of Phytic Acid on Renal Stone Formation in Rats », Scandinavian Journal of Urology and Nephrology, vol. 32, no 4,
- Curhan, G. C.,Willett,W. C., Knight, E. L., Stampfer, M. J., « Dietary factors and the risk of incident kidney stones in younger women: Nurses’ health study », Arch. Intern. Med., vol. 164, (lire en ligne)
- Jariwalla, R. J., Sabin, R., Lawson, S. and Herman, Z. S., « Lowering of serum cholesterol and triglycerides and modulation of divalent cations by dietary phytate. », Journal of Applied Nutrition, vol. 42, no 1, , p. 18-28
- Ivana Vucenik and AbulKalam M. Shamsuddin, « Protection Against Cancer by Dietary IP 6 and Inositol », Nutrition and Cancer, vol. 55, no 2, , p. 109-25