Chélation
La chélation (prononcer kélassion, du grec χηλή / khêlḗ, « pince, serre de certains animaux »), appelée aussi séquestration ou complexation, est un processus physico-chimique au cours duquel est formé un complexe, le chélate, entre un ligand, dit « chélateur » (ou chélatant), et un cation (ou atome) métallique, alors complexé, dit « chélaté ».
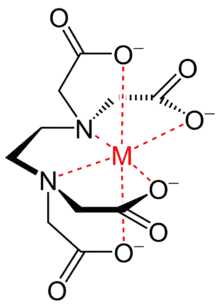
Le chélate se distingue du simple complexe par le fait que le cation métallique est fixé au ligand chélateur par au moins deux liaisons de coordination. Le métal est ainsi pincé entre les fonctions chimiques du ligand. Le nombre de liaisons métal-ligand d’une molécule de ligand définit la « denticité » : on parle de coordinats[1] ou ligands bidentes, tridentes, tétradentes (ou bidentés, tridentés, tétradentés). L’atome central est lié aux atomes voisins par au moins deux liaisons en formant une structure annulaire, un cycle chélate. Les cycles chélates les plus stables sont les cycles chélates à 5 et à 6 chaînons. Grâce à cet effet, les chélates sont des complexes plus stables que les complexes de ligands monodentés comportant les mêmes fonctions chimiques.
Des chélateurs sont utilisés comme médicaments (en cas de saturnisme par exemple), mais ils doivent être utilisés avec précaution car ils peuvent interférer avec d’autres métaux que le métal cible et avec l’immunité[2].
La thérapie par chélation est utilisée en médecine avec une efficacité démontrée dans le cas d’intoxication à des métaux lourds. En médecine non conventionnelle, ce traitement est aussi proposé pour désintoxiquer le corps de supposées toxines (provenant par exemple de plombage dentaire ou de vaccin) ou pour retirer les ions calcium du sang (étant considérés comme source d’artériosclérose). Mais aucun essai clinique n’a démontré l’efficacité de ces approches alternatives, avec d’ailleurs un danger lié à la diminution de stock d’électrolytes dans le sang[3].
Effet chélate
Comparons les deux réactions chimiques suivantes :
- Cu(OH2)6 (II) + 2NH3 ⇌ Cu(NH3)2(OH2)4 (II) + 2H2O
- Enthalpie standard : -46 kJ/mol.
Dans chaque cas, les liens Cu–N sont semblables, mais la formation du chélate est favorisée pour des raisons de thermodynamique chimique[4] - [5].
Shriver et Atkins concluent ainsi :
« L’effet chélate est l’augmentation de stabilité des complexes qui contiennent un ligand polydentate coordonné par rapport aux complexes qui contiennent un nombre équivalent de ligands monodentates analogues. »
Typologie des chélateurs
Il existe des chélatants faibles, qui forment des complexes labiles et instables, et des chélatants forts, tels l'EDTA, qui peuvent former des complexes extrêmement stables et inertes, caractérisés par des constantes de dissociation inférieures à 10-27, c'est-à-dire que la forme complexée est un milliard de milliards de milliards de fois plus stable que la forme dissociée.
Fonctions biologiques
La chélation est un phénomène naturel fondamental.
- En chimie bioinorganique : par exemple les ions de cobalt dans la vitamine B12, de magnésium dans la chlorophylle, de cuivre dans l'hémocyanine ou de fer dans l'hémoglobine sont chélatés.
- En biologie : la plupart des organismes vivants produisent des protéines spéciales (métallothionéines), riches en soufre qui contribuent à détoxiquer l'organisme. De plus, la plupart des plantes sécrètent par leur racine des chélateurs pour faciliter l'absorption de certains éléments du sol[6].
- Chez l'homme, les individus le font plus ou moins efficacement selon leur patrimoine génétique. Ceux dont l'organisme ne se détoxifie pas assez vite ont plus de risque de développer des maladies neurodégénératives (Maladie d'Alzheimer (MA) notamment), en particulier en cas d'exposition au mercure inorganique perdu par les plombages dentaires[7]. Chez les personnes génétiquement moins aptes à sa détoxication, le mercure augmente quantitativement et ses effets toxiques sont aggravés (hydrargyrisme). Remarque : la susceptibilité génétique au mercure est liée au polymorphisme du gène de l’apolipoprotéine E ou APOE ; elle est corrélée à un risque beaucoup plus élevé de développer une MA et de la développer plus jeune[8] - [9]. Un trouble cognitif léger a aussi plus de valeur prédictive chez ces derniers[10]. Ce gène APOE existe sous 3 formes (allèles APOE2, APOE3 et APOE4). L'APOE2 est plutôt protecteur, alors que l'APOE4 expose au risque maximal (y compris pour l'âge) [11] - [12] - [13]. Par exemple, un caucasien homozygote pour APOE2 a 25 fois moins de risques de MA que son homologue homozygote pour APOE4 (OR = 0,6 vs 14,9).
Toxicologie, écotoxicologie
Certains chélateurs naturels sont utilisés à leur profit par des organismes vivants, mais certains chélateurs issus de la chimie de synthèse en interférant négativement avec les cycles écologiques et biologiques de certains minéraux et métaux qui sont des oligoéléments ou des métaux toxiques (plomb, mercure, cadmium…) ou radioactifs, certains polluants chélateurs très présents dans notre environnement pourraient avoir des effets toxiques et écotoxicologiques[14].
Applications
Les applications des chélateurs sont nombreuses, par exemple :
- en médecine : lors d'une intoxication avec des poisons métalliques ou contamination interne par des produits radiologiques (plutonium, américium, berkélium, curium, yttrium, californium…), cette propriété est mise à profit avec des antidotes - par exemple du Zn-DTPA ou Ca-DTPA - qui forment un chélate éliminé lors de la miction. Cette capacité de soustraire les cations métalliques du milieu est appelée séquestration : on donne donc aussi aux chélateurs le nom d'agents séquestrants; on cherche à élargir le panel des chélateurs médicaux disponibles, par exemple pour chélater l'aluminium[15] et le phosphore[15].
- en imagerie médicale : en IRM, le gadolinium est utilisé comme agent de contraste sous forme de chélate pour limiter la toxicité de celui-ci sur l'organisme vivant[16] ;
- en chimie analytique ;
- dans l'industrie nucléaire ;
- dans la teinturerie ;
- dans la métallurgie ;
- en agronomie : ces agents peuvent soit passiver une surface métallique (comme le cuivre) par complexation (liaison pendante en surface) soit éloigner les ions métalliques de la surface ;
- en histologie : on utilise des chélateurs du Ca++ (de type EDTA) au cours de l'étape de décalcification des tissus osseux et dentaires. Cette étape est en général nécessaire pour permettre la coupe du prélèvement ; attention toutefois, elle est à éviter si possible, car elle provoque l'altération de la pièce à étudier ;
- pour le traitement des eaux trop chargées en métaux (piscines par exemple).
Il existe aussi des chélateurs naturels tels que des molécules contenues dans la bardane, l'ail, le lierre terrestre, les algues et la coriandre.
Autisme
L'utilisation de la chélation sur des enfants autistes est devenue très courante aux États-Unis au début du XXIe siècle[17]. Des analyses sanguines effectuées sur les enfants autistes ont révélé que certains d'entre eux stockent une quantité anormale de métaux lourds dans leur corps, lançant la théorie d'une plus grande difficulté à les éliminer naturellement[18]. Des cas anecdotiques d'amélioration du comportement après une chélation ont été rapportés. Il n'a longtemps existé aucune étude sur l'efficacité de cette approche appliquée à l'autisme[19].
Une pré-étude faite en 2007 sur dix enfants permet d'affirmer que « les études publiées qui signalent les effets de la thérapie de chélation et/ou du contrôle de l'environnement sur l'autisme et le trouble du déficit de l'attention sont rares »[20]. En 2008, la revue Clinical Toxicology rapporte la mort d'un enfant autiste de 5 ans des suites d'une chélation, et en conclut que « l'efficacité de cette thérapie pour les enfants autistes n'a pas été validée, et peut avoir des conséquences tragiques »[17]. Mal administrée, la chélation peut drainer des minéraux « utiles » ou des métaux pris dans les tissus[21]. Elle est « non-recommandée » par la HAS dans le cadre d'une recherche de réduction des symptômes liés à l'autisme[22].
Notes et références
- « Coordinats », sur Termium plus, (consulté le )
- (en) Roger Segelken, « Commonly used therapy for lead poisoning might alter the immune system, Cornell animal study indicates », sur Cornell Chronicle, (consulté le )
- Simon Singh et Edzard Ernst (trad. de l'anglais par Marcel Blanc), Médecines douces : info ou intox ? [« Trick or Treatment? Alternative Medicine on Trial »], Paris, Cassini, , 416 p. (ISBN 978-2-84225-208-3, OCLC 886619515)
- D. F. Shriver et P. W. Atkins (trad. de l'anglais par André Pousse), Chimie inorganique [« Inorganic Chemistry, Third Edition »], Paris, De Boeck Université, , 763 p. (ISBN 2-7445-0110-7, lire en ligne
 ), partie 1, chap. 7 (« Complexes des métaux d »), p. 243
), partie 1, chap. 7 (« Complexes des métaux d »), p. 243 - Groupe Universitaire d’Innovation Pédagogique (GUIP) en Chimie, UFR de Chimie, « Stabilité des complexes : effet chélate », Ulysse, Université Bordeaux 1, (consulté le )
- Jean-François Morot-Gaudry, « Nutrition minerale des plantes : aspect moléculaire », Académie d'agriculture de France, (lire en ligne)
- Mutter J, Naumann J, Sadaghiani C, Schneider R, Walach H. Alzheimer disease: mercury as pathogenetic factor and apolipoprotein E as a moderator;Neuro Endocrinol Lett.Octobre 2004 ; 25(5):331-9.
- Blacker D, Haines JL, Rodes L, Terwedow H, Go RC, Harrell LE, Perry RT, Bassett SS, Chase G, Meyers D, Albert MS, Tanzi R. ApoE-4 and age at onset of Alzheimer's disease: the NIMH genetics initiative. 1: Neurology. Janvier 1997 Jan ; 48(1):139-47
- Olarte L, Schupf N, Lee JH, Tang MX, Santana V, Williamson J, Maramreddy P, Tycko B, Mayeux R.Apolipoprotein E epsilon4 and age at onset of sporadic and familial Alzheimer disease in Caribbean Hispanics. ; Arch Neurol. Novembre 2006 ; 63(11):1586-90
- Aggarwal NT, Wilson RS, Beck TL, Bienias JL, Berry-Kravis E, Bennett DA. ; The apolipoprotein E epsilon4 allele and incident Alzheimer's disease in persons with mild cognitive impairment. Neurocase. Février 2005 ; 11(1):3-7
- Huang Y. ; Apolipoprotein E and Alzheimer disease. ; Neurology. 2006 Jan 24;66(2 Suppl 1):S79-85
- Slooter AJ, Cruts M, Kalmijn S, Hofman A, Breteler MM, Van Broeckhoven C, van Duijn CM Arch Neurol ; Risk estimates of dementia by apolipoprotein E genotypes from a population-based incidence study : the Rotterdam Study. Juillet 1998 ; 55(7):964-8
- Effects of age, sex, and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease. A meta-analysis. APOE and Alzheimer Disease Meta Analysis Consortium. Farrer LA, Cupples LA, Haines JL, Hyman B, Kukull WA, Mayeux R, Myers RH, Pericak-Vance MA, Risch N, van Duijn CM JAMA. Octobre 1997 ; 2-29;278(16):1349-56.
- Jayasumana C, Gunatilake S, Senanayake P (2014). Glyphosate, hard water and nephrotoxic metals: are they the culprits behind the epidemic of chronic kidney disease of unknown etiology in Sri Lanka? Int J Environ Res Public Health ;11:2125–47. doi:10.3390/ijerph110202125
- Graff L (1996). Recherche et étude de nouveaux chélateurs de l'aluminium et du phosphore utilisables en médecine (Doctoral dissertation, Metz)|résumé.
- Principe de l'IRM, agents de contraste, CultureSciences-Chimie, ENS, 10 mai 2010
- (en) Arla J. Baxter et Edward P. Krenzelok, « Pediatric fatality secondary to EDTA chelation », Clinical Toxicology, vol. 6, , p. 1083–1084 (ISSN 1556-9519, DOI 10.1080/15563650701261488).
- (en) Stephen M. Shore et Linda G. Rastelli (trad. Josef Schovanec et Caroline Glorion), Comprendre l'autisme pour les nuls, Éditions First, , 384 p. (ISBN 2-7540-6581-4).
- (en) Bernard Metz, James A. Mulick et Eric M. Butter, « Autism: A late-20th-century Fad Magnet », dans Controversial Therapies for Developmental Disabilities: Fad, Fashion, and Science in Professional Practice, CRC Press, , 528 p. (ISBN 1135636117 et 9781135636111), p. 248-249.
- (en) Kalpana Patel et Luke T. Curtis, « A comprehensive approach to treating autism and attention-deficit hyperactivity disorder: a prepilot study », Journal of Alternative and Complementary Medicine (New York, N.Y.), vol. 13, , p. 1091–1097 (ISSN 1075-5535, PMID 18166120, DOI 10.1089/acm.2007.0611, lire en ligne, consulté le ).
- Metz, Mulick et Butter 2005, p. 249.
- Shore et Rastelli 2015, p. 145-149.
Annexes
Articles connexes
Liens externes
- (en) Description et utilisation de trisodium calcium diéthylènetriaminepentaacétate dans l'élimination des produits transuraniques par chélation, Radiation Emergency Assistance Center/Training Site.
- Traitement d'ouvriers contaminés par des produits radiologiques avec des infusions de Ca-DPTA. Radioprotection 2004, Vol. 39, no 3, pages 383 à 387.