Fer
Le fer est l'élément chimique de numéro atomique 26, de symbole Fe.
| Fer | |||||||||||

| |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Fe | ||||||||||
| Nom | Fer | ||||||||||
| Numéro atomique | 26 | ||||||||||
| Groupe | 8 | ||||||||||
| Période | 4e période | ||||||||||
| Bloc | Bloc d | ||||||||||
| Famille d'éléments | Métal de transition | ||||||||||
| Configuration électronique | [Ar] 4s2 3d6 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 14, 2 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 55,845 ± 0,002 u[1] | ||||||||||
| Rayon atomique (calc) | 140 pm (156 pm) | ||||||||||
| Rayon de covalence | 132 ± 3 pm (bas spin)[2] |
||||||||||
| État d’oxydation | +2, +3, +4, +6 | ||||||||||
| Électronégativité (Pauling) | 1,83 | ||||||||||
| Oxyde | Amphotère | ||||||||||
| Énergies d’ionisation[3] | |||||||||||
| 1re : 7,902 4 eV | 2e : 16,187 7 eV | ||||||||||
| 3e : 30,652 eV | 4e : 54,8 eV | ||||||||||
| 5e : 75,0 eV | 6e : 99,1 eV | ||||||||||
| 7e : 124,98 eV | 8e : 151,06 eV | ||||||||||
| 9e : 233,6 eV | 10e : 262,1 eV | ||||||||||
| 11e : 290,2 eV | 12e : 330,8 eV | ||||||||||
| 13e : 361,0 eV | 14e : 392,2 eV | ||||||||||
| 15e : 457 eV | 16e : 489,256 eV | ||||||||||
| 17e : 1 266 eV | 18e : 1 358 eV | ||||||||||
| 19e : 1 456 eV | 20e : 1 582 eV | ||||||||||
| 21e : 1 689 eV | 22e : 1 799 eV | ||||||||||
| 23e : 1 950 eV | 24e : 2 023 eV | ||||||||||
| 25e : 8 828 eV | 26e : 9 277,69 eV | ||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | Solide ferromagnétique | ||||||||||
| Allotrope à l'état standard | Fer α (cubique centré) | ||||||||||
| Autres allotropes | Fer γ (cubique à faces centrées), fer δ (cubique centré) | ||||||||||
| Masse volumique | 7,874 g·cm-3[1] à (20 °C) | ||||||||||
| Système cristallin | Cubique centré | ||||||||||
| Dureté (Mohs) | 4 | ||||||||||
| Couleur | Blanc argenté ; reflets gris | ||||||||||
| Point de fusion | 1 538 °C[1] | ||||||||||
| Point d’ébullition | 2 861 °C[1] | ||||||||||
| Énergie de fusion | 13,8 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 349,6 kJ·mol-1 | ||||||||||
| Volume molaire | 7,09×10−6 m3·mol-1 | ||||||||||
| Pression de vapeur | 7,05 Pa | ||||||||||
| Vitesse du son | 4 910 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 440 J·kg-1·K-1 | ||||||||||
| Conductivité électrique | 9,93×106 S·m-1 | ||||||||||
| Conductivité thermique | 80,2 W·m-1·K-1 | ||||||||||
| Solubilité | sol. dans H2SO4 dilué[4], HCl[5] | ||||||||||
| Divers | |||||||||||
| No CAS | [6] | ||||||||||
| No ECHA | 100.028.270 | ||||||||||
| No CE | 231-096-4 | ||||||||||
| Précautions | |||||||||||
| SGH[7] | |||||||||||
État pulvérulent : Danger |
|||||||||||
| SIMDUT[8] | |||||||||||
Produit non contrôlé |
|||||||||||
| Transport | |||||||||||
|
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Le corps simple est le métal et le matériau ferromagnétique le plus courant dans la vie quotidienne, le plus souvent sous forme d'alliages divers. Le fer pur est un métal de transition ductile, mais l'adjonction de très faibles quantités d'éléments additionnels modifie considérablement ses propriétés mécaniques. Allié au carbone et avec d'autres éléments d'addition il forme les aciers, dont la sensibilité aux traitements thermomécaniques permet de diversifier encore plus les propriétés du matériau.
Généralités
Le fer fait partie du groupe des éléments à l'origine des métaux de transition, il montre des analogies caractéristiques avec le ruthénium, l'osmium, le cobalt et le nickel.
Étymologie
Le mot français « fer » est issu du latin ferrum, de même sens[9]. Il est "indénombrable"[10] (au sens où, quand il désigne le métal, il ne s'utilise pas au pluriel ni directement avec un numéral[Note 1]).
Le mot latin ferrum était traditionnellement rattaché à la famille de sens de firmus (« ferme, solide »)[12]. Mais aujourd'hui on voit dans l’espagnol hierro et l’anglais iron (même sens) un emprunt celtique et on le rattache plutôt au radical de aes (« airin » et autres métaux) et sa racine indo-européenne reconstruite : *ḫeṷis ou encore *ai̯os- [« métal »,(cuivre, bronze ou fer)][13].
Physico-chimie nucléaire, isotopes, fréquence
Le fer 56 est le nucléide stable le plus lourd issu de la fusion du silicium par réactions α lors de la nucléosynthèse stellaire, qui produit en fait du nickel 56, lequel est instable et donne du 56Fe par deux désintégrations β+ successives ; les éléments de numéro atomique plus élevé sont synthétisés par des réactions plus énergétiques intervenant plutôt lors de l'explosion de supernovas.
Propriétés nucléaires
Le noyau de fer 56 possède la masse par nucléon la plus faible de tous les nucléides mais pas l'énergie de liaison la plus élevée, en raison d'une proportion de protons un peu plus élevée que le nickel 62 qui, lui, a l'énergie de liaison la plus élevée par nucléon[14].
Le fer 56 résulte de la désintégration naturelle du nickel 56, isotope instable produit au cœur d'étoiles massives par fusion du silicium 28 au cours de réactions alpha en cascade qui s'arrêtent au nickel précisément parce que ce dernier possède l'énergie de liaison nucléaire par nucléon la plus élevée : poursuivre la fusion, pour produire par exemple du zinc 60, consommerait de l'énergie au lieu d'en libérer.
Isotopes
Le fer possède 28 isotopes connus, de nombre de masse variant de 45 à 72, ainsi que six isomères nucléaires. Parmi ces isotopes, quatre sont stables, 54Fe, 56Fe, 57Fe et 58Fe. 56Fe est largement le plus abondant (91,754 %), suivi de 54Fe (5,845 % possiblement légèrement radioactif avec une demi-vie supérieure à 3,1 × 1022 années), 57Fe (2,119 %) et 58Fe (0,282 %). La masse atomique standard du fer est de 55,845(2) u.
Le plus stable des radioisotopes du fer est 60Fe avec une demi-vie de 1,5 million d'années, suivi de 55Fe (2,7 années), 59Fe (un peu moins de 44,5 jours) et de 52Fe (8,5 heures).
Occurrence et abondance naturelle
Le fer est le métal le plus abondant dans les météorites ainsi que dans le noyau des planètes, comme celui de la Terre.
Le fer minéral est présent dans la nature sous forme pure ou plus rarement sous forme d'alliage avec du nickel (5 à 18 %) d'origine météoritique mais aussi sous forme de fer terrestre dit « tellurique ». Trop rare et surtout disséminé, il est fabriqué artificiellement par l'Homme forgeron et sidérurgiste et massivement dans certaines civilisations caucasiennes depuis plus de trois millénaires à partir de ses principaux minerais. Les combinaisons chimiques et minérales impliquant le fer sont pléthoriques, mais les véritables minerais relativement purs à forte teneur en fer sont beaucoup moins communs et souvent très localisés dans des mines de fer la plupart connues de haute antiquité.
Le fer est le 6e élément le plus abondant dans l'Univers, il est formé comme « élément final » de fusion nucléaire, par fusion du silicium dans les étoiles massives. Tandis qu'il compose environ 5 % (en masse) de la croûte terrestre, le noyau terrestre est censé être en grande partie un alliage de fer-nickel, constituant ainsi 35 % de la masse de la Terre dans son ensemble. Le fer est peut-être, en fait, l'élément le plus abondant sur Terre ou du moins comparable (en juste 2e position) en masse à l'oxygène, mais seulement le 4e élément le plus abondant dans la croûte terrestre.
Des courants de convection dans la couche externe du noyau terrestre (noyau externe), de « l'alliage » liquide principalement fer-nickel, sont supposés être à l'origine du champ magnétique terrestre.
Fonctions dans la biosphère
Le fer joue un rôle majeur en tant qu'oligoélément ou micronutriment pour de nombreuses espèces, et comme élément régulant l'amplitude et la dynamique de la productivité primaire océanique, ce qui en fait une composante essentielle des cycles biogéochimiques marins et des puits de carbone marins[15].
Les données récentes montrent que le cycle du fer océanique d'abord supposé lié aux apports de poussières riches en fer est en réalité bien plus complexe, et étroitement couplé biogéochimiquement avec des nutriments majeurs (carbonés, azotés)[15]. On a montré en 2017 que dans les zones pauvres en fer de l'Antarctique, le fer particulaire issu du rabotage des roches par les glaciers est une source alternative de fer que le phytoplancton sait exploiter[16]. Des études ont montré que certains phytoplanctons semblent effectivement bénéficier d'un taux élevé de CO2, mais pour assimiler ce CO2 il leur faut aussi du fer ; il est spéculé depuis la fin du XXe siècle que l'ensemencement de l'océan avec du fer pourrait aider à limiter le changement climatique. Or on découvre que chez la plupart des espèces phytoplanctoniques, ce fer n’est assimilable qu’en présence de carbonates. Problème : ces derniers sont détruits par l’acidification induite par la solubilisation du CO2 dans l’eau[17].
Corps simple
Le fer dévoile un polymorphisme métallique. L'allotropie n'en applique pas moins un changement basique du cortège des propriétés physiques (dilatation, résistivité, chaleur spécifique liée à la structure cristallochimique, etc.).
Propriétés physiques
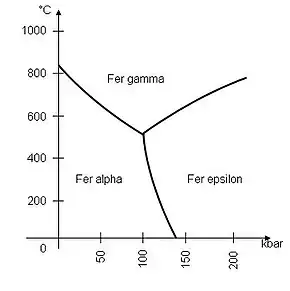
C'est un métal qui, en fonction de la température, présente un évident polymorphisme métallique. L'allotropie distingue :
- dans les conditions normales de température et de pression, c'est-à-dire aux basses températures ou « à basse température », un solide cristallin de structure cubique centrée (fer α, structure appelée ferrite dans l'acier). Le fer α est fortement ferromagnétique : les moments magnétiques des atomes s'alignent sous l'influence d'un champ magnétique extérieur et conservent leur nouvelle orientation après la disparition de ce champ. Sa température de Curie est de 770 °C. Sa capacité calorifique est de 0,5 kJ kg−1 °C−1. À température ambiante, il a une dureté entre 4 et 5 sur l'échelle de Mohs. Sa masse volumique avoisine 7,86 g cm−3 à 20 °C. Le fer alpha est caractérisé par une chaleur de sublimation atomique équivalent à 99,6 kcal/atome-gramme à température ambiante (298 K) ;
- le fer β bêta est une structure cubique face centrée obtenue au-dessus du point de Curie, vers 770 °C ou 1 042 K. Le ferromagnétisme du fer α disparaît sans réarrangement atomique ;
- dès les hautes températures à pression ambiante, à partir de 912 °C, le fer α devient un fer cubique à faces centrées (fer γ, structure appelée austénite dans l'acier), la transformation implique une variation d'énergie interne d'environ 0,22 kcal/atome-gramme à 1 184 K. Le fer γ est paramagnétique ;
- au-delà de 1 394 °C ou 1 665 K, il redevient un minéral de maille cubique centrée (fer δ) ; cette transformation implique une variation d'énergie interne d'environ 0,27 kcal/atome-gramme ;
- la transformation en fer ε (structure hexagonale compacte) se produit à température ambiante à 130 kilobars[18] - [19].
Le corps pur fond à 1 538 °C avec une chaleur latente de fusion qui est de l'ordre de 3,7 kcal/atome-gramme. L'ébullition du fer, caractérisée par une chaleur latente d'ébullition de l'ordre de 84,18 kcal/atome-gramme apparaît vers 2 860 °C, en pratique pour un corps simple plus ou moins impur entre 2 750 °C et 3 000 °C.
Propriétés chimiques
Le fer est insoluble dans l'eau et les bases. Il est attaqué par les acides.
Chimie du fer
Le fer présente essentiellement trois degrés d'oxydation :
- 0 dans le corps simple fer et ses alliages ;
- +II dans les composés ferreux (ion ferreux Fe2+ dans les composés ioniques) ;
- +III dans les composés ferriques (ion ferrique Fe3+ dans les composés ioniques).
Dans les carbures, le degré d'oxydation du fer n'est pas définissable de façon univoque. On en connaît trois, de formules Fe3C, Fe5C2 et Fe7C3.
À très haute température, le fer peut être présent dans des états d'ionisation bien plus élevés, dont on peut observer plusieurs raies d'émission dans l'atmosphère du Soleil et des autres étoiles. Les ions Fe9+ et Fe10+ notamment, également notés FeX et FeXI, sont détectés dans les zones de la couronne solaire portées à des températures de l'ordre de 1–1,5 × 106 K[20]. L'ion Fe16+, noté FeXVII, a la même configuration électronique que le néon, ce qui le rend stable dans une large gamme de températures (environ 2–10 × 106 K) ; on le détecte dans les éruptions solaires[21] - [22].
Oxydation du métal
Le fer, combiné à l'oxygène, s'oxyde, suivant les conditions en trois oxydes de fer :
- l'oxyde de fer(II) FeO (« oxyde ferreux ») ;
- l'oxyde de fer(III) Fe2O3 (« oxyde ferrique ») ;
- l'oxyde de fer(II,III) Fe3O4 (« oxyde magnétique »).
À l'air libre en présence d'humidité, il se corrode en formant de la rouille, constituée d'oxydes et d'oxyhydroxydes ferriques hydratés, qu'on peut écrire Fe2O3·nH2O et FeO(OH)·nH2O respectivement. La rouille étant un matériau poreux, la réaction d'oxydation peut se propager jusqu'au cœur du métal, contrairement, par exemple, à l'aluminium, qui forme une couche fine d'oxyde imperméable.
La spectroscopie Mössbauer fournit un outil puissant pour la distinction des différents degrés d'oxydation du fer. Avec cette technique, il est possible de faire une analyse quantitative en présence de mélange de phases de fer.
Les ions du fer en solution aqueuse

En solution aqueuse, l’élément chimique fer est présent sous forme ionique avec deux valences principales :
- Fe2+ (l'ion fer(II), anciennement appelé ferreux). Suivant l'environnement chimique en solution, il peut prendre différentes couleurs. La solution obtenue par dissolution de sel de Mohr, par exemple, présente une couleur vert pâle. Une telle solution est stable pour les pH inférieurs à 6. Pour un pH supérieur à cette valeur, l'hydroxyde de fer(II) Fe(OH)2 précipite ;
- Fe3+ (l'ion fer(III), anciennement appelé ferrique). Les solutions de chlorure de fer(III) sont orange, et celle de nitrate de fer(III) sont incolores. Ces solutions doivent avoir un pH inférieur à 2 car l'hydroxyde de fer(III) Fe(OH)3 est peu soluble.
Précipitation
Un certain nombre d'ions conduisent à la précipitation des ions du fer en solution. L'ion hydroxyde HO− est de ceux-là (voir ci-dessus). L'ion sulfure S2− permet de former le sulfure de fer(II) FeS, le sulfure de fer(III) et Fe2S3 pour des pH pas trop acides. Il faut en effet qu'une quantité raisonnable d'ions sulfure soit présents, ce qui n'est pas le cas à pH acide puisque l'ion sulfure est alors sous sa forme diacide, le sulfure d'hydrogène H2S.
Oxydoréduction des ions du fer
Les potentiels de référence des couples du fer sont :
- Fe2+ / Fe : E° = −0,44 V
- Fe3+ / Fe2+ : E° = +0,77 V
Cela indique que le fer métallique n'est pas stable en milieu aqueux. Il s'oxyde d'autant plus vite que le pH est bas.
Cela indique également qu'en présence de dioxygène dissous (E°(O2 / H2O) = 1,3 V), les ions fer(II) ne sont pas stables non plus.
Ces potentiels de référence changent en fonction des ions présents en solution, surtout si les constantes de stabilité des complexes correspondant en Fe(II) et Fe(III) sont notablement différentes.
L'oxydoréduction est une manière de titrer les ions fer(II), par exemple par les ions cérium(IV) (couple Ce4+/Ce3+) ou par les ions permanganate MnO4− (couple MnO4− / Mn2+ en milieu acide sulfurique).
Bien que la réduction en fer métallique des ions du fer soit possible, elle est rarement pratiquée à partir de solution aqueuse.
Complexation des ions fer
De nombreux complexes du fer en solution aqueuse se forment facilement, par simple addition du ligand (au bon pH). Parmi les complexes les plus courants se trouvent ceux impliquant les ligands :
- ion cyanure CN−
- pour Fe(II) : Fe(CN)64−, ion hexacyanoferrate(II), diamagnétique, jaune ;
- pour Fe(III) : Fe(CN)63−, ion hexacyanoferrate(III), paramagnétique, orange ;
Ces complexes permettent de préparer le bleu de Prusse ;
- ion fluorure F−
- pour Fe(III) : FeF2+, ion fluorofer(III) incolore
En chimie analytique, ce complexe permet de marquer la couleur des ions fer(III) ;
- 1,10-phénantroline (o-phen en abrégé)
- pour Fe(II) : Fe(ophen)32+, rouge, ions triorphophénantrolinefer(II)
- pour Fe(III) : Fe(ophen)33+, vert, ions triorphophénantrolinefer(III)
Le couple redox constitué de ces deux complexes est utilisé comme indicateur de titrage d'oxydoréduction ;
- ions thiocyanate SCN−
- pour Fe(III) : Fe(SCN)2+, rouge sang, ion thiocyanatofer(III)
Ce complexe permet de mettre en évidence de petite quantité d'ion fer(III) en solution grâce à sa couleur caractéristique.
Chimie organométallique
Le premier complexe organométallique isolé comme tel, en 1951, fut un complexe du fer : le ferrocène. Il est constitué d'un ion fer(II) avec deux ions cyclopentadiényles C5H5−. De nombreux autres complexes ont été produits depuis, soit dérivés du ferrocène, soit de nature toute différente.
Gisements
La majeure partie du fer dans la croûte est combinée avec l'oxygène, formant des minerais d'oxyde de fer, tels que l'hématite (Fe2O3), la magnétite (Fe3O4) et la limonite (Fe2O3·nH2O). L'oxyde magnétique ou magnétite Fe3O4 est connu depuis l'Antiquité grecque. Il tire son nom du mont Magnetos (le grand mont), une montagne grecque particulièrement riche en ce minéral.
Environ une météorite sur vingt comprend de la taénite, unique alliage de minéral de fer-nickel (fer 35-80 %), et de la kamacite (fer 90-95 %). Bien que rares, les météorites de fer sont une source de fer nickelé, ce fer météorique arrivé sur la surface terrestre étant à l'origine de la sidérurgie au sens étymologique ; l'autre source naturelle de fer métal légèrement nickelé sont les gisements de fer tellurique ou fer natif des minéralogistes qui sont plus rares.
La couleur rouge de la surface de Mars est due à un régolithe riche en hématite amorphe ; la planète rouge est en quelque sorte une « planète rouillée ».
90 % des gisements de minerai de fer dans le monde sont retenus dans une couche de faible épaisseur et très riche en Fe(II), la couche de fer rubané. Aux premiers temps de la vie, à l'éon Archéen vers −2 à −4 Ga, les cyanobactéries vivent dans des océans de Fe(II). Lorsqu'elles commencent à faire de la photosynthèse, l'oxygène produit est dissous et réagit avec Fe(II) pour former des oxydes de Fe(III) qui précipitent au fond des océans. Après consommation de Fe(II), l'oxygène se concentre dans les océans puis dans l'atmosphère, il constitue alors un poison pour la proto-vie. Ainsi, les gisements de fer rubané se trouvent systématiquement entre les couches géologiques des massifs cristallins (schistes, gneiss, etc.) et les couches calcaires dolomitiques (coraux) constituant les massifs préalpins.
Histoire de la métallurgie du fer
Le fer était connu dès le chalcolithique à travers les sites de fer telluriques et surtout les météorites de fer au fer souvent déjà allié de grande qualité, et il n'est pas assuré que sa métallurgie soit demeurée confidentielle comme on l'estime souvent jusqu'au XIIe siècle av. J.-C., époque qui marque, précisément, le début de « l'Âge du fer » : autour du XVe siècle av. J.-C. les Hittites, en Anatolie, avaient développé une assez bonne maîtrise du travail du fer, leur tradition déterminant son origine dans la région du Caucase, et cette technique semble également avoir été connue assez tôt en Inde du nord, notamment dans l'Uttar Pradesh.
Dans le monde hellénistique le fer est l'attribut d'Héphaïstos, dieu grec de la métallurgie et des volcans[23]. Chez les Romains, toujours forgé par Vulcain, avatar italique de Héphaïstos, il est un attribut princier de Mars. Les alchimistes donnèrent au fer le nom de Mars, dieu de la guerre dans la mythologie romaine.
Jusqu'au milieu du Moyen Âge, l'Europe raffina le fer au moyen de bas fourneaux, qui ne produisent pas de fonte ; la technique du haut fourneau, qui, elle, produit de la fonte brute à partir de charbon de bois et de minerai de fer, a été mise au point en Chine au milieu du Ve siècle av. J.-C.. Elle est courante en Europe occidentale dès le milieu du XVe siècle.
L’Occident réinvente indépendamment la technique plus d'un millier d'années après la Chine. Selon le doxographe antique Théophraste, c'est Délas, un Phrygien, qui inventa le fer[24].
Les infimes changements dans les pièces de métal solide obtenues par le labeur physique du forgeron (martelage, réchauffement, alliages superficiels, etc.) sont très peu importants pour le chimiste. La chimie du fer oublie en grande partie l'appréciation extrêmement fine des forgerons ou des mares de forges au cours de la longue histoire technique du fer.
Industrie du fer
Extraction de minerais de fer
Les principaux pays producteurs de minerais de fer en 2013 sont[25] :
| Pays | Minerai
(millions tonnes) |
% monde
minerai fer |
Fer contenu
(millions tonnes) |
% monde
fer contenu | |
|---|---|---|---|---|---|
| 1 | Chine | 1 450,0 | 45,9 | 436,0 | 29,5 |
| 2 | Australie | 609,0 | 19,3 | 377,0 | 25,5 |
| 3 | Brésil | 386,27 | 12,2 | 245,67 | 16,6 |
| 4 | Inde | 150,0 | 4,7 | 96,0 | 6,5 |
| 5 | Russie | 105,0 | 3,3 | 60,7 | 4,1 |
| 6 | Afrique du Sud | 71,53 | 2,3 | 45,7 | 3,1 |
| 7 | Ukraine | 81,97 | 2,6 | 45,1 | 3,0 |
| 8 | États-Unis | 53,0 | 1,7 | 32,8 | 2,2 |
| 9 | Canada | 42,8 | 1,4 | 26,0 | 1,8 |
| 10 | Iran | 50,0 | 1,6 | 24,0 | 1,6 |
| 11 | Suède | 26,04 | 0,8 | 17,19 | 1,2 |
| 12 | Kazakhstan | 25,5 | 0,8 | 14,5 | 1,0 |
| 13 | Chili | 17,11 | 0,5 | 9,09 | 0,6 |
| 14 | Mauritanie | 13,0 | 0,4 | 7,8 | 0,5 |
| 15 | Mexique | 14,5 | 0,5 | 7,53 | 0,5 |
| 16 | Venezuela | 10,58 | 0,3 | 6,58 | 0,4 |
| 17 | Malaisie | 10,0 | 0,3 | 5,7 | 0,4 |
| 18 | Pérou | 6,79 | 0,2 | 4,55 | 0,3 |
| 19 | Mongolie | 6,01 | 0,2 | 3,79 | 0,3 |
| 20 | Turquie | 4,45 | 0,1 | 2,98 | 0,2 |
| Total mondial | 3 160 | 100 | 1 480 | 100 | |
Les principales sociétés productrices de minerais de fer dans le monde sont, en 2008[26] :
- BHP Billiton et Rio Tinto (39,6 % du marché mondial estimé en 2008, en cas de fusion) ;
- Vale (ex-CVRD) (Brésil) (35,7 %) ;
- Rio Tinto (24 % seul) ;
- BHP Billiton (16 % seul) ;
- Fortescue (5,4 %) ;
- Kumba (5,2 %) ;
- autres (LKAB, SNIM, CVG Ferrominera, Hierro Peru, Kudremukh, CAP) (13,7 %).
En 2007, la Chine produit un tiers de l'acier mondial et 50 % des exportations de minerai de fer[27].
Recyclage

La plupart des métaux à base de fer sont magnétiques. Cette propriété simplifie leur tri. Dans la deuxième moitié du XXe siècle, le faible coût des ferrailles rend les aciéries électriques plus compétitives que les hauts fourneaux.
Sidérurgie
Le fer s'obtient industriellement en réduisant par le monoxyde de carbone (CO) provenant du carbone les oxydes de fer contenus dans le minerai ; ceci peut être réalisé depuis l'Âge du fer, et jusqu'au XIXe siècle dans certaines régions du monde, par réduction du minerai avec du charbon de bois dans un bas fourneau ou bas-foyer. On obtient, sans passer par une phase liquide, une masse hétérogène de fer, d'acier, voire de fonte, mélangés avec des scories, appelée « loupe », « massiot » ou « éponge de fer ». Afin de rendre le métal propre à l'élaboration d'objets, la « loupe » peut être brisée et triée par type de teneur en carbone ou plus simplement être directement compactée à la forge.
C'est avec le développement des moulins et de la force hydraulique que la lignée technique du haut fourneau a pu se développer et s'est globalement imposée au détriment de celle du bas fourneau. La principale différence dans ce procédé est que la réduction des oxydes de fer se fait en même temps que la fusion. Le métal est produit en phase liquide sous forme de fonte qui a absorbé une partie du carbone du coke et qui fond plus facilement que le fer (température de fusion plus basse d'au moins 200 °C). Mais la fonte devra ensuite être transformée en fer.
C'est aussi en ajoutant de la silice au minerai à gangue calcaire, ou du calcaire au minerai à gangue siliceuse, que l'on est passé au haut fourneau : une proportion précise de silice et de calcaire donne un laitier facilement fusible qui se sépare naturellement de la fonte liquide. Pendant longtemps les hauts fourneaux ont fonctionné au charbon de bois. Le coke, plus dur et plus abondant, a permis de faire des hauts fourneaux beaucoup plus hauts mais produisant une fonte chargée en soufre.
Pour obtenir un métal forgeable, il faut affiner la fonte. Cette étape, réalisée dans une aciérie, consiste essentiellement à décarburer la fonte pour obtenir un alliage plus faible en carbone : fer ou acier. La fonte est transformée en acier au convertisseur. Dans cette cuve, on souffle de l'oxygène sur ou dans la fonte pour en éliminer le carbone.
Si l'élimination du carbone par combustion avec l'oxygène est l'étape principale dans l'affinage de la fonte, l'aciérie va également :
- éliminer le soufre venant du coke chargé dans le haut-fourneau ; en injectant du carbure de calcium, du magnésium et/ou de la soude, le soufre forme des sulfures qui viennent flotter parmi le laitier de la fonte ; ce laitier sera alors enlevé à l'aide d'un racloir ;
- brûler le silicium dissous dans la fonte ; cette combustion est la première réaction chimique qui se produit dans un convertisseur ; elle est suivie immédiatement par la combustion du carbone ;
- éliminer le phosphore venant du minerai ; comme le soufre, cet autre élément fragilisant, on procède par réaction avec de la chaux dans le convertisseur, pour former du P2O5 qui, en allant dans le laitier, sera éliminé par séparation d'avec le fer liquide ; la réaction de déphosphoration est la troisième et dernière réaction chimique recherchée dans le convertisseur.
Dans certains cas, l'abondance de gaz naturel ou la difficulté d'adapter le minerai de fer au haut fourneau, ont mené à l'adoption de la filière dite de « réduction directe ». Le principe consiste à réduire le fer présent dans les minerais sans passer par l'étape de fusion (comme au bas fourneau), en utilisant des gaz réducteurs obtenus à partir d'hydrocarbures ou de charbon. Un grand nombre de procédés a été développé. En 2010, 5 % de l'acier produit sont issus de fer obtenu par réduction directe.
Alliages

Le fer n'est pratiquement pas utilisé à l'état pur (hormis pour résoudre certains problèmes de soudabilité, notamment sur aciers inoxydables). La fonte et l'acier (1 000 Mt) sont les principaux alliages :
- la fonte contient de 2,1 % à 6,67 % de carbone ;
- l'acier contient de 0,025 % à 2,1 % de carbone, le fer étant le principal élément entrant dans sa composition ;
- en dessous de 0,025 % de carbone, on parle de « fers industriels ».
L'ajout de divers éléments d'additions permet d'obtenir des fontes et des aciers spéciaux, mais l'élément ayant la plus forte incidence sur les propriétés de ces alliages reste le carbone.
Les aciers inoxydables doivent leurs propriétés de résistance à la corrosion à la présence de chrome qui, en s'oxydant, va former une fine pellicule protectrice.
Produits
L'appellation « fil de fer » ne signifie en rien fil en fer pur, les fils de fer sont en fait fabriqués en acier doux, très malléable.
Le fer métallique et ses oxydes sont utilisés depuis des décennies pour fixer des informations analogiques ou numériques sur des supports appropriés (bandes magnétiques, cassettes audio et vidéo, disquettes). L'usage de ces matériaux est cependant désormais supplanté par des composés possédant une meilleure permittivité, par exemple dans les disques durs.
Utilisation biochimique
Le fer est un élément indispensable au corps humain. Dans les toutes premières années de la vie d'un enfant, les besoins en fer alimentaire sont très importants, sous peine de carence alimentaire (anémie ferriprive). Par ailleurs, un surdosage en fer est également nocif pour la santé. En effet, une quantité trop importante de fer augmenterait le risque d'hépatite, de cancer, et pourrait être impliquée dans la maladie de Parkinson[28].
Complexe bioinorganique
L'hémoglobine du sang est une métalloprotéine constituée d'un complexe du fer(II). Ce complexe permet aux globules rouges de transporter le dioxygène des poumons aux cellules du corps. La solubilité du dioxygène dans le sang est en effet insuffisante pour alimenter efficacement les cellules. Ce complexe est constitué d'un cation Fe(II) complexé par les quatre atomes d'azote d'une porphyrine et par l'azote d'un résidu histidine appartenant à la chaîne protéique. Le sixième site de complexation du fer est soit vacant, soit occupé par une molécule de dioxygène.
Il est notable que le fer(II) fixe une molécule de dioxygène sans être oxydé. Cela est dû à l'encombrement du fer par la protéine.
Dans l'alimentation
Le fer est un oligo-élément et fait partie des sels minéraux indispensables qu'on retrouve dans les aliments, mais peut être toxique sous certaines formes. Une carence en fer est source d'anémie et peut affecter le développement cognitif et socio-émotionnel du cerveau de l'enfant[29] ou exacerber les effets de certaines intoxications (saturnisme par exemple).
Le fer est essentiel au transport de l'oxygène et à la formation des globules rouges dans le sang. Il est un constituant essentiel des mitochondries, puisqu'il entre dans la composition de l'hème du cytochrome c. Il joue aussi un rôle dans la fabrication de nouvelles cellules, d'hormones et de neurotransmetteurs. Comme le bœuf, les insectes sont une bonne source de fer[30]. Le fer contenu dans les végétaux (fer dit « non héminique ») Fe3+ ou fer ferrique est moins bien absorbé par l'organisme que celui contenu dans les aliments crus d'origine animale (fer « héminique ») Fe2+ ou fer ferreux. La cuisson des viandes transforme une partie du fer héminique en fer non héminique, moins biodisponible.
L'absorption du fer est favorisée si on le consomme avec certains nutriments, comme la vitamine C (présente par exemple dans les agrumes, le chou-fleur ou les poivrons rouges). Mettre du jus de citron sur ses aliments est donc une excellente habitude culinaire si l'on manque de fer ; par contre, un complément en vitamine C est inutile si l'on ne souffre pas de carence en vitamine C (la carence extrême est le scorbut), même si cela ne peut pas mener à une hypervitaminose puisque la vitamine C est hydrosoluble (et donc son surplus s'élimine par la sudation et la voie urinaire).
De même, cuisiner avec de l'ail et de l'oignon augmente la biodisponibilité du fer et du zinc présents dans le bol alimentaire[31].
En revanche son absorption est inhibée par la consommation de thé et/ou de café[32] car les tanins (polyphénols) sont des chélateurs de fer. C'est pourquoi il est recommandé aux personnes à risques (adolescentes, femmes enceintes, femmes en âge de procréer, végétariens) et buveuses de thé ou de café d'en boire plutôt une heure avant le repas ou deux heures après[33].
L'accumulation de fer dans l'organisme entraîne la mort cellulaire. Des chercheurs de l'Inserm suspectent, à cause de cela, que l'excès de fer pourrait être impliqué dans la dégénérescence des neurones chez les patients atteints de la maladie de Parkinson[34].
Pour la femme en ménopause et l’homme adulte, les apports journaliers recommandés de fer sont de 10 mg ; ce besoin nutritionnel est de 16 à 18 mg pour la femme de sa puberté à la ménopause.
En pharmacie
Le fer est utilisé en tant que médicament. Il est utilisé dans les cas de carences en fer (dites « carence martiale ») pouvant provoquer une asthénie, voire une anémie ferriprive. Il peut être donné par voie orale ou en injection.
Production mondiale
La production mondiale de minerai de fer s'est élevée à 2,4 milliards de tonnes en 2010[35], assurée en grande partie par la Chine (37,5 %), devant l'Australie (17,5 %), le Brésil (15,4 %), l'Inde (10,8 %), la Russie (4,2 %) et l'Ukraine (3,0 %) ; les réserves mondiales de minerai de fer sont estimées à 180 milliards de tonnes, contenant 87 milliards de tonnes de fer, et sont détenues essentiellement par l'Ukraine (16,7 %), le Brésil (16,1 %) et la Russie (13,9 %). La Chine a produit 60 % du fer métallique mondial en 2010[36] (environ 600 millions sur 1 milliard de tonnes) et 45 % de l'acier mondial (environ 630 millions sur 1,4 milliard de tonnes), devant le Japon (8,2 % du fer et 7,9 % de l'acier produits dans le monde).
Notes
- Ce qui n'est pas le cas dans une expression comme « avoir plusieurs fers au feu », où le mot fer admet le pluriel quand il désigne — ici métaphoriquement — un outil[11].
Références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832-2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, , 87e éd. (ISBN 0849304873), p. 10-202
- (en) Metals handbook, vol. 10 : Materials characterization, ASM International, , 1310 p. (ISBN 0-87170-007-7), p. 343
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0803120664, lire en ligne), p. 71
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- SIGMA-ALDRICH
- « Fer » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Félix Gaffiot, « Dictionnaire latin-français, entrée "ferrum, i, n." », sur lexilogos.com, (consulté le ), page 662.
- « Annexe : Glossaire grammatical », sur Wiktionnaire (consulté le ), entrée « indénombrable ».
- « "Tenir deux fers au feu" », sur lintern@ute.fr (consulté le ).
- (en) Charlton T. Lewis & Charles Short, A Latin Dictionary, Oxford, The Clarendon Press, (lire en ligne), entrée "ferrum".
- (de + en) Julius Pokorny, Indogermanisches etymologisches Wörterbuch [« Dictionnaire étymologique indo-germanique »], Tübingen–Berne–Munich, A. Francke, 1957/1969 (lire en ligne), entrées "ai̯os" et "ḫeṷis".
- (en) The Most Tightly Bound Nuclei (« Les nucléides les plus solidement liés »).
- Alessandro Tagliabue, The integral role of iron in ocean biogeochemistry, Nature, 543, 51–59, 2 mars 2017, DOI 10.1038/nature21058 (résumé)
- Kristen French, Iron chemistry matters for ocean carbon uptake, 26 juin 2017, Earth Institute, Columbia University
- The State of Greenhouse Gases in the Atmosphere Based on Global Observations through 2013 (consulté le 11 septembre 2014), voir notamment le chap. Ocean acidification, p. 4.
- (en) R.L. Clendenen et H.G. Drickamer, « The effect of pressure on the volume and lattice parameters of ruthenium and iron », Journal of Physics and Chemistry of Solids, vol. 25, no 8, , p. 865-868 (DOI 10.1016/0022-3697(64)90098-8).
- (en) Ho-Kwang Mao, William A. Bassett et Taro Takahashi, « Effect of Pressure on Crystal Structure and Lattice Parameters of Iron up to 300 kbar », Journal of Applied Physics, vol. 38, no 1, , p. 272-276 (DOI 10.1063/1.1708965).
- (en) S. Rifai Habbal, M. Druckmüller, H. Morgan, A. Daw, J. Johnson et al., « Mapping the distribution of electron temperature and Fe charge states in the corona
with total solar eclipse observations », The Astrophysical Journal, vol. 708, , p. 1650-1662 (DOI 10.1088/0004-637X/708/2/1650
 ).
). - (en) Daniel Garisto, « Experiment resolves long-standing iron-spectrum discrepancy », Physics Today, (DOI 10.1063/PT.6.1.20230202a
 ).
). - (en) Steffen Kühn, Charles Cheung, Natalia S. Oreshkina, René Steinbrügge, Moto Togawa et al., « Experiment resolves long-standing iron-spectrum discrepancy », Physical Review Letters, vol. 129, no 24, , article no 245001 (DOI 10.1103/PhysRevLett.129.245001, lire en ligne
 , consulté le ).
, consulté le ). - « Héphaïstos le dieu grec du feu et du fer », sur mythologie.ca
- Pline l'Ancien, Histoire naturelle [détail des éditions] [lire en ligne] : Livre VII
- William S. Kirk, « USGS Minerals Information: Iron Ore », sur minerals.usgs.gov (consulté le )
- Bernstein Resaerch, dans Les Échos, 5 février 2008, p. 35
- Alain Faujas, « Le minerai de fer augmentera d'au moins 65 % en 2008 », Le Monde, 20 février 2008, mis en ligne le 19 février 2008, [lire en ligne]
- Un excès de fer impliqué dans la maladie de Parkinson, Google/AFP, 28 octobre 2008
- R. Colin Carter, Joseph L. Jacobson, Matthew J. Burden, Rinat Armony-Sivan, Neil C. Dodge, Mary Lu Angelilli, Betsy Lozoff et Sandra W. Jacobson, Iron Deficiency Anemia and Cognitive Function in Infancy, Pediatrics, août 2010, vol. 126, no 2, e427-e434, résumé
- Gladys O. Latunde-Dada, Wenge Yang et Mayra Vera Aviles, « In Vitro Iron Availability from Insects and Sirloin Beef », Journal of Agricultural and Food Chemistry, vol. 64, no 44, , p. 8420–8424 (ISSN 0021-8561, DOI 10.1021/acs.jafc.6b03286, lire en ligne, consulté le )
- Smita Gautam, Kalpana Platel et Krishnapura Srinivasan, « Higher bioaccessibility of iron and zinc from food grains in the presence of garlic and onion », Journal of Agricultural and Food Chemistry, vol. 58, no 14, , p. 8426–8429 (ISSN 1520-5118, PMID 20597543, DOI 10.1021/jf100716t, lire en ligne, consulté le )
- Voir par exemple la notice du Ferrostrane (férédétate de sodium) de Teofarma ou du Timoferol (vitamine C + Fe) d'Elerte.
- « L'anémie ferriprive », sur passeportsante.net, (consulté le )
- « L'excès de fer dans les cellules nerveuses impliqué dans la maladie de Parkinson », sur Inserm, (consulté le )
- (en) « Iron Ore », USGS Minerals.
- (en) http://minerals.usgs.gov/minerals/pubs/commodity/iron_&_steel/mcs-2011-feste.pdf « Iron and Steel »], USGS Minerals.
Voir aussi
Bibliographie
- Élie Bertrand, Dictionnaire universel des fossiles propres, et des fossiles accidentels contenant une description des terres, des sables, des sels…, chez Louis Chambeau, Avignon, 1763, 606 p., en particulier l'entrée fer p. 239-256.
- Robert Luft, Dictionnaire des corps purs simples de la chimie, Nantes, Association Cultures et Techniques, , 392 p. (ISBN 978-2-9510168-3-5), en particulier le chap. 26 fer p. 132-134.
- Bruce Herbert Mahan, Chimie, InterEdition, Paris, 1977, 832 p. (trad. de University Chemistry, 2e éd., Addison-Wesley Publishing Company, Massachusetts, 1969 (ISBN 978-2-7296-0065-5)), en particulier p. 673-676.
- Paul Pascal, P. Bothorel, Adolphe Pacault, Guy Pannetier (dir.), Nouveau traité de chimie minérale : Fer et complexes du fer, vol. 17-18, Masson, 1958.
Articles connexes
- Accumulateur nickel-fer
- Âge du fer
- Chlorose
- Déferrisation
- Fer 56
- Fer à cheval
- Fer forgé
- Ferraille
- Ferroalliage
- Forge
- Hémochromatose
- Hydroxyde de fer(II)
- Hydroxyde de fer(III)
- Mine de fer, Minerai de fer
- Oxyhydroxyde de fer(III)
- Oxyde de fer
- Teneur en fer dans les aliments
- Sulfure de fer(II)
- Sept métaux
- Sidérurgie
- Empoisonnement au fer
Liens externes
- Résumé de chimie descriptive du fer, faculté des sciences de l'université du Maine
- Dossier sur le fer : Le fer tombe le masque, Futura-Sciences
- (en) Minéralogie de l'élément fer : Sur Mindat
- (en) « Technical data for Iron » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||

