Ferrocène
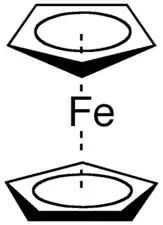
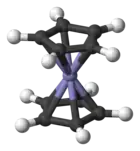
Le ferrocène est un composé organométallique de formule (η5-C5H5)2Fe. Il fait partie de la famille des métallocènes, un type de composé sandwich[5] dans lequel le centre métallique est entouré de deux cycles cyclopentadiényles. La découverte d'un tel composé et de ses analogues a précipité la croissance dans le domaine de la chimie organométallique donnant suite à un prix Nobel.
| Ferrocène | |
  |
|
| Représentations du ferrocène. | |
| Identification | |
|---|---|
| Nom UICPA | ferrocene, bis(η5-cyclopentadienyl) fer |
| Synonymes |
Dicyclopentadiényle de fer |
| No CAS | |
| No ECHA | 100.002.764 |
| No CE | 203-039-3 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | cristaux orange, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
| Formule | Fe(C5H5)2 |
| Masse molaire[2] | 186,031 ± 0,011 g/mol C 64,56 %, H 5,42 %, Fe 30,02 %, 186.04 g/mol |
| Propriétés physiques | |
| T° fusion | 173 °C[1] |
| T° ébullition | 249 °C[1] Point de sublimation : au-dessus 100 °C[1] |
| Solubilité | dans l'eau : nulle[1], soluble dans la plupart des solvants organiques |
| Masse volumique | 2,69 g·cm-3 (20 °C) |
| Pression de vapeur saturante | à 40 °C : 4 Pa[1] |
| Cristallographie | |
| Notation Schönflies | Eclipsé : D5h Alterné : D5v |
| Précautions | |
| SGH | |
   |
|
| SIMDUT[3] | |
Produit non contrôlé |
|
| Directive 67/548/EEC | |
| Transport | |
| Écotoxicologie | |
| DL50 | 1320 mg/kg (Rat, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |

Historique
Comme pour beaucoup de produits, la première synthèse du ferrocène fut accidentelle. En 1951, Pauson et Kealy, de l'université de Duquesnes firent état de la réaction du bromure de cyclopentadiénylmagnésium et du chlorure de fer(II) dans l'objectif de coupler le diène et ainsi synthétiser le fulvalène. À la place, ils obtinrent une poudre légèrement orangée, d'une "remarquable stabilité"[6]. Cette stabilité fut accordée au caractère aromatique du cyclopentadiènyle mais la structure "en sandwich" ne fut pas découverte à cet instant.
Ce sont Robert Burns Woodward et Geoffrey Wilkinson qui découvrirent cet assemblage particulier en se basant sur sa réactivité[7]. Ils démontrèrent les propriétés typiquement aromatiques de ce dernier à l'aide d'une acylation de Friedel-Crafts et décidèrent de nommer ce composé "ferrocène" en référence au benzène qui partage les mêmes propriétés aromatiques[8]. Indépendamment, Ernst Otto Fischer arriva à la même conclusion et commença à synthétiser d'autres métallocènes, comme le nickelocène et le cobaltocène[9]. La structure des ferrocènes fut ensuite confirmée par spectroscopie RMN et cristallographie Rayons X[10] - [11]. Sa structure distinctive mena à un engouement sans précédent pour la chimie des métaux du bloc d avec les hydrocarbures. En 1973 Fischer de l'Université Louis-et-Maximilien de Munich et Wilkinson de l'Imperial College London partagèrent un prix Nobel de chimie pour leurs travaux sur les métallocènes et autres aspects sur la chimie organométallique.
Robert Burns Woodward qui fit la découverte avec Geoffrey Wilkinson, ne reçut pas le prix Nobel de chimie contrairement à ce dernier. Certains historiens pensent que Woodward aurait dû partager ce prix avec Wilkinson. Du même avis que les historiens, Woodward lui-même écrivit une lettre au comité Nobel[12].
Synthèse
Les ferrocènes sont facilement obtenus par réaction du cyclopentadiénure de sodium sur le chlorure de fer anhydre, en milieu éthéré.
Liaisons et structure
L'atome de fer dans le ferrocène est à l'état d'oxydation +2. Chaque cycle pentadiènyle est donc chargé une fois négativement, amenant le nombre d'électrons π à six sur chaque cycle. Ils sont donc aromatiques. Ces douze électrons - six pour chaque cycle - forment des liaisons covalentes avec le métal. Ajoutés aux six électrons de la couche d du fer, le complexe complait à la règle des 18 électrons. La distance des liaisons carbone-carbone des cycles est de 1,40 Å. Les liaisons Fer - carbone font 2,04 Å.
Propriétés physiques
Le ferrocène est un solide stable à l'air, bien qu'il se sublime assez facilement. Comme on pouvait le prévoir pour une molécule symétrique et neutre, le ferrocène est soluble dans les solvants organiques courants, mais insoluble dans l'eau. Il est stable à haute température, jusqu'à 400 °C[13].
Le tableau suivant donne quelques valeurs de pression de vapeur à différentes températures.
| Pression (Pa) | 1 | 10 | 100 |
|---|---|---|---|
| Température (K) | 298 | 323 | 353 |
Propriétés chimiques
Préparation[14] - [15]
La préparation du ferrocène est basée sur la réaction de C5H5K (noté CpK) préparé in situ avec du chlorure de fer(II) en solution.
- (CpH)2 → 2 CpH
- CpH + KOH → CpK + H2O
- 2 CpK + FeCl2 → Cp2Fe + 2 KCl
Le cyclopentadiène est préparé par crackage de son dimère à 180 °C ; c'est une réaction de rétro-Diels-Alder. La réaction se fait dans une colonne à distiller et le monomère est récupéré à la température de la glace.
Sous azote, 6 g de ce monomère sont introduits avec un mélange de 30 g de KOH dans 75 mL de diméthoxy-1,2-éthane ; puis 8,5 g de FeCl2, 4H2O dans 35 mL de DMSO sont ajoutés goutte à goutte en 30 min. Après quelques minutes d'agitation vigoureuse, le milieu réactionnel est induit dans un mélange de 20 mL d'acide chlorhydrique 12 M avec 150 mL de glace. Des cristaux orange de ferrocène se forment. Les cristaux sont filtrés sur Buchner et lavés avec un peu d'eau froide. Ils peuvent être sublimés depuis un fond de boîte de Petri posé sur une plaque chauffante et couvert d'un verre de montre contenant de la glace. Des cristaux jaune vif s'y déposent.
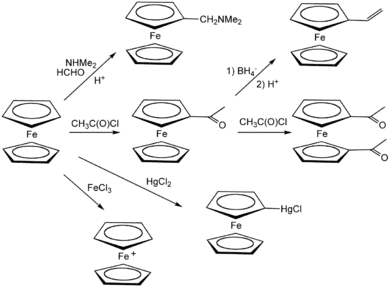
Réaction avec les électrophiles
Le ferrocène se comporte comme la plupart des aromatiques, permettant la synthèse de dérivés substitués. Une expérience classique de démonstration est une réaction de Friedel-Crafts avec l'anhydride acétique en présence d'acide phosphorique comme catalyseur. En présence de chlorure d'aluminium, Me2NPCl2 et le ferrocène réagissent pour donner la ferrocenyl dichlorophosphine[16], alors que le traitement avec la phenyldichlorophosphine dans les mêmes conditions conduit à la P,P-diferrocenyl-P-phenyl phosphine[17].
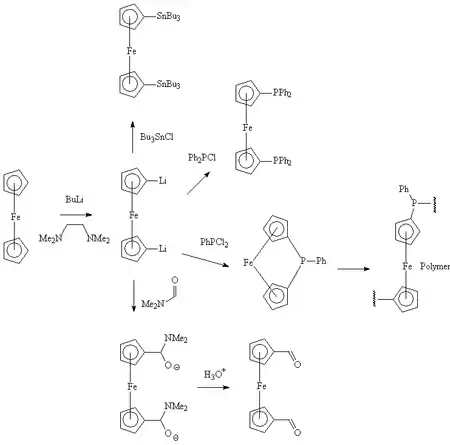
Lithiation
Le ferrocène réagit facilement avec le butyllithium pour donner le 1,1'-dilithioferrocene, qui est un nucléophile polyvalent. Il peut réagir avec le diethyldithiocarbamate de sélénium pour donner un ferrocenophane dans lequel les deux cycles pentadiènyles sont liés par l'atome de sélénium[18]. Ce ferrocephane peut être converti en un polymère par une réaction de polymérisation par ouverture de cycle et former des poly(ferrocenyl sélénide)s. De même, en mettant en jeu des ferrocenophanes liés par un atome de silicium ou de phosphore, on peut obtenir les polymères correspondants (poly(ferrocenylsilane)s et poly(ferrocenylphosphines)s)[19] - [20].
Oxydoréduction
Contrairement à la majorité des hydrocarbures, le ferrocène peut être oxydé une fois à faible potentiel, environ 0,5 V par rapport à une électrode au calomel. L'oxydation du ferrocène donne un ion stable appelé ferrocénium. À l'échelle préparative, l'oxydation peut se faire par ajout de FeCl3 pour donner un ion bleu, [Fe(C5H5)2]+. À défaut, le nitrate d'argent peut aussi être utilisé comme oxydant.
Les sels de ferrocenium sont parfois utilisés comme oxydants, principalement pour l'inertie de ferrocène, et sa facilité à être séparé de produits ioniques[21]. L'ajout de substituants sur les cycles pentadiènyles altère le potentiel redox : les groupements attracteurs d'électrons comme les acides carboxyliques déplacent le potentiel vers l'anode (donc le rend plus positif), alors que les groupements donneurs comme le méthyle le rendent plus négatif. Ainsi, la décaméthylferrocène est beaucoup plus facile à oxyder que le ferrocène. Ce dernier est souvent utilisé comme étalon interne pour calibrer les potentiels rédox en électrochimie des milieux non aqueux.
Applications
Le ferrocène et ses dérivés ne possèdent pas beaucoup d’applications directes mais il trouve parfois sa place dans certaines applications pharmaceutiques, pétrochimiques et agrochimiques.
Pharmaceutique
Certains dérivés du ferrocène ont fait l’objet de recherche en tant que médicament. Par exemple certains sels comprenant du ferrocène possèdent des propriétés anticancéreuses et antipaludiques[22]. En 1984, Köpf-Meier P., Köpf H. et Neuse EW. ont découvert que certains dérivés du ferrocène possèdent effectivement des propriétés antitumorales. Le groupe de recherche de Gérard Jaouen a démontré que du ferrocène couplé avec du tamoxifène possède une action bénéfique contre le cancer du sein. Le principe étant que le tamoxifène se lie aux œstrogènes produisant un effet cytotoxique[23].
Additifs pour carburants
Rausch Marvin de l’université de Massachusetts[24], Vogel Martin de l’université de Münster[25] et Rosenberg Harold de l'US air force[26] ont découvert que le ferrocène et plusieurs dérivés sont des agents antidétonants utilisés dans les moteurs à essence[27]. Ils sont moins dangereux que le tetraéthylplomb utilisé précédemment. Le fer du ferrocène peut recouvrir les bougies d’allumage améliorant ainsi la conductivité électrique[28]. Ces additifs sont notamment produits par Octel Corporation[29].
Chimie des matériaux
Amelia Barreiro et son équipe des chercheurs des universités IFW de Dresde et Autonome de Barcelone ont développé une méthode pour synthétiser des nanotubes de carbone à l’aide de ferrocène sublimé puis décomposé thermiquement et d’argon. Cette méthode donne de bons résultats concernant le choix du diamètre en fonction de la pression et de bons rendements pour la synthèse à grande échelle[30].
Donneur de ligand
Des ferrocenyl phosphines chiraux sont employés comme ligand dans des réactions catalysées par des métaux de transition. Certains d'entre eux possèdent des applications industrielles dans la synthèse de produits pharmaceutiques ou agrochimiques.
Hans-Ulrich Blaser et son équipe de Solvias, une organisation de recherche contractuelle, avec l’aide de Walter Brieden de Lonza group et Antonio Togni de l’ETH, ont développé une classe de ligand de Josiphos nommée « Solvias Josiphos ». Ce ligand a ensuite été utilisé pour la synthèse asymétrique du S-métolachlore, herbicide utilisé dans plusieurs produits de la firme agrochimique Syngenta qui remplace son prédécesseur le métolachlore (mélange racémique des énantiomères R et S). Il est notamment utilisé dans le Dual magnum de Syngenta, le leader mondial dans la recherche liée à l’agriculture[31] - [32].
Références
- FERROCENE 0123 FIBRES CERAMIQUES&], Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Dicyclopentadiényle de fer » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Entrée du numéro CAS « 102-54-5 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript nécessaire)
- (en) R. Dagani, « Fifty Years of Ferrocene Chemistry », Chemical and Engineering News, vol. 79, no 49, , p. 37–38 (lire en ligne [Subscription required])
- (en) T. J. Kealy, P. L. Pauson, « A New Type of Organo-Iron Compound », Nature, vol. 168, , p. 1039 (DOI 10.1038/1681039b0)
- (en) G. Wilkinson, M. Rosenblum, M. C. Whiting, R. B. Woodward, « The Structure of Iron Bis-Cyclopentadienyl », Journal of the American Chemical Society, vol. 74, , p. 2125–2126 (DOI 10.1021/ja01128a527)
- (en) Kauffman, George B., « The discovery of ferrocene, the first sandwich compound », Journal of Chemical Education, no 60, , p. 185-186 (lire en ligne)
- (en) E. O. Fischer, W. Pfab, « Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels », Z. Naturforsch. B, vol. 7, , p. 377–379
- (en) J. Dunitz, L. Orgel, A. Rich, « The crystal structure of ferrocene », Acta Crystallographica, vol. 9, , p. 373–5 (DOI 10.1107/S0365110X56001091)
- (en) Pierre Laszlo, Roald Hoffmann,, « Ferrocene: Ironclad History or Rashomon Tale? », Angewandte Chemie International Edition, vol. 39, , p. 123–124 (DOI 10.1002/(SICI)1521-3773(20000103)39:1<123::AID-ANIE123>3.0.CO;2-Z)
- (en) Helmut Werner, Landmarks in Organo-Transition Metal Chemistry : A Personal View, New York, Springer Science & Business Media, (ISBN 978-0-387-09848-7, lire en ligne)
- Solomons, Graham, and Craig Fryhle. Organic Chemistry. 9th ed. États-Unis: John Wiley & Sons, Inc., 2006.
- Fieser L.F., Williamson K.L. (1998). Organic expériments, D.C. Heath & Co.
- Blanchard-Desce M., Fosset B., Guyot F., Jullien L. & Palacin S. (1998). Chimie organique expérimentale, Hermann Ed., coll Enseignement des sciences.
- (en) G.R. Knox, P.L. Pauson and D. Willison, « Ferrocene derivatives. 27. Ferrocenyldimethylphosphine », Organometallics, vol. 11, no 8, , p. 2930 – 2933 (DOI 10.1021/om00044a038)
- (en) G.P. Sollott, H.E. Mertwoy, S. Portnoy and J.L. Snead, « Unsymmetrical Tertiary Phosphines of Ferrocene by Friedel-Crafts Reactions. I. Ferrocenylphenylphosphines », J. Org. Chem., vol. 28, , p. 1090 – 1092 (DOI 10.1021/jo01039a055)
- Ron Rulkens, Derek P. Gates, David Balaishis, John K. Pudelski, Douglas F. McIntosh, Alan J. Lough, and Ian Manners, J. Am. Chem. Soc., 1997, 119, 10976
- Paloma Gómez-Elipe, Rui Resendes, Peter M. Macdonald, and Ian Manners, J. Am. Chem. Soc., 1998, 120, 8348
- Timothy J. Peckham, Jason A. Massey, Charles H. Honeyman, and Ian Manners, Macromolecules, 1999, 32, 2830
- (en) N. G. Connelly, W. E. Geiger, « Chemical Redox Agents for Organometallic Chemistry », Chemical Reviews, vol. 96, , p. 877–910 (DOI 10.1021/cr940053x)
- (en) C. Biot, F. Nosten, L. Fraisse et D. Ter-Minassian, « The antimalarial ferroquine: from bench to clinic », Parasite, vol. 18, , p. 207–214 (ISSN 1252-607X et 1776-1042, PMID 21894260, PMCID 3671469, DOI 10.1051/parasite/2011183207, lire en ligne, consulté le )
- (en) Cátia Ornelas, « Application of ferrocene and its derivatives in cancer research », New Journal of Chemistry, vol. 35, (ISSN 1369-9261, DOI 10.1039/C1NJ20172G, lire en ligne, consulté le )
- « Rausch Seminar Series-News & Announcements-Department of Chemistry-University of Massachusetts Amherst », sur www.chem.umass.edu (consulté le )
- Universität Münster, FB Chemie, Institut für Anorganische und Analytische Chemie, AK Karst, « Homepage Karst... Dr. Vogel », sur www.uni-muenster.de (consulté le )
- CHRIST TAMBORSKI et HAROLD ROSENBERG, « Organosilicon Compounds. II. 1,1-Disubstituted Silacyclohexanes », The Journal of Organic Chemistry, vol. 25, , p. 246–248 (ISSN 0022-3263, DOI 10.1021/jo01072a027, lire en ligne, consulté le )
- Marvin Rausch, Martin Vogel and Harold Rosenberg, « Ferrocene: A novel organometallic compound », J. Chem. Educ.,
- Tai S. Chao et Jr Owston, Iron-containing motor fuel compositions and method for using same, (lire en ligne)
- Hansjuergen Guttmann, Dieter Hoehr, Heinz-Kuno Schaedlich et Kurt-Peter Schug, Process for the addition of ferrocene to combustion or motor fuels, (lire en ligne)
- (en) A. Barreiro, S. Hampel et al., « Thermal decomposition of ferrocene as a method for production of single-walled carbon nanotubes without additional carbon sources », Journal of Physical Chemistry B, no 42, , p. 20973-20977 (10.1021/jp0636571)
- (en) HU Blaser, « Josiphos Ligands: From Discovery to Technical Applications », Privileged Chiral Ligands and Catalysts, no 19, , p. 93-136
- (en) « Dual Gold : raising yields at lower doses », sur syngenta.com, (consulté le )
