Métolachlore
Le métolachlore (metolachlor en anglais) est un composé organochloré dérivé de l’aniline de la famille des chloroacétanilides utilisé comme herbicide selectif. Son mélange racémique (50% de (R)-métalachlore et 50% de (S)-métalachlore) appelé métolachlore est interdit en France depuis 2003[3]. Il est à nouveau autorisé en 2005 sous forme purifiée appelée S-métolachlore et contenant au moins 80% de l'énantiomère actif (S)-métolachlore[4].
| Métolachlore | |||
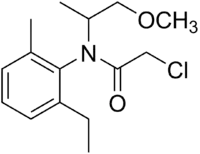
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | (RS)-2-chloro-N-(2-éthyl-6-méthylphényl)-N-(1-méthoxypropan-2-yl)acétamide | ||
| No CAS | (R) |
||
| No ECHA | 100.051.856 | ||
| No CE | 257-060-8 | ||
| No RTECS | AN3430000 | ||
| PubChem | 4169 11601631 (R) 11140605 (S) |
||
| SMILES | |||
| InChI | |||
| Apparence | liquide huileux blanchâtre à légèrement coloré | ||
| Propriétés chimiques | |||
| Formule | C15H22ClNO2 |
||
| Masse molaire[1] | 283,794 ± 0,016 g/mol C 63,48 %, H 7,81 %, Cl 12,49 %, N 4,94 %, O 11,28 %, |
||
| Propriétés physiques | |||
| T° fusion | −62,1 °C[2] | ||
| T° ébullition | 100 °C à 0,053 8 mbar[2] | ||
| Solubilité | 490 mg·l-1 (eau, 25 °C)[2] | ||
| Masse volumique | 1,12 g·cm-3 à 20 °C[2] | ||
| Point d’éclair | 190 °C[2] | ||
| Limites d’explosivité dans l’air | min=210 g·m-3[2] | ||
| Pression de vapeur saturante | 0,000 042 mbar à 20 °C[2] | ||
| Précautions | |||
| SGH | |||
  Attention |
|||
| Directive 67/548/EEC[2] | |||
 Xn  N |
|||
| Transport[2] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 2 200 mg·kg-1 (rat, oral)[2] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le métolachlore a été très utilisé en Amérique du Nord et en Europe. Il était l'un des plus utilisés avec le glyphosate, l'atrazine, et l'acétochlore. Il a été le désherbant le plus populaire pour le maïs aux États-Unis jusqu'au début des années 2000[5]. À la différence du glyphosate, il n'est normalement pas utilisé en jardinage urbain ou dans les parcs et espaces publics, ou pour l'entretien des bords de routes, néanmoins, il peut y être apporté par l'air, les pluies ou la brume. Avec les 3 autres produits déjà cités et la métribuzine, il fait partie des pesticides le plus souvent trouvés dans la nappe phréatique aux États-Unis[6]). Il est considéré par l'USGS comme un perturbateur endocrinien potentiel[6], pour la faune sauvage ou domestique dans le milieu naturel, pour l'homme, via l'eau potable ou l'inhalation, ou l'ingestion en tant que résidu de pesticides.
Peu à peu depuis 1986, puis là où il a été interdit, il a été théoriquement remplacé par le S-métolachlore qui est son énantiomère actif. C'est la substance active de produits phytosanitaires (ou produit phytopharmaceutique, ou pesticide ; herbicide sélectif), de la famille des chloroacétamides (tout comme l'acétochlore, l'alachlore ou le diméthénamide).
Le métolachlore, bien qu'interdit en 2003 en France était encore trouvé dans l'eau et l'air en 2016 sous la forme de ses produits de dégradation [7]. Au Canada, c'est avec l'atrazine, à l'embouchure de la rivière Yamaska, le premier polluant pesticide (en fréquence et quantité) trouvé dans l'eau, à cause des cultures de maïs et soja du bassin versant (400 t/an de pesticides y seraient appliqués[8] - [9]).
Depuis l'interdiction de l'atrazine, le S-métolachlore est devenu l'un des produits les plus vendus pour le désherbage chimique du maïs (ceci implique que l'analyse de ces produits passe par une quantification des proportions de différents isomères).
Caractéristiques chimiques
Le métolachlore possède un atome de carbone asymétrique et se présente donc sous la forme de deux énantiomères (R)- et (S)-métolachlore, la forme (S) étant la plus active comme herbicide. Ainsi, pendant un certain temps, les méthodes de fabrication ont été améliorées pour augmenter la proportion de l'isomère (S). Finalement, le produit vendu comme (S)-métolachlore contient plus de 80 % de l'énantiomère S.
Une particularité du métolachlore est que ces deux épimères sont en outre atropisomères, du fait du blocage de la rotation autour de la liaison C-N, C aryle à cause de l'encombrement stérique des substituants en ortho sur le cycle aromatique et de ceux sur l'atome d'azote. Il y a donc 4 stéréoisomères du métolachlore : deux atropoisomères du (S)-métolachlore, les isomères (Ra,S) et (Sa,S) qui ont le même effet herbicide[10] d'une part. D'autre part, les deux atropoisomères du (R)-métolachlore, (Ra,R) et (Sa,R) qui sont inactifs comme herbicide[11].
Par ailleurs :
- C'est un produit considéré comme assez dégradable[12], mais très utilisé, très soluble dans l'eau (solubilité : 530 mg l−1 à 20 °C) et assez mobile voire très mobile dans les milieux basiques. Ceci en fait un polluant potentiellement important pour les cours d'eau et la nappe phréatique.
- Sa pression de vapeur est de 0,001 7 pascal (à 20 °C)[13], pour une Constante de Henry de 0,000 91 pascal m−3 mole−1 ; il migre donc également facilement dans l'air, où les pluies peuvent à nouveau le solubiliser et le transporter.
- DJA (dose journalière acceptable) :
- 0,03 mg kg−1 de poids corporel/jour pour le métolachlore.
- 0,10 mg kg−1 de poids corporel/jour pour le S-métolachlore.
Histoire
Ce désherbant a été mis sur le marché par la multinationale Ciba-Geigy, notamment sous la marque Dual Magnum comme désherbant du maïs. Il est maintenant interdit dans certains pays, mais largement remplacé par le S-métolachlore, qui fait lui-même en 2023 l'objet d'un processus de renouvellement d'autorisation pour une utilisation sur le maïs et le tournesol dans l'Union européenne, avec un avis très mitigé de l'Agence européenne de sécurité des aliments (Efsa) en raison « de préoccupations critiques » liées au fait que la molécule mère et/ou certains de ses métabolites sont trop souvent retrouvés à des seuils dépassant les normes dans l'eau potable[14].
Mode d'action
C'est un inhibiteur des élongases et des géranyl-pyrophosphate (GGPP) cyclases, enzymes participant à la biosynthèse des gibbérellines (famille de phytohormones dont le composé actif est l'acide gibbérellique).
Le métolachlore tel qu'originellement formulé (mélange racémique) est de moins en moins commun. L'énantiomère R étant inactif en tant que désherbant, les méthodes de production (catalyse asymétrique[15]) permettent désormais de produire du (S)-métolachlore plus pur.
Toxicologie, écotoxicologie
Du métolachlore a été détecté dans les eaux souterraines et de surface à des concentrations allant de 0,08 à 4,5 parties par million (ppm) un peu partout aux États-Unis[16]. Il est aussi détecté dans l'eau potable en France, près de la Loire en 2017 [17]. On a montré qu'il était bioaccumulable chez plusieurs espèces comestibles de poissons et ses effets préjudiciables sur la croissance et le développement des animaux qui y sont exposés soulèvent des préoccupations quant à d'éventuels effets sur la santé humaine.
Il est classé comme un pesticide de catégorie C par l'EPA, ce qui indique des indices de cancérogénicité[18].
Aux États-Unis, il n'y a pas encore de niveau maximal de contamination (Maximum Contaminant Level (en) ou MCL) pour le métolachlore dont la présence est donc autorisée dans l'eau potable. L'EPA a toutefois établi un niveau préoccupant pour la santé (HAL [19]) de 0,525 mg l−1.
Aux échelles cellulaires, on a montré que le métolachlore a - in vitro - des effets cytotoxiques et génotoxiques chez les lymphocytes humains[20]. Ces effets génotoxiques ont également été observés chez des têtards de la grenouille Rana catesbeiana[21].
- In vitro, sans avoir un réel effet fongicide, le métolachlore altère également la croissance cellulaire et réduit la division cellulaire chez la levure Saccharomyces cerevisiae[22].
- Des embryons de poulet exposés au métolachlore présentaient une diminution significative de la masse corporelle moyenne par rapport aux témoins[23].
Devenir dans l'environnement
Les métabolites du métolachlore ont été trouvés dans différents niveaux des plantes traitées. Les plantes conservent toutefois leurs métabolites métolachlore même si les animaux qui consomment ces plantes sont capables de décomposer et d'éliminer le produit chimique rapidement. Certaines parties de plantes, comme les feuilles de coton peuvent conserver des niveaux élevés de résidus de métolachlore par rapport à d'autres parties des plantes telles que les graines.
La répartition de métolachlore dans le sol est affectée par un certain nombre de facteurs comme l'humidité, la température, l'activité microbienne, le type de sol, la concentration de l'oxygène et de la nitrification et est mobile et facilement lessivé dans le sol. L'effet des changements de la teneur en humidité et de température liées à l'activité microbienne affecte également sa ventilation.
Contamination des aliments
Au Canada, la limite maximale de résidus[24] (ou apport alimentaire maximal de métolachlore) est de 0,026 mg/jour[25]. Lors d'essais (avec taux d'épandage non noté), selon l'OMS, dans les années 1980, le taux résiduel moyen dans divers végétaux destinés à la vente était de 0,046 mg·kg-1 (environ deux fois la limite canadienne), avec une teneur maximale, de 0,08 mg·kg-1 dans des pommes de terre (environ 3 fois la limite max ministérielle)[25].
Contamination de l'eau, cinétique dans l'environnement
Le métolachlore est réputé facilement adsorbé sur la matière organique (MO) du sol, au point d'être peu lixivié dans les sols très riche en humus[26] - [27] et plus facilement relargué dans les sols pauvres et acides[28].
Il s'adsorbe également sur l'argile du sol ; un taux élevé d'argile dans le sol freine aussi sa lixiviation[26], mais on sait mal ce qui se passe dans la nature lors des épisodes de sécheresse et réhydratation de l'argile, ou lors des phénomènes d'érosion éolienne ou hydrique.
- Il est soluble dans l'eau et on retrouve également ses métabolites dans les eaux de surfaces et souterraines[29] - [30].
- De plus, au Canada, là où on l'a cherché (en Ontario) au début des années 1980, sur 440 échantillons prélevés dans 3 bassins fluviaux étudiés entre 1981 et 1985, il était présent dans 21 échantillons, avec une teneur moyenne variant de 0,7 à 4,1 µg/l selon les années.
On en utilisait alors dans ce pays plus de 300 T/an[31].
- En 1985 dans le sud-Ontario, 15 % de 351 puits privés étudiés pour vérifier si on y trouvait de l'alachlore en contenaient aussi[32].
- Du métolachlore avait contaminé l'eau de 125 des 917 échantillons venant de réserves d'eau municipales et privées de la région canadienne de l'Atlantique (de 1985 à 1986), du Québec (de 1984 à 1985), de l'Ontario (de 1979 à 1986) et de l'Alberta (1986). En Ontario, une réserve d'eau en contenait même 1 800 µg/l [32]
Les deux principaux métabolites connus du métolachlore sont :
- [2-[(2-éthyl-6-méthylphényl)(2-méthoxy-1-méthyléthyl)amino]-2-acide oxoacétique] (AO) ;
- [2-[(2-éthyl-6-méthylphényl)(2-méthoxy-1-méthyleéthyl-1)amino]-2-acide oxoéthanesulfonique] (AOES).
Dissous dans l'eau, le métolachlore donne le [2-chloro-N-(2-éthyl-6-méthylphényl)-N-(méthoxy-1-méthyléthyl) acétamide]. Cette molécule est plus ou moins bien adsorbée selon le type de sol[33] - [34] sur certains supports (feuillets d'argile par exemple) , absorbée par les racines ou certains mycéliums ou emportée par le ruissellement de surface[35].
- De premières études et indices laissaient penser que cette phase dissoute était significativement retenue (par adsorption sur le complexe argilo-humique et microbien[36] du sol et des racines) par des bandes enherbées filtrantes[37] plantées par certains agriculteurs ou riverains des champs, mieux que les deux principaux métabolites (acide oxanilique ou l'acide éthane métolachlore), peut-être en raison d'une augmentation des complexes argilo-humiques et des organismes fongiques dans ces bandes enherbées[38].
- Une étude[39] a montré les capacités d'adsorption et de relargage (dissolution ou désorption[40] - [41] - [42]) pour des bandes enherbées exposées à des doses courantes de métolachlore. Cette étude a mesuré la cinétique de trois molécules : la phase dissoute du métolachlore, et ses 2 principaux métabolites. Le coefficient de sorption du métolachlore a effectivement été 88 % plus élevé dans les bandes enherbées que dans les sols cultivés, mais les métabolites n'y étaient pas du tout mieux retenus que dans le sol cultivé (coefficient de sorption 79 % inférieure à celui du métolachlore dans les deux types de sols). Quant au coefficient de désorption, il était pour le métolachlore en solution 59 % plus élevé dans le sol de la bande enherbée que dans un sol équivalent cultivé. Le coefficient de désorption des deux métabolites était au moins 66 % inférieur à celui du métolachlore (en sol cultivé ou dans la bande enherbée). Les bandes enherbées limitent donc significativement le transfert de la molécule mère dissoute, mais non celui de ses métabolites[39].
Biodégradation
Elle se fait par oxydation du groupement acétyle, en passant par la formation d'un dérivé d'acide oxalique[26] (OXA métolachlore) et d'acide sulfonique (ESA métolachlore)[43].
- Demi-vie de biodégradation dans le sol cultivé : initialement (en 1986) estimée entre 6 et 10 semaines[44], une étude plus récente réalisée à partir de marquage isotopique au carbone 14 a démontré une forte rémanence dans les phases solides à hauteur de 95 % après 12 semaines, ce qui conduirait à une accumulation d'à peu près 80 % de la quantité initialement épandue dans les sols d'une année sur l'autre[45].
- Dans un sol riche en matières organiques et en champignons microscopiques (ce qui est rarement le cas des sols d'agriculture industrielle, à cause de l'emploi de fongicides et d'un déficit fréquent en matière organique), la biodégradation peut être plus rapide, avec 5 métabolites trouvés dans le cas d'une expérimentation avec une communauté de deux champignons ; Aspergillus flavus, Aspergillus terricola isolés à partir d'un sol agricole « acclimaté » au métolachlore. Dans ce cas, la demi-vie du métolachlore en culture de laboratoire n'était que de 3,5 jours ; cinq métabolites ont été identifiés dans ce cas. La déchloration hydrolytique, une N-désalkylation et le clivage de la liaison amide semblent être les transformations dominantes appliquées au métolachlore par ces champignons qui ont produit 2 métabolites jamais auparavant signalés dans des cultures mixtes ou purement microbiennes (6-méthyl acétanilide 2-éthyl et 6-méthyl aniline 2-éthyl). Selon les auteurs de l'étude, une culture mixte en laboratoire pourrait dégrader 99 % du métolachlore, même à un niveau d'enrichissement aussi élevé que 100 mg·ml-1 [46]. En termes de bilan écotoxicologique, il reste à vérifier l'innocuité des métabolites produits.
Synthèse
Le métolachlore est dérivé de l'aniline qui est un composé organique aromatique toxique et écotoxique, dérivé du benzène.
Il est aujourd'hui produit à partir de 2-éthyl-6-méthylaniline (MEA) par condensation avec du méthoxy-acétone. La molécule résultante (une imine) est hydrogénée pour donner principalement la S- amine stéréoisomérique, par hydrogénation énantiosélective catalysée par un composé d'iridium (procédé testé à partir de 1986 et commercialement opérationnel depuis 1996[15]). Cette amine secondaire est alors acétylée avec du chlorure de chloracétyle. Les effets stériques de l'aniline 2,6-disubstituée freinent la rotation autour de la liaison N – aryl-C. Donc, à la fois les énantiomères R et S existent en tant qu'atropo-isomères. Les deux atropo-isomères du (S)-métolachlore présentent la même activité biocide en interagissant négativement avec le système phytohormonal des plantes qui l'absorbent[15].
Utilisation comme herbicide
Le S-métolachlore est surtout utilisé, seul ou en combinaison avec d'autres herbicides, pour le désherbage sélectif du maïs en prélevée (avril-juin ; de mars à mai surtout) et parfois sur le tournesol et le sorgho, les arachides, la fève, le soja ou contre les dicotylédones dans d'autres cultures. Il cible les graminées et dicotylédones considérées comme des « mauvaises herbes ».
- À titre d'exemple, la vente régionale moyenne en zones agricoles en 2000 pour la région Poitou-Charentes était de 3,07 kg/km²[47].
- On en utilisait déjà plus de 1.000.000 kg/an au Canada dans les années 1980[48].
Réglementation
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l’Union européenne :
- pour la France : interdit,
- au Canada, la concentration maximale acceptable provisoire (CMAP) de métolachlore dans l'eau potable est de 0,05 mg·l-1 (50 µg/l).
Les fonds de bidons non utilisés ne doivent pas être éliminés dans la nature, ni brûlés (sous peine de produire des dioxines, PCB ou furanes ou d'autres organochlorés toxiques). Plusieurs pays ou régions ont mis en place des systèmes d'aides et de participation volontaire à l'élimination sécurisée des stocks de pesticides désuets ou interdits (ex : Programme de gestion des produits désuets de pesticide d'Environnement-Canada).
Pollution, surveillance
Dès les années 1980, ce produit était devenu très présent dans l'environnement de toutes les régions cultivées de l'hémisphère nord (dans l'air et dans l'eau). On recherche dans l'eau la molécule-mère qu'on détecte aussi dans l'air ambiant[49] mais aussi deux de ses produits de dégradation (qui sont par ailleurs communs au métolachlore et à l'acétochlore) :
- le "2-éthyl, 6-méthyl, 2-chloro acétanilide" (recherché dans les eaux superficielles depuis 2003 et dans les eaux souterraines depuis 2005) ;
- le "2-éthyl, 6-méthylaniline" (recherché dans les eaux superficielles depuis 2004 et dans les eaux souterraines depuis 2005).
Dosage
Plusieurs méthodes[50] sont proposées par le fabricant :
- extraction au chloroforme, puis séparation par chromatographie gaz-liquide et détection par conductivité électrolytique, mode azote (limite de détection : 0,02 µg/l)[51] ;
- extraction au dichlorométhane, puis séparation par chromatographie en phase gazeuse et suivie d'un dosage au moyen d'un détecteur spécifique de l'azote et du phosphore (limite de détection approximative : de 0,1 à 2,0 µg/l)[52].
Autre méthode :
- extraction par séparation de phase solide puis dilution au méthanol [53].
Traitement de l'eau potable
Ce produit peut être adsorbé par un filtre à charbon activé (qui en éliminerait 99,5 pour cent d'eaux usées en contenant en moyenne 16,4 mg·l-1)[54].
Articles connexes
- Perturbateur endocrinien
- Biocide
- Pesticide
- Désherbant
- Substance active d'un produit phytopharmaceutique
- Liste de substances actives de produits phytosanitaires
- Liste de substances actives de produits phytopharmaceutiques autorisées par l'Union européenne
- Liste de substances actives de produits phytopharmaceutiques interdites par l'Union européenne
Bibliographie
- Aga, D.S., E.M. Thurman, M.E. Yockel, L.R. Zimmerman, and T.D. Williams. 1996. Identification of a new sulfonic acid metabolite of metolachlor in soil. Environ. Sci. Technol. 30:592–597
- Al-Khatib, K., J.B. Unland, B.L.S. Olson, and D.W. Graham. 2002. Alachlor and metolachlor transformation pattern in corn and soil. Weed Sci. 50:581–586.
- Arora, K., S.K. Mickelson, J.L. Baker, D.P. Tierney, and C.J. Peters. 1996. Herbicide retention by vegetative buffer strips from runoff under natural rainfall. Trans. ASAE 39:2155–2162
- Avis de l’ANSES relatif à la détermination de valeurs sanitaires maximales pour des acides sulfonique (ESA) et oxanilique (OXA) de l’alachlore et du métolachlore sur www.ANSES.fr, Maisons-Alfort, .
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « 2-Ethyl-6-methyl-1-N-(2-methoxy-1-methylethyl)chloroacetanilide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire)
- Date limite d'utilisation : 30/12/2003 ; Texte référent : avis JORF du 18/08/2002 p13961
- ANSES, « Non-conformités dans les eaux destinées à la consommation humaine dues aux métabolites du métolachlore », , p. 27
- Kiely, T., D. Donaldson, and A. Grube. 2004. Pesticide industry sales and usage: 2000 and 2001 market estimates (Ventes de l'industrie des pesticides et l'utilisation: 2000 et prévisions 2001 du marché) ; Programmes de l'Agence américaine de protection de l'environnement, Office des pesticides, Washington, DC.
- Endocrine Disrupting Compounds ; A Report to the Minnesota Legislature ; Minnesota Pollution Control Agency; 2008/01/15 - Voir p56/181
- rapport de l'Agence régionale de santé des Pays de la Loire sur la qualité de l'eau distribuée par l'unité de distribution de Saint-Georges-sur-Loire en 2016
- Poissant, L., C. Beauvais, P. Lafrance et C. Deblois. 2008. « Pesticides in fluvial wetlands catchments under intensive agricultural activities ». Science of the Total Environment , 404 (1) : 182-195. ; cités par Des pesticides voyagent jusqu'au fleuve Saint-Laurent par ses tributaire (Environnement Canada, consulté 2010/0/12)
- Pham, T.T., B. Rondeau, H. Sabik, S. Proulx et D. Cossa. 2000. « Lake Ontario: The predominant source of triazine herbicides in the St. Lawrence River ». Journal canadien des sciences halieutiques et aquatiques, vol. 57, p. 78-85.*
- H.-U. Blaser, The chiral switch of (S)-metolachlor: A personal account of an industrial odyssey in Asymmetric Catalysis, Advanced Synthesis and Catalysis, 2002, vol. 344, pp. 17–31.
- Hans-Ulrich Blaser, Industrielle asymmetrische Hydrierung „Made in Switzerland“, Nachrichten aus der Chemie, 2010, vol. 58, pp. 864−867.
- Braverman, M.P., T.L. Lavy, and C.J. Barnes. 1986. The degradation and bioactivity of metolachlor in soil. Weed Sci. 34:479–484.
- Agriculture Canada. Guide to the chemicals used in crop protection. 7e édition. Publication d'Agriculture Canada no 1093 (1982)
- « Autorisation du S-métolachlore : l'Efsa relève deux points préoccupants », sur Actu-Environnement (consulté le ).
- H.U.-Blaser “The Chiral Switch of (S)-Metolachlor: A Personal Account of an Industrial Odyssey in Asymmetric Catalysis” Advanced Synthesis and Catalysis 2002, 344, 17-31. (Résumé)
- Pothuluri, J.V., Evans, F.E., Doerge, D.R., Churchwell, M.I., Cerniglia, C.E. (1997). Metabolism of metolachlor by the fungus Cunninghamella elegans. Arch. Environ. Contam. Toxicol. 32,117-125.
- Rapport d'analyse de l'eau potable de l'année 2017 consultable en mairie d'Erdre-en-Anjou.
- USEPA, 1987. Metolachlor Pesticide Registeration Standard. Springfield, IL: Natl. Tech. Info. Serv.
- health advisory level (HAL) ; niveau préoccupant pour la santé, pour l'EPA, aux USA
- Rollof, B., Belluck, D., Meiser, L. (1992). Cytogenic effects of cyanazine and metolachlor on human lymphocytes exposed in vitro. Mut. Res. Lett. 281: 295-298.
- Clements, C., Ralph, S., Petras, M. (1997). Genotoxicity of select herbicides on Rana catesbeiana tadpoles using alkaline single-cell gel DNA electrophoresis (Comet) assay. Env. Mol. Mut. 29: 277-288.
- Echeverrigaray, S., Gomes, L.H., Taveres, F.C.A.(1999). Isolation and characterization of metolachlor resistant mutants of Saccharomyces cerevisiae. World Journal of Micro and Biotech. 15: 679-681.
- Varnargy, L., Budai, P., Fejes, S., Susan, M., Francsi, T., Keseru, M., Szabo, R.(2003). Toxicity and degradation of metolachlor (Dual 960EC)in chicken embryos. Commun. Agric. Appl. Biol. Sci.68:807-11.
- source : Direction des aliments du ministère de la Santé nationale et du Bien-être social
- Organisation mondiale de la santé. Document de travail sur le métolachlore. Deuxième consultation sur les herbicides dans l'eau potable, Rome, du 13 au 18 juillet (1987)
- Weed Science Society of America. Herbicide handbook. 5e édition. Champaign, IL (1983)
- Rutheford, D.W., C.T. Chiou, and D.E. Kile. 1992. Influence of soil organic matter composition on the partition of organic compounds. Environ. Sci. Technol. 26:336–340.
- Graham, J.S., and J.S. Conn. 1992. Sorption of metribuzin and metolachlor in Alaskan sub-arctic agricultural soils. Weed Sci. 40:155–160.
- Kalkhoff, S.J., D.W. Kolpin, E.M. Thurman, I. Ferrer, and D. Barcelo. 1998. Degradation of chloroacetanilide herbicides: The prevalence of sulfonic and oxanilic acid metabolites in Iowa groundwaters and surface waters. Environ. Sci. Technol. 32:1738–1740.
- Kolpin, D.W., E.M. Thurman, and D.A. Goolsby. 1996. Occurrence of selected pesticides and their metabolites in near-surface aquifers of the Midwestern United States. Environ. Sci. Technol. 30:335–340.
- Frank, R. et Logan, L. Pesticide and industrial chemical residues at the mouth of the Grand, Saugeen and Thames rivers, Ontario, Canada, 1981-85. Arch. Environ. Contam. Toxicol., 17 : 741 (1988)
- Hiebsch, S.C. The occurrence of thirty-five pesticides in Canadian drinking water and surface water. Rapport non publié préparé pour la Direction de l'hygiène du milieu, ministère de la Santé nationale et du Bien-être social (1988)
- Obrigawitch, T., F.M. Hons, J.R. Abernathy, and J.R. Gipson. 1981. Adsorption, desorption and mobility of metolachlor in soils. Weed Sci. 29:332–336
- Patakioutas, G., and T.A. Albanis. 2002. Adsorption-desorption studies of alachlor, metolachlor, EPTC, chlorothalonil and pirimiphos-methyl in contrasting soils. Pest Manage. Sci. 58:352–362.
- Phillips, P.J., G.R. Wall, E.M. Thurman, D.A. Eckhardt, and J. Vanhoesen. 1999. Metolachlor and its metabolites in tile drain and stream runoff in the Canajoharie Greek watershed. Environ. Sci. Technol. 33:3531–3537
- Staddon, W.J., M.A. Locke, and R.M. Zablotowicz. 2001. Microbiological characteristics of a vegetative buffer strip soil and degradation and sorption of metolachlor. Soil Sci. Soc. Am. J. 65:1136–1142 (En ligne)
- Tingle, C.H., D.R. Shaw, M. Boyette, and G.P. Murphey. 1998. Metolachlor and metribuzin losses in runoff as affected by width of vegetative filter strips. Weed Sci. 46:475–479.
- Mersie, W., C.A. Seybold, C. McNamee, and J. Huang. 1999. Effectiveness of switchgrass filter strips in removing dissolved atrazine and metolachlor from runoff. J. Environ. Qual. 28:816–821 (Voir)
- L. J. Krutz, S. A. Senseman, K. J. McInnes, D. W. Hoffman and D. P. Tierney ; Adsorption and Desorption of Metolachlor and Metolachlor Metabolites in Vegetated Filter Strip and Cultivated Soil ; TECHNICAL REPORTS ; Organic Compounds in the Environment ; J. Environ. Qual. 33:939-945 (2004).
- Calvet, R. 1980. Adsorption-desorption phenomena. p. 1–30. In R.J. Hance (ed.) Interactions between herbicides and the soil. Academic Press, New York
- Ding, G., J.M. Novak, S. Herbert, and B. Xing. 2002. Long-term effects on soil metolachlor sorption and desorption behavior. Chemosphere 48:897–904
- Seybold, C.A., and W. Mersie. 1996. Adsorption and desorption of atrazine, deethylatrazine, deisopropylatrazine, hydroxyatrazine, and metolachlor in two soils from Virginia. J. Environ. Qual. 25:1179–1185. (Texte en ligne)
- Détermination des valeurs sanitaires maximales pour des acides sulfonique (ESA) et oxanilique (OXA) de l’alachlore et du métolachlore dans les EDCH : avis de l'Anses
- Senes Consultants. Drinking water criteria reviews for alachlor and metolachlor. Rapport préparé pour le ministère de l'Environne-ment de l'Ontario (1986).
- Aurore ANDRIAMALALA, Devenir du S-métolachlore dans les sols : impact i) d'un apport sous forme de cocktails de pesticides et ii) de la formulation, Université Pierre et Marie Curie (Paris 6) ; Institut des Sciences et Industries du Vivant et de l'Environnement, (lire en ligne)
- D. Sanyal and G. Kulshrestha ; Metabolism of Metolachlor by Fungal Cultures ; J. Agric. Food Chem., 2002, 50 (3), pp 499–505 ; DOI:10.1021/jf010850d
- Observatoire des pesticides en poitou-Charente
- Métolachlore / Santé de l'environnement et du milieu de travail Canada
- Information et cartographie sur le métolachlore en Poitou-Charentes, dans l'eau et dans l'air (version 2007)
- Yokley, R.A., L.C. Mayer, S.B. Huang, and J.D. Vargo. 2002. Analytical method for the determination of metolachlor, acetochlor, alachlor, dimethenamid, and their corresponding ethanesulfonic and oxanillic acid degradates in water using SPE and LC/ESI-MS/MS. Anal. Chem. 74:3754–3759.En ligne/Medline
- Frank, R. et Logan, L. Pesticide and industrial chemical residues at the mouth of the Grand, Saugeen and Thames rivers, Ontario, Canada, 1981-85. Arch. Environ. Contam. Toxicol., 17 : 741 (1988).
- U.S. Environmental Protection Agency. Health advisory--Metolachlor. Office of Drinking Water (1987).
- (en)Analysis of S-Metolachlor, Metolachlor ESA, and Metolachlor OXA in Well Water, California Department of Food and Agriculture, 2001 révisé en 2015.
- Holiday, A.D. et Hardin, D.P. Activated carbon removes pesticides from wastewater. Chem. Eng., 88 : 88 (1981), cité au renvoi 8, et cité par Environnement-Canada dans sa fiche sur le métolachlore (mise à jou 2009-03-09, consultée 2010 06 12)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Metolachlor » (voir la liste des auteurs).