Benzène
Le benzène est un composé organique de formule brute C6H6, également noté Ph-H, φ-H, ou encore ϕ-H. Il appartient à la famille des hydrocarbures aromatiques monocycliques, car le cycle formé par les six atomes de carbone est plan et comporte six électrons délocalisés.
| Benzène | |
| |
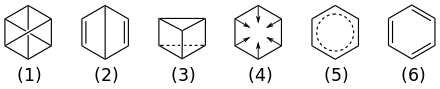
| Structure et représentations du benzène. | |
| Identification | |
|---|---|
| Nom UICPA | Benzène |
| No CAS | |
| No ECHA | 100.000.685 |
| No CE | 200-753-7 |
| SMILES | |
| InChI | |
| Apparence | Liquide incolore, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
| Formule | C6H6 [Isomères] |
| Masse molaire[2] | 78,111 8 ± 0,005 2 g/mol C 92,26 %, H 7,74 %, |
| pKa | 43[3] |
| Susceptibilité magnétique | 54,8 × 10−6 cm3 mol−1[4] |
| Diamètre moléculaire | 0,526 nm[5] |
| Propriétés physiques | |
| T° fusion | 5,5 °C[6] |
| T° ébullition | 80,1 °C[6] |
| Solubilité | dans l'eau à 25 °C : 1,79 g/L[6] |
| Paramètre de solubilité δ | 18,8 MPa1/2 (25 °C)[7] |
| Miscibilité | avec l'éthanol, le chloroforme, l'éther, le disulfure de carbone, l'acétone, les huiles, le tétrachlorure de carbone, l'acide acétique glacial[6] |
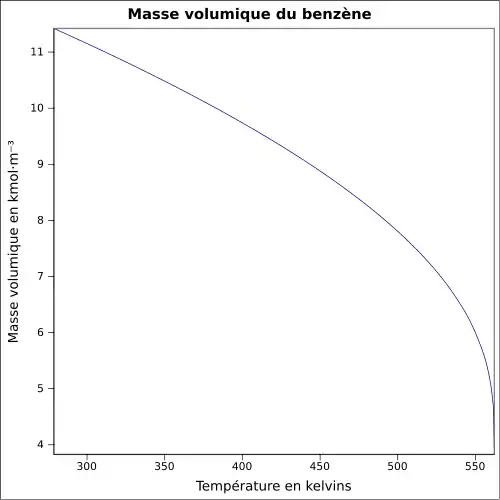
| Masse volumique | 0,878 7 g/cm3 à 45 °C[6]
|
| T° d'auto-inflammation | 498 °C[1] |
| Point d’éclair | −11 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 1,2 à 7,8 %vol[6] |
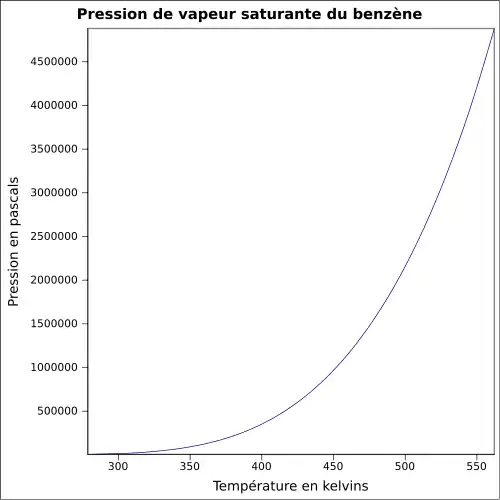
| Pression de vapeur saturante | à 20 °C : 10 kPa[1], 12,6 kPa à 25 °C[6] |
| Viscosité dynamique | 0,65 mPa s à 20 °C |
| Tension superficielle | 28,88 × 10−3 N m−1 à 25 °C[9] |
| Point critique | 288,9 °C, 48,6 atm[6] |
| Vitesse du son | 1 310 m s−1 à 25 °C[10] |
| Thermochimie | |
| S0gaz, 1 bar | 269 J K−1 mol−1 |
| S0liquide, 1 bar | 173,4 J K−1 mol−1 |
| ΔfH0gaz | 82,96 kJ·mol-1[11] |
| ΔfH0liquide | 49,06 kJ·mol-1[11] |
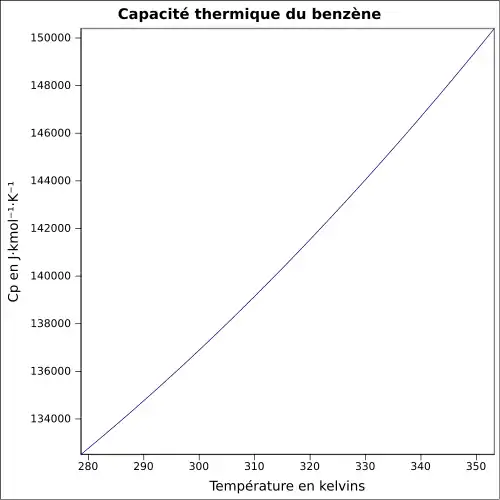
| Cp | 136,0 J·K-1·mol-1
|
| PCS | 3 267,6 kJ·mol-1 (25 °C, liquide)[13] |
| Cristallographie | |
| Paramètres de maille | a = 7,440 Å b = 9,550 Å |
| Volume | 491,68 Å3[14] |
| Propriétés optiques | |
| Indice de réfraction | 1,501 08[6] |
| Précautions | |
| SGH[15] | |
   Danger |
|
| SIMDUT[16] | |
  B2, D2A, D2B, |
|
| NFPA 704 | |
| Transport | |
| Classification du CIRC | |
| Groupe 1 : Cancérogène pour l'homme[17] | |
| Inhalation | toxique |
| Peau | irritant |
| Yeux | irritant |
| Ingestion | toxique |
| Écotoxicologie | |
| LogP | 2,13[1] |
| Seuil de l’odorat | bas : 34 ppm haut : 119 ppm[18] |
| Unités du SI et CNTP, sauf indication contraire. | |
Dans les conditions usuelles, le benzène est un liquide incolore, d'odeur caractéristique, volatil, très inflammable et cancérogène.
C'est un précurseur important pour la synthèse de nombreux composés organiques : matières plastiques, caoutchoucs synthétiques, solvants, plastifiants, détergents, parfums, colorants, additifs alimentaires, médicaments, pesticides, explosifs, etc. Il est également utilisé comme solvant dans différentes industries, et comme additif antidétonant dans l'essence. Il est produit par l'industrie pétrochimique essentiellement par reformage catalytique, hydrodésalkylation du toluène et vapocraquage.
Histoire
Découverte
En 1825, le scientifique britannique Michael Faraday isole, dans le liquide résiduel du fond des bouteilles d'éclairage, un composé qu'il nomme « bicarburet of hydrogen ». Il le caractérise, déterminant son point d'ébullition (80 °C), son point de fusion (5,5 °C), les proportions massiques de carbone et d'hydrogène (12:1) et testant sa réactivité avec différents réactifs, tels que le dichlore, le diiode, le potassium, l'acide nitrique et l'acide sulfurique[19] - [20].
La première synthèse du benzène revient au chimiste allemand Eilhard Mitscherlich qui le produit en 1833 par réaction de l'acide benzoïque et de la chaux[21]. Mitscherlich baptise ce composé « benzin » en référence à la gomme benjoin, dont il a extrait l'acide benzoïque, mais l'éditeur Liebig lui préfère le nom « benzol », la terminaison -ol faisant référence à l'huile (Öle en allemand) ; le composé sera finalement dénommé « Benzol » en allemand, mais « benzène » en français et « benzene » en anglais. Le chimiste français Auguste Laurent propose de son côté le nom « phène » (du grec ancien φαινω / phainô, « j'éclaire »), le composé étant issu du gaz d'éclairage ; cette racine restera dans le nom du radical phényle et dans celui de l'alcool dérivé, le phénol[22] - [23].
En 1845, le chimiste britannique Charles Mansfield, travaillant sous la direction d'August Wilhelm von Hofmann, l'isole dans le goudron de houille[24]. Quatre ans plus tard, il lance la première production de benzène à l'échelle industrielle à partir de goudron de houille[25] - [26].
Marcellin Berthelot le synthétise à son tour en 1868 par trimérisation de l'acétylène (ci-dessous)[27].

Élucidation de la structure
Si la formule brute du benzène, C6H6, fut déterminée aisément par l'analyse de sa combustion, il fallut près d'un siècle pour déterminer sa structure et expliquer sa réactivité particulière et son exceptionnelle stabilité[22].

La première hypothèse de structure circulaire fut proposée en 1861 par Johann Josef Loschmidt[28], soit quatre ans avant celle du chimiste allemand Friedrich August Kekulé von Stradonitz[29] - [30] qui s'est avérée la plus proche de la structure réelle. Le Français Paul Havrez propose également en 1865 une structure cyclique dans laquelle les six liaisons C–C sont équivalentes[31].
Kekulé dira avoir eu la vision de cette structure en rêve, les six atomes de carbone se transformant en un serpent qui se mord la queue, peut-être une façon d'éviter d'admettre qu'il s'était inspiré des travaux de Loschmidt et Havrez[22].
Cette structure, qu'on nommerait formellement 1,3,5-cyclohexatriène, est critiquée dès 1869 par Adolf von Baeyer, Wilhelm Körner et Albert Ladenburg, trois anciens étudiants de Kékulé. Ils montrent en particulier que cette structure conduirait à l'existence de deux dérivés ortho-dibromés (ci-dessous), or l'expérience montre qu'il n'en existe qu'un[32].
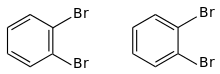
D'autres structures, comme celles du benzène de Dewar, de Ladenburg ou de Claus, furent proposées successivement, sans parvenir à expliquer les propriétés chimiques du composé.
Kékulé proposa donc en 1872 une nouvelle représentation fondée sur une « oscillation » très rapide entre deux structures équivalentes, les liaisons simples et doubles échangent leurs positions. Les six liaisons carbone-carbone sont alors équivalentes, chacune étant liaison simple la moitié du temps et liaison double l'autre moitié du temps, et cette hypothèse permet de justifier l'existence d'un seul composé ortho-dibromé[32].
.png.webp)
Les mesures par diffraction des rayons X de Kathleen Lonsdale en 1929[33] montrent que toutes les liaisons carbone-carbone de la molécule de benzène ont la même longueur, et que cette longueur est intermédiaire entre celle d'une liaison simple et celle d'une liaison double. Cette observation est compatible avec l'hypothèse d'une oscillation entre deux formes limites, si l'on admet qu'elle est si rapide que la diffraction ne peut mettre en évidence qu'une mesure moyenne[34].
Cependant, la structure de Kékulé ne peut expliquer que le benzène n'ait pas la même réactivité chimique que les alcènes : en effet celui-ci n'est pas oxydé par le permanganate de potassium (test de Bayer) et ne réagit pas avec le dibrome (test au dibrome)[35].
Ce n'est qu'avec l'avènement de la chimie quantique que Linus Pauling propose, en 1933, une formule mésomère unique avec six liaisons carbone-carbone identiques, expliquant la stabilité du benzène par l'énergie de résonance du système conjugué[36].
Propriétés physiques
Identification
Le benzène est un liquide incolore, dont l'indice de réfraction est 1,50 (proche de celui du verre)[6]. Sa viscosité est plus faible que celle de l'eau[6]. Il est très soluble dans les solvants organiques polaires, mais sa solubilité dans l'eau est assez faible[6]. Il possède une odeur sucrée caractéristique, avec un seuil de détection de 1,5 à 900 mg m−3 d'air[6].
Géométrie
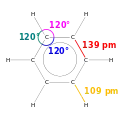
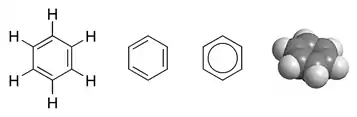
La structure géométrique de la molécule est donnée par les éléments suivants[37] :
- le cycle benzénique est un hexagone régulier plan ; les six atomes d'hydrogène appartiennent également au plan du cycle ;
- les six liaisons C–C sont de longueur identique : 139 pm, longueur intermédiaire entre celles des liaisons simples (154 pm) et celle des liaisons doubles (134 pm) ;
- les liaisons C–H ont une longueur de 109 pm.
Délocalisation des électrons
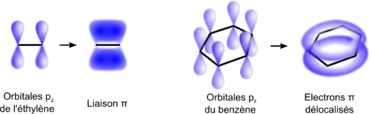
Dans une molécule organique, les liaisons simples sont des liaisons σ, formées d'électrons dont la probabilité de présence est très importante entre les atomes (recouvrement axial). Les liaisons doubles sont formées à la fois d'une liaison σ et d'une liaison π, cette dernière étant formée par recouvrement latéral de deux orbitales pz non-hybridées[38]. Dans la molécule de benzène, les six électrons π ne sont pas localisés sur trois liaisons particulières du cycle mais délocalisés sur l'ensemble des six liaisons, formant un nuage électronique appelé « système pi délocalisé »[note 1] ou « sextet aromatique », de part et d'autre du plan du cycle[39].

Les électrons π sont donc répartis sur tous les atomes de carbone, et la molécule peut être représentée comme la superposition quantique, une sorte de chat de Schrödinger des deux formes mésomères, qui ne sont que des formes limites n'ayant pas d'existence réelle ; il est donc plus correct de représenter les électrons délocalisés par un cercle contenu dans l'hexagone[40] : ![]()
Cette délocalisation des électrons explique :
- que les liaisons C–C soient toutes de même longueur, intermédiaire entre la longueur d'une liaison simple et celle d'une liaison double[40] ;
- que la molécule soit plane, cette conformation optimisant le recouvrement latéral des orbitales 2pz[41].
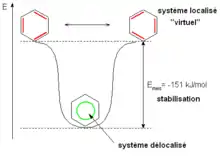
Le système π délocalisé est également responsable de la grande stabilité du benzène, qui définit son caractère aromatique (ou aromaticité)[39]. On constate en effet que l'hydrogénation du cyclohexène dégage 120 kJ mol−1. L'hydrogénation du benzène version « 1,3,5-cyclohexatriène » devrait donc dégager trois fois plus d'énergie, soit 360 kJ mol−1, or l'hydrogénation du benzène ne dégage que 210 kJ mol−1[42]. Par rapport au système virtuel pour lequel les liaisons π seraient localisées entre deux atomes de carbone, le système réel dans lequel les liaisons π sont délocalisées sur la totalité du cycle est stabilisé de plus de 150 kJ mol−1 ; cette énergie est appelée « énergie de stabilisation » ou « énergie de résonance ».
La méthode d'orbitales moléculaires de Hückel permet d'affiner cette description en déterminant le diagramme énergétique du benzène par combinaison linéaire d'orbitales atomiques[43].
Propriétés spectroscopiques
En spectroscopie infrarouge, le benzène présente une bande d'absorption entre 3 030 et 3 100 cm−1 (vibrations d'élongation des liaisons C–H), une bande fine au voisinage de 1 480 cm−1 (vibrations d'élongation des liaisons C–C), et une bande fine au voisinage de 675 cm−1 (vibrations de déformation hors du plan des liaisons C–H)[44]. La position et l'amplitude de ces derniers pics donnent des informations sur les substitutions éventuelles d'atomes d'hydrogène[45].
En spectroscopie RMN, la symétrie du cycle benzénique fait que les spectres RMN 1H et 13C du benzène, découplés respectivement en 13C et 1H, ne présentent qu'un seul pic de déplacement chimique[46], respectivement à δ (CDCl3) = 7,34 ppm[47] et δ (CDCl3) = 128,4 ppm[47]. Les couplages scalaires 1J, 2J, 3J, et 4J entre les noyaux 1H et 13C, séparés respectivement de 1, 2, 3 et 4 liaisons, valent respectivement 157,5, 1,0, 7,4 et −1,1 Hz[48]. Les couplages scalaires 3J, 4J et 5J entre deux noyaux 1H valent respectivement 7,6, 1,4 et 0,7 Hz[49].
Réactivité chimique
La réactivité chimique du benzène est fortement dépendante de son caractère aromatique qui lui procure une grande stabilité. Les réactions qui font perdre la structure aromatique au cycle (additions et oxydations) sont donc très défavorisées par rapport à celles qui la conservent (substitutions électrophiles aromatiques)[50].
Réactions de substitution électrophile aromatique

La substitution électrophile aromatique est une réaction au cours de laquelle un des atomes d'hydrogène du cycle aromatique (Ar–H) est substitué par un groupe électrophile[51] (noté « E » dans le bilan réactionnel) :
- Ar–H + EX → Ar–E + HX.
L'intermédiaire réactionnel, nommé « intermédiaire de Wheland »[52] ou cation arénium, porte une charge positive délocalisée sur l'ensemble du cycle benzénique. Ce carbocation est donc stabilisé par mésomérie. Cet intermédiaire réactionnel va finalement perdre un proton de façon à restaurer l'aromaticité[53].
Cette réaction permet la préparation de composés aromatiques substitués par une grande variété de groupes fonctionnels, mais nécessite généralement un catalyseur tel qu'un acide de Lewis.
Nitration
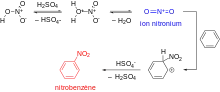
L'introduction d'un groupe nitro sur le cycle aromatique, ou nitration, est possible en présence d'ions nitronium (NO2+). Cet électrophile très puissant est généré à partir d'acide nitrique et d'un autre acide minéral fort, généralement l'acide sulfurique[51] - [54].
L'électrophile NO2+ est tout d'abord généré par protonation de l'acide nitrique, suivie de la perte d'une molécule d'eau. Cet ion nitronium, très réactif, réagit sur le benzène pour former l'intermédiaire de Wheland, qui perd un proton afin de restaurer l'aromaticité. Le nitrobenzène préparé selon ce procédé peut ensuite être utilisé pour la synthèse de l'aniline[55].
Sulfonation

Le benzène réagit avec l'acide sulfurique concentré ou l'oléum (SO3 dissout dans l'acide sulfurique) pour donner l'acide benzènesulfonique selon une réaction de sulfonation[51] - [56]. L'espèce électrophile est dans les deux cas le trioxyde de soufre (SO3), qui est formé par déshydratation de l'acide sulfurique.
Cet électrophile réagit avec le benzène selon le même mécanisme que celui observé lors de la nitration, puis l'intermédiaire cationique perd un proton pour restaurer l'aromaticité. Cette réaction reste toutefois réversible, et le groupe acide sulfonique peut être éliminé par simple chauffage de l'acide benzènesulfonique dans l'eau en présence d'une trace d'acide sulfurique[56].
Halogénation
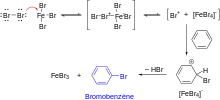
Les halogènes (Cl2, Br2, etc.) ne sont pas suffisamment électrophiles pour réagir directement avec le benzène. La réaction d'halogénation doit être catalysée par un acide de Lewis, comme le chlorure de fer(III) ou le bromure de fer(III)[57]. L'activité de ces catalyseurs est due à leur capacité de polarisation de la liaison halogène-halogène[56], par coordination du catalyseur à l'un des doublets non-liants de l'halogène. Si l'on prend l'exemple de la réaction de bromation du benzène, cela permet de générer l'espèce électrophile Br⁺[FeBr4]⁻ qui peut ensuite réagir sur le benzène selon un mécanisme de substitution électrophile aromatique vu précédemment.
Réaction de Friedel-Crafts
Les réactions d'alkylation et d'acylation de Friedel-Crafts sont très importantes en chimie organique, car elles permettent l'introduction rapide de substituants carbonés sur le cycle benzénique. L'espèce électrophile active (un carbocation ou un ion acylium) est généralement obtenue par réaction d'un réactif halogéné en présence d'un acide de Lewis[58] - [59].
Alkylation
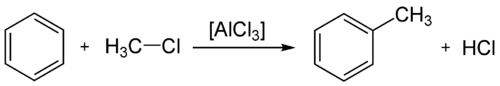
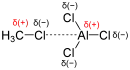
La réaction du chlorométhane sur le benzène en présence de chlorure d'aluminium permet la synthèse du toluène. En réalité, le toluène peut à son tour réagir avec le chlorométhane, ce qui conduit souvent à un mélange d'isomères dans différentes proportions[60]. La polarisation de la liaison Cl–CH3 par le catalyseur (par mobilisation d'un des groupes non-liants de l'halogène) permet la génération de l'espèce active, qui réagit ensuite selon le mécanisme général de substitution électrophile aromatique.
L'alkylation de Friedel-Crafts n'est cependant pas limitée à l'emploi d'halogénoalcanes. L'acide fluorhydrique permet par exemple de générer un carbocation à partir d'un alcène, suivant la règle de Markovnikov. L'anion fluorure n'attaquant pas immédiatement le carbocation, la réaction de substitution électrophile aromatique du benzène peut avoir lieu[61] - [56]. Les alcools peuvent également être utilisés comme source de carbocations, notamment par traitement avec du trifluorure de bore (BF3). Ce dernier est cependant entièrement consommé au cours de la réaction, et doit donc être introduit en quantité stœchiométrique[61].
Bien qu'efficace, cette réaction présente quelques difficultés :
- le produit de réaction est plus nucléophile que le réactif (à cause de l'effet inductif donneur de la chaîne alkyle introduite). Il est donc difficile de limiter la réaction à la mono-alkylation du benzène ;
- lorsque l'halogénoalcane utilisé conduit à la formation d'un carbocation primaire, ce dernier se réarrange pour former un carbocation secondaire, plus stable. Ainsi, le produit majoritaire formé lors de la réaction du benzène avec le 1-chlorobutane est le 2-phénylbutane et non le 1-phénylbutane[60].
Acylation
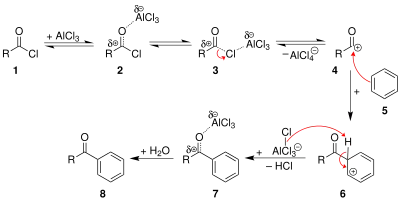
L'acylation de Friedel-Crafts est utilisée pour introduire un groupe acyle sur le benzène. Le produit d'acylation est généralement obtenu par traitement du benzène (ou tout autre composé aromatique) avec un chlorure d'acyle en présence d'un acide de Lewis fort tel le chlorure d'aluminium. L'ion acylium intermédiaire réagit sur le benzène, puis l'intermédiaire cationique (stabilisé par mésomérie) est déprotoné pour restaurer l'aromaticité du cycle. La cétone aromatique est obtenue après hydrolyse du milieu réactionnel[61].
Cette réaction présente plusieurs avantages par rapport à la réaction d'alkylation de Friedel-Crafts :
- l'ion acylium ne se réarrange pas, un seul régioisomère est donc formé ;
- le groupe carbonyle étant désactivant, la réaction s'arrête à la mono-acylation.
En revanche, il est nécessaire d'employer le catalyseur en quantité stœchiométrique en raison de la formation d'un complexe acide-base de Lewis avec le produit de réaction.
L'acylation du benzène suivie de la réduction de la fonction cétone permet de pallier les problèmes rencontrés lors de l'alkylation de Friedel-Crafts (réarrangement du carbocation, produit plus nucléophile que le réactif). Cette approche peut ainsi permettre la synthèse de l'éthylbenzène par réaction du benzène avec le chlorure d'éthanoyle, ou bien du 1-propylbenzène par réaction avec le chlorure de propyle[60]. Les réductions de Wolff-Kishner et de Clemmensen peuvent être utilisées pour réduire les cétones intermédiaires en chaînes hydrocarburées.
Réactions d'addition
Bien que défavorisées par la perte d'aromaticité, certaines réactions d'addition sur le cycle benzénique sont possibles. Les plus courantes sont l'hydrogénation et l'halogénation. L'addition d'eau (réaction d'hydratation) ou d'hydracides (H–X) n'est en revanche pas possible[62].
Hydrogénation
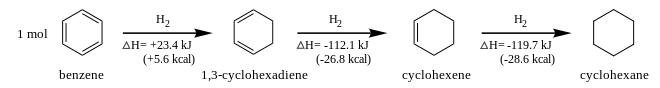
Tandis que la plupart des alcènes peuvent être hydrogénés sous une pression de 1 atm à température ambiante en présence de catalyseurs au nickel classiques tels que le nickel de Sabatier, cette même réaction sur le benzène doit être réalisée entre 200 °C et 225 °C sous une pression de 50 bar en présence d'un catalyseur plus actif, le nickel de Raney[63].
Cette différence de réactivité est due à la perte de l'aromaticité lors de l'hydrogénation d'une des liaisons aromatiques. En effet, la réduction du benzène en 1,3-cyclohexadiène est endothermique (ΔH = +23,4 kJ mol−1), tandis que les réductions suivantes (en cyclohexène puis cyclohexane) sont exothermiques (ΔH = −112,1 et −119,7 kJ mol−1 respectivement)[64]. Dans ces conditions, la réduction en cyclohexane est totale et consomme trois molécules de H2[62].
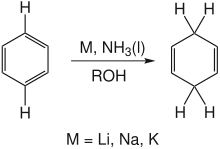
La réduction de Birch permet de réduire le benzène en cyclohexa-1,4-diène à l'aide d'une solution de métal alcalin dans l'ammoniac liquide, en présence d'un alcool (éthanol, tert-butanol, etc.)[62].
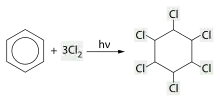
Halogénation radicalaire
Le cycle benzénique peut fixer trois molécules de dichlore selon un mécanisme d'halogénation radicalaire, conduisant à un mélange d'énantiomères du 1,2,3,4,5,6-hexachlorocyclohexane[62] :
La bromation est également possible et conduit au 1,2,3,4,5,6-hexabromocyclohexane[62].
Réactions d'oxydation
Le cycle benzénique est très résistant à l'oxydation ; il ne réagit pas avec les oxydants classiques des alcènes comme le permanganate de potassium[35]. Trois réactions d'oxydation sont cependant possibles :
- la combustion, en présence de dioxygène, forme du dioxyde de carbone et de l'eau :
- 2 C6H6 + 15 O2 → 12 CO2 + 6 H2O.
- La chaleur de combustion du benzène vaut[6] : ΔcH0 = −3 275,3 kJ mol−1 ;
- l'oxydation catalysée par l'oxyde de vanadium V2O5 permet d'obtenir l'anhydride maléique[65] :
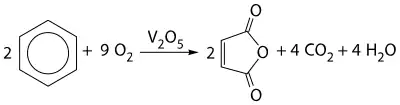
- l'ozonolyse suivie d'une réduction (par le sulfure de diméthyle ou par le zinc) forme principalement de l'éthanedial[66] :
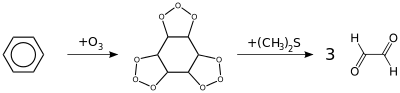
Dérivés du benzène
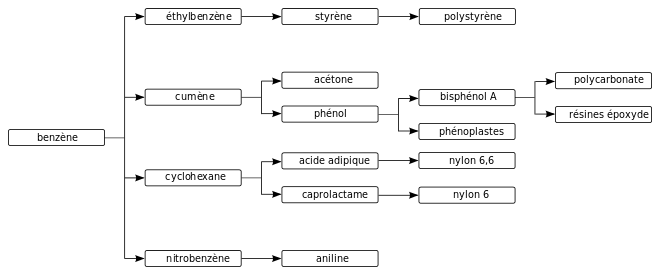
Un grand nombre de composés chimiques industriellement importants ont une structure comportant un ou plusieurs cycles benzéniques :
- les hydrocarbures aromatiques monocycliques sont des hydrocarbures (constitués uniquement d'atomes de carbone et d'hydrogène) dans lesquels un ou plusieurs atomes d'hydrogène du benzène est remplacé par des groupes alkyle : toluène, xylène, cumène, styrène, etc. ;
- les hydrocarbures aromatiques polycycliques sont des hydrocarbures aromatiques dont la structure comporte au moins deux cycles aromatiques soudés (ou condensés) : naphtalène, anthracène, phénanthrène, etc. ;
- on obtient d'autres composés aromatiques en substituant un ou plusieurs atomes d'hydrogène du benzène par différents groupes fonctionnels : phénol, aniline, nitrobenzène, chlorobenzène, etc.
Production
Aspects économiques
| Données industrielles | Tonnage (Mt)[67] |
|---|---|
| Capacité de production mondiale en 2012 | 57,2 |
| Production mondiale en 2011 | 41,6 |
| Production en Chine en 2012 | 11,0 |
| Production dans l'Union européenne en 2012 | 6,3 |
| Production aux États-Unis en 2011 | 5,8 |
| Capacité du Japon en 2010 | 5,5 |
| Capacité de la Corée du Sud en 2010 | 5,0 |
Historiquement, les marchés des aromatiques sont en général très volatils et caractérisés par un surplus de production. Les prix bas du benzène sur la période 1993-2002 ont incité certains producteurs à se désengager. Depuis 2004, la situation s'est inversée, en raison de la hausse des cours du pétrole et de la faiblesse de l'offre[68]. Les cours du benzène se sont donc envolés, passant de 200 US$ en 2002 à 1 500 US$ en 2013.
Procédés chimiques
Jusqu'à la Seconde Guerre mondiale, le benzène était principalement un produit secondaire de la production de coke à partir de la houille. Depuis la croissance de la demande des années 1950, liée au développement de l'industrie des matières plastiques, le benzène est fourni par l'industrie pétrochimique, une part restant issue de la houille[69].
La production de 2013 met en œuvre essentiellement trois procédés chimiques : le reformage catalytique, le vapocraquage et l'hydrodésalkylation du toluène[70] :
- Dans le reformage catalytique, un mélange d'hydrocarbures, issu de la distillation du pétrole, est porté à haute température (entre 450 °C et 550 °C), sous pression (15 à 70 bar), en présence d'un catalyseur à base de platine, pour provoquer des réactions d'isomérisation, de cyclisation et d'aromatisation par déshydrogénation. Les composés aromatiques produits sont extraits en utilisant des solvants comme le sulfolane ou le diéthylène glycol. Le benzène est ensuite séparé par distillation[71] ;
- Le vapocraquage permet de produire de l'éthylène et d'autres alcènes à partir d'hydrocarbures aliphatiques. Dans le cas de certains hydrocarbures, le vapocraquage donne un liquide riche en benzène et utilisé joint à d'autres hydrocarbures en tant qu'additif pour l'essence, ou distillé pour le séparer en différents composés dont le benzène[72] ;
- L'hydrodésalkylation ôte au toluène son groupe alkyle, le méthyle :
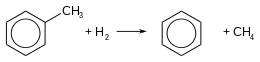
Le mélange de toluène et de dihydrogène passe sur un catalyseur (oxyde de chrome, de molybdène ou de platine) à une température comprise entre 500 °C et 600 °C et une pression comprise entre 40 et 60 atm. Une alternative consiste à se passer de catalyseur en élevant la température. Le rendement de la réaction est supérieur à 95 %. Des composés aromatiques plus lourds comme le xylène sont parfois utilisés à la place du toluène avec des rendements similaires[73].
Utilisations
Au XIXe siècle et au début du XXe siècle, le benzène était fréquemment utilisé comme solvant, dans les colles, vernis, peintures, encres, pour le nettoyage à sec, le dégraissage des métaux[68] - [74] ou la décaféination du café[75]. La mise en évidence de sa toxicité a conduit à son remplacement progressif, souvent par le toluène, à partir des années 1950[76] dans la plupart de ces usages, mais il est encore employé pour quelques applications spécifiques, comme le dégraissage et le nettoyage des circuits électroniques ou l'extraction en parfumerie, ainsi que dans les pays asiatiques[74] - [77] - [78].
En tant qu'additif à l'essence, le benzène permet d'augmenter l'indice d'octane, agissant donc comme antidétonant. De ce fait, jusque dans les années 1950, l'essence contenait fréquemment quelques pour cent de benzène, puis il fut remplacé par le tétraéthylplomb dans les additifs antidétonants les plus utilisés ; la haute toxicité et l'interdiction progressive du tétraéthylplomb (depuis la fin des années 1970 aux États-Unis) ont conduit à un retour du benzène, mais réglementée dans la plupart des pays occidentaux : aux États-Unis, la limite est de 1 %[79]. En Europe, cette limite a été abaissée de 5 %vol à 1,0 %vol le [80] - [76]. En France, son taux dans l’essence sans plomb et le gazole a été réduit en 2000 (de 5 % à 1 % en volume)[81].
Au XXIe siècle, le benzène est encore utilisé en parfumerie (comme solvant) et par les laboratoires d’analyse et de recherche (comme solvant et réactif), mais il est surtout utilisé comme intermédiaire dans la synthèse d'autres composés de la chimie organique[81]. L'éthylbenzène (précurseur du styrène et du polystyrène) représente à lui seul 51 % (en 2010) de la consommation de benzène, le cumène (précurseur de l'acétone et de différentes résines), 20 %, et le cyclohexane (précurseur du nylon), 11 %[82]. Dans de moindres proportions, il est également utilisé pour la synthèse de l'anhydride maléique, de nitrophénols, d'alkylbenzènes et de chlorobenzènes[68]. Ces intermédiaires de synthèse sont utilisés pour la production d'une large gamme de composés chimiques (polymères et caoutchoucs, solvants, plastifiants, détergents, parfums, colorants azoïques, additifs alimentaires, médicaments, pesticides, explosifs, etc.)[68].
Toxicologie, écotoxicologie, effets sur la santé

Le benzène est désormais reconnu comme :
- cancérogène ; en raison de ses propriétés d'agent intercalant, sa structure parfaitement plane lui permettant de se glisser entre les bases azotées de l'ADN, provoquant des erreurs de transcription et/ou de réplication[83] - [84] ;
- génotoxique ; notamment en raison de l’action de ses métabolites, dont en phénol, hydroquinone[85] et catéchol (métabolisé dans le foie par les cytochromes P4502E1 et CYP2F1). De plus, « les intermédiaires de transformation (aldéhyde muconique) après ouverture du noyau benzénique peuvent également donner de l’acide trans-transmuconique. Les métabolites du benzène jouent un rôle prépondérant dans l’apparition des effets toxiques et cancérogènes ». Chez l’Homme, Le benzène est clastogène[86] et aneugène[87], source d’aneuploïdie, de polyploïdie[88], de production anormale de micronoyaux t de délétions, translocations et réarrangements chromosomiques[89] - [90] et d’aberrations chromosomiques fréquentes dans la moelle osseuse des travailleurs exposés[91] - [92] - [93] (et susceptibles d’expliquer chez ces personnes un risque accru[94] de plusieurs types de leucémies[95], dont la leucémie myéloïde aiguë et les syndromes myélodysplasiques[96] - [84]). Le CIRC explique les mécanismes génotoxiques pour plusieurs types de leucémie (CIRC, 2012) : la leucémie aiguë myéloïde est par exemple provoquée par deux mécanismes majoritaires :
- Des cassures du centromère, causant des aberrations chromosomiques dites « déséquilibrées »[97] ;
- L’inhibition des topoisomérases de type II, provoquant des aberrations chromosomiques dites « équilibrées » par des translocations ou inversions de chromosomes non homologues (t(21q22), t(15 ; 17) et inv(16)).
Intoxication aigüe
L'ingestion provoque des troubles digestifs (douleurs abdominales, nausées, vomissements) et neurologiques (vertiges, ivresse, céphalées, somnolence, coma, convulsions). L'inhalation provoque les mêmes symptômes neurologiques, pouvant entraîner la mort (à titre indicatif, la mort intervient en cinq à quinze minutes d'exposition à une concentration de 2 %). En application cutanée, le benzène est irritant[98].
Intoxication chronique
L'intoxication chronique par le benzène et ses homologues (toluène, xylène et styrène essentiellement), appelée « benzolisme » ou « benzénisme »[99], est reconnue comme maladie professionnelle[100] depuis 1931. Le CIRC a classé le benzène comme cancérogène depuis 1982, et l'a intégré en 1987 dans la liste des cancérogènes de catégorie 1 (cancérogènes avérés pour l'Homme)[17]. Il est également classé cancérogène par l'Union européenne[101] et par l'Agence américaine de protection de l'environnement[102].
Les principaux effets d'une exposition chronique concernent les cellules sanguines[103] et la moelle osseuse. L'exposition prolongée au benzène provoque des hémopathies bénignes (thrombopénie, leucopénie, hyperleucocytose, anémie, polyglobulie, aplasie médullaire), puis des hémopathies malignes (syndromes myéloprolifératifs, myélomes, leucémies, lymphomes)[98] - [17]. L'exposition chronique à de faibles doses, telles que celles qu'on peut respirer à proximité d'une station-service ou d'un garage automobile, augmenterait significativement le risque de leucémie aigüe chez l'enfant[104]. Des études décrivent également des effets sur le système immunitaire : augmentation de la susceptibilité aux allergies, diminution des taux d'IgA et IgG, leucopénie[70].
Reproduction et développement
Le benzène n'a pas d'effets reconnus sur la reproduction et le développement[70], même si plusieurs études montrent une corrélation entre l'exposition au benzène de femmes enceintes et des facteurs tels que le risque de fausse couche[105], la réduction du poids à la naissance et du périmètre crânien[106].
Exposition au benzène
Sources d'exposition
Le benzène est produit lorsque des composés riches en carbone subissent une combustion incomplète. Par exemple, il est produit naturellement dans les volcans ou les feux de forêt[6]. Les principales voies d'exposition de la population au benzène sont les vapeurs d'essence, les gaz d'échappement, les émanations industrielles, la fumée de cigarette[17] ainsi que la combustion du bois[107].
La principale source d'exposition chronique au benzène est liée au milieu professionnel[78] :
- industrie pétrochimique (raffinage, transport) ;
- industrie chimique (utilisation du benzène comme réactif ou comme solvant) ;
- parfumerie (solvant) ;
- industrie électronique (dégraissant) ;
- laboratoires de chimie (solvant) ;
- garages automobiles (dégraissant et émanations de carburant) ;
- stations-service, postes de péage de parkings, d'autoroutes (émanations de carburants) ;
- bloc opératoire (fumées chirurgicales).
- gaz naturel (contamination prévalente en Californie)[108]
Afin de diminuer les émissions de composés organiques volatils, dont le benzène, au niveau des stations-service, la récupération des vapeurs d'essence lors du remplissage des réservoirs des véhicules et de la livraison d'essence des terminaux est obligatoire dans de nombreuses régions, dont l'Europe[109] et la Grande-Bretagne[110].
En France métropolitaine, les émissions de benzène ont baissé de 60 % entre 2000 et 2011 (−17 kt, milliers de tonnes). Le principal secteur émetteur de benzène dans l'atmosphère est le résidentiel/tertiaire (48,4 % des émissions totales en 2011), en particulier du fait de la combustion du bois, suivi des transports (35,6 %)[111].
Valeurs seuil, valeurs guide
En Europe, la valeur moyenne d'exposition professionnelle (VME) dans l'Union européenne est fixée par la réglementation à 1 ppm soit 3,5 mg/m3 sur huit heures. La teneur en benzène des eaux destinées à la consommation humaine ne doit pas dépasser 1 µg/L (à l'exception des eaux minérales).
En France, en milieu intérieur, les valeurs guides sont les suivantes[112] :
- VGAI court terme : 30 µg/m3 pour une exposition d'une journée à 14 jours ;
- VGAI intermédiaire : 20 µg/m3 pour une exposition de plus de deux semaines à un an ;
- VGAI long terme :
- 10 µg/m3 pour une exposition supérieure à un an,
- 0,2 µg/m3 pour une exposition vie entière correspondant à un excès de risque de 10−6,
- 2 µg/m3 pour une exposition vie entière correspondant à un excès de risque de 10−5.
Depuis 2004, l’Anses met en place une nouvelle méthode de construction des valeurs toxicologiques de référence (VTR) pour les produits reprotoxiques, puis à partir de 2009 pour les produits cancérogènes (après une phase pilote lancée en 2008 pour le benzène, le cadmium, l’éthanol, le naphtalène et le chlorure de vinyle), l'Anses a dans ce cadre réévalué les VTR cancérogènes de ces substances. L'Anses les a ensuite soumises pour validation au Comité d’experts spécialisés « Évaluation des risques liés aux substances chimiques » et s'est autosaisie le de la question des effets cancérogènes par inhalation du benzène, pour en produire un avis (Rapport d’expertise collective) consacré aux VTR du benzène inhalé[113].
Catastrophe de l'usine pétrochimique de Jilin
Le 13 novembre 2005, à la suite de l'explosion d'une usine pétrochimique dans la ville de Jilin en Chine, une quantité de benzène estimée à une centaine de tonnes s'est déversée dans la rivière Songhua, un important affluent du fleuve Amour. Cet accident a entraîné de nombreuses coupures d'eau dans les villes situées en aval, notamment Harbin[114].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « benzene » (voir la liste des auteurs) et en allemand « Benzol » (voir la liste des auteurs).
Notes
- On parle aussi de « système résonant », mais le terme a été critiqué, parce qu'il n'y a pas de fréquence de résonance : (en) Robert C. Kerber, « If it's resonance, what is resonating? », J. Chem. Educ., vol. 83, no 2, , p. 223-227 (DOI 10.1021/ed083p223)
Références
- BENZÈNE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « pKa du benzène (onglet « pKa table » puis « filter by name : benzene ») », sur pKavalues (consulté le ).
- (en) Hyp J. Dauben Jr., James D. Wilson et John L. Laity, « Diamagnetic susceptibility exaltation in hydrocarbons », J. Am. Chem. Soc., vol. 91, no 8, , p. 1991-1998 (ISSN 0002-7863, DOI 10.1021/ja01036a022).
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- (en) « Benzène » dans la base de données Hazardous Substances Data Bank, consulté le 4 octobre 2013
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- Atkins 2007, p. 187.
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40.
- (en) Irvin Glassman et Richard A. Yetter, Combustion, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-858-6).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- (en) « Benzene », sur reciprocalnet.org (consulté le ).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 [PDF], 16 décembre 2008.
- « Benzène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009.
- (en) « Benzene » [PDF], sur CIRC, (consulté le ).
- (en) « Benzene », sur Haz-Map (consulté le ).
- (en) Michael Faraday, « On New Compounds of Carbon and Hydrogen, and on Certain Other Products Obtained during the Decomposition of Oil by Heat », Philos. Trans. R. Soc., vol. 115, , p. 440–466 (lire en ligne).
- (en) R. Kaiser, « Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968 », Angew. Chem. Int. Ed., vol. 7, no 5, , p. 345–350 (ISSN 1433-7851, DOI 10.1002/anie.196803451).
- (de) E. Mitscherlich, « Ueber das Benzol und die Säuren der Oel- und Talgarten », Ann. Pharm., vol. 9, no 1, , p. 39-48 (ISSN 0365-5490, DOI 10.1002/jlac.18340090103, lire en ligne).
- Jean-Bernard Baudin, « Le benzène, de Faraday à Thiele - Quand la légende est plus belle que la réalité, on imprime la légende ! », Eduscol (consulté le ).
- Dumon 2008, p. 91.
- (de) August Wilhelm Hofmann, « Ueber eine sichere Reaction auf Benzol », Annalen der Chemie und Pharmacie, vol. 55, , p. 200–205 (lire en ligne).
- (de) Charles Blachford Mansfield, « Untersuchung des Steinkohlentheers », Annalen der Chemie und Pharmacie, vol. 69, , p. 162–180 (lire en ligne).
- (en) Alistair Grant and Elmbridge Museum, « Biographie de Charles Blachford Mansfield », sur The Elmbridge Hundred (consulté le ) : « The extraction method of benzene from coal tar, which he patented in May 1848 (no. 11,960), which was the basis for the coal tar and dyestuffs industries from which others reaped the profits. ».
- Bensaude-Vincent 2013, p. 145-146.
- (de) Johann Josef Loschmidt, Chemische Studien I : Constitutiosformeln der organischen Chemie in graphischer Darstellung, Vienne, Carl Gerold's Sohn, (lire en ligne [PDF]).
- F. A. Kekulé, « Sur la constitution des substances aromatiques », Bull. Soc. Chim. Paris, vol. 3, , p. 98–110 (ISSN 0037-8968, lire en ligne).
- (de) F. A. Kekulé, « Untersuchungen über aromatische Verbindungen Ueber die Constitution der aromatischen Verbindungen. I. Ueber die Constitution der aromatischen Verbindungen », Liebigs Ann. Chem., vol. 137, no 2, , p. 129–196 (ISSN 0075-4617, DOI 10.1002/jlac.18661370202).
- Edgar Heilbronner et Jean Jacques, Paul Havrez (1838-1875) et sa formule du benzène : Comptes rendus de l'Académie des sciences, vol. IIc 1.9, chimie, Elsevier, (ISSN 1387-1609, lire en ligne), p. 587-596.
- Henk Kubbinga, L'Histoire du concept de « molécule », vol. 3, Paris, Springer, , 1865 p. (ISBN 9782287597039, lire en ligne), p. 856-875.
- (en) Kathleen Lonsdale, « The Structure of the Benzene Ring in Hexamethylbenzene », Proc. R. Soc., vol. A, no 123, , p. 494-515.
- Dumon 2008, p. 98.
- Johnson 2002, p. 269.
- (en) Linus Pauling et George W. Wheland, « The nature of the chemical bond. V. The quantum-mechanical calculation of the resonance energy of benzene and naphthalene and the hydrocarbon free radicals », J. Chem. Phys., vol. 1, no 6, , p. 362-374 (lire en ligne).
- (en) William Henry Brown, Christopher S. Foote, Brent L. Iverson et Eric V. Anslyn, Organic Chemistry, Cengage Learning, , 5e éd., 1232 p. (ISBN 978-0-5384-9675-9, lire en ligne), p. 802.
- Atkins 2007, p. 107.
- Johnson 2002, p. 271.
- Johnson 2002, p. 270.
- Atkins 2007, p. 113.
- Jean-Pierre Mercier et Pierre Godard, Chimie organique : une initiation, PPUR, , 343 p. (ISBN 9782880744779, lire en ligne), p. 92.
- Atkins 2007, p. 125.
- (en) « Spectre IR du benzène », sur université de Clemson (consulté le ).
- « Base de données IR par fréquences et par groupes », sur université Nice Sophia Antipolis (consulté le ).
- Robert Milton Silverstein, G. Clayton Bassler et Terence C. Morrill, Identification spectrométrique de composés organiques, De Boeck Supérieur, , 420 p. (ISBN 9782804124632, lire en ligne), p. 174, 239.
- « AIST:RIO-DB Spectral Database for Organic Compounds, SDBS », sur Spectral Database for Organic Compounds, SDBS (consulté le ).
- « C-H Coupling Constants », sur chem.wisc.edu (consulté le ).
- « Proton-Proton Coupling », sur chem.wisc.edu (consulté le ).
- Arnaud 1990, p. 229.
- Jonathan Clayden, Stuart Warren et Nick Greeves (trad. André Pousse), Chimie organique, De Boeck Supérieur, , 1534 p. (ISBN 978-2-7445-0149-4, lire en ligne), p. 549-555.
- (en) G. W. Wheland, « A Quantum Mechanical Investigation of the Orientation of Substituents in Aromatic Molecules », J. Am. Chem. Soc., vol. 64, no 4, , p. 900-908 (DOI 10.1021/ja01256a047).
- Johnson 2002, p. 278.
- (en) Lyle F. Albright, Nitration, Wiley-VCH Verlag, coll. « Kirk‑Othmer Encyclopedia of Chemical Technology », .
- Johnson 2002, p. 282.
- (en) P. S. Kalsi, Organic Reactions and their Mechanisms, New Age International, (ISBN 978-81-224-1268-0, lire en ligne), p. 288-290.
- Johnson 2002, p. 279.
- Jonathan Clayden, Stuart Warren et Nick Greeves (trad. André Pousse), Chimie organique, De Boeck Supérieur, , 1534 p. (ISBN 978-2-7445-0149-4, lire en ligne), p. 569.
- Jonathan Clayden, Stuart Warren et Nick Greeves (trad. André Pousse), Chimie organique, De Boeck Supérieur, , 1534 p. (ISBN 978-2-7445-0149-4, lire en ligne), p. 573-574.
- (en) Singh, Advanced Organic Chemistry: Reactions And Mechanisms, Pearson Education India, (ISBN 978-81-317-1107-1, lire en ligne), p. 311-312.
- (en) P. S. Kalsi, Organic Reactions and their Mechanisms, New Age International, (ISBN 978-81-224-1268-0, lire en ligne), p. 290-297.
- Arnaud 1990, p. 230.
- Weissermel 2000, p. 357.
- (en) Kenneth B. Wiberg, David Y. Nakaji et Kathleen M. Morgan, « Heat of hydrogenation of a cis imine. An experimental and theoretical study », J. Am. Chem. Soc., vol. 115, no 9, , p. 3527-3532 (DOI 10.1021/ja00062a017).
- Arnaud 1990, p. 239.
- (en) William P. Keaveney, Raymond V. Rush et James J. Pappas, « Glyoxal from ozonolysis of benzene », Ind. Eng. Chem. Prod. Res. Dev., vol. 8, no 1, , p. 89-92 (DOI 10.1021/i360029a017).
- Jean-Louis Vignes, « Benzène, toluène, xylènes », Société chimique de France, (consulté le ).
- Jean-Marc Brignon, « Données technico-économiques sur le benzène » [PDF], sur INERIS, (consulté le ).
- Weissermel 2000, p. 324.
- Annick Pichard, « Données toxicologiques et environnementales sur le benzène » [PDF], sur INERIS, (consulté le ).
- Weissermel 2000, p. 330-333.
- Weissermel 2000, p. 327.
- Weissermel 2000, p. 341-342.
- Pierre L. Auger, « Benzène : est-ce encore un problème en Amérique du Nord en ce début de millénaire ? », Le Médecin du Québec, vol. 38, no 10, , p. 111-113 (lire en ligne [PDF]).
- (en) « Ludwig Roselius (1874-1943) » (consulté le ) : « The Roselius process involved the use of benzene or methylene chloride as a solvent and was used for many years to produce the Sanka brand of decaf coffee in France and the United States (today a different process is used) / Traduction : Le procédé Berzélius impliquait l'utilisation du benzène ou du dichlorométhane comme solvant, et a été utilisé pendant de nombreuses années pour produire le café décaféiné de marque Sanka en France et aux États-Unis (aujourd'hui on utilise un procédé différent) ».
- « Éléments techniques sur l'exposition professionnelle aux carburants et solvants pétroliers » [PDF], sur invs.sante.fr, Institut de veille sanitaire (consulté le ).
- (en) [vidéo] Who Pays the Price? The Human Cost of Electronics sur YouTube, (consulté le ).
- « Benzène / Données générales », sur travailler-mieux.gouv.fr (consulté le ).
- (en) Karl Kolmetz, Joseph C. Gentry et Jeff N. Gray, « Guidelines For BTX Distillation Revamps » [PDF] (consulté le ).
- « Directive 2009/30/CE du Parlement européen et du Conseil du 23 avril 2009 modifiant la directive 98/70/CE » [PDF], sur eur-lex.europa.eu, (consulté le ).
- Anses (2014), Rapport d’expertise collective Saisine « no 2009-SA-0346 » - VTR benzène, voir Tableau XVI : Exposition humaine, p. 75-, 116 p.
- (en) « Benzene », IHS, (consulté le ).
- (en) S. Scheiner et M.M. Szczesniak, « Interaction between benzene and DNA bases: a model of intercalation », Prog. Clin. Biol. Res., vol. 172, no B, , p. 53-63 (PMID 3991722).
- Centre international de recherche sur le cancer (CIRC) (2012), « Benzene. Chemical Agents and related occupations. Volume 100F. A review of human carcinogens », p. 249-294 (CIRC, Lyon), (en) « Benzene » [PDF].
- (en) Stillman W.S., Varella-Garcia M., Gruntmeir J.J. et Irons R.D., The benzene metabolite, hydroquinone, induces dose-dependent hypoploidy in a human cell line, Leukemia, 1997, 11(9):1540-5.
- (en) Gad-El-Karim M.M., Harper B.L. et Legator M.S., Modifications in the myeloclastogenic effect of benzene in mice with toluene, phenobarbital, 3-methylcholanthrene, Aroclor 1254 and SKF-525A, Mutat. Res., 1984, 135(3):225-43.
- (en) Zhang L., Rothman N., Wang Y., Hayes R.B., Li G., Dosemeci M. et al., Increased aneusomy and long arm deletion of chromosomes 5 and 7 in the lymphocytes of Chinese workers exposed to benzene, Carcinogenesis, 1998, 19(11):1955-61.
- (en) Eastmond D.A., Rupa D.S. et Hasegawa L.S., Detection of hyperdiploidy and chromosome breakage in interphase human lymphocytes following exposure to the benzene metabolite hydroquinone using multicolor fluorescence in situ hybridization with DNA probes, Mutat. Res., 1994, 322(1):9-20.
- Santé Canada (2007), Le benzène dans l'eau potable, document de consultation publique (Gouvernement du Canada, Environnement Canada, Santé et Bien-être social Canada, Ottawa).
- (en) Zhang L., Wang Y., Shang N. et Smith M.T., Benzene metabolites induce the loss and long arm deletion of chromosomes 5 and 7 in human lymphocytes, Leuk. Res., 1998, 22(2):105-13.
- (en) Zhang B. (1996), Investigation of health status in workers exposed to low-level benzene, .
- (en) Zhang L., Rothman N., Wang Y., Hayes R.B., Bechtold W., Venkatesh P. et al., Interphase cytogenetics of workers exposed to benzene, Environ. Health Perspect., 1996, 104 Suppl 6:1325-9, DOI 10.1289/ehp.961041325.
- (en) Paci E., Buiatti E., Seniori Costantini A.S., Miligi L., Pucci N., Scarpelli A. et al., Aplastic anemia, leukemia and other cancer mortality in a cohort of shoe workers exposed to benzene, Scand. J. Work Environ. Health, 1989, 15(5):313-8.
- (en) Richardson D.B., Temporal variation in the association between benzene and leukemia mortality, Environ. Health Perspect., 2008, 116(3):370-4.
- (en) Aksoy M., Erdem S. et Dincol G., Types of leukemia in chronic benzene poisoning. A study in thirty-four patients, Acta Haematol., 1976, 55(2):65-72.
- (en) Smith M.T. et Zhang L., Biomarkers of leukemia risk: benzene as a model, Environ. Health Perspect., 1998, 106 Suppl 4:937-46.
- Perte de parties de chromosomes sur le bras long ou de la totalité d’un chromosome (5q–/–5 ou 7q–/–7).
- « Benzène - Fiche toxicologique no 49 », sur inrs.fr, (consulté le ).
- « benzolisme », sur fracademic.com (consulté le ) : « n. m. ; 1938, de benzol ; benzolisme ou benzénisme. Intoxication chronique due au benzol ou à ses constituants (benzène, toluène, xylène), ainsi qu'aux essences de pétrole ».
- Tableaux de référence sur le site de l'INRS : Régime général Tableau 4 - Hémopathies provoquées par le benzène et tous les produits en renfermant et Régime agricole Tableau 19 - Hémopathies provoquées par le benzène et tous les produits en renfermant, Régime général Tableau 4BIS - Affections gastro-intestinales provoquées par le benzène, le toluène, les xylènes et tous les produits en renfermant et Régime agricole Tableau 19BIS - Affections gastro-intestinales et neurologiques provoquées par le benzène, le toluène, les xylènes et tous les produits en renfermant.
- « Règlement (CE) no 1272/2008 du Parlement européen et du Conseil » [PDF], sur eur-lex.europa.eu, (consulté le ).
- (en) « Fiche Benzène de la base de données IRIS (Integrated Risk Information System) », sur EPA (consulté le ).
- (en) Rinsky R.A., Hornung R.W., Silver S.R. et Tseng C.Y., Benzene exposure and hematopoietic mortality: A long-term epidemiologic risk assessment, Am. J. Ind. Med., 2002, 42(6):474-80.
- (en) P. Brosselin, « Acute childhood leukaemia and residence next to petrol stations and automotive repair garages: the ESCALE study (SFCE) », Occup. Environ. Med., vol. 66, no 9, , p. 598-606 (DOI 10.1136/oem.2008.042432).
- (en) X. Xu, « Association of petrochemical exposure with spontaneous abortion », Occup. Environ. Med., vol. 55, no 1, , p. 31-36 (PMID 9536160).
- (en) Rémy Slama, « Maternal personal exposure to airborne benzene and intrauterine growth », Environmental Health Perspectives, vol. 117, no 8, , p. 1313-21 (PMID 19672414).
- « Évaluation de l'impact des appareils de chauffage domestique à bois sur la qualité de l'air intérieur et extérieur » [PDF], sur INERIS, (consulté le ).
- (en) Elena Shao, « Researchers Find Benzene and Other Dangers in Gas Piped to California Homes », sur New York Times, (consulté le )
- « Directive 2009/126/CE du Parlement européen et du Conseil du 21 octobre 2009 », sur EUR-Lex, l'accès au droit de l'Union européenne (consulté le ), traduite dans la loi française par l'« arrêté du 15 avril 2010 », sur Légifrance (consulté le ).
- (en) « Petrol Vapour Recovery Stage I and Stage II Directives », sur Department for Environment, Food & Rural Affairs, (consulté le ).
- « Inventaire des émissions de polluants atmosphériques et de gaz à effet de serre en France » [PDF], sur Citepa, (consulté le ).
- « Avis de l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail relatif à une demande d'avis sur un projet de décret relatif aux valeurs guides pour l'air intérieur pour le formaldéhyde et le benzène » [PDF], sur Anses, (consulté le ).
- Valeur toxicologique de référence cancérogène par inhalation pour le benzène [PDF] ; avis de l’Anses (rapport d’expertise collective), juillet 2014, 116 p.
- Brice Pedroletti, « Catastrophe écologique en Chine du Nord », Le Monde, (lire en ligne).
Voir aussi
Bibliographie
- Bernadette Bensaude-Vincent et Isabelle Stengers, Histoire de la chimie, Paris, La Découverte, , 499 p. (ISBN 978-2-707-17254-9, lire en ligne), p. 145-146.
- Alain Dumon et Robert Luft, Naissance de la chimie structurale, EDP Sciences, coll. « Sciences et Histoire », , 252 p. (ISBN 978-2-759-80349-1, lire en ligne), p. 91-101 et 125-126.
- Klaus Weissermel et Hans-Jürgen Arpe, Chimie organique industrielle, De Boeck Université, , 453 p. (ISBN 2-744-50073-9, lire en ligne), p. 323-394.
- Peter William Atkins et Loretta Jones, Principes de chimie, De Boeck Université, , 787 p. (ISBN 978-2-804-15508-7, lire en ligne).
- A. William Johnson, Invitation à la chimie organique, De Boeck, , 784 p. (ISBN 978-2-744-50138-8, lire en ligne), p. 257-310.
- Paul Arnaud, Cours de chimie organique, Éditions Dunod, , 522 p. (ISBN 978-2-040-19716-2), p. 227-246.
Symboles Unicode
En Unicode, les symboles sont :
- U+232C
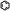 anneau de benzène (HTML :
anneau de benzène (HTML : ⌬) ⌬ ; - U+23E3
 anneau de benzène avec cercle (HTML :
anneau de benzène avec cercle (HTML : ⏣) ⏣.
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- (en) Medical Subject Headings
- (en) National Drug File
- (no + nn + nb) Store medisinske leksikon
- Notices dans des dictionnaires ou encyclopédies généralistes :