Dibrome
Le dibrome (Br2) est une molécule composée de deux atomes de brome. C'est l'unique forme moléculaire (allotrope) de l'élément brome.
| Dibrome | ||

| ||
| Dibrome | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| No ECHA | 100.028.890 | |
| No CE | 231-778-1 | |
| Apparence | liquide fumant, rouge à brun, d'odeur âcre[1] | |
| Propriétés chimiques | ||
| Formule | Br2 [Isomères] |
|
| Masse molaire[2] | 159,808 ± 0,002 g/mol Br 100 %, |
|
| Propriétés physiques | ||
| T° fusion | −7,2 °C[1] | |
| T° ébullition | 58,8 °C[1] | |
| Solubilité | dans l'eau à 20 °C : 31 g·l-1[1] | |
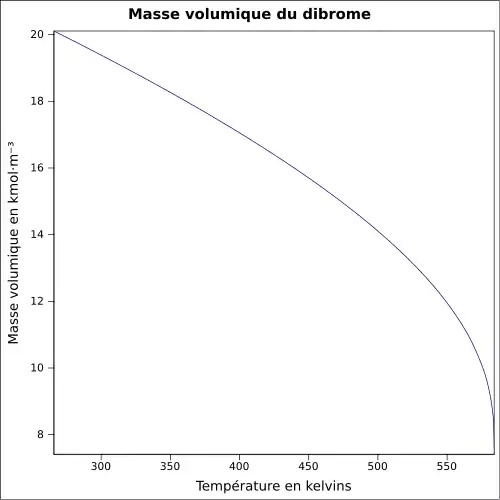
| Masse volumique | 3,1 g·ml-1[1]
|
|
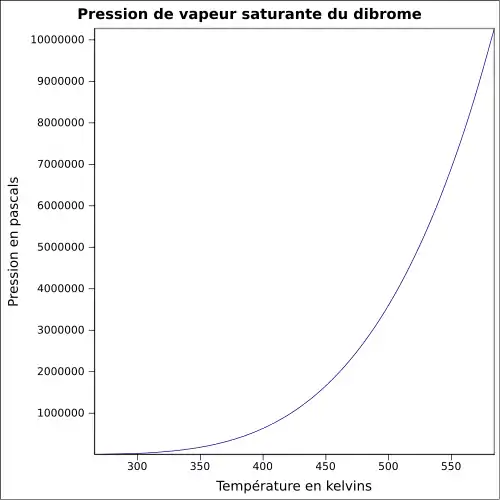
| Pression de vapeur saturante | à 20 °C : 23,3 kPa[1]
|
|
| Viscosité dynamique | viscosité cinématique à 20 °C : 0,314 mm2·s-1 |
|
| Point critique | 103,0 bar, 314,85 °C[4] | |
| Thermochimie | ||
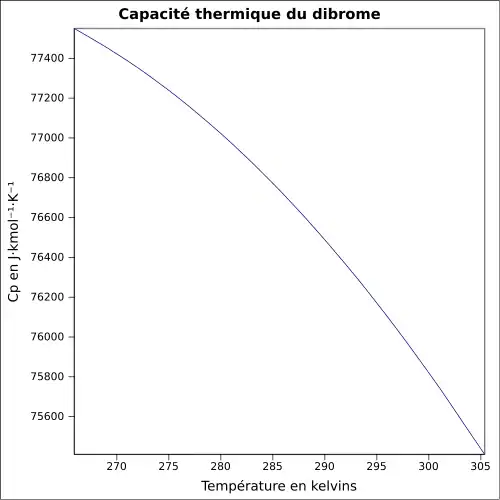
| Cp | ||
| Cristallographie | ||
| Symbole de Pearson | [5] | |
| Classe cristalline ou groupe d’espace | Cmca (no 64)[5] | |
| Strukturbericht | A14[5] | |
| Structure type | I2[5] | |
| Précautions | ||
| SGH[6] | ||
   Danger |
||
| SIMDUT[7] | ||
  D1A, E, |
||
| NFPA 704 | ||
| Transport | ||
| Écotoxicologie | ||
| Seuil de l’odorat | bas : 0,009 9 ppm haut : 0,46 ppm[9] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Le dibrome est un liquide rouge très volatil. Il est très toxique par inhalation et provoque de graves brûlures. Les vapeurs attaquent les muqueuses, la peau et le système respiratoire. Sa solution aqueuse s'appelle « l'eau de brome », qui est beaucoup moins nocive.
Propriété oxydante
Le dibrome a un pouvoir oxydant élevé : E°(Br2/Br−) = 1,07 V.
Ainsi, l'eau de brome permet de mettre en évidence la présence d'une double liaison (voir Test au dibrome) en l'oxydant.
Précautions
Du fait de son fort pouvoir oxydant, et parce qu'il est extrêmement volatil, le dibrome dégage des vapeurs toxiques, suffocantes et rougeâtres.
Au contact de la peau, il engendre des plaies qui cicatrisent très lentement.
Le dibrome est détruit par une solution de thiosulfate de sodium.
Références
- BROME, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- « The Molecular Iodine (I2) Crystal Structure (A14) », sur cst-www.nrl.navy.mil (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- « Brome » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Entrée du numéro CAS « 7726-95-6 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript nécessaire)
- « Bromine », sur hazmap.nlm.nih.gov (consulté le )
Liens externes
- Fiche toxicologique, sur le site de l'INRS, 2006