Thiosulfate de sodium
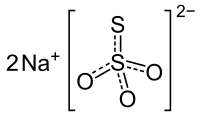
Le thiosulfate de sodium (appelé anciennement hyposulfite de sodium) est un composé inorganique de formule Na2S2O3. C'est le sel de sodium de l'acide thiosulfurique H2S2O3, instable en milieu aqueux. Les utilisations du thiosulfate de sodium sont nombreuses, notamment comme agent fixateur ou pour neutraliser l'effet de biocides tels que le dichlore, le diiode ou le dibrome et d'autres oxydants. La solubilité dans l'eau du sel pentahydraté (forme commerciale usuelle) est élevée (voir encadré ci-contre) et sa dissolution est endothermique.
| Thiosulfate de sodium | |
| |
| Identification | |
|---|---|
| No CAS | (anhydre) (pentahydrate) |
| No ECHA | 100.028.970 |
| No CE | 231-867-5 |
| No E | E539 |
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule | Na2S2O3 |
| Masse molaire[1] | 158,108 ± 0,011 g/mol Na 29,08 %, O 30,36 %, S 40,56 %, 248,2 g/mol (pentahydrate) |
| Propriétés physiques | |
| T° fusion | 48,5 °C[2] |
| Solubilité | 501 g l−1 à 0 °C 701 g l−1 à 20 °C 2 450 g l−1 à 80 °C |
| Masse volumique | 1,667 × 103 kg/m3 (solide) |
| Précautions | |
| SGH | |
 |
|
| SIMDUT[3] | |
Produit non contrôlé |
|
| Directive 67/548/EEC[4] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Histoire
En 1819, John Herschel découvre que l'on peut fixer des images photographiques par un bain dans de l’hyposulfite de soude.
Lors de la Première Guerre mondiale, des compresses ou capuches de tissus imbibés de ce produit ont servi à neutraliser les premiers gaz de combat, dont le dichlore, la difficulté étant de se procurer dans les tranchées des quantités suffisantes de ce produit. Dans le livre il était minuit cinq a bopal, le thiosulfate sert d'antidote contre les intoxications au cyanure d'hydrogène.
Structure
D'après Greenwood et Earnshaw[5], la longueur des trois liaisons S-O est égale à 147 pm ; celle-ci est un peu plus longue que dans SO2, (143,1 pm), ce qui est en accord avec le fait que, dans l'ion thiosulfate, la liaison S-O est intermédiaire entre une liaison double (comme dans SO2) et simple.
La longueur de la liaison S-S est 201 pm ; celle-ci est inférieure à la longueur de la liaison simple S-S dans S8 qui est 206,0 pm. Comme précédemment, cette donnée est en accord avec le caractère intermédiaire entre une liaison simple et une liaison double.
Le diamètre effectif de l'ion hydraté en solution aqueuse et 4 × 10−8 cm[6].
L'ion thiosulfate possède une forme tétraédrique. Il dérive formellement de l'ion sulfate par remplacement d'un O par un S. Il fait partie de la grande famille des oxoanions du soufre avec les ions sulfite, disulfite, dithionite, peroxodisulfate, disulfate, dithionate, et polythionate[7]. Les deux valences de l'élément chimique de l’ion S2O32− sont différentes. Suivant la forme de résonance, les degrés d’oxydation du soufre sont 0 et IV, ou –I et V.
Propriétés
L'ion thiosulfate possède des propriétés d'oxydoréduction, acido-basique et de ligand. La solvatation du thiosulfate de sodium dans l'eau provoque une réaction endothermique, ce qui signifie que la température du solvant diminue.
Propriétés d'oxydoréduction
Les propriétés rédox des ions thiosulfate sont assez complexes du fait de la grande variété d'oxoanions du soufre. Par exemple, les réactions de cet ion avec un dihalogène ne sont pas généralisables à tous les dihalogènes. Cependant, les oxydants forts ont tendance à oxyder l'ion thiosulfate en sulfate, tandis que les oxydants plus doux l'oxydent en tétrathionate[8].
Les potentiels de références de quelques couples sont[9] :
- H2SO3 / S2O32− : E° = 0,40 V ;
- SO32− / S2O32− : E° = 0,571 V ;
- S2O32− / S : E° = 0,5 V ;
- S4O62− / S2O32− : E° = 0,08 V.
Réaction avec I2
Le potentiel de référence du couple S4O62− / S2O32− est E° = 0,09 V/ENH. C'est une valeur intermédiaire dans l'échelle des potentiels. L'utilisation la plus courante de ce couple est avec le diiode. Le potentiel du couple I2 / I− vaut 0,54 V/ENH. Il permet la réaction d'équation :
- 2 S2O32− + I2 → S4O62− + 2 I−.
L'ion tétrathionate S4O62− qui se forme résulte de la formation d'un pont disulfure -S-S- entre deux ions thiosulfate. Cette observation témoigne d'une oxydation très douce, avec un seul électron échangé par ion thiosulfate, à la différence de ce qui se passe avec le dichlore (voir ci-dessous).
Cette réaction est rapide et sans réaction concurrente. Elle sert de réaction de base aux titrages iodométriques.
Réaction avec Cl2
Le dichlore Cl2 étant plus oxydant que le diiode I2, la réaction avec les ions thiosulfate est différente. Il se forme du soufre au degré d'oxydation VI sous la forme d'ions hydrogénosulfate HSO4− :
- S2O32− + 4 Cl2 + 5 H2O → 2 HSO4− + 8 Cl− + 8 H+.
Pas moins de 8 électrons sont échangés par ion thiosulfate (au lieu de 1 avec le diiode).
Cette réaction est utilisée pour éliminer les traces de dichlore après le blanchiment du linge.
Réaction avec Br2
La réaction du dibrome avec les ions thiosulfate donne à la fois l'ion tétrathionate (comme avec le diiode) et l'ion hydrogénosulfate (comme avec le dichlore). Cette observation est en accord avec le potentiel rédox intermédiaire de ce dihalogène.
Réaction de dismutation
En milieu acide, l'ion thiosulfate, sous forme d'acide thiosulfurique H2S2O3, se dismute. Parmi les produits de la réaction se trouvent[5] :
- du soufre, sous la forme habituelle cyclo-S8 mais aussi cyclo-S6 ;
- du dioxyde de soufre SO2 ;
- du sulfure d'hydrogène H2S ;
- la forme acide de l'ion polysulfure H2Sn ;
- et de l'acide sulfurique H2SO4.
La réaction est donc plus compliquée que l'équation usuellement écrite :
- H2S2O3 → S + SO2 + H2O.
Réalisation expérimentale
La dismutation se montre en acidifiant, par exemple avec de l'acide chlorhydrique, une solution de thiosulfate de sodium. Suivant la concentration de ces deux réactifs (couramment entre 0,01 M et 0,1 M), le milieu réactionnel se trouble plus ou moins rapidement (quelques minutes à quelques secondes). Ce trouble est du soufre colloïdal.
En conséquence, les réactions utilisant les ions thiosulfate, comme les titrages iodométriques, ne doivent pas être réalisées en milieu acide.
Propriété acidobasique
L'ion thiosulfate est la base conjuguée de l'acide thiosulfurique H2S2O3. Ce dernier se dismutant en solution aqueuse, même à 0 °C, ne peut être préparé de cette manière.
En absence d'eau, celui-ci est plus stable. Une autre réaction de décomposition intervient cependant :
- H2S2O3 → SO3 + H2S.
C'est formellement la même réaction que la décomposition de l'acide sulfurique :
- H2SO4 → SO3 + H2O.
Les pKA de l'acide thiosulfurique sont 0,6 et 1,7[10].
Propriété de ligand
L'ion thiosulfate est également un ligand de cations métalliques. Par exemple, la réaction de complexation des ions argent Ag+ s'écrit[5] :
- Ag+ + 2 S2O32− → Ag(S2O3)23−.
La constante de stabilité (en) de ce complexe est telle qu'elle permet la redissolution du bromure d'argent peu soluble AgBr. Cette réaction est utilisée dans le procédé de fixation des photos argentiques.
Quelques constantes de complexation ont été déterminées[11] :
- pour les complexes constitués d'un cation métallique et d'un seul ligand thiosulfato, le logarithme de la constante de complexation (log ß1) vaut :
| Complexe | log ß1 |
|---|---|
| Ba(S2O3) | 2,33 |
| Ca(S2O3) | 1,91 |
| Cd(S2O3) | 3,94 |
| Co(S2O3) | 3,05 |
| Fe(II)(S2O3) | 0,9 |
| Fe(III)(S2O3)+ | 2,1 |
| Mg(S2O3) | 1,79 |
| Mn(S2O3) | 1,95 |
| Ni(S2O3) | 2,06 |
| Pb(S2O3) | 5,1 |
| (Sr(S2O3) | 2,04 |
| Tl(S2O3)− | 1,9 |
| Zn(S2O3) | 2,29 |
- pour les complexes constitués d'un cation métallique et de deux ligands thiosulfato, les logarithmes des constantes de complexation (log ß1) et (log ß2) valent respectivement :
| Complexe | log ß1 | log ß2 |
|---|---|---|
| Ag(S2O3)− | 8,82 | |
| Ag(S2O3)23− | 13,5 | |
| Hg(S2O3) | 29, 86 | |
| Hg(S2O3)22− | 32,26 |
- pour les complexes constitués d'un cation métallique et de trois ligands thiosulfato, les logarithmes des constantes de complexation (log ß1), (log ß2) et (log ß1), valent respectivement :
| Complexe | log ß1 | log ß2 |
|---|---|---|
| Cu(I)(S2O3)− | 10,3 | |
| Cu(I)(S2O3)23− | 12,2 | |
| Cu(I)(S2O3)35− | 13,8 |
Usages
Le thiosulfate de sodium est utilisé comme agent fixateur ou pour neutraliser l'effet de biocides tels que le dichlore, le diiode ou le dibrome et d'autres oxydants. Il est également utilisé en photographie pour la réalisation de bains de fixateur et dans les laboratoires pour titrer l'eau de Javel. Il est également utilisé pour l'extraction de l'or (procédé par lixiviation en tas), l'usage de thiosulfate de sodium étant bien moins agressif pour le milieu naturel que le procédé utilisant le mercure.
Le thiosulfate de sodium est également un antidote de l'intoxication au cyanure. Il permet en effet sa métabolisation en thiocyanate. L'antidote est constitué (outre de thiosulfate de sodium), de nitrite d'amyle et de nitrite de sodium. Il a un effet autoprotecteur, en particulier dans le cas d'utilisation du cisplatine[12].
Il fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[13].
Risques et dangers
Il se décompose sous l'action de la chaleur à partir de 45 °C et peut réagir vivement en présence de nitrites et peroxydes (risque d'explosion). En présence d'acides, il peut y avoir formation d'oxydes de soufre dangereux[14].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Sodium thiosulfate », sur nih.gov (consulté le ).
- « Thiosulfate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Fiche sécurité
- Greenwood N. et Earnshaw A. (2003). Chemistry of the elements, Elsevier. p. 714
- Bernard M. et Busnot F. Usuel de chimie générale et minérale. Dunod, Paris, 1996, p. 161
- (en) « Polythionate - Wiktionary », sur wiktionary.org (consulté le ).
- C. Chaussin, Travaux pratiques de chimie analytique minérale, Paris, Dunod, , 174 p.
- Bernard M. et Busnot F. Usuel de chimie générale et minérale. Dunod, Paris, 1996, p. 195
- Bernard M. et Busnot F., Usuel de chimie générale et minérale. Dunod, Paris, 1996, p. 175
- Bernard M. et Busnot F., Usuel de chimie générale et minérale. Dunod, Paris, 1996, p. 210
- Brock PR, Maibach R, Childs M et al. Sodium thiosulfate for protection from cisplatin-induced hearing loss, N Engl J Med, 2018;378:2376-2385
- WHO Model List of Essential Medicines, 18th list, avril 2013
- Fiche sécurité