Nitrite
L'ion nitrite est la base conjuguée de l'acide nitreux. L'acide nitreux est un acide faible instable de formule HNO2. La formule de l'ion nitrite est NO2−.
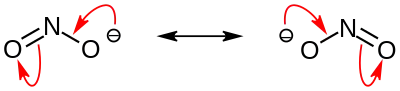
Confusions possibles
Il ne faut pas confondre l'ion nitrite avec le dioxyde d'azote NO2 auquel il ressemble beaucoup par la structure chimique, mais qui est une molécule, et donc de charge électrique neutre[1].
Toxicité
Dans les cours d'eau, notamment canalisés, et dans les régions densément habitées ou d'agriculture intensive, les nitrites (ou bien les nitrates) sont souvent une source de pollution.
Chez l'humain et autres mammifères, la présence de nitrites dans le sang empêche l'hémoglobine de fixer convenablement l'oxygène. C'est l'une des causes de la « maladie bleue du nourrisson », plus savamment appelée « méthémoglobinémie » . En , trois enfants en sont morts en Chine[2].
C'est pourquoi la teneur en nitrites dans l'eau potable est réglementée (notamment pour la préparation des biberons) et, indirectement celle des nitrates en raison de leur capacité à se transformer en nitrites.
Le nitrite est un conservateur des viandes transformées très utilisé par l'industrie agroalimentaire[3]. Il est classé cancérigène probable par le CIRC. En milieu acide, comme c'est le cas dans l'estomac, les nitrites, très présents dans la charcuterie comme additifs, provoquent la formation de deux produits cancérogènes avérés[4] : d'une part du fer nitrosylé (en réagissant avec le fer héminique)[5], d'autre part, des nitrosamines (en réagissant avec les amines secondaires). Ces molécules, appelées « composés nitrosés » (en anglais : nitroso-compounds) sont cancérogènes[6], notamment impliquées dans l'apparition du cancer colorectal[7] - [8]. Une étude sur une cohorte de plus de 100 000 adultes suggère également une association entre la consommation de nitrites (notamment présents dans la charcuterie) et un risque accru de diabète de type 2[9].
Hème nitrosylé
Dans la chair nitrée, l'oxyde nitrique NO, issu de la décomposition du nitrite, se fixe à la myoglobine Fe2+ et forme la nitroso-myoglobine NO-Mb. Lorsque cette chair nitritée est soumise à la chaleur, la nitroso-myoglobine se transforme, son pigment nitré (l'hème nitrosylé, appelé aussi « nitrosohème » ou « fer nitrosylé », de couleur rouge foncé) se métamorphose et donne naissance à un nouveau pigment, appelé « nitrosylhémochrome », de couleur rose[10]. La salaison donne ainsi une nouvelle teinte qui ne ressemble pas exactement à la couleur de la viande fraîche (c'est un rose framboisé qui n'a guère d'équivalent) mais correspond au ton vif attendu par le consommateur[11].
Les données épidémiologiques indiquent une association positive entre consommation de fer héminique et cancer colorectal[12]. L’hème catalyse deux types de réaction : la lipoperoxydation et la formation de composés N-nitrosés. De plus, l’hème peut avoir un effet direct sur les cellules de la muqueuse.
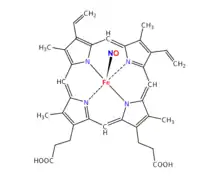
Dans les charcuteries nitritées, contrairement à la viande rouge, l’hème est sous forme nitrosylé en raison de l’ajout de nitrites qui se retrouvent principalement sous forme d’ions nitrite NO2−. Les réactions produites lors de la fabrication de la charcuterie peuvent modifier la molécule d'hème vers la forme appelée « nitrosylée », qui permet à son tour la formation d'agents cancérigènes, comme les peroxydes[13].
Les réactions de nitrosylation conduisent à la formation de S-nitrosothiols ou de fer nitrosylé FeNO à la suite de l’ajout d’un ion nitrosyl NO− sur des métaux ou des groupes thiol. Les nitrites, utilisés sous forme d’acide nitreux, favorisent ce type de réaction et conduisent à la formation d’oxyde d’azote et d’hème nitrosylé[14] - [15].
Propriétés
L’ion nitrite a un comportement très différent de l'ion nitrate, en particulier, il se lie aux métaux. Les nitrites alcalins sont solubles dans l'eau et hygroscopiques.
Exemples de nitrites :
- nitrite de sodium NaNO2 ;
- nitrite de calcium Ca(NO2)2 ;
- nitrite de potassium KNO2.
Obtention
Les nitrites alcalins sont obtenus par décomposition des nitrates correspondants vers 1 200 °C.
On les prépare actuellement par synthèse lors de la production de l’acide nitrique.
Utilisations
- Conservation de la viande.
- Agriculture : la bactérie Nitrosomonas convertit l'ammoniac des plantes, résultant de l'azote, en nitrite puis Nitrobacter transforme le nitrite en nitrate absorbé par les racines.
- Transformation d'amines en sels de diazonium, base de l'industrie des colorants organiques.
Voir aussi
Articles connexes
Liens externes
- Anses, « Information sur l’expertise relative aux risques associés à la consommation de nitrites et de nitrates », 6 décembre 2021.
- Afssa, « Fiche 19 : Évaluation des risques sanitaires liés au dépassement des limites de qualité des nitrates et des nitrites dans les eaux destinées à la consommation humaine » [PDF], Saisine no 2004-SA-0067.
- Assemblée nationale, « Rapport d'information sur les sels nitrités dans l'industrie agroalimentaire », 13 janvier 2021.
- Que Choisir, « Sels nitrités - Les recettes indigestes des charcutiers », 3 décembre 2020.
- Académie d'agriculture de France, « Nitrite - Fiche no 08.02.Q04 - Évaluation du risque des additifs autorisés en charcuterie ».
Bibliographie
- Guillaume Coudray, Cochonneries, comment la charcuterie est devenue un poison ?, Paris, La Découverte, , 320 p. (ISBN 978-2707193582)[16].
Notes et références
- Différence entre le nitrite et le dioxyde d'azote
- 3 enfants morts en Chine, sur lemonde.fr.
- « Blog - Si l'utilisation de nitrites séduit l'industrie de la charcuterie, elle représente un vrai danger pour le consommateur », sur Le Huffington Post, (consulté le ).
- « Axel Kahn : Les nitrites provoquent la formation dans l'estomac de deux produits cancérigènes avérés », sur Dailymotion (consulté le ).
- Raphaëlle L. Santarelli, Jean-Luc Vendeuvre, Nathalie Naud et Sylviane Taché, « Meat processing and colon carcinogenesis: cooked, nitrite-treated, and oxidized high-heme cured meat promotes mucin-depleted foci in rats », Cancer Prevention Research (Philadelphia, Pa.), vol. 3, no 7, , p. 852–864 (ISSN 1940-6215, PMID 20530708, PMCID 2931773, DOI 10.1158/1940-6207.CAPR-09-0160, lire en ligne, consulté le ).
- Centre de référence sur la nutrition de l'Université de Montréal : les nitrates et les nitrites.
- William Crowe, Christopher T. Elliott et Brian D. Green, « A Review of the In Vivo Evidence Investigating the Role of Nitrite Exposure from Processed Meat Consumption in the Development of Colorectal Cancer », Nutrients, vol. 11, no 11, (ISSN 2072-6643, PMID 31694233, PMCID 6893523, DOI 10.3390/nu11112673, lire en ligne, consulté le ).
- « Charcuterie – Comment se passer des nitrites », sur quechoisir.org (consulté le ).
- #, « L’exposition alimentaire aux nitrites associée à un risque accru de diabète de type 2 », sur Salle de presse | Inserm, (consulté le )
- En revanche, la coloration des produits carnés séchés ou fermentés est due au protoporphyrine zinc.
- Guillaume Coudray, Cochonneries. Comment la charcuterie est devenue un poison, La Découverte, , p. 23.
- Océane Martin, Promotion de la cancérogène colorectale par le fer héminique des viandes : Prévention nutritionnelle, rôle du microbiote et de l'inflammation, Toulouse, universite de Toulouse INPT, , 214 p. (lire en ligne).
- « Charcuterie et cancer colorectal », sur futura-sciences.com, .
- Auréline Malric, Viandes et cancérogenèse colorectale chez le Rat chimio-induit et la Souris Min : effet de l’hème (thèse ENVT), (lire en ligne).
- « Cancers et alimentation », sur axelkahn.fr, (consulté le ).
- Marc-Olivier Déplaude, « Aux origines des charcuteries industrielles », sur Transhumances (consulté le ).