Myoglobine
La myoglobine, couramment symbolisée par Mb, est une métalloprotéine contenant du fer présente dans les muscles des vertébrés, et particulièrement des mammifères. Elle est apparentée structurellement à l'hémoglobine, mais a pour fonction de stocker l'oxygène O2 plutôt que de le transporter. Comme l'hémoglobine, elle utilise l'hème comme groupe prosthétique, et est donc une hémoprotéine ; contrairement à l'hémoglobine, en revanche, la myoglobine est une protéine monomérique, c'est-à-dire qu'elle n'est formée que d'une seule sous-unité globine. Elle ne possède donc qu'un seul site de liaison au dioxygène par molécule, et ne présente pas d'effet coopératif par allostérie.
| Myoglobine | ||
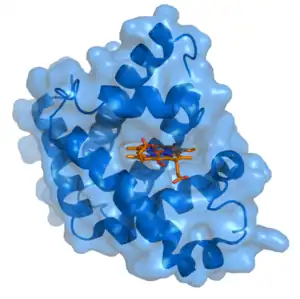 Myoglobine de grand cachalot avec hème en rouge (PDB 1MBO) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | MB | |
| Homo sapiens | ||
| Locus | 22q12.3 | |
| Masse moléculaire | 17 184 Da[1] | |
| Nombre de résidus | 154 acides aminés[1] | |
| Entrez | 4151 | |
| HUGO | 6915 | |
| OMIM | 160000 | |
| UniProt | P02144 | |
| RefSeq (ARNm) | NM_005368.2, NM_203377.1, NM_203378.1, XM_005261605.2 | |
| RefSeq (protéine) | NP_005359.1, NP_976311.1, NP_976312.1, XP_005261662.1 | |
| Ensembl | ENSG00000198125 | |
| PDB | 3RGK | |
|
GENATLAS • GeneTests • GoPubmed • HCOP • H-InvDB • Treefam • Vega | ||
| Liens accessibles depuis GeneCards et HUGO. | ||
La myoglobine est le principal pigment de liaison à l'oxygène dans le muscle[2]. Une concentration plus élevée en myoglobine dans les myocytes permet aux vertébrés de retenir leur respiration plus longtemps : les muscles des mammifères marins comme les baleines et les pinnipèdes sont ainsi particulièrement riches en myoglobine, ceux des cétacés pouvant ainsi contenir jusqu'à près de 6 g de myoglobine pour 100 g de muscle[3], c'est-à-dire dix fois plus que chez l'homme. D'une manière générale, la myoglobine est présente dans le myocarde et les muscles striés squelettiques, mais la plupart des sources considèrent que les muscles lisses en sont dépourvus. Chez l'homme, sa présence dans le sang est anormale et résulte d'une lésion musculaire accompagnée de destruction des myocytes, ou rhabdomyolyse ; elle peut d'ailleurs être significative dans certains cas pour aider au diagnostic.
La myoglobine présente une affinité pour l'oxygène très supérieure à celle de l'hémoglobine : mesurée par la p50, c'est-à-dire la pression partielle d'oxygène à laquelle la moitié des sites de liaison à l'oxygène sont occupés, celle de la myoglobine vaut typiquement 130 Pa, contre environ 3,5 kPa pour l'hémoglobine. La myoglobine peut ainsi emmagasiner l'oxygène apporté par l'hémoglobine de la circulation sanguine. De même que l'hémoglobine peut prendre les formes oxyhémoglobine HbO2, carboxyhémoglobine HbCO et méthémoglobine mét-Hb, la myoglobine peut prendre les formes oxymyoglobine MbO2, carboxymyoglobine MbCO et métmyoglobine mét-Mb.
La myoglobine est apparentée aux cytoglobines, qui sont des globines ubiquitaires dans le cytoplasme des cellules[4], où elles assurent le stockage de l'oxygène. La myoglobine est la première protéine dont la structure tridimensionnelle a été élucidée par cristallographie aux rayons X ; ce résultat a été publié en 1958 par John Kendrew et al.[5], qui partagea en 1962 le prix Nobel de chimie avec Max Perutz[6]. Chez l'homme, la myoglobine est une protéine de 154 résidus d'acides aminés et 17,2 kDa, codée par le gène MB, situé sur le chromosome 22[7]. Bien que la myoglobine soit l'une des protéines les plus étudiées en biologie, sa fonction physiologique n'est toujours pas pleinement comprise : ainsi, la myoglobine n'est pas indispensable à la vie des mammifères, comme l'illustrent les souris dépourvues de myoglobine, qui sont viables bien qu'elles présentent une réduction de 30 % du volume de sang pompé par le cœur à chaque contraction ; elles compensent cette déficience par les réactions naturelles observées en cas d'hypoxie, notamment la vasodilatation[8].
Structure et fonctionnement
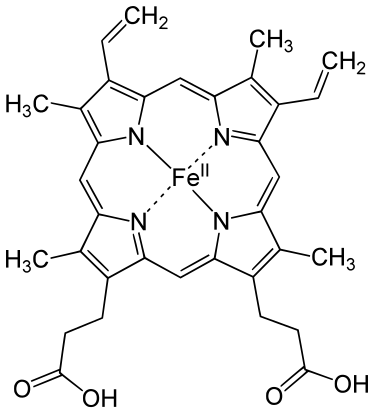
Chez l'homme, la structure primaire de la myoglobine comprend une seule chaîne polypeptidique qui compte 154 résidus, pour une masse moléculaire de 17,2 kDa. Sa structure secondaire comprend huit hélices α, lesquelles regroupent les trois quarts des résidus d'acides aminés de la protéine. Sa structure tertiaire est celle d'une globine utilisant l'hème b comme groupe prosthétique.
Chaque molécule de myoglobine contient une molécule d'hème b. Il s'agit d'une protoporphyrine IX complexée avec un cation de fer ferreux Fe2+, lequel est hexavalent et engage quatre liaisons avec quatre atomes d'azote de l'hème, une cinquième liaison avec un atome d'azote de la chaîne latérale d'un résidu d'histidine de l'hélice F, dite histidine proximale (résidu His94), tandis que la sixième position de coordination est laissée vacante pour recevoir la molécule d'oxygène. Un résidu d'histidine de l'hélice E, dite histidine distale (résidu His65), introduit un encombrement stérique dans le site de liaison à l'oxygène qui empêche le ligand de la sixième position de coordination de se lier à l'hème de manière orthogonale. Ceci convient bien à l'oxygène, qui se lie au cation de fer en formant un angle de 120° avec le plan de l'hème, angle qui permet également l'établissement d'une liaison hydrogène entre la molécule d'oxygène et l'histidine distale. En revanche, le monoxyde de carbone tend à se lier à l'hème de manière orthogonale : la présence de l'histidine distale, qui empêche stériquement l'établissement de cette interaction orthogonale, a pour effet de réduire de deux ordres de grandeur l'affinité de la myoglobine pour le monoxyde de carbone, laquelle demeure malgré tout très supérieure — près de 250 fois — à celle de la myoglobine pour l'oxygène.
Le cation ferreux Fe2+ de la désoxymyoglobine est situé à 30 pm du plan de l'hème, mais la liaison de l'oxygène de l'autre côté le ramène à seulement 10 pm de ce plan, induisant une traction sur l'histidine proximale, qui se transmet à toute la molécule en provoquant une modification conformationnelle de la protéine. Dans certaines circonstances, le fer ferreux peut être oxydé en fer ferrique Fe3+ pour former de la métmyoglobine, ce qui inhibe la fonction de stockage de l'oxygène de cette protéine.
Myoglobine et colorations de la viande rouge


L'abondance de la myoglobine dans les muscles des mammifères est responsable de la couleur rouge de leur viande, par opposition à la couleur pâle des viandes blanches (essentiellement volailles et porc) et de la chair des poissons. La viande rouge est généralement plus riche en fibres musculaires fines destinées à fonctionner en continu sans périodes de repos (comme le muscle cardiaque) tandis que la viande blanche est généralement plus riche en fibres musculaires épaisses destinées à fonctionner de manière intense sur une période de temps plus limitée (comme les muscles pectoraux des oiseaux, par exemple le blanc de poulet).
La viande rouge présente différentes teintes selon son état de cuisson et de conservation. Ces variations de couleur s'expliquent par des changements d'état de la myoglobine présente dans ces tissus. La couleur rouge de la myoglobine est due aux liaisons π de l'hème, qui absorbent les longueurs d'onde de la partie bleue du spectre visible, de sorte que seul le rouge est réémis. C'est notamment le cas de la viande fraîche, dont le cation de fer est ferreux, c'est-à-dire qu'il est à l'état d'oxydation +2, et lié à l'oxygène. Lorsqu'elle est bien cuite, la viande rouge prend une teinte brune en raison de l'oxydation de sa myoglobine en métmyoglobine, dans laquelle le cation de fer est ferrique, c'est-à-dire qu'il est à l'état d'oxydation +3 (cation Fe3+). La viande peut prendre une teinte rose lorsqu'elle est exposée aux nitrites NO2− à la suite de la liaison d'une molécule de monoxyde d'azote NO à l'hème : c'est par exemple le cas du corned-beef et de certains jambons.
La viande rouge tend à brunir lorsqu'elle vieillit, sous l'effet notamment de l'activité microbienne qui s'y déroule et qui tend à oxyder la myoglobine en métmyoglobine. C'est la raison pour laquelle on associe viande crue de couleur brune à viande avariée. Cependant, si la viande bien cuite est brune par suite de la formation de métmyoglobine, les viandes grillées peuvent également prendre une teinte rose par liaison d'une molécule de monoxyde de carbone CO à l'hème. Cette propriété peut être mise à profit par les distributeurs de produits alimentaires pour améliorer l'apparence des viandes rouges et les rendre plus attractives pour l'acheteur potentiel, afin que le consommateur identifie cette viande comme « fraîche ». Une viande emballée sous atmosphère de monoxyde de carbone prendra ainsi une teinte rose indépendamment de son état de fraîcheur réel ; compte tenu de l'affinité très élevée de l'hème pour le monoxyde de carbone, cette teinte peut persister près d'un an[9].
Implications médicales
La myoglobine est libérée par les muscles en cas de rhabdomyolyse, c'est-à-dire d'une lésion musculaire accompagnée de destruction des myocytes. La myoglobine ainsi libérée est filtrée par les reins, mais est toxique pour l'épithélium des tubules du néphron, ce qui peut conduire à une insuffisance rénale aiguë[10]. La myoglobine elle-même n'est pas toxique — c'est une protoxine — mais le sont les produits de son altération en milieu acide.
La myoglobine est un indicateur sensible de lésions musculaires, ce qui peut en faire un indicateur d'infarctus du myocarde chez les patients présentant des douleurs thoraciques[11]. Sa concentration sanguine s'élève une à trois heures après un infarctus du myocarde et tend à se normaliser en moins de 24 heures[12], mais son utilisation est supplantée par le dosage de la troponine, plus spécifique.
Découverte de la structure
En 1957, John Kendrew et ses collaborateurs déterminèrent avec succès la structure en trois dimensions de la myoglobine[13] par la cristallographie par rayons X. Pour cette découverte, il partagea en 1962, le prix Nobel de chimie avec Max Perutz.
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) George A. Ordway et Daniel J. Garry, « Myoglobin: an essential hemoprotein in striated muscle », Journal of Experimental Biology, vol. 207, no Pt 20, , p. 3441-3446 (PMID 15339940, DOI 10.1242/jeb.01172, jeb.biologists.org/content/207/20/3441.full.pdf)
- (en) S. R. Noren et T. M. Williams, « Body size and skeletal muscle myoglobin of cetaceans: adaptations for maximizing dive duration », Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, vol. 126, no 2, , p. 181-191 (PMID 10936758, DOI 10.1016/S1095-6433(00)00182-3, lire en ligne)
- (en) James T. Trent III et Mark S. Hargrove, « A Ubiquitously Expressed Human Hexacoordinate Hemoglobin », Journal of Biological Chemistry, vol. 277, no 22, , p. 19538-19545 (PMID 11893755, DOI 10.1074/jbc.M201934200, lire en ligne)
- (en) J. C. Kendrew, G. Bodo, H. M. Dintzis, R. G. Parrish, H. Wyckoff et D. C. Phillips, « A Three-Dimensional Model of the Myoglobin Molecule Obtained by X-Ray Analysis », Nature, vol. 181, no 4610, , p. 662-666 (PMID 13517261, DOI 10.1038/181662a0, Bibcode 1958Natur.181..662K, lire en ligne)
-
(en) « The Nobel Prize in Chemistry 1962 » (consulté le ) :
« The Nobel Prize in Chemistry 1962 was awarded jointly to Max Ferdinand Perutz and John Cowdery Kendrew "for their studies of the structures of globular proteins". »
- (en) Akaboshi Eiko, « Cloning of the human myoglobin gene », Gene, vol. 33, no 3, , p. 241–249 (PMID 2989088, DOI 10.1016/0378-1119(85)90231-8, lire en ligne)
- (en) Pradeep P. A. Mammen, Shane B. Kanatous, Ivan S. Yuhanna, Philip W. Shaul, Mary G. Garry, Robert S. Balaban et Daniel J. Garry, « Hypoxia-induced left ventricular dysfunction in myoglobin-deficient mice », American Journal of Physiology, vol. 285, no 5, , H2132-H2141 (PMID 12881221, DOI 10.1152/ajpheart.00147.2003, lire en ligne)
- (en) M. J. Fraqueza et A. S. Barreto, « Gas mixtures approach to improve turkey meat shelf life under modified atmosphere packaging: The effect of carbon monoxide », Poultry Science, vol. 90, no 9, , p. 2076-2084 (PMID 21844276, DOI 10.3382/ps.2011-01366, lire en ligne)
- (en) Toshio Naka, Daryl Jones, Ian Baldwin, Nigel Fealy, Samantha Bates, Hermann Goehl, Stanislao Morgera, Hans H. Neumayer et Rinaldo Bellomo, « Myoglobin clearance by super high-flux hemofiltration in a case of severe rhabdomyolysis: a case report », Critical Care, vol. 9, no 2, , R90-R95 (PMID 15774055, PMCID 1175920, DOI 10.1186/cc3034, lire en ligne)
- (en) Michael Weber, Matthias Rau, Katharina Madlener, Albrecht Elsaesser, Dragic Bankovic, Veselin Mitrovic et Christian Hamm, « Diagnostic utility of new immunoassays for the cardiac markers cTnI, myoglobin and CK-MB mass », Clinical Biochemistry, vol. 38, no 11, , p. 1027-1030 (PMID 16125162, DOI 10.1016/j.clinbiochem.2005.07.011, lire en ligne)
- Dekker MS, Mosterd A, van 't Hof AWJ, Hoes AW, [Novel biochemical markers in suspected acute coronary syndrome: systematic review and critical appraisal Marieke S Dekker, Arend Mosterd, Arnoud W J van 't Hof, Arno W Hoes Heart 2010;96:1001-1010 Novel biochemical markers in suspected acute coronary syndrome: systematic review and critical appraisal, Heart, 2010;96:1001-1010
- (en) J.C. Kendrew, G. Bodo, H.M. Dintzis, R.G. Parrish, H. Wyckoff et D.C. Phillipps, « A three-dimensional model of the myoglobin molecule obtained by x-ray analysis », Nature, vol. 181, , p. 662-666 (PMID 13517261)