Pyrrole
Le pyrrole ou azole, de formule brute C4H5N, est un composé hétérocyclique simple et fondamental de la classe des métalloles, constitué d'un cycle aromatique de 5 atomes dont un atome d'azote. Le pyrrole est un composé aromatique qui possède une réactivité différente du benzène. Il est utilisé en tant que réactif ou précurseur en chimie organique. Il fut découvert par Runge dans les huiles empyreumatiques issues de la distillation sèche des os. On peut aussi l'extraire de l'huile animale de Dippel.
| Pyrrole | |
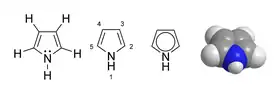
| |
| représentations du pyrrole | |
| Identification | |
|---|---|
| Nom UICPA | Azole |
| Synonymes |
pyrrole |
| No CAS | |
| No ECHA | 100.003.387 |
| No CE | 203-724-7 |
| PubChem | |
| FEMA | 3386 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore |
| Propriétés chimiques | |
| Formule | C4H5N [Isomères] |
| Masse molaire[1] | 67,089 2 ± 0,003 8 g/mol C 71,61 %, H 7,51 %, N 20,88 %, |
| pKa | 0,4 (PyrH+/PyrH) 16,5 (PyrH/Pyr-) |
| Moment dipolaire | 1,767 ± 0,001 D[2] |
| Diamètre moléculaire | 0,501 nm[3] |
| Propriétés physiques | |
| T° fusion | −23,4 °C[4] |
| T° ébullition | 129,7 °C[4] |
| Solubilité | 45 g·l-1 (eau, 25 °C); |
| Paramètre de solubilité δ | 24,8 J1/2·cm-3/2 (25 °C)[3] |
| Masse volumique | 0,969 8 g·cm-3 (20 °C)[4] |
| T° d'auto-inflammation | 550 °C |
| Point d’éclair | 39 °C |
| Limites d’explosivité dans l’air | 3,10–14,8 %vol |
| Pression de vapeur saturante | 9 hPa (à 20 °C) |
| Point critique | 366,75 °C 6,21·10⁶ Pa[4] |
| Thermochimie | |
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 8,207 ± 0,005 eV (gaz)[6] |
| Propriétés optiques | |
| Indice de réfraction | 1,5085[4] |
| Précautions | |
| NFPA 704 | |
| Directive 67/548/EEC | |
| Transport | |
| Écotoxicologie | |
| LogP | 0,75[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
Biochimie du noyau pyrrole
Les pyrroles sont les composés les plus importants parmi ceux possédant un cycle aromatique. Ils entrent dans la structure des porphyrines telles que l'hème, des chlorines telles que la chlorophylle et du noyau corrine de la vitamine B12.
Aromaticité
Le pyrrole est un composé aromatique qui respecte la règle de Hückel. Les électrons délocalisés sont ceux des deux double liaisons ainsi que les deux électrons du doublet libre de l'azote, soit six électrons en tout. Chaque carbone apporte un de ses électrons pi dans la délocalisation et l’azote apporte deux électrons. Les carbones sont hybridés sp². Le pyrrole possède une énergie de résonance de 100 kJ par mole. Cette énergie est inférieure à celle du benzène et du thiophène, mais supérieure à celle du furane[7]. Le pyrrole est un composé moins aromatique que le benzène et le thiophène mais plus aromatique que le furane.
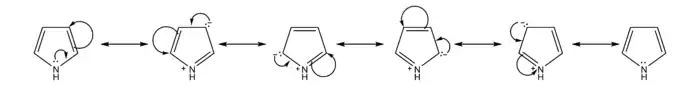
Bibliographie
- (fr) R.Milcent, F.Chau Chimie Organique Hétérocyclique, EDP Sciences.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1).
- « PYRROLE », sur Hazardous Substances Data Bank (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8).
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- Chimie organique hétérocyclique structures fondamentales.
Liens externes
Voir aussi
Composés structurellement ou chimiquement apparentés :
- Pyrrolidine, pyrrole saturé
- Pyrroline, pyrrole partiellement saturé
- Pyrroles substitués
- Pyrrole liés à des cycles
- Analogues du pyrrole





