Indole
L'indole est un composé organique aromatique hétérocyclique. Le nom indole est dérivé de l'indigo, pigment bleu dont la molécule contient deux groupements indoles soudés. Il peut être décrit schématiquement comme étant formé d'un cycle benzénique et d'un cycle pyrrole accolés. Le doublet électronique porté par l'atome d'azote dans la représentation de Lewis participe à la délocalisation aromatique. Contrairement aux amines classiques, l'indole n'est donc pas une base puisque le caractère aromatique serait perdu en cas de réaction chimique mettant en jeu ce doublet.
| Indole | |
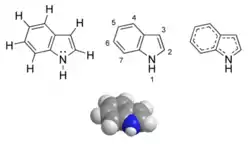
| |
| Structure | |
| Identification | |
|---|---|
| Synonymes |
2,3-benzopyrrole |
| No CAS | |
| No ECHA | 100.004.019 |
| No CE | 204-420-7 |
| SMILES | |
| InChI | |
| Apparence | solide blanc |
| Propriétés chimiques | |
| Formule | C8H7N [Isomères] |
| Masse molaire[1] | 117,147 9 ± 0,007 1 g/mol C 82,02 %, H 6,02 %, N 11,96 %, |
| Propriétés physiques | |
| T° fusion | 52,5 °C[2] |
| T° ébullition | 254 °C[2] |
| Solubilité | 3,56 g·l-1 (eau, 25 °C)[2] |
| Masse volumique | 1,22 g·cm-3 (solide) 5,6 (gaz, air=1) |
| Point d’éclair | 110 °C |
| Pression de vapeur saturante | 1,6 Pa à 25 °C |
| Thermochimie | |
| Cp | |
| Yeux | Irritant |
| Unités du SI et CNTP, sauf indication contraire. | |
L'indole est un composé solide à la température ambiante, qui possède une odeur puissante, à la fois florale, fongique et animale. Il est naturellement présent dans de nombreuses fleurs blanches, comme le jasmin et la fleur d'oranger, et est responsable de leur caractère capiteux. Comme le scatol (ou méthyl-indole), l'indole possède des tonalités olfactives animales pouvant rappeler la matière fécale, mais beaucoup moins prononcées que dans le scatole, un autre composé. L'indole peut aussi évoquer l'odeur des boules anti-mites. Il est présent dans la formule de nombreux parfums, principalement floraux.
L'indole est naturellement présent dans le goudron de houille. La structure indole est présente dans de nombreux composés organiques comme le tryptophane (un acide aminé qui, en présence de tryptophanase, le libère en cas de stress cellulaire), ainsi que dans les protéines contenant du tryptophane, dans des alcaloïdes et des pigments.
L'indole peut subir une substitution électrophile aromatique, principalement en position 3. Les composés de type indole substitué constituent les blocs de base des alcaloïdes de type tryptamine comme la sérotonine (un neurotransmetteur) et la mélatonine, et des tryptamines hallucinogènes comme la psilocybine, la diméthyltryptamine, la 5-MeO-DMT ou encore le LSD.
D'autres alcaloïdes indoliques existent à l'état naturel et sont utilisés en thérapeutique, comme la vinblastine ou la catharandine, qui sont des agents anticancéreux.
Parmi les autres composés dérivés de l'indole, on peut citer l'auxine (une hormone des plantes), l'indométacine (un anti-inflammatoire) ou le pindolol (un bêta-bloquant)
Étymologie et historique
Le mot français indole est dérivé du mot allemand Indol, forgé par le chimiste Adolf von Baeyer, en ajoutant au radical du mot indigo le suffixe -ol.
La chimie de l'indole a commencé à se développer avec l'étude de l'indigo, pigment de couleur bleue.
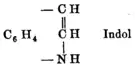
Celui-ci était transformé en isatine puis en oxindole (oxyde d'indole). En 1866, Adolf von Baeyer (prix Nobel de chimie en 1905) parvint à réduire l'oxindole en indole en utilisant de la poussière de zinc comme réducteur. En 1869, il proposa une formule chimique (voir image à gauche) pour ce nouveau composé[4].
Certains dérivés de l'indole étaient utilisés comme colorants jusqu'à la fin du XIXe siècle. L'intérêt pour ce composé s'accrut au cours des années 1930, lorsque l'on découvrit que l'indole est une brique constitutive d'un grand nombre d'alcaloïdes, ainsi que d'auxines et du tryptophane. L'indole demeure un composé très étudié et utilisé.
Synthèse et production de l'indole
La principale méthode industrielle de production d'indole est la distillation du goudron de houille, dont l'indole est l'un des constituants importants. L'indole est contenu dans la fraction de distillat obtenue entre 220 °C et 260 °C.
L'indole et ses dérivés peuvent également être synthétisés par une grande variété de réactions chimiques. Ce chapitre ne présente pas toutes les techniques de synthèse de manière exhaustive mais un panorama historique.
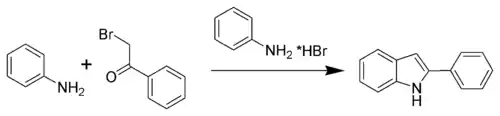
Synthèse de Bischler-Möhlau
Développée au cours de la décennie 1880, la méthode de Bischler-Möhlau est l'une des toutes premières techniques de synthèse de l'indole. Au cours de la réaction, de l'α-bromo-acétophénone réagit avec un excès d'aniline en milieu acide pour former un 2-aryl-indole. Cependant, elle ne permet pas de préparer directement de l'indole non substitué.
Synthèse de Fischer
La synthèse de Fisher de l'indole est une réaction remarquable qui a été découverte par un des plus grands chimistes organiciens, Hermann Emil Fischer (prix Nobel en 1902). Elle consiste en une addition de phenylhydrazine sur une cétone ou un aldéhyde en milieu acide.
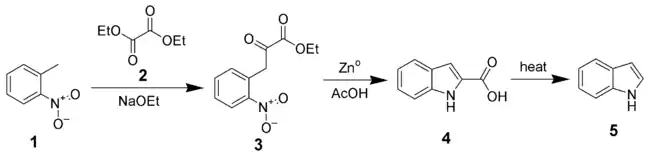
Synthèse de Reissert
Proposée en 1897, la synthèse de Reissert est l'une des premières à permettre la synthèse d'indole non substitué, en trois étapes à partir d'ortho-nitrotoluène (1).
Synthèse de Madelung
La synthèse de Madelung, développée en 1912, est une réaction permettant la fabrication d'indole (substitué ou non substitué) par la cyclisation intramoléculaire d'un N-phénylamide. Elle se fait à haute température en présence d'une base forte.
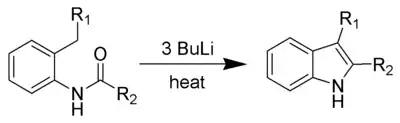
Synthèse de Leimgruber-Batcho
La méthode de synthèse de l'indole de Leimgruber-Batcho, découverte et brevetée en 1976, permet de préparer de l'indole et des dérivés substitués avec un bon rendement. Elle est tout particulièrement utilisée dans l'industrie pharmaceutique pour préparer des médicaments dont la structure contient des dérivés indolés.
Cette synthèse s'effectue en deux étapes, à partir de l'ortho-nitrotoluène. Celui-ci est d'abord transformé en une énamine, qui est ensuite réduite pour obtenir l'indole.
Synthèse de Bartoli
La synthèse de Bartoli est une méthode de synthèse d'indole substitué, à partir d'un nitrobenzène ortho-substitué et d'un réactif de Grignard vinylique.
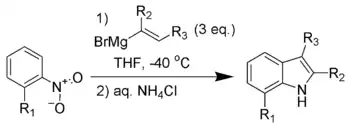
Cette réaction ne fonctionne qu'avec un nitrobenzène substitué en position ortho (et ne marche pas sans). Trois équivalents en organomagnésien sont nécessaires pour la mener à bien.
Utilisation de l'indole
L'absolu de jasmin utilisé en parfumerie contient environ 2,5 % d'indole. La production de 1 kg d'absolu jasmin requiert plusieurs millions de fleurs et coûte plusieurs milliers d'euros. L'indole est utilisé (avec beaucoup d'autres composés) pour recréer un accord jasmin, pour un coût bien moins élevé.
L'indole a une senteur puissante à la fois florale (odeur de fleur blanche) et animale.
L'indole est aussi utilisé pour la synthèse industrielle du tryptophane par fermentation. Cette transformation repose sur l'activité enzymatique de la tryptophane synthase produite par les bactéries cultivées dans le fermenteur.
L'indole est également le réactif de départ de la synthèse d'un grand nombre de composés organiques : pigments, composants de parfums, médicaments...
Réactions chimiques mettant en jeu l'indole
Caractère basique du doublet de l'azote
Bien que l'atome d'azote possède un doublet libre (deux électrons ne participant pas aux liaisons chimiques), l'indole est nettement moins basique que les amines ou que l'aniline. En effet, ce doublet d'électron est délocalisé et participe à l'aromaticité du système. La forme basique (l'indole) est donc nettement plus stable que la forme acide (protonée) pour laquelle l'aromaticité est perdue. La forme protonée possède une constante d'acidité pKa=-3,6. Il faut donc utiliser un acide fort (comme l'acide chlorhydrique), pour protoner une fraction significative d'indole.
Substitution électrophile aromatique
Du fait de son caractère aromatique, l'indole peut subir une substitution électrophile aromatique (substitution d'un atome d'hydrogène par un groupement électrophile. La position la plus réactive vis-à-vis de la substitution électrophile aromatique est la position C-3 (qui est environ 1000 fois plus réactive que celles situées sur le cycle benzénique). Par exemple, lors d'une formylation de Vilsmeier-Haack[5] effectuée à la température ambiante, seule la position C-3 est substituée (voir schéma).
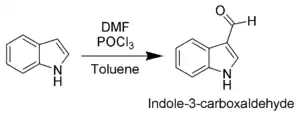
Les positions situées sur le cycle pyrrole étant plus réactives, les substitutions électrophiles aromatiques du cycle benzénique ne peuvent avoir lieu que lorsque les positions N-1, C-2 et C-3 ont subi une substitution.
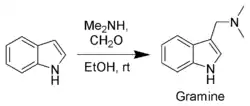
Parmi les composés obtenus par ce type de réactions on peut citer la gramine, un intermédiaire de synthèse important, fabriqué à partir d'indole, de diméthylamine et de formaldéhyde par la réaction de Mannich.
Caractère acide de l'atome d'hydrogène lié à l'azote
L'atome d'hydrogène porté par l'azote possède un faible caractère acide, avec une constante d'acidité pKa=21 dans le DMSO. La déprotonation de l'atome d'azote nécessite donc l'utilisation d'une base très forte comme l'hydrure de sodium ou le butyllithium, et un milieu totalement anhydre. Les sels résultant de la déprotonation peuvent réagir de deux manières. Les sels très ioniques comme les sels de sodium ou de potassium réagissent préférentiellement par une attaque électrophile sur l'atome d'azote (voie de gauche sur le schéma). À l'inverse, les sels plus covalents, notamment les organo-magnésiens (réactif de Grignard) et les complexes à base de zinc, réagissent préférentiellement par l'intermédiaire du carbone C-3 (voie de droite sur le schéma). De même, le solvant utilisé influe sur la réaction : les solvants polaires et aprotiques comme le DMF ou le DMSO favorisent une réaction par l'atome d'azote, tandis que les solvants apolaires comme le toluène favorisent une réaction par le carbone C-3[6].
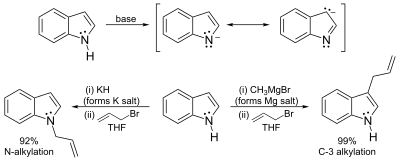
Acidité du carbone, lithiation de la position 2
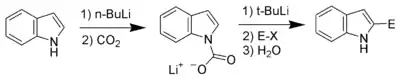
En termes d'acidité, l'atome d'hydrogène le plus acide après celui lié à l'atome d'azote est celui lié à l'atome de carbone en position 2. À condition d'effectuer en premier lieu une protection de la fonction azotée, il est donc possible de déprotoner le carbone en position 2, en utilisant par exemple du butyllithium ou du diisopropylamide lithium (LDA). Le carbanion résultant est un nucléophile très puissant, qui peut donc réagir avec des composés électrophiles[7].
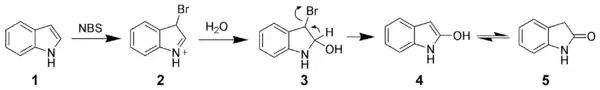
Oxydation de l'indole
L'indole est un composé riche en électrons (10 électrons délocalisés sur les cycles) qui peut être facilement oxydé. Par exemple, le N-Bromosuccinimide permet d'oxyder l'indole (1) de manière sélective pour former l'oxindole (4 en équilibre avec 5).
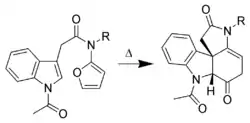
Cycloadditions
Les liaisons π portées par les atomes de carbone en positions C-2 et C-3 peuvent réagir dans des réactions de type cycloaddition (Réaction de Diels-Alder). Les réactions intermoléculaires ne sont pas favorables. En revanche, les réactions intramoléculaires (utilisant des dérivés substitués de l'indole) permettent d'obtenir de bons rendements. Dans l'exemple présenté ci-dessous[8], l'indole est le diénophile et le 2-aminofurane est le diène.
Sécurité
L'indole peut réagir fortement avec les oxydants forts. C'est un composé irritant pour les yeux. En cas d'ingestion, il est irritant pour la bouche, la gorge, l’œsophage et le tube digestif.
Certains dérivés de l'indole sont toxiques ou psychoactifs (ex : 5-(2-Aminopropyl)indole (ou 5-API ou 5-IT))
Phrases de risque et conseils de prudence


- R: 21/22 (Nocif par contact avec la peau et par ingestion)
- R: 36 (Irritant pour les yeux)
- R: 50 (Très toxique pour les organismes aquatiques)
- S: 36/37 (Porter un vêtement de protection et des gants appropriés)
- S: 61 (Éviter le rejet dans l’environnement. Consulter les instructions spéciales/la fiche de données de sécurité)
Références générales
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Indole », sur ChemIDplus, consulté le 8 février 2009
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Inorganic Compounds and Elements, vol. 3, Huston, Texas, Gulf Pub. Co., , 384 p. (ISBN 0-88415-859-4)
- A. Baeyer, A. Emmerling, Chemische Berichte, 2, 679 (1869).
- Organic Syntheses, Coll. Vol. 4, p.539; Vol. 39, p.30 Article
- Organic Syntheses, Coll. Vol. 6, p.104; Vol. 54, p.58 Article
- Bergman, J.; Venemalm, L. J. Org. Chem. 1992, 57, 2495 - 2497.
- Lynch, S. M. ; Bur, S. K.; Padwa, A.; Org. Lett. 2002, 4, 4643 - 4645. Abstract
- Indoles Part One, W. J. Houlihan (ed.), Wiley Interscience, New York, 1972.
- J. A. Joule, K. Mills Heterocyclic Chemistry, 4th edition, Blackwell Science, Oxford, UK, 2000.


