N-Bromosuccinimide
Le N-bromosuccinimide ou NBS est un composé organobromé utilisé pour réaliser des substitutions radicalaires et des additions électrophiles en chimie organique. Il est capable de bromer de très nombreux composés.
| N-Bromosuccinimide | |
| |
| structure du NBS | |
| Identification | |
|---|---|
| Nom UICPA | 1-bromopyrrolidine-2,5-dione |
| Synonymes |
NBS |
| No CAS | |
| No ECHA | 100.004.435 |
| No CE | 204-877-2 |
| SMILES | |
| InChI | |
| Apparence | solide blanc |
| Propriétés chimiques | |
| Formule | C4H4BrNO2 [Isomères] |
| Masse molaire[1] | 177,984 ± 0,005 g/mol C 26,99 %, H 2,27 %, Br 44,89 %, N 7,87 %, O 17,98 %, |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Utilisation en synthèse
Addition sur des alcènes
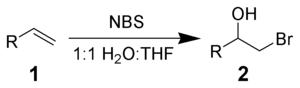
Le NBS peut réagir avec un alcène 1 en milieu aqueux pour donner la bromohydrine 2. Les conditions optimales correspondent à l'ajout de NBS à la solution d'alcène dans un mélange 50/50 d'eau et de DMSO, DMF, THF ou tert-butanol à 0 °C[3]. La formation de l'ion bromonium et l'attaque immédiate par l'eau implique une stricte addition Markovnikov et une stéréochimie anti[4].
Des réactions secondaires, comme la formation d'α-bromo-cétones ou de composés dibromés, sont observées. Elles peuvent être minimisées en utilisant du NBS fraîchement recristallisé.
L'addition d'un nucléophile, à la place de l'eau, permet de synthétiser des alcanes bi-fonctionnalisés variés[5].
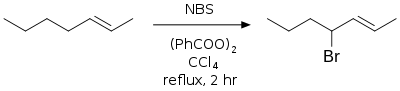
Bromation allylique et benzylique
Il s'agit d'une bromation radicalaire aussi connue sous le nom de réaction de Wohl-Ziegler[6] - [7]. Les conditions classiques sont l'utilisation de NBS en solution dans le CCl4 anhydre, avec un initiateur de radicaux (classiquement AIBN ou peroxyde de benzoyle) ou une irradiation[8] - [9]. Les radicaux allyliques et benzyliques formés durant la réaction sont plus stables que les autres radicaux carbonés et les produits majoritaires sont les bromures allyliques et benzyliques.
Le milieu doit rester strictement anhydre tout au long de la réaction, le produit désiré étant aisément hydrolysable[10]. Le carbonate de baryum est souvent utilisé pour maintenir ces conditions anhydres et non-acides.
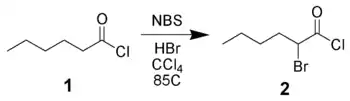
Bromation de dérivés carbonylés
Le NBS peut réaliser la bromation en α de dérivés carbonylés via un mécanisme radicalaire (semblable à la réaction de Wohl-Ziegler) ou via une catalyse acide. Ainsi, le chlorure d'hexanoyle 1 peut être bromé en α par le NBS à l'aide d'une catalyse acide[11].
L'utilisation du NBS est la méthode majoritairement utilisée pour la bromation en α des énolates, éthers d'énols ou acétates d'énols en raison de son rendement élevé et du peu de sous-produits[12] - [13].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche de sécurité établie par Sigma-Aldrich https://www.sigmaaldrich.com/MSDS/MSDS/DisplayMSDSPage.do?country=FR&language=fr&productNumber=B81255&brand=ALDRICH&PageToGoToURL=https%3A%2F%2Fwww.sigmaaldrich.com%2Fcatalog%2Fproduct%2Faldrich%2Fb81255%3Flang%3Dfr consultée le 12/05/219
- Hanzlik, R. P., Selective epoxidation of terminal double bonds, Org. Synth., coll. « vol. 6 », p. 560
- (en) Beger, J., « Präparative Aspekte elektrophiler Dreikomponentenreaktionen mit Alkenen », Journal für praktische Chemie, vol. 333, no 5, , p. 677–698 (DOI 10.1002/prac.19913330502)
- Haufe, G.; Alvernhe, G.; Laurent, A.; Ernet, T.; Goj, O.; Kröger, S.; Sattler, A., Bromofluorination of alkenes, Org. Synth., coll. « vol. 10 », , p. 128
- (en) A. Wohl, « Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge », Chemische Berichte, vol. 52, , p. 51 (DOI 10.1002/cber.19190520109)
- (en) Karl Ziegler, et al., « Die Synthese des Cantharidins », Justus Liebigs Annalen der Chemie, vol. 551, , p. 30 (DOI 10.1002/jlac.19425510102)
- (en) Carl Djerassi, « Brominations with N-Bromosuccinimide and Related Compounds. The Wohl-Ziegler Reaction », Chemical Reviews, vol. 43, , p. 271 (DOI 10.1021/cr60135a004)
- F. L. Greenwood; M. D. Kellert; J. Sedlak, 4-Bromo-2-heptene, Org. Synth., coll. « vol. 4 », , p. 108
- (en) Binkley, R. W, Goewey, G. S et Johnston, J, « Regioselective ring opening of selected benzylidene acetals. A photochemically initiated reaction for partial deprotection of carbohydrates », Journal of Organic Chemistry, vol. 49, , p. 992 (DOI 10.1021/jo00180a008)
- Harpp, D. N.; Bao, L. Q.; Coyle, C.; Gleason, J. G.; Horovitch, S., 2-Bromohexanoyl chloride, Org. Synth., coll. « vol. 6 », , p. 190
- (en) P. L. Stotter et K. A. Hill, « α-Halocarbonyl compounds. II. Position-specific preparation of α-bromoketones by bromination of lithium enolates. Position-specific introduction of α,β-unsaturation into unsymmetrical ketones », J. Org. Chem., vol. 38, , p. 2576 (DOI 10.1021/jo00954a045)
- (en) JM Stewart, DJ O'dea, GC Shapiro, MB Patel, JT Mcintyre, MH Gewitz, CT Hoegler, JT Shapiro et GA Zeballos, « Various Glycosyl Donors with a Ketone or Oxime Function next to the Anomeric Centre: Facile Preparation and Evaluation of their Selectivities in Glycosidations », Synthesis, vol. 1992, no 9, , p. 179 (PMID 1839242, DOI 10.1055/s-1992-34167)
- Amat, M.; Hadida, S.; Sathyanarayana, S.; Bosch, J., Regioselective synthesis of 3-substituted indoles, Org. Synth., coll. « vol. 9 », , p. 417
- (en) H. W. Gilow et D. E. Burton, « Bromination and chlorination of pyrrole and some reactive 1-substituted pyrroles », Journal of Organic Chemistry, vol. 46, , p. 2221 (DOI 10.1021/jo00324a005)
- Brown. W. D.; Gouliaev, A. H., Synthesis of 5-bromoisoquinoline and 5-bromo-8-nitroisoquinoline, Org. Synth. 81, coll. « vol. », , 98 p.
- (en) R. H. Mitchell, Y.H. Lai et R. V. Williams, « N-Bromosuccinimide-dimethylformamide: a mild, selective nuclear monobromination reagent for reactive aromatic compounds », Journal of Organic Chemistry, vol. 44, , p. 4733 (DOI 10.1021/jo00393a066)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « N-Bromosuccinimide » (voir la liste des auteurs).