Brome
Le brome est l'élément chimique de numéro atomique 35, de symbole Br. C'est un membre de la famille des halogènes.
| Brome | |||||||||||
 Ampoule de brome. | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Br | ||||||||||
| Nom | Brome | ||||||||||
| Numéro atomique | 35 | ||||||||||
| Groupe | 17 | ||||||||||
| Période | 4e période | ||||||||||
| Bloc | Bloc p | ||||||||||
| Famille d'éléments | Halogène | ||||||||||
| Configuration électronique | [Ar] 3d10 4s2 4p5 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 7 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 79,904 ± 0,001 u[1] | ||||||||||
| Rayon atomique (calc) | 115 pm (94 pm) | ||||||||||
| Rayon de covalence | 120 ± 3 pm[2] | ||||||||||
| Rayon de van der Waals | 195 pm[3] | ||||||||||
| État d’oxydation | -1, 0, 1, 3, 5, 7 | ||||||||||
| Électronégativité (Pauling) | 2,96 | ||||||||||
| Oxyde | Acide fort | ||||||||||
| Énergies d’ionisation[1] | |||||||||||
| 1re : 11,813 8 eV | 2e : 21,591 eV | ||||||||||
| 3e : 36 eV | 4e : 47,3 eV | ||||||||||
| 5e : 59,7 eV | 6e : 88,6 eV | ||||||||||
| 7e : 103,0 eV | 8e : 192,8 eV | ||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | Liquide (non-magnétique) | ||||||||||
| Allotrope à l'état standard | Dibrome Br2 | ||||||||||
| Masse volumique | 7,59 g·l-1 (gaz)[1] 3,12 g·cm-3 (liquide, 20 °C)[1] |
||||||||||
| Système cristallin | Orthorhombique | ||||||||||
| Couleur | brun rougeâtre | ||||||||||
| Point de fusion | −7,2 °C[1] | ||||||||||
| Point d’ébullition | 58,8 °C[1] | ||||||||||
| Énergie de fusion | 5,286 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 29,96 kJ·mol-1 (1 atm, 58,8 °C); 30,91 kJ·mol-1 (1 atm, 25 °C)[1] |
||||||||||
| Volume molaire | 21,055×10-3 m3·mol-1 | ||||||||||
| Pression de vapeur | 5 800 Pa à 6,95 °C | ||||||||||
| Vitesse du son | 206 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 480 J·kg-1·K-1 | ||||||||||
| Conductivité thermique | 0,122 W·m-1·K-1 | ||||||||||
| Divers | |||||||||||
| No CAS | [4] | ||||||||||
| Précautions | |||||||||||
| SGH[5] | |||||||||||
Dibrome Br2 :   Danger |
|||||||||||
| Transport[5] | |||||||||||
| Dibrome Br2 : |
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Le corps simple brome, de formule chimique Br2 (dibrome, formé de molécules homonucléaires diatomiques), est un liquide de couleur brunâtre dans les conditions normales de température et de pression. Carl Löwig et Antoine-Jérôme Balard ont découvert ce corps simple en 1825 et 1826, indépendamment l'un de l'autre. Son nom dérive du grec bromos (« puanteur »), en raison de son odeur piquante.
Peu abondant, il n'est que le 62e élément chimique de la croûte terrestre[6]. Dans la nature, il n'est jamais présent sous forme de dibrome, mais le plus souvent sous forme de bromure. À cause du lessivage des roches et de la grande solubilité de nombreux bromures métalliques, le brome s'est accumulé dans les océans (où il est cependant 289 fois moins abondant que le chlore) : l'eau de mer est une source de brome. Les eaux de la mer Morte contiennent 50 000 ppm d'ions bromure et constituent, avec des gisements aux États-Unis et en Chine, les principales réserves mondiales[6].
Dans les minerais, l'ion bromure est souvent associé à l'argent. Les minéraux correspondants sont la bromargyrite (bromure d'argent AgBr), découvert à Mexico en 1841[7], et l'embolite.
Outre qu'il peut contribuer à dégrader la couche d'ozone, il semble jouer un rôle de catalyseur dans le phénomène atmosphérique écotoxicologiquement préoccupant dit de « pluies de mercure » (impliqué dans environ 80 % des cas)[8]. Il est notamment émis dans l'air par l'incinération des déchets et pour de nombreux secteurs, il n'y a pas de valeurs limites d'émission (VLE) dans l'air ou dans les rejets d'eaux usées. En France, depuis 2013 dans certaines ICPE, les émissions de brome et de composés inorganiques gazeux du brome (exprimées en HBr) sont réglementées : leur flux horaire ne doit pas dépasser 50 g/h, et 5 mg/m3 de gaz rejeté dans l'atmosphère[9].
Histoire
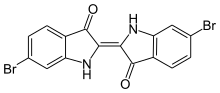
Le premier composé du brome utilisé (bien avant que l'élément chimique ne soit isolé) remonte à l'Antiquité. Le magnifique pigment mentionné dans la Bible[10] et connu des Romains sous le nom de pourpre de Tyr a été analysé en 1909 par P. Friedländer ; il s'agit du 6,6'-dibromoindigo[11]. Ce colorant était à l'époque extrait de l'escargot Murex brandaris. Il en fallait 12 000 pour préparer 1,5 g de colorant.
Le brome a été découvert indépendamment par Antoine-Jérôme Balard en 1826[12] et par Carl Löwig en 1825[13]. Voir un fac-similé du mémoire de Balard à cette référence[14].
Le chimiste Antoine-Jérôme Balard a trouvé le brome dans les eaux mères restant après avoir cristallisé le chlorure de sodium et le sulfate de sodium des prés-salés de Montpellier. Le jeune Balard (23 ans) avait remarqué la coloration jaune-soutenu de cette eau lors de l'addition de dichlore. L'extraction par l'éther et la potasse conduisait à un sel (KBr) qu'il traita par le dioxyde de manganèse MnO2 (oxydant) en présence d'acide sulfurique. Il obtint ainsi un liquide rouge (Br2). Balard développa rapidement la chimie du brome et reconnut son caractère élémentaire, par comparaison au monochlorure d'iode ICl qui avait été isolé quinze ans auparavant[11]. Balard a nommé cet élément « muride », dérivé du latin muria[15].
Un an plus tôt, en 1825, le chimiste Carl Löwig avait pu isoler un peu de dibrome en l'extrayant d'un échantillon d'eau. Pour extraire le dibrome de l'eau, il a saturé la solution avec du dichlore et l'a extrait grâce à sa solubilité dans l'éther diéthylique. L'évaporation de ce solvant a laissé une substance liquide brune. Mais le retard de la publication de sa découverte a permis à Antoine Balard[16] de publier en premier la découverte de ce nouvel élément chimique.
Après que les trois chimistes français Louis-Nicolas Vauquelin, Louis Jacques Thénard, et Louis Joseph Gay-Lussac eurent approuvé la découverte de Balard, ses résultats furent présentés à l'Académie des sciences et publiés dans les Annales de chimie et physique. Dans sa publication, à la demande de M. Anglada, Balard changea le nom muride en Brôme ou brome, du grec βρῶμος (brômos) qui signifie « puanteur »[17].
Le brome (avec le chlore et l'iode) a pris une place importante, au cours de l'histoire de la chimie, pour comprendre la structure des composés organiques. Par exemple, Jean-Baptiste Dumas formulait en 1838 (bien avant que la tétravalence du carbone soit établie) une théorie de la substitution dont une des règles indiquait que, lors d'une déshydrogénation par le chlore, le brome ou l'iode, un atome H était remplacé par un atome d'halogène.
Gisement
La production industrielle du dibrome résulte de l'oxydation des ions bromure par le dichlore[11]. La source de bromure en Amérique est généralement la saumure d'Arkansas qui en contient 4 000 à 5 000 ppm. Les nations européennes s'approvisionnent pour l'essentiel dans les eaux de la mer Morte (4 000 à 6 000 ppm). L'eau des océans n'en contient que 65 ppm mais reste une source utilisée. La France a produit du brome jusqu'en 1998 à partir de la sylvinite extraite des Mines de potasse d'Alsace.
Méthode de production
Après oxydation par le dichlore, le dibrome est extrait en insufflant un courant d'air dans la solution de dibrome. Le dibrome est ensuite condensé et purifié. Bien que le procédé soit simple dans son principe, il nécessite, d'un point de vue technologique, de mettre en place des matériaux hautement résistants à l'oxydation[18].
Production et demande mondiale
Au début du XXIe siècle, la production mondiale se fait principalement aux États-Unis, qui sont suivis de près par Israël (qui dispose d'un gisement important dans la mer Morte) alors que les nations d'Europe qui sont le 3e producteur n'en produit que 6 % du marché mondial[19].
La demande mondiale en brome a été dopée par son usage croissant dans certains pesticides, additifs de carburants, huiles de forage, biocides mais surtout dans les retardateurs de flamme (si dans les années 1960 seuls 5 % du brome extrait dans le monde servait à fabriquer des retardateurs de flammes, ce taux a été porté à 38 % et sa production annuelle n'a cessé de croître atteignant environ 540 000 tonnes en 2000[20]. Son usage comme additif de carburant a décliné de 1970 à 1995, alors que ses usages comme ignifugeant augmentaient en proportion inverse[20].
Dangers, précautions de transport
En tant qu'agent oxydant fort, le brome est incompatible avec la plupart des composés organiques et inorganiques[21]. La prudence est requise lors du transport du brome (généralement transporté dans des réservoirs en acier doublés de plomb, soutenus par de solides cadres métalliques[18].
Il est classé aux États-Unis comme « substance extrêmement dangereuse » au sens de la section 302 de la loi américaine sur la planification d'urgence et le droit de savoir (42 USC 11002). Il y est soumis à des exigences strictes en matière de rapportage par les entreprises ou entités qui le produisent, l’utilisent ou le stockent en quantité importante[22].
Isotopes
Le brome possède 32 isotopes connus, de nombre de masse compris entre 66 et 97, ainsi que 13 isomères nucléaires. Parmi ces isotopes, deux seulement sont stables, le brome 79 et le brome 81, qui constituent l'ensemble du brome naturel à raison de 50,69 et 49,31 %, respectivement. La masse atomique standard du brome est de 79,904(1) u.
Le radioisotope de plus longue durée de vie est le brome 77, avec une demi-vie de 57,036 heures.
Propriétés

Dans les conditions normales, le dibrome est un liquide de densité supérieure à 3 (ce qui est beaucoup comparé aux liquides usuels, mais nettement moins que le mercure qui a une densité voisine de 13,6) et de couleur brun-rouge. Il est toxique et non métallique à pression ordinaire (il le devient à très haute pression, à partir de 55 GPa). À température ordinaire, c'est un liquide extrêmement volatil qui dégage des vapeurs rousses, de la même couleur que le dioxyde d'azote. Avec le mercure, le dibrome est le seul corps simple liquide à température ambiante. Il dégage une odeur suffocante apparentée à celle du dichlore. Son point de fusion est de −7,2 °C ; dans un environnement froid, le dibrome peut facilement geler. Son point d'ébullition n'est pas très élevé : 58,8 °C[23] car les interactions entre molécules de dibrome sont faiblement attractives ; ce sont des interactions de van der Waals.
Le dibrome est plus oxydant que le diiode mais moins que le dichlore. Son potentiel redox est E° = 1,07 V (1,36 V pour Cl2/Cl− et 0,54 V pour I2/I−). Il réagit avec la plupart des autres corps simples, donc les métaux, pour former des sels : bromure de sodium, bromure de fer, etc.
Le brome est l'un des sept éléments qui forment une molécule diatomique, à l'instar de O2, N2, etc. Il réagit avec la majorité des composés organiques.
La solubilité dans l'eau du dibrome est largement supérieure à celle des autres dihalogènes. Elle est de 35 g/L, soit 0,214 mol/L. La solution de dibrome dans l'eau s'appelle « l'eau de brome » ; elle génère une vapeur de dibrome d'autant plus colorée que l'eau de brome est concentrée (loi de Henry). L'eau de brome est légèrement acide (jusqu'à pH = 2,6 pour une concentration élevée[24]). Le dibrome est également largement soluble dans les solvants organiques.
L'élément chimique brome entre dans la composition de plusieurs composés interhalogénés : BrF, BrF3, BrF5, BrCl et IBr. Leur formation se produit par interaction directe entre les dihalogènes correspondants dans la bonne stœchiométrie. Dans les composés BrF3 et dans BrF5, l'atome central est Br. Ce dernier adopte une géométrie conforme à celle prévue par la théorie VSEPR. Les anions interhalogénés, appelés polyhalogénures, existent également comme BrF6−.
Dans des conditions fortement oxydantes, Br2 forme les cations dibrominium Br2+ et Br5+.
Dans l'eau en présence d'ions bromure, le dibrome se transforme en tribromure Br3− (à l'image de l'ion triiodure I3−, plus connu). En milieu aqueux basique, le dibrome se dismute en ions bromure Br− et ions bromate BrO3−, ce que montre bien un diagramme de Pourbaix. Dans l'eau, les entités Br2, Br3−, HBrO, BrO−, HBrO3 et BrO3− coexistent[24].
Le bromure d'argent AgBr est moins soluble que son homologue AgCl et plus que AgI. La précipitation de AgBr résultant de l'addition d'une solution de nitrate d'argent à une solution de bromure de sodium est une réaction classique en chimie analytique qualitative ou quantitative. Cette dernière peut être suivie par potentiométrie avec une électrode d'argent et une électrode de référence au calomel protégée par une allonge de nitrate de sodium.
En chimie de coordination, la série spectrochimique montre que le ligand bromure est à champ plus faible que le ligand chlorure.
En chimie organique, les halogénures d'alkyle s'hydrolysent assez facilement en présence d'eau. Plus généralement, l'ion bromure est un bon groupe partant dans les conditions d'une substitution nucléophile.
Toxicologie
Sur le modèle animal
Le brome pur est neurotoxique et perturbateur endocrinien, mais une étude de 2014 suggère que sous forme d'ion bromure (peu toxique), cet élément serait un cofacteur nécessaire à la biosynthèse du collagène IV, ce qui en fait l'élément essentiel pour l'architecture de la membrane basale et le développement des tissus chez les animaux[25]. Néanmoins, aucun symptôme ou syndrome de privation évident n'a été documenté[26].
Dans d'autres fonctions biologiques, sans être un élément essentiel, l'ion bromure semble toujours bénéfique là où il remplace le chlore. Par exemple, en présence de peroxyde d'hydrogène (H2O2) formé par les éosinophiles et d'ions chlorure ou bromure, l'éosinophile peroxydase fournit un mécanisme puissant par lequel les éosinophiles tuent les parasites multicellulaires (comme les vers nématodes impliqués dans la filariose) et certaines bactéries (ex. : de la tuberculose). L'éosinophile peroxydase est une haloperoxydase (en) qui utilise préférentiellement le bromure au chlorure à cette fin, générant de l'hypobromite (acide hypobromeux), bien que l'utilisation de chlorure soit possible[27].
Les α-haloesters sont considérés comme hautement réactifs, et donc toxiques, en synthèse organique. Pourtant les mammifères (dont les humains, les chats et les rats) semblent en biosynthétiser des traces (α-bromoester, le 2-octyl 4-bromo-3- l'oxobutanoate) dans leur liquide céphalo-rachidien où il jouerait un rôle encore à clarifier dans l'induction du sommeil paradoxal[28].
La myéloperoxydase de neutrophile peut utiliser de la désoxycytidine, du H2O2 et du bromate, ce qui pourrait entraîner des mutations de l’ADN[29].
Chez l'être humain
Le brome élémentaire est toxique et caustique (il provoque des brûlures chimiques sur la peau, les muqueuses et la chair), et son inhalation sous forme de gaz ou de vapeur provoque une irritation des voies respiratoires, se manifestant par une toux, puis une suffocation conduisant à la mort au-delà d’un certain seuil inhalé. Une exposition chronique conduit à des infections bronchiques fréquentes et à une détérioration générale de la santé.
L’OSHA (Occupational Safety and Health Administration) des États-Unis a défini une limite d'exposition admissible (PEL) pour le brome à une moyenne pondérée dans le temps (TWA) de 0,1 ppm. L’Institut national pour la sécurité et la santé au travail (NIOSH) a fixé une limite d’exposition recommandée (REL) de TWA 0,1 ppm et une limite à court terme de 0,3 ppm. L'exposition au brome immédiatement dangereux pour la vie et la santé (IDLH) est de 3 ppm[30].
L'anion bromure est peu toxique. Son apport quotidien normal est de 2 à 8 mg selon Nielsen (2000)[26]. Une exposition chronique à des niveaux élevés de bromure altèrent cependant la membrane des neurones, ce qui entrave progressivement la transmission de l'influx nerveux, entraînant une intoxication chronique dite bromisme. Le bromure a une demi-vie d’élimination de 9 à 12 jours, ce qui peut entraîner une accumulation excessive. Des doses de 0,5 à 1 g/j de bromure peuvent provoquer le bromisme. Historiquement, la dose thérapeutique de bromure était d'environ 3 à 5 g de bromure, ce qui explique pourquoi les intoxications étaient courantes. Bien que des perturbations importantes et parfois graves des fonctions neurologiques, psychiatriques, dermatologiques et gastro-intestinales se produisent, la mort par intoxication aiguë au brome est rare[31]. Le bromisme est principalement lié à la neurotoxicité du brome dans le cerveau, qui entraîne somnolence, psychose, convulsions et délire[32].
Facteur d'autisme
En 2011, un lien entre des difficultés neurodéveloppementales (du fœtus et de l'enfant de 0 à 4 ans) et une exposition (prénatale ou post-natale) à certains produits bromés persistants est établi par la chercheuse espagnole Mireia Gascon et son équipe[33]. Les produits en cause sont des retardateurs de flamme de type polybromodiphényléthers (groupe de 209 composés issus de la chimie, dit « PBDE », dont certains ont été massivement utilisés dans les années 1990 à 2010 comme ignifugeant par les industries textiles, du plastique et de l'électronique, après qu'ils ont aussi été utilisés à très haute dose dans les années 1970 et 1980 pour l'extraction pétrolière). Deux ans plus tard, d'autres chercheurs montrent qu'il existe un risque accru de développer des troubles du spectre autistique pour des enfants dont la mère était en état d'hypothyroïdie lors de son premier trimestre de grossesse[34] ; sachant que le brome fait partie des causes d'hypothyroïdie, car en tant qu’halogène chimiquement proche de l’iode il peut en effet prendre la place de l’iode dans le système thyroïdien (ce qui en fait un perturbateur endocrinien[35]).
En 2014, le caractère délétère des diphényléthers polybromés pour le neurodéveloppement est confirmé[36], puis réaffirmé en 2015 par une autre équipe via des tests menés chez des enfants de 9 à 12 ans[37]. Une autre équipe met également le brome en relation avec des anomalies de date de survenue de la puberté chez les filles[38].
En 2016, on admet que certaines maladies du trouble du spectre autistique (et des retards mentaux) sont clairement liées à des dysfonctionnements endocriniens (survenu in utero[39] et/ou chez le nouveau-né) et notamment au niveau de l’axe thyroïdien[40]. Il semble exister une corrélation entre la déficience en iode (source d'hypothyroïdie) et la sévérité des symptômes de l'autisme[41].
Le modèle animal confirme ce lien, en 2012, via une étude sur des souris. L'étude a utilisé des souris femelles génétiquement modifiées pour développer un trouble similaire au syndrome de Rett (trouble autistique), par la mutation du gène MECP2 du chromosome X. Après exposition des mères au BDE-47 (un PDBE), leur descendance, également exposée, avait un poids de naissance et un taux de survie inférieurs, et présentait des déficits de sociabilité et d'apprentissage[42]. En 2013, une étude montre des lésions cérébrales liées au BDP-49, induites chez des souris par l'inhibition du processus de production d'ATP mitochondriale (nécessaire pour que les cellules du cerveau disposent d'énergie). Une neurotoxicité se manifestait dès les faibles doses. Cette étude offre une autre voie d'explication possible au fait que les PDBE entraîneraient l’apparition de symptômes autistiques[43].
Facteur (in utero ou dans l'enfance) de troubles du développement
Les concentrations prénatales de certains BDE ou de la somme de tous les BPDE sont associées à une diminution des taux de TSH à l'âge de 3 ans (phénomène qui avait déjà été observé chez l’animal de laboratoire), avec des différences selon le sexe de l’enfant, les garçons semblant plus touchés que les filles[44]. Une étude (ayant porté sur 208 enfants de 8 ans) sur les effets d’expositions simultanées à certains PBDE après la naissance a conclu qu’une telle exposition induit à l’âge de 8 ans une fonction exécutive dégradée (troubles du comportement et de l’attention), mais chez les jeunes garçons et pas chez les fillettes[45]. Ces ignifugeants (PBDE) sont retrouvés dans le cordon ombilical (mesures faites juste après l’accouchement) et ils passent au travers de la barrière placentaire, avec des séquelles sur le développement moteur également observées des années plus tard[46]. Le risque plus élevé pour le garçonnet est confirmé en 2019 par une autre étude[47]. Les effets délétères persistent chez l’enfant puis l’adolescent dont la mémoire visuelle, verbale et de travail est affectée ; une étude basée sur des enfants dont le taux de PBDE avait été mesuré dans le cordon ombilical, puis qui ont été suivis aux âges de 2, 3, 5, 7 et 9 ans avec des tests de mémoire chez les adolescents, montre que le taux PBDE dans le cordon ombilical est associé à une moindre mémoire de travail auditive chez les filles, une moindre mémoire visuelle chez les enfants (perte de cinq à huit points aux tests)[48].
En 2019, les effets neurotoxiques d’une exposition in utero aux PBDE sont incontestables, de même qu’un effet inhibiteur du taux d’hormones thyroïdiennes (HT), mais on ignore encore si ce dernier effet peut expliquer toute la neurotoxicité des PBDE[49].
Dans le monde animal
Les organismes marins sont la principale source de composés organobromés et c’est dans ces organismes que le caractère essentiel du brome est plus évident. Plus de 1 600 de ces composés organobromés ont été identifiés en 1999. Le plus abondant est le bromure de méthyle (CH3Br), dont environ 56 000 tonnes sont produites chaque année par des algues marines[28]. L'huile essentielle de l'algue hawaïenne Asparagopsis taxiformis est composée à 80% de bromoforme[50].
La plupart des composés organobromés présents dans la mer résultent de l'action d'une enzyme algale unique, la vanadium bromoperoxydase[51].
Utilisations
- Utilisation courante pour la désinfection de l'eau des piscines.
- Il a été très utilisé sous forme de bromure de méthyle (bromométhane, CH3Br) comme pesticide en fumigation, dont en culture sous serre avant d'être récemment interdit en raison de sa toxicité, de son écotoxicité, en tant que gaz à effet de serre et en tant que destructeur de la couche d'ozone (le brome est 45 fois plus réactif que le chlore pour détruire la molécule d’ozone).
- L'utilisation du bromure d'argent en photographie argentique a été un procédé gros consommateur d'élément chimique brome. L'implication de AgBr dans le procédé photographique remonte à 1840[11]. Ce procédé est devenu minoritaire, faisant place aux photos numériques.
- L'usage du bromure de potassium KBr comme sédatif et anti-convulsivant dans le traitement de l'épilepsie a été initié en 1857[11]. Un bromure (bromure de potassium) a été utilisé pour calmer ou inhiber le désir sexuel de soldats vivant dans la promiscuité ou en opération. Ce sont ses propriétés de perturbateur endocrinien (anti-androgènes) qui étaient impliquées.
- C'est devenu un contaminant courant de l'environnement (sous forme de PBDE) ; il figure en effet parmi des centaines de composés retardateur de flamme très couramment utilisés dans des isolants, matières plastiques et textiles (surtout utilisés aux États-Unis où la règlementation a tardé à prendre en compte l'écotoxicité et la toxicité de nombreux PBDE. On en trouve aujourd'hui dans tous les organismes animaux filtreurs ou prédateurs de la planète, et ils s'avèrent pour certains être facteurs de délétion de la spermatogenèse et facteurs de handicap mental à faible dose (voir l'article Polybromodiphényléther pour plus de détails).
- Et encore dans les lampes halogènes, les extincteurs, les colorants, en cosmétique (notamment pour les cheveux).
- De nombreux intermédiaires de synthèse en chimie fine contiennent un atome de brome, auquel on substitue d'autres groupements lors d'étapes ultérieures de synthèse.
- Les traces de dibrome présentes dans l'atmosphère proviennent du gaz « halon » relâché par l’utilisation des extincteurs ainsi que par la transformation de certains produits agricoles.
- Le brome est utilisé pour la fabrication du bromazépam, seule benzodiazépine bromée.
Composés
Composés minéraux
Les composés minéraux du brome sont pour beaucoup des bromures au sens strict (c'est-à-dire où l'anion Br− est présent). Certains composés également nommés « bromure » sont des composés moléculaires (ex. : dibromure de disoufre). Il existe aussi de nombreux composés du brome aux nombres d'oxydation différents de -I comme les oxoanions et leurs acides correspondant, ou les composés interhalogénés.
Bromures ioniques
Les bromures sont dits « ioniques » si l'élément brome n'est pas lié à un voisin par une liaison covalente, éventuellement polarisée, mais s'il est présent à titre d'ion individuel Br−.
Bromures métalliques

Il existe de nombreux bromures métalliques comme le bromure de sodium, le bromure de cuivre CuBr2, etc. Ce sont tous des solides dans les conditions normales. Ils ne sont colorés que quand l'ion métallique est coloré, sinon, ils sont blancs comme le bromure de sodium ci-contre, l'ion bromure ne participant pas à la couleur du sel.
Contre-ion
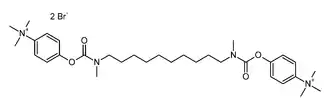
L'ion bromure se rencontre souvent comme contre-ion d'ions complexes, par exemple dans le cas des ammoniums organiques. C'est le cas du bromure de démécarium de formule ci-contre. Ce composé est un inhibiteur de l'acétylcholinestérase.
C'est aussi le cas avec les organomagnésiens, par exemple le bromure de phénylmagnésium C6H5MgBr.
Bromures moléculaires
Les bromures sont moléculaires s'il existe une liaison covalente, le plus souvent polarisée, entre Br et son atome voisin. Dans cette section ne sont traités que les composés inorganiques. Les bromures organiques sont mentionnés plus loin.
Acide bromhydrique
Le bromure d'hydrogène HBr est un gaz dans les conditions normales, structurellement identique au chlorure d'hydrogène plus connu, HCl. Sa solution aqueuse est l'acide bromhydrique ; c'est un acide fort dans l'eau.
Dérivés d'acides
De nombreux composés du brome dérivent d'un acide minéral (pour les acides organiques voir ci-dessous) par remplacement du groupe d'atome OH par Br. C'est le cas du bromure de thionyle SOBr2, formule ci-contre et du bromure de sulfuryle SO2Br2 qui sont des dérivés de l'acide sulfureux et de l'acide sulfurique respectivement.
Les composés phosphorés tribromure de phosphore PBr3 et pentabromure de phosphore PBr5 sont des dérivés de l'acide phosphoreux H3PO3 et de l'acide phosphorique H3PO4 respectivement.
Composés interhalogénés
Les composés interhalogénés sont des composés moléculaires qui ne contiennent que des atomes d'halogènes. Ils sont préparés par interaction directe de deux dihalogènes (par exemple Br2 et Cl2). Plusieurs composés interhalogénés contiennent du brome :
- les composés contenant F et Br :
- BrF,
- BrF3,
- le pentafluorure de brome BrF5 : liquide incolore fumant, très toxique, extrêmement réactif y compris avec l'eau au contact de laquelle il explose ;
- un composé contenant Br et Cl : BrCl ;
- deux composés contenant I et Br :
- IBr,
- IBr5.
Autres bromures

Le dibromure de disoufre S2Br2 est un liquide orange-rouge (voir photo). C'est un composé qui a la même structure que le sulfure d'hydrogène H2S.
Oxoanions
Les anions oxygénés du brome existent aux degrés d'oxydation +I, +III, +V et +VII. Il s'agit respectivement de l'ion hypobromite BrO−, bromite BrO2−, bromate BrO3− et perbromate BrO4−. Dans l'eau, l'ion bromate est majoritaire en milieu basique. L'ion hypobromite est responsable du caractère bactéricide du brome mis à profit dans la stérilisation de l'eau par le dibrome. L'ion perbromate n'a été synthétisé que tardivement (1968 par radiochimie[52], 1969 par une méthode chimique[53]).
Ces oxoanions sont des bases dont l'acide conjugué est d'autant plus fort que le brome est dans un état d'oxydation élevé. L'acide bromique HBrO3 et l'acide perbromique HBrO4 sont des acides forts.
Composés organiques
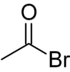
De très nombreux composés organiques contiennent du brome. Ils sont structurellement identiques à leurs homologues chlorés. Par exemple le bromure d'acétyle CH3COBr dérive de l'acide éthanoïque par remplacement du groupe d'atomes OH par l'atome Br. Il est structurellement identique au chlorure d'acétyle CH3COCl. Certains ont une importance industrielle :
- le dibromoéthane a été un additif des essences qui captait le plomb provenant de la décomposition de l'antidétonnant PbEt4 (Tétraéthylplomb). La production du dibromoéthane consommait (dans les années 1970) à elle seule 70 % de la production mondiale de brome[14]. La disparition de ces additifs dans les essences a été compensée par l'émergence d'autres utilisations du brome (en particulier le bromométhane)[18] ;
- l'éosine B contient deux atomes de brome par molécule et l'éosine Y en contient quatre ;
- de nombreux composés du brome contribuent à la destruction de la couche d'ozone (60 fois plus « efficaces » que les CFC). Un plan d'élimination est programmé au niveau mondial (protocole de Montréal). Notamment :
- bromure de méthyle CH3Br : pesticide à très large spectre (vers, insectes, rongeurs). Il est très toxique par inhalation. Le bromométhane est le plus efficace des nématicides connu, pour tuer les vers[18],
- halons, composés de carbone, fluor, brome et chlore (CF3Br, CF2BrCl, C2F4Br2) utilisés pour éteindre les incendies, notamment en présence d'électricité.
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- Paul Arnaud, Brigitte Jamart, Jacques Bodiguel, Nicolas Brosse, Chimie Organique 1er cycle/Licence, PCEM, Pharmacie, Cours, QCM et applications, Dunod, , 710 p., Broché (ISBN 2100070355)
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Entrée « Bromine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 21 août 2018 (JavaScript nécessaire)
- « Brome - Produits SCF », sur Société chimique de France (SCF) (consulté le ).
- Greenwood N.N., Earnshaw et Alan, Chemistry of the Elements, 2, 1997, p. 1138.
- E. Tas, D. Obrist, M. Peleg, V. Matveev, X. Faïn, D. Asaf et M. Luria (2011), Measurement-based modeling of bromine-induced oxidation of mercury above the Dead Sea, Atmos. Chem. Phys. Discuss., 11, 24467–24502 (www.atmos-chem-phys-discuss.net/11/24467/2011/), DOI 10.5194/acpd-11-24467-2011 (étude publiée sous licence CC-by-sa 3.0).
- Arrêté du 14 décembre 2013 relatif aux prescriptions générales applicables aux installations relevant du régime de l'enregistrement au titre de la rubrique no 2560 de la nomenclature des installations classées pour la protection de l'environnement NOR: DEVP1326230A, 14 décembre 2013.
- Ezekiel, 27:7,16.
- (en) N.N. Greenwood, A. Earnshaw, Chemistry of the Elements, Elsevier Éd., 2003, p. 793.
- (en) A. J. Balard, « Mémoire sur une substance particulière contenue dans l'eau de la mer », Annales de Chimie et de Physique 2nd series, vol. 32, , p. 337–381 (lire en ligne).
- (en) Carl Löwig, « Über Brombereitung und eine auffallende Zersetzung des Aethers durch Chlor (Sur la préparation du brome et une éclatante décomposition de l'éther par le chlore) », Magazine für Pharmacie, vol. 21, , p. 31–36 (lire en ligne).
- Flahaut, Jean, « Applications modernes du brome et de ses dérivés », Revue d'Histoire de la Pharmacie, Persée - Portail des revues scientifiques en SHS, vol. 65, no 232, , p. 34–62 (DOI 10.3406/pharm.1977.1749, lire en ligne
 , consulté le ).
, consulté le ). - Antoine Balard, « Mémoire sur une substance particulière contenue dans l'eau de la mer », Annals of Philosophy, , p. 387– and 411– (lire en ligne).
- (en) Carl Löwig, « Ueber einige Bromverbindungen und über Bromdarstellung », Annalen der Physik, vol. 90, no 11, , p. 485–499 (DOI 10.1002/andp.18280901113).
- p. 382-384.
- N.N. Greenwood et A. Earnshaw (2003), Chemistry of the Elements, Elsevier Éd., p. 798.
- Alaee et al., 2003.
- Anne Riu, « Devenir des retardateurs de flammes bromés chez le rat et l'homme: caractérisation des métabolites et évaluation de l'exposition fœtal (Thèse) » [PDF], sur Institut national polytechnique de Toulouse), .
- Science Lab.com, Material Safety Data Sheet: Bromine MSDS, sciencelab.com. Archived from the original on 15 November 2017 (consulté le 27 octobre 2016).
- (en) « 40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities » [archive du ] [PDF], Government Printing Office, (consulté le ).
- Yinon Bentor, « Chemical Elements.com - Bromine (Br) », sur chemicalelements.com (consulté le ).
- Michalowski T. (1994), Calculation of pH and Potential E for Bromine Aqueous Solution, J. Chem. Educ., 71 (7) p. 560-2.
- McCall A.S., Cummings C.F., Bhave G., Vanacore R., Page-McCaw A. et Hudson B.G., « Bromine Is an Essential Trace Element for Assembly of Collagen IV Scaffolds in Tissue Development and Architecture », Cell, vol. 157, no 6, , p. 1380–92 (PMID 24906154, PMCID 4144415, DOI 10.1016/j.cell.2014.05.009).
- Forrest H. Nielsen, « Possibly Essential Trace Elements », Clinical Nutrition of the Essential Trace Elements and Minerals, (ISBN 978-1-61737-090-8, DOI 10.1007/978-1-59259-040-7_2, lire en ligne).
- Mayeno A.N., Curran A.J., Roberts R.L. et Foote C.S., « Eosinophils preferentially use bromide to generate halogenating agents », J. Biol. Chem., vol. 264, no 10, , p. 5660–8 (PMID 2538427).
- Gribble, Gordon W., « The diversity of naturally occurring organobromine compounds », Chemical Society Reviews, vol. 28, no 5, , p. 335–346 (DOI 10.1039/a900201d).
- Henderson J.P., Byun J., Williams M.V. et Mueller D.M., « Production of brominating intermediates by myeloperoxidase », J. Biol. Chem., vol. 276, no 11, , p. 7867–75 (PMID 11096071, DOI 10.1074/jbc.M005379200).
- « Pocket Guide to Chemical Hazards 0064 », NIOSH.
- Kent R. Olson, Poisoning & drug overdose, Appleton & Lange, , 4e éd., 140–141 p. (ISBN 978-0-8385-8172-8, lire en ligne).
- (en) Marc Galanter et Herbert D. Kleber, The American Psychiatric Publishing Textbook of Substance Abuse Treatment, United States of America, American Psychiatric Publishing Inc, , 4e éd., 752 p. (ISBN 978-1-58562-276-4, lire en ligne), p. 217.
- Gascon, M., Vrijheid, M., Martínez, D., Forns, J., Grimalt, J. O., Torrent, M. et Sunyer, J. (2011), Effects of pre and postnatal exposure to low levels of polybromodiphenyl ethers on neurodevelopment and thyroid hormone levels at 4 years of age, Environment International, 37(3), 605-611.
- Roman G.C., Ghassabian A., Bongers-Schokking J.J. et al. (2013), Association of gestational maternal hypothyroxinemia and increased autism risk, Annals of neurology, 74 : 733-42.
- Jean-Baptiste Fini et Barbara Demeinex (2017), Maladies neurologiques en lien avec l’environnement, YearBook Santé et environnement.
- Herbstman J.B. et Mall J.K. (2014), Developmental exposure to polybrominated diphenyl ethers and Neurodevelopment, Curr. Environ. Health Rep., 1:101–112.
- Sagiv S.K., Kogut K., Gaspar F.W. et al. (2015), Prenatal and childhood polybrominated diphenyl ether (PBDE) exposure and attention and executive function at 9-12 years of age, Neurotoxicol Teratol., 52 (Pt B), 151–161.
- Windham G.C., Pinney S.M., Voss R.W. et al. (2015), Brominated flame retardants and other persistent organohalogenated compounds in relation to timing of puberty in a longitudinal study of girls, Environ. Health Perspect., 123:1046–1052.
- Hamra, G. B., Lyall, K., Windham, G. C., Calafat, A. M., Sjödin, A., Volk, H. et Croen, L. A. (2019), Prenatal Exposure to Endocrine-disrupting Chemicals in Relation to Autism Spectrum Disorder and Intellectual Disability, Epidemiology, 30(3), 418-426.
- Lyall K., Anderson M., Kharrazi M. et Windham G.C. (2016), Neonatal thyroid hormone levels in association with autism spectrum disorder, Autism Res. (résumé).
- Charles M.A., Delpierre C. et Bréant B. (2016), Le concept des origines développementales de la santé, Med. Sci. (Paris), 32, 15–20, lire en ligne.
- (en) UC Davis Health System, Public Affairs and Marketing, « Common flame retardant linked to social, behavioral and learning deficits », University of California, (lire en ligne, consulté le ).
- (en) UC Davis Health System, Public Affairs and Marketing, « Low levels of common flame-retardant chemical damages brain cells », University of California, (lire en ligne, consulté le ).
- Vuong, A. M., Braun, J. M., Webster, G. M., Zoeller, R. T., Hoofnagle, A. N., Sjödin, A., ... et Chen, A. (2018), Polybrominated diphenyl ether (PBDE) exposures and thyroid hormones in children at age 3 years, Environment International, 117, 339-347.
- Vuong, A. M., Yolton, K., Poston, K. L., Xie, C., Webster, G. M., Sjödin, A., ... et Chen, A. (2018), Childhood polybrominated diphenyl ether (PBDE) exposure and executive function in children in the HOME Study, International Journal of Hygiene and Environmental Health, 221(1), 87-94.
- Gibson, E. A., Siegel, E. L., Eniola, F., Herbstman, J. B. et Factor-Litvak, P. (2018), Effects of polybrominated diphenyl ethers on child cognitive, behavioral, and motor development, International Journal of Hygiene and Environmental Health, 15(8), 1636.
- Cowell, W. J., Sjödin, A., Jones, R., Wang, Y., Wang, S., Whyatt, R. M., ... et Herbstman, J. B. (2019), Pre-and Postnatal Polybrominated Diphenyl Ether Concentrations in Relation to Thyroid Parameters Measured During Early Childhood, Thyroid, 29(5), 631-641.
- Cowell, W. J., Margolis, A., Rauh, V. A., Sjödin, A., Jones, R., Wang, Y., ... et Herbstman, J. B. (2018), Associations between prenatal and childhood PBDE exposure and early adolescent visual, verbal and working memory, Environment International, 118, 9-16.
- Ji, H., Liang, H., Wang, Z., Miao, M., Wang, X., Zhang, X., ... et Yuan, W. (2019), Associations of prenatal exposures to low levels of Polybrominated Diphenyl Ether (PBDE) with thyroid hormones in cord plasma and neurobehavioral development in children at 2 and 4 years, Environment International, 131, 105010.
- B. Jay Burreson, Moore, Richard E. et Roller, Peter P., « Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta) », Journal of Agricultural and Food Chemistry, vol. 24, no 4, , p. 856–861 (DOI 10.1021/jf60206a040).
- Alison Butler et Carter-Franklin, Jayme N., « The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products », Natural Product Reports, vol. 21, no 1, , p. 180–8 (PMID 15039842, DOI 10.1039/b302337k).
- Evan H. Appelman (1968), Synthesis of perbromates, J. Am. Chem. Soc., 1968, 90 (7), p. 1900–1901, http://pubs.acs.org/doi/abs/10.1021/ja01009a040
- E.H. Appelman (1969), Research Article Perbromic acid and perbromates: synthesis and some properties, J. Am. Chem. Soc., 8, 223-7, http://pubs.acs.org/doi/abs/10.1021/ic50072a008
Voir aussi
Liens externes
- (en) « Technical data for Bromine » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||

