Lithium
Le lithium est l'élément chimique de numéro atomique 3, de symbole Li. C'est un métal alcalin, du premier groupe du tableau périodique des éléments.
Les noyaux atomiques des deux isotopes stables du lithium (6Li et 7Li) comptent parmi ceux ayant l'énergie de liaison par nucléon la plus faible de tous les isotopes stables, ce qui signifie que ces noyaux sont assez peu stables comparés à ceux des autres éléments légers. C'est pourquoi ils peuvent être utilisés dans des réactions de fission nucléaire comme de fusion nucléaire. C'est aussi pourquoi le lithium est moins abondant dans le système solaire que 25 des 32 éléments chimiques les plus légers[11]. Sa surabondance relative dans la nature par rapport aux prédictions de la nucléosynthèse primordiale et stellaire s'explique en fait par sa nucléosynthèse interstellaire (phénomène de spallation cosmique) par bombardement d'éléments plus lourds par des rayons cosmiques.
Pur, le lithium est un métal mou et gris argenté et le plus léger des éléments solides. Il s'oxyde rapidement au contact de l'air et de l'eau, devenant gris foncé, puis rapidement anthracite, puis noir. Comme les autres métaux alcalins, il est conservé dans de l'huile minérale pour le préserver de l'air.
Il est utilisé pour fabriquer des piles électriques et batteries d'accumulateurs rechargeables ou à haute tension (71 %), par l'industrie du verre et des céramiques techniques (14 %), des lubrifiants spéciaux, le traitement de l'air vicié par le CO2, par la métallurgie et l'industrie du caoutchouc et des thermoplastiques, la chimie fine, la production d'alliages. En médecine, il est utilisé pour le traitement du trouble bipolaire et est largement utilisé en psychiatrie malgré sa fenêtre thérapeutique étroite[12] ; en physique nucléaire, il sert à produire du tritium (6Li + n → 4He + 3H) et le deutérure de lithium (6Li2H) est le combustible de la bombe H.
Très réactif, le lithium n'existe pas à l'état natif dans le milieu naturel, mais uniquement sous la forme de composés ioniques. On l'extrait de roches de type pegmatite, ainsi que d'argiles et de saumures. L'élément chimique est le plus souvent directement utilisé à partir des concentrés miniers. On l'obtient industriellement à l'état métallique par l'électrolyse de sel fondu (55 % LiCl et 45 % KCl, à 400 °C).
Les réserves mondiales prouvées de lithium sont estimées par l'Institut d'études géologiques des États-Unis (USGS) à 22 Mt (mégatonnes) fin 2021, dont 42 % au Chili, 26 % en Australie, 10 % en Argentine, 7 % en Chine et 3,4 % aux États-Unis ; l'ensemble des ressources identifiées est estimé à 89 Mt, dont 24 % en Bolivie, 21 % en Argentine, 11 % au Chili, 10 % aux États-Unis, 8 % en Australie et 6 % en Chine. Sa production mondiale est de 100 000 tonnes en 2021, essentiellement en Australie (55 %), au Chili (26 %), en Chine (14 %) et en Argentine (6 %).
Le lithium est présent à l'état de traces dans les océans et chez tous les êtres vivants, et est peut-être un oligoélément (mais aux fonctions encore mal comprises, les animaux et végétaux semblant pouvoir bien vivre dans un milieu dépourvu de lithium).
Histoire

Le lithium (du grec λίθος (lithos) signifiant « pierre »[13]) fut découvert par le chimiste suédois Johan August Arfwedson en 1817 en analysant de la pétalite (LiAlSi4O10)[14] - [15]. En 1800 lors d'un voyage en Europe, José Bonifácio de Andrada e Silva découvrit un nouveau minéral sur l'île de Utö dans la commune de Haninge en Suède qu'il nomma pétalite[16]. C'est en analysant cette roche qu'Arfwedson, dans le laboratoire de Berzelius, identifie un nouvel élément jusque-là inconnu. Plus tard, il le détecte dans des minéraux de spodumène (LiAlSi2O6) et de lépidolite (K(Li,Al)3(Si,Al)4O10(F,OH)2) eux aussi en provenance de l'île de Utö[17]. C'est pour souligner son origine minérale, contrairement aux deux autres alcalins connus à l'époque le potassium et le sodium qui avaient été découverts dans le règne végétal, que Berzelius le nomme lithion[15] - [18] - [19].
En 1818, Christian Gmelin (1792-1860) note que les « sels de lithion » donnent une flamme rouge et brillante[20].
Les deux hommes cherchent à isoler l'élément de son sel mais n'y parviennent pas. L'élément sera isolé par électrolyse d'un oxyde de lithium par William Thomas Brande et Sir Humphry Davy.
La production commerciale de lithium commença en 1923 par la firme allemande Metallgesellschaft AG qui utilisa l'électrolyse d'un mélange de chlorure de lithium et de chlorure de potassium fondu[21].
Les différentes nations impliquées dans le développement de la bombe H à la fin des années 1940 et au début des années 1950 produisent du deutérure de lithium enrichi en lithium 6. Le lithium appauvri est introduit sur le marché des réactifs, augmentant significativement l'incertitude sur la masse atomique du lithium. En conséquence, la masse atomique d'échantillons de lithium (naturels et commerciaux) peut varier entre 6,938 7 et 6,995 9 u[1].
Isotopes
Les deux isotopes stables du lithium présents dans la nature sont 6Li et 7Li, ce dernier étant le plus abondant (92,5 %)[22] - [23].
En 2012, les radioisotopes 3Li, 4Li, 5Li, 8Li, 9Li, 10Li, 11Li, 12Li et 13Li ont par ailleurs déjà été observés[24]. 12Li et 13Li sont ceux qui ont été découverts le plus récemment, en 2008[25]. Parmi ces isotopes radioactifs les plus stables sont le 8Li avec une demi-vie de 838 ms et le 9Li avec une demi-vie de 178 ms[26].
Abondance
Dans l'univers

Selon la théorie moderne de la cosmologie, le lithium est l'un des trois éléments synthétisés au cours du Big Bang, sous forme de lithium 7[28]. La quantité de lithium générée dépend du nombre de photons par baryon, mais l'abondance du lithium peut être calculée pour les valeurs couramment admises pour ce nombre. Il existe cependant une contradiction cosmologique concernant le lithium, les étoiles les plus anciennes semblant contenir moins de lithium qu'elles ne devraient alors que les plus jeunes en possèdent plus[29]. Une hypothèse est que dans les étoiles anciennes, le lithium est mélangé et détruit, alors que les étoiles jeunes en génèrent. Bien que le lithium se transmute en deux atomes d'hélium après collision avec un proton à des températures supérieures à 2,4 millions de degrés Celsius, l'abondance du lithium dans les étoiles les plus jeunes est plus importante que les modèles numériques ne le prévoient[30]. En 2017, douze étoiles de la Voie lactée contenant jusqu'à 2 800 fois plus de lithium que le Soleil ont été observées ; ces étoiles n'ayant pas atteint la phase de géante rouge, le lithium qu'elles contiennent est supposé dater de la formation de celles-ci, mais sa présence demeure largement inexpliquée[31].
Bien qu'il soit l'un des trois éléments synthétisés à l'origine de l'univers, le lithium, tout comme le béryllium et le bore, est nettement moins abondant que d'autres éléments. Cela s'explique par les faibles températures nécessaires à sa destruction et au manque de processus pour le produire[32].
Sur Terre
Le lithium est bien moins abondant que les alcalins et alcalino-terreux usuels (Na, K, Mg, Ca) même s'il est largement distribué dans la nature. Dans la croûte terrestre, les estimations indiquent une concentration variant entre 20 et 70 parties par million (ppm) en poids (c'est-à-dire entre 20 et 70 mg/kg)[33]. À 20 mg par kg de croûte terrestre[34], cela fait du lithium le 33e élément le plus abondant sur Terre[35]. Bien qu'il soit présent dans toutes les régions du monde, on ne le trouve pas à l'état de métal pur du fait de sa réactivité importante avec l'eau et l'air[35]. Le lithium est présent en faible quantité dans les roches magmatiques, sa concentration la plus importante étant au sein des granites. Les pegmatites granitiques sont les minéraux présentant la plus forte abondance en lithium, le spodumène et la pétalite étant les sources les plus viables pour une exploitation commerciale[33]. La lépidolite contient elle aussi du lithium en quantité non négligeable[36]. Une autre source de lithium sont les argiles d'hectorite, exploitées notamment par la Western Lithium Corporation aux États-Unis[37].
Le contenu en lithium total des eaux marines est estimé à 230 milliards de tonnes, avec une concentration relativement constante comprise entre 0,14 et 0,25 ppm[38] - [39] ou 25 micromole[40]. On observe cependant des concentrations plus importantes, proches de 7 ppm, à proximité des monts hydrothermaux[39].
Teneurs et fonction biologique
Le lithium est trouvé à l'état de traces dans le plancton, dans de nombreuses plantes et invertébrés à des concentrations variant de 69 à 5 760 parties par milliard (ppb). Dans les tissus et fluides vitaux des vertébrés, la concentration varie de 21 à 763 ppb[41]. Les organismes marins en bioaccumulent plus que leurs homologues terrestres[42].
Un rôle éventuel d'oligoélément dans tout ou partie du Vivant est soupçonné, notamment depuis les années 1990[43] - [44], mais encore obscur[41].
En 2001, au Japon, une étude nutritionnelles chez les mammifères suggère qu'il serait un oligoélément chez l'humain et les métazoaires. Les auteurs, qui ont utilisé le vers Caenorhabditis elegans comme modèle animal (déjà utilisé pour des études sur les facteurs de longévité)[45], suggèrent une dose journalière admissible d'environ 1 mg/jour[46].
Réserves terrestres et production
Les réserves mondiales prouvées sont estimées à 26 Mt (millions de tonnes) fin 2022 par l'Institut d'études géologiques des États-Unis (USGS) et les ressources identifiées atteindraient 98 Mt. Les réserves prouvées se répartissent pour l'essentiel entre le Chili (36 %), l'Australie (24 %), l'Argentine (10 %), la Chine (8 %) et les États-Unis (4 %). Les ressources identifiées sont situées surtout en Bolivie (21 %), en Argentine (20 %), aux États-Unis (12 %), au Chili (11 %), en Australie (8 %) et en Chine (7 %)[47].
En 2022, la production mondiale de lithium est estimée à 130 000 tonnes par l'USGS, en progression de 21 % par rapport à 2021 (107 000 tonnes) en réponse à une demande mondiale estimée à 134 000 tonnes (+ 41 %), en particulier pour les batteries lithium-ion, et à des prix en hausse. Les principaux producteurs sont l'Australie (47 %), le Chili (30 %), la Chine (15 %) et l'Argentine (5 %)[47].
Pour 2021, des estimations de production légèrement supérieures sont données par BP, avec un total de 106 kt en 2021 ; BP estime les réserves à 20,25 Mt fin 2021[48].
Au rythme de 2022 (130 kt/an), les réserves (26 Mt)[47] correspondent environ à 200 ans de production.
| Pays | Production 2018 | Production 2019 | Production 2020 | Production 2021 | Production 2022 estimée |
Réserves prouvées | Ressources estimées |
|---|---|---|---|---|---|---|---|
| 6 400 | 6 300 | 5 900 | 5 970 | 6 200 | 2 700 000 | 20 000 000 | |
| 58 800 | 45 000 | 39 700 | 55 300 | 61 000 | 6 200 000 | 7 900 000 | |
| nd | nd | nd | nd | nd | nd | 21 000 000 | |
| 300 | 2 400 | 1 420 | 1 700 | 2 200 | 250 000 | 730 000 | |
| 2 400 | 200 | nd | nd | 500 | 930 000 | 2 900 000 | |
| 17 000 | 19 300 | 21 500 | 28 300 | 39 000 | 9 300 000 | 11 000 000 | |
| 7 100 | 10 800 | 13 300 | 14 000 | 19 000 | 2 000 000 | 6 800 000 | |
| nd | nd | nd | nd | nd | nd | 3 000 000 | |
| 900 | 900 | 900 | nd | 900 | 1 000 000 | 12 000 000 | |
| nd | nd | nd | nd | nd | nd | 3 200 000 | |
| nd | nd | nd | nd | nd | nd | 1 700 000 | |
| nd | nd | nd | nd | nd | nd | 1 300 000 | |
| nd | nd | nd | nd | nd | nd | 880 000 | |
| nd | nd | nd | nd | nd | nd | 320 000 | |
| 800 | 900 | 348 | 900 | 600 | 60 000 | 270 000 | |
| nd | nd | nd | nd | nd | nd | 840 000 | |
| nd | nd | nd | nd | nd | nd | 1 000 000 | |
| nd | nd | nd | nd | nd | nd | 1 200 000 | |
| 1 600 | 1 200 | 417 | 710 | 800 | 310 000 | 690 000 | |
| Autres pays | 3 300 000 | ||||||
| Total mondial | 95 000 | 86 000 | 82 500 | 107 000 | 130 000 | 26 000 000 | 98 000 000 |
Les ressources d'autres pays non mentionnés dans ce tableau sont : Namibie 230 000 tonnes, Ghana 180 000 tonnes, Finlande 68 000 tonnes, Autriche 60 000 tonnes, Kazakhstan 50 000 tonnes[47].
Gisements

Le lithium n'existe, en concentration permettant une exploitation économique rentable, qu'en très peu d'endroits sur Terre. C'est principalement une impureté des sels d'autres métaux alcalins, sous forme principalement de :
- chlorure de lithium LiCl, essentiellement dans les saumures de certains vieux lacs salés continentaux et mélangés à d'autres sels de métaux alcalins, de certaines eaux géothermales ou de champs pétrolifères ;
- silicates, dont le spodumène, LiAl (Si2O6) ou la pétalite (Li(AlSi4O10)) dans la pegmatite ;
- hectorite, une sorte d'argile de formule NaO,4Mg2,7LiO,3Si4O10(OH)2, issue de l'altération de certaines roches volcaniques ;
- jadarite, Li Na Si B3O7(OH) qui est un borate ;
- rhassoul, une argile marocaine riche en stevensite (Mg3Si4O10(OH)2 et lithium[50]).
Le plus grand gisement mondial est le salar d'Uyuni, dans le département de Potosí, dans le sud-ouest de la Bolivie. Représentant un tiers de la ressource mondiale, il intéresse notamment le groupe Bolloré[51]. En , la Bolivie a autorisé l'exploitation du lithium sur le désert de sel fossile d'Uyuni et la création d'une usine d'extraction[51].
Le second plus grand gisement est le salar d'Atacama, au Chili qui est depuis 1997 le premier exportateur mondial, avec la compagnie allemande Chemetall comme opérateur principal[51].
L'Argentine possède également un gisement de lithium, au salar del Hombre Muerto, à une centaine de kilomètres au nord d'Antofagasta de la Sierra, dans le nord-ouest du pays, difficile d'accès (seules des pistes en terre naturelle y mènent) mais exploité par FMC depuis 1995[52].
En Australie-Occidentale, dans la pegmatite des mines de Greenbushes, Talison Lithium Ltd extrayait vers 2010-2011 plus de 300 000 t/an de concentré de spodumène contenant 8 000 à 9 000 t de lithium (plus de 25 % de la production mondiale de lithium, dont les réserves prouvées et probables atteignent 31,4 millions de tonnes de minerai renfermant 1,43 % de lithium)[52]. Dans la même région, Galaxy Ressources a entamé en 2010 l'exploitation à ciel ouvert d'un gîte de pegmatite dans la mine de Mount Cattlin, proche de Ravensthorpe, visant une production de 137 000 t/an de concentré de spodumène à 6 % de Li2O avec coproduction d'oxyde de tantale. En 2012, 54 047 t de concentré de spodumène ont été produites. Les réserves prouvées et probables sont de 10,7 Mt de minerai contenant 1,04 % de Li2O et 146 ppm de Ta2O5 « principalement expédié en Chine et transformé en carbonate de lithium »[53].
D'autres gisements sont exploités, notamment des lacs asséchés au Tibet[54], en Russie et aux États-Unis (Silver Peak, Nevada, exploité par Rockwood Lithium) ou au Zimbabwe (mine de Bikita, à ciel ouvert, avec 30 000 t/an de minerai à 4,45 % de Li2O).


Les eaux géothermales de Salton Sea (Californie) sont aussi riches en lithium que les lacs salés boliviens et chiliens. Leur extraction avait été envisagée[55], mais la société chargée du projet a fermé ses portes en 2015[56].
Au Canada, un gisement a été découvert en 2010 aux environs de la baie James, exploité par plusieurs entreprises, jusqu'à sa fermeture en 2014[57]. Un projet de mine est à l'étude dans l'Abitibi[58].
En Afghanistan de très importantes réserves ont été mentionnées en dans la presse[59].
Le gouvernement indien annonce en février 2023 la découverte d'un gisement majeur de lithium dans la région du Jammu-et-Cachemire, dans le nord-ouest du pays. Ce gisement est évalué à 5,9 Mt, soit 5,7 % des réserves mondiales. La découverte est alors au stade « préliminaire » et de nombreuses autres analyses doivent être conduites pour confirmer la taille du gisement[60].
Europe
L'Union européenne prévoit une multiplication par 18 de sa consommation de lithium entre 2020 et 2030. Or la quasi-totalité du lithium qu'elle utilise est importée. Une seule mine de lithium est active en Europe, au Portugal : elle extrait 1 200 tonnes par an qui servent à l'industrie de la céramique. Bruxelles estime que l'Europe pourrait d'ici à 2025 assurer 80 % des besoins de son industrie automobile, principal consommateur.
Toutefois, l'Institut d'études géologiques des États-Unis (USGS) estime en 2021 les réserves européennes (gisements de taille connue et économiquement exploitables) à 60 000 tonnes, soit 0,7 % des réserves mondiales, et les ressources (gisements découverts ou probables) à 7 % du total mondial. Cela permettrait au mieux de couvrir à peine la moitié de la demande pour les voitures électriques en 2030, selon un analyste de Natixis.
En France, des chercheurs du Bureau de recherches géologiques et minières (BRGM) affirment, dans un article paru sur le site The Conversation, que, grâce aux gisements de lithium dans le Massif central ou dans les saumures géothermales d'Alsace, le pays pourrait être autonome pour le lithium, le potentiel minier dépassant les 200 000 tonnes de lithium métal[61].
En Autriche, à proximité de Wolfsberg, European Lithium entend commencer à produire dès 2023. Le projet le plus avancé est celui de Mina do Barroso au nord du Portugal, où la société britannique Savannah Resources espère ouvrir prochainement une première mine dans le plus important gisement de spodumène en Europe. La population locale s'oppose à ce projet, craignant que l'extraction de minerais n'endommage les terres alentour[62].
Rio Tinto annonce fin la suspension de son projet de mine de lithium de la région de Jadar, au sud-ouest de la Serbie, après quatre semaines de manifestations monstres de la part de militants écologistes, qui craignent une pollution des champs de maïs. Le projet prévoyait le début de la commercialisation en 2026 et une production de 58 000 tonnes par an à partir de 2029, soit assez pour équiper un million de voitures électriques[63]. Le , le gouvernement serbe annonce avoir retiré les permis d'exploitation, mettant un point final au projet[64].
En Espagne, l'Estrémadure, région proche du Portugal, recèle d'importants gisements de lithium. La compagnie Lithium Iberia, constituée par un groupe d'entrepreneurs et d'ingénieurs espagnols, développe un projet de mine à Las Navas, dans la commune de Cañaveral, qui devrait produire à partir de 2024 pendant 20 ans 30 000 à 35 000 tonnes par an d'hydroxyde de lithium, durée qui pourrait être prolongée de dix ans. La compagnie australienne Infinity Lithium menait des recherches pour exploiter une mine à ciel ouvert près de San José, à Cáceres, mais ce projet se heurte à une opposition farouche de la population et des élus municipaux, malgré la présentation en d'une nouvelle version, qui passerait de l'exploitation à ciel ouvert à une exploitation en galeries et offrirait de nouvelles garanties pour la restauration des lieux[65].
Le producteur de lithium germano-australien Vulcan Energy Resources envisage une exploitation raisonnée de lithium en Allemagne par extraction de saumure avec réinjection de cette saumure une fois traitée, réduisant drastiquement son empreinte carbone. Vulcan Energy s'engage en 2021 à fournir à Stellantis entre 81 000 et 99 000 tonnes d'hydroxyde de lithium sur cinq ans à partir de 2026[66]. Vulcan Energy Resources, créée en 2018 en Australie, développe un projet d'extraction de lithium de quatre sites géothermiques de la vallée du Rhin. L'eau chaude et salée sera extraite à plus de trois kilomètres de profondeur, puis filtrée pour récupérer le lithium, lequel sera ensuite concentré sur place puis raffiné à Francfort. La chaleur de cette eau à 165 °C sera utilisée pour produire de l'énergie verte, dont une moitié sera utilisée pour le procédé et l'autre revendue aux collectivités locales. Vulcan dispose d'une dizaine de licences en Allemagne et d'une autre en Italie et espère, avec le soutien de Renault et Stellantis, en acquérir en France, en Alsace, où le potentiel est important. Stellantis annonce le avoir investi 50 millions d'euros pour prendre 8 % de Vulcan Energy Resources, qui a signé des contrats avec Renault, Volkswagen, Umicore et LG[67]. En septembre 2022, le premier pilote de son procédé fonctionne à la centrale géothermique d'Insheim, près de Karlsruhe, opérationnelle depuis 2012. Une deuxième installation pilote du procédé doit multiplier les volumes par 200 d'ici à la fin de 2022. La production doit démarrer fin 2024 ; elle est censée atteindre un volume de plus de 50 000 tonnes d'hydroxyde de lithium par an en 2027, à l'issue de plus de deux milliards d'euros d'investissements[68].
Les projets de mines de lithium en Europe se multiplient donc : Syväjärvi en Finlande, Cinovec en Tchéquie, Zinnwald, Brichsal et Karlsruhe en Allemagne, Wolfsberg en Autriche, Soultz-sous-Forêts en Alsace, Échassières dans l'Allier, ou Barroso au Portugal. Mais la plupart de ces gisements sont de petite taille. Selon un rapport de l'université de Louvain, ils pourraient représenter une production de l'ordre de 130 000 tonnes annuelles en 2030, et les projets de raffineries atteindraient 155 000 tonnes, mais ces estimations étaient optimistes car elles prenaient en compte le projet minier de Rio Tinto dans la vallée de Jadar qui a été stoppé par Belgrade.
D'après Eramet, les projets en cours permettraient de répondre au mieux à 15 à 20 % des besoins européens en 2030. Le potentiel du recyclage pourrait être plus important : l'université de Louvain l'estime à 150 000 tonnes en 2030 et 600 000 tonnes en 2050 pour une demande de 700 000 à 860 000 tonnes[69].
Le 29 juin 2023, le groupe minier français Imerys, qui a déjà lancé le projet d'exploitation de lithium de Beauvoir dans l'Allier, annonce un partenariat avec British Lithium en vue d'exploiter les ressources en lithium de la carrière de kaolin d'Imerys à St Austell, dans les Cornouailles, au sud-ouest de l'Angleterre. Une coentreprise entre Imerys (80 %) et British Lithium (20 %) doit être créée pour produire 20 000 tonnes de carbonate de lithium par an, permettant de fabriquer 500 000 véhicules électriques, soit près d'un tiers de la demande annuelle estimée au Royaume-Uni en 2030[70].
France
En France métropolitaine, un gisement (« gîte de gros tonnage à faible teneur en Sn, Ta-Nb, Li, Be », encore inexploité) a été identifié en 1986 par le Bureau de recherches géologiques et minières à Tréguennec (Finistère) sur le site de l'ancienne carrière de Prat-ar-Hastel[71] - [72]. Quelques gisements ont déjà été ponctuellement exploités dans de la lépidolite dans le nord-ouest du Massif central surtout et moindrement dans de la pétalite et amblygonite (à Échassières, à Montrebas ou dans les monts d'Ambazac). En 2015, seul le site d'Echassières en fournit (exploité par le groupe Imerys), comme coproduit de l'exploitation de kaolin, sables et granulats ; le gîte est lié à un apex leucogranitique différencié (à albite). Son potentiel a été estimé par le BRGM à 280 000 t de Li2O, à 0,7 %, sous forme de lépidolite disséminée (mica lithinifère), accompagné de 20 000 t de Sn, 5 000 t de WO3 et 5 000 t de Ta-Nb. Le minerai est assez difficile à exploiter en raison de sa richesse en fer et en fluor[73].
Le BRGM a publié en 2019 un rapport de synthèse sur les ressources en lithium de la France, qui conclut que « les productions de carbonates ou d'hydroxyde de lithium à partir de roche dure actuellement sont tirées exclusivement de pegmatites LCT sous-type spodumène ; à l'exception de très rares indices, ce type d'objet n'existe pas en France métropolitaine. Une production de lithium à partir de roche dure ne pourrait donc être réalisée qu'avec le développement de procédés d'extraction du lithium d'échelle industrielle à partir de minéraux comme la série de la lépidolite, de la zinnwaldite et de la série amblygonite-montebrasite. » Il évalue les ressources en Li2O à 23 564 t de « ressources mesurées » (gisement de Beauvoir, en exploitation) plus 65 895 t de « ressources indiquées » (gisement de Tréguennec[alpha 3]) et 443 200 t de « ressources supposées »[77].
Dans son rapport, le BRGM ajoute que 41 sites potentiels sont recensés en France, essentiellement en Alsace et dans une diagonale allant du Massif armoricain au Massif central[78].
La plaine d'Alsace recèle du lithium dans des aquifères très profonds (entre 1 000 et 4 000 mètres), dans des grès déposés il y a 235 millions d'années. Le tonnage utile était estimé par le BRGM à environ un million de tonnes de lithium métal en 2017. L'Association française des professionnels de la géothermie (AFPG) évalue en 2021 la coproduction possible de lithium en Alsace à 15 000 tonnes par an sur dix sites géothermiques[79] - [80]. De fait, les sociétés ES Géothermie et Fonroche Géothermie, qui exploitent le sous-sol alsacien pour la production de chaleur et d'électricité par géothermie, annoncent en que les eaux chaudes qui remontent du sous-sol alsacien contiennent 180 à 200 mg de lithium par litre. Elles estiment donc la possibilité de fourniture par site à l'équivalent de 1 500 tonnes de carbonate de lithium (LCE) par an.
Globalement, les réserves de LCE du fossé rhénan sont estimées entre 10 et 40 millions de tonnes. Les besoins de l'industrie française, notamment automobile, s'élèvent à 15 000 tonnes de LCE par an[81]. Ainsi, en Alsace, Eramet s'intéresse à la saumure des stations géothermales du fossé rhénan, tout comme Vulcan Energy Resources, côté allemand. Un projet pilote mené par Eramet a déjà permis de raffiner du carbonate de lithium de qualité batterie à partir d'un des sites géothermiques d'ES Géothermie ; la start-up Geolith a aussi des projets à Haguenau ; Lithium de France, filiale du groupe Arverne, s'est implantée à Bischwiller dans l'objectif de produire en même temps de la chaleur et du lithium et vient d'obtenir un permis exclusif de recherche de sites géothermiques dans le Nord Alsace. La start-up strasbourgeoise Viridian annonce la construction, à Lauterbourg (Bas-Rhin), de la première raffinerie de lithium en France, d'une capacité de 25 000 t d'hydroxyde de lithium en 2025, avec une capacité d'expansion jusqu'à 100 000 t/an d'ici à 2030, en exploitant un procédé qui réduirait fortement les émissions de CO2[82].
La recherche de gisements se poursuit en métropole, par exemple en , par une demande de permis exclusif de recherches de lithium et substances connexes (« Permis de bassin de la Limagne », pour cinq ans, sur 707 km 2 dans la région de Clermont-Ferrand), déposée par la société Fonroche Géothermie. Elle fait suite à des études géochimiques du BRGM, qui ont mis en évidence dans le secteur de Riom des eaux souterraines très chaudes[83] contenant 80 mg/l ou plus de lithium[84].
Gisements exploités
À Beauvoir dans l'Allier, le projet Emili, « l'un des plus grands projets d'extraction de lithium » européens, annoncé le 24 octobre 2022 par le groupe français de minéraux industriels Imerys, prévoit l'ouverture, d'ici 2027, d'une mine de lithium dont Imerys estime les réserves à 1 million de tonnes. La mine produirait 34 000 tonnes d'hydroxyde de lithium par an à partir de 2028 pendant au moins 25 ans[85]. Dans cette carrière, ouverte depuis 1850, sont déjà extraites chaque année quelque 30 000 tonnes de kaolin. Le site a été racheté en 2005 par Imerys[86]. La production de lithium permettrait d'équiper 700 000 voitures électriques — et de limiter au maximum l'empreinte carbone de l'extraction : huit tonnes de CO2 par tonne d'hydroxyde de lithium, contre 15 à 20 t pour des projets similaires en Asie et en Australie[87].
En , la société minière australienne Vulcan Energy crée une entité française et dépose une première demande de permis de recherche dans le nord de l'Alsace, près de Haguenau, pour extraire du lithium des eaux géothermales. Elle a demandé un permis similaire en Allemagne, où la production commerciale devrait débuter autour de 2025 et atteindre une capacité de 8 000 tonnes d'hydroxyde de lithium par an et par module, c'est-à-dire par station de géothermie ; elle table sur trois modules dans un premier temps[88].
Dans les territoires d'outre-mer, des indices ponctuels d'une faible présence de minéraux à lithium ont été trouvés en Guyane par le BRGM[89].
En janvier 2023, Eramet et Électricité de Strasbourg signent un protocole d'accord pour développer la production de lithium à partir des saumures géothermales du bassin rhénan. La production envisagée pour la fin des années 2020 est d'environ 10 000 tonnes de carbonate de lithium par an, de quoi fabriquer quelque 250000 batteries de voitures électriques. Elle compte utiliser le procédé d'extraction directe du lithium mis au point par Eramet, qui consiste à capter le lithium à l'aide d'un matériau « éponge » et à réinjecter l'eau dans la nappe où elle a été pompée, procédé économe en eau et en énergie[90].
Le 31 mai 2023, Stellantis et Vulcan Energy signent un accord pour une étude de faisabilité destinée à préciser les potentiels en chaleur et en lithium du réservoir géothermal sous-jacent au site d'assemblage alsacien de Stellantis à Mulhouse. La chaleur extraite pourrait couvrir une partie des besoins de l'usine et le lithium serait raffiné par Vulcan Energy, probablement à Francfort, pour alimenter la fabrication de batteries. Un premier partenariat entre les deux sociétés a été conclu pour le site de Rüsselsheim, en Allemagne[91].
Production
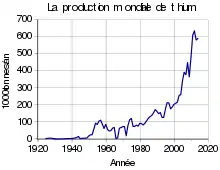
L'USGS estime la production mondiale en 2022 à 130 000 tonnes (2021 : 107 000 tonnes ; 2020 : 82 500 tonnes), dont 61 000 tonnes en Australie, 39 000 tonnes au Chili, 19 000 tonnes en Chine et 6 200 tonnes en Argentine[47].
En 2022, un tiers de la production mondiale de lithium (soit la moitié de la production des grandes entreprises) dépendrait de deux sociétés minières contrôlées par des investisseurs chinois[93].
En 2017, 136 petites compagnies ont investi 157 millions de dollars dans la recherche du lithium, un doublement par rapport à 2016[94].
Entre 2005 et 2015, la production a augmenté de 20 % par an, passant de 16 600 à 31 500 tonnes par an. Portée par la demande, cette hausse a eu pour conséquence une augmentation du prix du lithium[95], qui à son tour a suscité la réouverture de mines fermées antérieurement, comme la mine à ciel ouvert de Mt Cattlin en Australie, ainsi que la relance de la recherche géologique : de nouveaux gisements ont été découverts, dans le Nevada, en Serbie et au nord du Mexique. De nombreux projets de nouvelles mines sont en développement : une étude de Citigroup en a recensé seize, notamment au Canada, aux États-Unis, en Australie et en Argentine. La structure d'oligopole formée par quatre entreprises qui ont produit la majorité du métal consommé en 2014 va disparaître ; ces quatre grands sont les Américains Albemarle (par l'intermédiaire de ses filiales Rockwood Lithium, Talison Lithium, etc.) et FMC, le Chilien Sociedad Química y Minera de Chile (SQM) et le Chinois Tianqi[96].
Le « triangle du lithium », réparti entre le Chili, l'Argentine et la Bolivie, recèlerait 85 % des réserves mondiales. En Argentine, les investissements d'exploration ont explosé : +928 % depuis 2015. Plus d'une vingtaine d'entreprises étrangères mènent des projets ; deux mines sont en activité et une est en construction en 2019. Au Chili, l'exploitation du lithium est supervisée par l'État et l'organisme gouvernemental Corfo attribue des quotas de production aux entreprises, principalement la chilienne SQM, la chinoise Tianqi, qui a racheté 24 % des parts de SQM en 2018, et l'américaine Albemarle. En Bolivie, le gouvernement d'Evo Morales contrôle l'exploitation du métal, même si sa production est bien inférieure à celle de ses voisins ; la firme nationale YLB a signé des accords de partenariats avec l'entreprise allemande ACI Systems et le chinois Xinjiang Tbea. Des projets de construction d'usines de batteries sont envisagés au Chili et en Bolivie[97].
Des scientifiques de l'Institut de technologie de Karlsruhe déposent en 2020 un brevet pour un processus d'extraction du lithium contenu dans les eaux profondes du fossé rhénan supérieur lors de leur passage dans les centrales géothermiques. Une installation d'essai est en cours de construction dans une de ces centrales. La concentration en lithium dans ces eaux irait jusqu'à 200 milligrammes par litre. En traitant les deux milliards de litres d'eau du Rhin qui transitent chaque année par les centrales géothermiques, des centaines de tonnes de lithium pourraient être extraites de façon rentable et sans effets négatifs sur l'environnement[98].
Des chercheurs de l'université des sciences et technologies du roi Abdallah (KAUST), en Arabie saoudite, affirment en avoir mis au point une cellule électrochimique permettant d'extraire à un coût intéressant le lithium contenu dans l'eau de mer, dont les réserves sont selon eux 5 000 fois supérieures à celles des gisements terrestres (voir plus haut). Les coproduits de ce procédé seraient de l'hydrogène et du chlore, le premier étant également intéressant pour le secteur des transports[99] - [100].
En mai 2023, l'australien Allkem fusionne avec l'américain Livent, donnant naissance au troisième producteur mondial de lithium, derrière le chilien SQM et l'américain Albemarle. La production du nouveau groupe représentera environ 7 % de la production mondiale de lithium. Les capacités de production annuelles estimées pour 2027 sont de 343 kt pour Albemarle, 302 kt pour SQM, 248 kt pour Allkem+Livent et 229 kt pour le chinois Ganfeng[101].
Propriétés
Le lithium est le métal ayant la plus faible masse molaire et la plus faible densité, avec une masse volumique inférieure de moitié à celle de l'eau. Conformément à la loi de Dulong et Petit, c'est le solide ayant la plus grande chaleur massique.
Comme les autres métaux alcalins, le lithium réagit facilement au contact de l'eau ou de l'air (cependant moins que le sodium) ; il n'existe pas à l'état natif.
Lorsqu'il est placé au-dessus d'une flamme, celle-ci prend une couleur cramoisie mais lorsqu'il commence à brûler, la flamme devient d'un blanc très brillant. En solution, il forme des ions Li+.
Propriétés physiques

Le lithium a une masse volumique très faible de 0,534 g/cm3, du même ordre de grandeur que le bois de sapin. C'est le moins dense de tous les éléments solides à température ambiante, le suivant étant le potassium avec une densité 60 % plus élevée (0,862 g/cm3). De plus, hormis l'hydrogène et l'hélium, il est moins dense que tous les autres éléments à l'état liquide. Sa densité est de deux tiers de celle de l'azote liquide (0,808 g/cm3)[102].
Le lithium peut flotter sur les huiles d'hydrocarbure les plus légères et est, avec le sodium et le potassium, l'un des rares métaux pouvant flotter sur l'eau.
Utilisation
Estimation des usages du lithium à l'échelle mondiale en 2020[103].
- Piles et batteries (71 %)
- Verres et céramiques (14 %)
- Graisses lubrifiantes (4 %)
- Polymères (2 %)
- Coulée continue (2 %)
- Traitement de l'air (1 %)
- Autres usages (6 %)
En 2020, le lithium est utilisé pour réaliser des piles et des batteries au lithium (71 % de la production de lithium), des verres et des céramiques (14 %), pour les graisses lubrifiantes (4 %), et à des taux moindres pour les matériaux comme dans la métallurgie (coulée continue : 2 %), la production de polymères (3 %), ainsi que pour le traitement de l'air (recyclage de l'air dans des espaces confinés : 1 %)[103] - [104].
Stockage de l'électricité
Le lithium est souvent utilisé dans les électrodes[105] de batterie du fait de son grand potentiel électrochimique. Les batteries lithium sont très utilisées dans le domaine des systèmes embarqués du fait de leur grande densité énergétique aussi bien massique que volumique. En 2020, c'est le premier usage du lithium à l'échelle mondiale : 71 %[103].
Carburant pour fusées et missiles
Le lithium sous forme métallique ou d'aluminate est utilisé comme additif à haute énergie pour la propulsion des fusées[106]. Sous cette forme, il peut aussi être utilisé comme combustible solide[107].
Verres et céramiques
Le lithium est parfois utilisé dans les verres et les céramiques à faible expansion thermique, comme pour le miroir de 200 pouces du télescope Hale du Mont Palomar[108] ; par ailleurs, il réagit faiblement aux rayons X, les verres au lithium (méta- et tétraborate de lithium) sont donc utilisés pour dissoudre des oxydes (méthode de la perle fondue) en spectrométrie de fluorescence des rayons X.
Graisses lubrifiantes
La troisième utilisation la plus courante du lithium est celle des graisses lubrifiantes. L'hydroxyde de lithium est une base qui, lorsqu'elle est chauffée avec une graisse, produit un savon composé de stéarate de lithium. Le savon au lithium a la capacité d'épaissir les huiles et il est utilisé pour fabriquer des graisses lubrifiantes à haute température[109] - [110] - [111].
Polymères
Les organolithiens sont utilisés dans la synthèse et la polymérisation des élastomères.
Métallurgie
Le lithium (par exemple sous forme de carbonate de lithium) est utilisé comme additif dans les laitiers de coulée continue où il augmente la fluidité[112], une utilisation qui représente 2 % de l'utilisation mondiale de lithium en 2020[103]. Les composés du lithium sont également utilisés comme additifs dans le sable de fonderie pour la fonte afin de réduire le veinage[113].
Lorsqu'il est utilisé comme flux de brasage pour le soudage ou le brasage, le lithium métallique favorise la fusion des métaux durant le processus[114] et élimine la formation d'oxydes en absorbant les impuretés[115]. Les alliages métallique du lithium avec l'aluminium, le cadmium, le cuivre et le manganèse sont utilisés pour fabriquer des pièces d'aéronefs à haute performance (les alliages aluminium-lithium (en) sont utilisés en France sur le Rafale)[116].
Traitement de l'air
Le chlorure de lithium et le bromure de lithium sont extrêmement hygroscopiques et sont utilisés comme dessiccants[109].
L'hydroxyde de lithium et le peroxyde de lithium (Li2O2) sont les sels les plus utilisés dans les endroits confinés, comme à bord des engins spatiaux et des sous-marins, pour éliminer le dioxyde de carbone et purifier l'air. L'hydroxyde de lithium absorbe le dioxyde de carbone de l'air en formant du carbonate de lithium et est préféré aux autres hydroxydes alcalins à cause de son faible poids.
En présence d'humidité le peroxyde de lithium réagit avec le dioxyde de carbone pour former du carbonate de lithium, mais libère également de l'oxygène[117] - [118]. La réaction chimique est la suivante :
- 2 Li2O2 + 2 CO2 → 2 Li2CO3 + O2
Pour ces raisons, certains des composés mentionnés, ainsi que le perchlorate de lithium, sont utilisés dans les générateurs d'oxygène qui alimentent les sous-marins en oxygène[119].
Médecine, toxicologie
Dans les années 1940, on découvre que le lithium peut calmer certains patients psychotiques[120]. Les sels de lithium (ex. : carbonate de lithium, le citrate de lithium ou l'orotate de lithium) sont depuis les années 1970 le traitement de référence des troubles bipolaires (anciennement psychose maniaco-dépressive)[121] - [122] - [123], seuls ou avec d'autres thymorégulateurs à une concentration thérapeutique de 0,8 à 1,2 mEq/L (0,8 à 1,2 mmol/L)[124].
Le lithium est aussi utilisé comme antidépresseur ou avec certains antidépresseurs, tels la fluoxétine, pour traiter les troubles obsessionnels compulsifs, certains autres troubles de l'humeur[125], dont certaines tendances suicidaires[126]. On suppose que le principe actif en est l'ion Li+, mais ses mécanismes d'actions précis sont encore débattus.
Le gluconate de lithium est utilisé en dermatologie comme anti-allergénique et dans le traitement de la dermite séborrhéique du visage chez l'adulte.
Le lithium est aussi utilisé dans les troubles du sommeil et l'irritabilité en oligothérapie (malgré l'absence d'activité spécifiquement démontrée).
Il pourrait ralentir la progression de la sclérose latérale amyotrophique (SLA), selon les résultats d'une étude pilote publiés dans Proceedings of the National Academy of Sciences (PNAS).
Une étude de 1990 laisse penser que les populations exposées à une eau de boisson contenant un peu plus de lithium que la moyenne connaitrait moins de crimes, suicides, arrestations et de risque d'addiction, comparativement à la population générale[127]. Près de 20 ans plus tard, une autre étude conforte en 2009 l'hypothèse d'un moindre risque de suicide chez les personnes buvant une eau plus riche en lithium[128].
Mécanisme d'action
Le mécanisme d'action est encore mal compris, mais on sait au moins que le lithium affecte deux voies de signalisation intracellulaires[124] : l'inositol monophosphate (inhibition de l'inositol intracellulaire, ce qui est peut-être le mécanisme de stabilisation de l'humeur) et la glycogène synthase kinase-3 (inhibition de cette enzyme impliquée dans diverses voies de signalisation du métabolisme énergétique, de la neuroprotection et de la neuroplasticité cérébrale).
Toxicologie
Le lithium n'est thérapeutiquement efficace que dans une étroite fourchette de doses, « de sorte qu'une grande partie des patients sous thérapie chronique au lithium connaissent au moins un épisode de toxicité pendant le traitement ». Le lithium intracellulaire est alors le plus élevés dans les cellules du cerveau et des reins ; dans les cellules tubulaires distales des reins, il est 10 à 20 fois plus concentré que dans le sérum sanguin, alors rapidement source de toxicité aigue pour ces cellules, ce qui se traduit par leur nécrose et le dysfonctionnement du rein[124].
L'intoxication aigue sévère semble rare et souvent associée à des erreurs de posologie ou de prise de médicament. Se forment alors des lésions cérébelleuses persistantes accompagnées, notamment, de tremblements, d'ataxie et de dysarthrie, et parfois de problèmes persistants de ganglions de la base[124]. À partir de 1,5 mmol/L environ, le patient devient ataxique, hypertonique, hyperréflexe, dysarthrique et confus, présentant souvent un tremblement grossier et une fasciculation musculaire. À partir de 3 mmol/L, des convulsions, puis un coma et des lésions cérébrales irréversibles peuvent entrainer la mort[124].
L'intoxication chronique est bien plus fréquente, qui a comme « complications biologiques classiques » une hypercalcémie, un diabète insipide[129] (diabète « néphrogénique » qui est l'effet secondaire le plus courant des traitements longs selon une méta-analyse publiée en 2012[130]), un dysfonctionnement thyroidien[124] et d'éventuels troubles cardiovasculaires, allant de changements de repolarisation bénins à (rarement) des tachyarythmies potentiellement mortelles, ou à des anomalies du temps de conduction, et (très rarement) à un bloc auriculo-ventriculaire complet avec choc cardiogénique[12]. En cas de « thérapie au lithium à long terme, les concentrations dans la plage thérapeutique sont associées à une mauvaise mémoire, à de la fatigue, à une perte de concentration et à un léger tremblement »[124].
Le lithium et ses sels ont une toxicité longtemps réputée réversible (symptômes disparaissant avec l'arrêt de la source), mais on sait maintenant que si la toxicité rénale aiguë est effectivement temporaire, le diabète insipide néphrogénique induit peut persister après l'arrêt d'un traitement long[124] - [131] ; la polyurie, la polydipsie sont souvent, associées au diabète insipide néphrogénique, des complications des traitements au lithium[124]. Ces effets surviennent parfois rapidement après le début du traitement[124].
Dans tous les cas, ce métal présente une néphrotoxicité non négligeable qui pour les faibles doses (intoxication généralement chronique) génère des anomalies tubulaires distales, et pour les fortes doses induit des lésions tubulaires proximales caractéristiques[124]. Pour ces raisons, le médecin prescrit normalement aux patients traités ou à traiter un bilan rénal (en début de traitement) puis un dosage mensuel du lithium sanguin. Le diagnostic d'une intoxication au lithium est rendu difficile par le fait que, quand les concentrations sériques de lithium sont élevées, les tissus cibles sont protégés dans une certaine mesure, mais « les taux de lithium dans le sérum ne reflètent pas les niveaux tissulaires et la corrélation entre les niveaux de lithium et sa toxicité est faible (...) Ce sont les symptômes qui sont à prendre en compte plutôt que les taux sériques de lithium »[124]. Dans le tube collecteur des reins, le lithium, par un mécanisme encore incompris, inhibe la fonction des aquaporines (aquaporine-2 surtout) ; une inhibition de l'activité de l'adénylate cyclase semble en cause[132].
En cas d'intoxication ou d'empoisonnement criminels, le bilan toxicologique d'urgence (screening immunologique sanguin et screening urinaire par CL-SM) peut ne rien révéler, car le taux sanguin ou urinaire de lithium retourne rapidement à la normale. Mais l'analyse du lithium dans le cheveux permet a posteriori de « documenter une exposition au lithium pendant la période supposée des faits »[133]. L'hémodialyse permet de protéger la fonction rénale et le cas échéant de traiter une « altération de l'état de conscience »[129].
En cas d'intoxication, « une étroite collaboration avec le service de neurologie, de néphrologie et de psychiatrie est fondamentale : l'intoxication au lithium doit être prise au sérieux, même en cas de lithémie normale, et surtout en présence de signes neurologiques. L'utilisation de l'EER doit être discutée assez tôt dans la prise en charge car le temps pris pour réduire la concentration en lithium est proportionnelle avec le risque de neurotoxicité chronique »[129].
Énergie
Selon Bernard Bigot, physicien et directeur du projet ITER, si la fusion thermonucléaire est maitrisée, 1 g de lithium et 50 litres d'eau suffisent pour extraire les isotopes de l'hydrogène nécessaires à la production de la consommation électrique d'une vie terrestre occidentale, énergie électrique qui produit relativement peu de déchets[134] - [135].
Autres usages
- Le lithium est un agent réducteur et/ou complexant utilisé pour la synthèse de composés organiques.
- Les sels de lithium sont utilisés pour le transfert de chaleur par convection.
- Pour la production de tritium par réaction nucléaire, qui est ensuite utilisé pour la fusion nucléaire (cf. section Énergie).
- Le lithium est, avec le potassium, un de deux alcalins possédant un isotope fermionique stable, d'où son intérêt pour l'étude des gaz ultrafroids fermioniques dégénérés.
Le lithium 6 est une matière nucléaire dont la détention est réglementée[136].
Économie, consommation
La demande ayant explosé, notamment pour la production de batteries lithium-ion pour le marché de l'informatique et de la téléphonie, le prix du lithium est passé d'environ 310 à 2 000 €/t (350 à près de 3 000 $/t) entre 2003 et 2008[51], et dépasse 9 000 $/t en 2017[137].
Un rapport de la Banque mondiale publié en [138] prévoit que le développement des accumulateurs électriques utilisés pour stocker l'électricité produite par les sources éoliennes et solaires pourrait entraîner un bond de 1000 % de la demande de lithium, si le monde prend les mesures requises pour contenir l'élévation de la température nettement en dessous de 2 °C par rapport aux niveaux préindustriels.
Les analystes de la banque Morgan Stanley prévoient toutefois, en [139] une chute de 45 % du prix du lithium d'ici à 2021 grâce aux nombreux projets en développement au Chili, qui pourraient augmenter l'offre mondiale de 500 000 t/an. Les experts de Wood Mackenzie prévoient également que dès 2019, la hausse de l'offre commencera à dépasser celle de la demande et que le niveau des prix déclinera en conséquence.
Selon un rapport gouvernemental chinois cité en par un média hongkongais, la Chine serait désormais capable de diviser par huit le coût d'extraction du lithium : de 17 000 $ par tonne actuellement facturés en moyenne sur les contrats à longs terme, il passerait à moins de 2 200 $. Avec une telle opportunité et la présence de la quatrième plus grande réserve de lithium au monde dans ses sols[140], la Chine deviendrait un acteur incontournable dans la production de batteries[141].
Après avoir culminé à 84 500 $/t en novembre 2022, les cours du lithium ont reculé de 37 % à 53 200 $/t au début mars 2023. Le décrochage des prix s'explique avant tout par une chute de la demande en Chine de la part des constructeurs automobiles, consécutive au recul des ventes de voitures électriques ou hybrides rechargeables. Celui-ci est lui-même causé par la fin du programme de subventions de Pékin à l'achat de véhicules électriques de 87 milliards de dollars en . Or la Chine représente 64 % des ventes mondiales de voitures électriques. De plus, le géant des batteries CATL a proposé de vendre des modules à prix très réduits. Enfin, la production minière de lithium devrait progresser de 41 % en 2023, selon Rystad Energy[142].
Politique
En , le Parlement mexicain adopte une loi interdisant toute nouvelle concession d'exploitation du lithium dans le pays et le gouvernement envisage la nationalisation de ses ressources. Selon le président Andrés Manuel López Obrador, son prédécesseur Enrique Peña Nieto aurait accordé 150 000 hectares de concessions. Le projet majeur est celui d'une entreprise à capitaux chinois, Bacanora, qui revendique dix concessions minières couvrant environ 100 000 hectares dans l'État de Sonora, où elle compte commencer sa production dès 2023, avec pour objectif 35 000 tonnes de lithium par an[143] - [144]. Le , un décret du gouvernement mexicain crée l'entreprise d'État Litio para Mexico (« Lithium pour le Mexique »), ou « LitioMx », avec pour mission « l'exploration, l'exploitation » du lithium sur le territoire national « ainsi que l'administration et le contrôle des chaînes de valeur économique ». L'entreprise devra être opérationnelle dans un délai de six mois[145].
En France, en , la ministre de la Transition écologique, Barbara Pompili, se déclare favorable à une ouverture de mines de lithium en France[146].
En avril 2023, le président chilien Gabriel Boric annonce le projet de créer une entreprise nationale du lithium contrôlée à 100 % par l'État, qui aura une participation de contrôle dans tous les futurs projets d'exploitation. En attendant cette création, l'entreprise publique du cuivre Codelco sera chargée de nouer des alliances stratégiques avec des entreprises privées, nationales ou étrangères, tout en gardant le contrôle des futures sociétés. Le Chili est le deuxième producteur mondial derrière l'Australie, et ses mines de lithium sont exploitées sous forme de concessions par deux entreprises privées, la chilienne SQM et l'américaine Albemarle[147].
Ressource, environnement
Pénurie
Le lithium est nécessaire à la fabrication des batteries lithium-ion de voitures électriques et hybrides actuelles. Le risque de pénurie, en l'état actuel des technologies, est important[148]. Le cabinet Meridian International Research estimait en 2007 que les réserves ne suffiront pas même au remplacement initial du parc mondial de voitures, avant même que le recyclage du lithium puisse être pris en compte[149].
En 2015, une explosion de la demande pour les voitures électriques a entraîné une tension sur le marché du lithium ; les prix du carbonate de lithium ont commencé à grimper en Asie, jusqu'à atteindre des records en . Depuis, avec l'afflux de production, ils ont chuté de 40 %, puis se sont stabilisés autour de 12 000 $ la tonne en 2019. D'après les analystes de Roskill, la demande dépassera un million de tonnes d'équivalent carbonate de lithium (LCE) d'ici à 2026, contre un peu plus de 320 000 tonnes en 2018. Goldman Sachs estime, de son côté, qu'il faudra quadrupler la production dans les dix ans à venir[150].
Des alternatives aux batteries au lithium sont recherchées : des batteries sodium-ion, en développement depuis les années 2010, pourraient être moins chères et contourner le problème de réserves, mais elles sont encore peu performantes ; de même pour les accumulateurs lithium fer phosphate.
Impact de l'extraction
Le lithium métallique réagit avec l'azote, l'oxygène et la vapeur d'eau de l'air. Sa surface devient alors un mélange d'hydroxyde de lithium (LiOH) corrosif du fait de son pH fortement basique, de carbonate de lithium (Li2CO3) et de nitrure de lithium (Li3N). Une attention particulière devrait être portée aux organismes aquatiques, exposés à la toxicité des sels de lithium[151] - [152].
L'extraction du lithium a un impact environnemental important. En effet, le procédé d'extraction consiste à :
- pomper la saumure présente dans le sous-sol des lacs salés ;
- augmenter la salinité de la saumure (par évaporation) ;
- purifier et traiter la saumure au chlore afin d'obtenir le carbonate de lithium (Li2CO3) pur à 99 % ;
- effectuer la calcination du carbonate pour obtenir l'oxyde Li2O.
Pomper la saumure consomme du carburant, puis l'évaporation requiert de larges espaces de salins ; puis la calcination du carbonate de lithium consomme de l'énergie et libère en tant que processus physique du CO2[153] - [154].
Les populations vivant près des sites d'extraction, sont affectées par la contamination de leurs sols. Sur le plateau tibétain, autour des lacs asséchés, les cancers se multiplient, du fait des solvants utilisés pour la production, et le lithium présent dans les sources d'eau provoque des intoxications[155].
Une forte hausse de la demande stimule la recherche et l'exploration de nouveaux gisements, ce qui conduit, selon l'association Les Amis de la Terre, à bafouer les droits collectifs à la terre des peuples indigènes, pourtant prévus par la convention 169 de l'OIT[156].
Recyclage
Le lithium des piles et batteries est longtemps resté peu recyclé en raison du faible taux de collecte, des prix bas et volatils du lithium sur les marchés, et de coûts réputés élevés du recyclage, comparés à ceux de la production primaire[52].
La première usine de recyclage de lithium métal et de batteries lithium-ion fonctionne depuis 1992 en Colombie britannique (Canada). Une autre, aux États-Unis, recycle les batteries lithium-ion de véhicules électriques depuis 2015, à Lancaster (Ohio). Sept autres, au Canada et aux États-Unis, ont commencé ou vont commencer le recyclage[103].
En 2009, le groupe Nippon Mining & Metals répond à un appel à projets du METI et doit inaugurer en 2011 une unité industrielle de récupération du cobalt, du nickel, du lithium et du manganèse des cathodes de batteries lithium-ion[157].
En Europe, le recyclage émerge dans les anénes 2010 : en Belgique, Umicore (par voie pyrométallurgique), et en France Récupyl à Domène (par voie hydrométallurgique)[52] s'y consacrent, mais la liquidation judiciaire de Récupyl est prononcée le [158]. La Société nouvelle d'affinage des métaux (SNAM) à Viviez (Aveyron), filiale de la holding belgo-floridienne, retraite 6 000 tonnes d'accumulateurs par an, dont 8 % de batteries d'automobiles en 2017 ; elle doit fabriquer à partir de 2018 des batteries avec les composants recyclés. SNAM ouvrira d'abord au printemps 2018 un atelier pilote de batteries lithium-ion recyclées. Pour la fabrication en série, elle annonce un autre site (dans l'Aveyron) pour y ouvrir en 2019 une usine d'une capacité de 20 MWh par an. Elle améliorera ensuite les procédés pour passer à 4 000 MWh par an vers 2025. Les constructeurs automobiles ne voulant pas de batteries recyclées, la société vise le marché en croissance du stockage de l'électricité dans l'industrie, le bâtiment et les énergies renouvelables[159].
Des études portent sur de nouveaux moyens de recycler le lithium des batteries[160]. Le lithium contenu dans les verres et céramiques reste toutefois trop diffus pour être récupéré.
Le 9 mai 2023, Glencore s'associe à l'entreprise canadienne Li-Cycle pour étudier la création d'un centre européen de recyclage de batteries au lithium à Portovesme, en Italie. La construction de ce nouveau centre pourrait débuter entre fin 2026 et début 2027. Il aurait la capacité de traiter entre 50 000 et 70 000 t de déchets prétraités par an[161].
Le rapport 2023 de l'USGS recense 44 compagnies aux Canada et aux États-Unis et 47 autres en Europe qui recyclent les batteries au lithium ou prévoient de le faire[47].
Balance commerciale
La France, selon ses douanes, était importatrice nette de lithium en 2014, à un prix moyen à l'import de 7 900 € par tonne[162].
Notes et références
Notes
- Cette masse atomique est celle d'un échantillon de référence. La masse atomique du lithium peut varier entre 6,938 7 et 6,995 9 u, soit M = 6,967 ± 0,03 u, avec un écart significatif entre le lithium naturel non contaminé par le lithium enrichi en 7Li et le lithium commercial[1] - [2]. Norman Holden suggère[1] que la masse atomique du lithium soit prise égale à 6,94 ± 0,06 u, soit avec une erreur de 0,9 %.
- Les statistiques de production de l'USGS excluent les États-Unis pour cause de secret commercial.
- Ce gisement, très riche, est situé sur une zone côtière gérée par le Conservatoire du littoral, et donc dans un espace naturel protégé, ce qui rend difficile une possible exploitation[74] - [75] ; cela d'autant plus que le maire de Tréguennec est très hostile à cette perspective d'extraction[76].
Références
- (en) Norman E. Holden, « The Impact of Depleted 6Li on the Standard Atomic Weight of Lithium », Chemistry International, Walter de Gruyter GmbH, vol. 32, no 1, (ISSN 1365-2192, DOI 10.1515/ci.2010.32.1.14, lire en ligne).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- "Ionization Energies of Atoms and Atomic Ions," in CRC Handbook of Chemistry and Physics, 91st Edition (Internet Version 2011), W. M. Haynes, ed., CRC Press/Taylor and Francis, Boca Raton, FL., p. 10-203
- « Lithium, elemental » dans la base de données Hazardous Substances Data Bank, consulté le 1 mai 2010
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- SIGMA-ALDRICH
- « Lithium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) « LITHIUM », sur https://cameochemicals.noaa.gov
- Entrée « Lithium » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 mars 2011 (JavaScript nécessaire)
- (en) Katharina Lodders, « Solar System Abundances and Condensation Temperatures of the Elements », The Astrophysical Journal, vol. 591, no 2, , p. 1220 (DOI 10.1086/375492, lire en ligne).
- (en) Theodoros Kalpakos, Gaëlle Vermeersch, Bart Hendriks et Paul Vermeersch, « Complete atrioventricular block with diastolic mitral regurgitation due to severe lithium intoxication. A case report », Acta Cardiologica, vol. 77, no 10, , p. 873–878 (ISSN 0001-5385, PMID 35322750, DOI 10.1080/00015385.2022.2054493).
- Krebs 2006, p. 47.
- Éditions Larousse, « lithium », sur Encyclopédie Larousse en ligne (consulté le ).
- Roger Naslain, « Lithium », sur Encyclopædia Universalis (consulté le ).
- Weeks 2003, p. 484-486.
- Weeks 2003, p. 487.
- Weeks 2003, p. 486.
- (de) Nikolaj A. Figurovskij, Die Entdeckung der chemischen Elemente und der Ursprung ihrer Namen, , 280 p. (ISBN 978-3-7614-0561-1 et 3761405618).
- (de) C. G. Gmelin, « Von dem Lithon », Annalen der Physik, Wiley-Blackwell, vol. 59, no 7, , p. 238-241 (ISSN 0003-3804, DOI 10.1002/andp.18180590702, lire en ligne).
- Garrett 2004, p. 99.
- Coplen et al. 2002.
- Tomascak 2004, p. 1.
- Audi et al. 2012, p. 1179-1180.
- Audi et al. 2012, p. 1180.
- (en) G. Audi, O. Bersillon, J. Blachot et A.H. Wapstra, « The Nubase evaluation of nuclear and decay properties », Nuclear Physics A, Elsevier BV, vol. 729, no 1, , p. 3-128 (ISSN 0375-9474, DOI 10.1016/j.nuclphysa.2003.11.001, lire en ligne).
- (en) ESO, « First Detection of Lithium from an Exploding Star », sur ESO, (consulté le ).
- (en) Ann Merchant Boesgaard et Gary Steigman, « Big Bang Nucleosynthesis: Theories and Observations », Annual Review of Astronomy and Astrophysics, Annual Reviews, vol. 23, no 1, , p. 319-378 (ISSN 0066-4146, DOI 10.1146/annurev.aa.23.090185.001535, lire en ligne).
- (en) A. J. Korn, F. Grundahl, O. Richard, P. S. Barklem, L. Mashonkina, R. Collet, N. Piskunov et B. Gustafsson, « A probable stellar solution to the cosmological lithium discrepancy », Nature, Nature Publishing Group, vol. 442, no 7103, , p. 657-659 (ISSN 0028-0836, DOI 10.1038/nature05011, lire en ligne).
- (en) Fraser Cain, « Why Old Stars Seem to Lack Lithium », sur Universe Today, (consulté le ).
- (en) Haining Li, Wako Aoki, Tadafumi Matsuno, Yerra Bharat Kumar, Jianrong Shi, Takuma Suda et Gang Zhao, « Enormous Li Enhancement Preceding Red Giant Phases in Low-mass Stars in the Milky Way Halo », The Astrophysical Journal Letters, vol. 852, (lire en ligne).
- (en) « Cosmic abundance of the elements and nucleosynthesis » (version du 1 septembre 2006 sur Internet Archive).
- Kamienski et al. 2004.
- (en) SR Taylor et SM McLennan, The Continental Crust : Its composition and evolution, Wiley-Blackwell, , 328 p. (ISBN 978-0-632-01148-3 et 0632011483).
- Krebs 2006, p. 48.
- (en) Peter Atkins, Shriver and Atkins' Inorganic Chemistry, Oxford, Oxford University Press, USA, , 824 p. (ISBN 978-0-19-923617-6 et 0199236178, lire en ligne).
- (en) Simon Moores, « Lithium - Between A Rock And A Salt Lake », sur fr.slideshare.net, (consulté le ).
- (en) Institute of Ocean Energy, « Lithium occurence [sic »] (version du 2 mai 2009 sur Internet Archive).
- (en) ENC Labs, « Some facts about lithium », sur enclabs.com (consulté le ).
- (en) Klaus Schwochau, « Extraction of metals from sea water », dans Inorganic Chemistry, Springer Science + Business Media, , 91-133 p. (ISSN 0340-1022, présentation en ligne).
- (en) « Some Facts about Lithium », ENC Labs (consulté le ).
- C Chassard-Bouchaud, P Galle, F Escaig et M Miyawaki, « Bioaccumulation of lithium by marine organisms in European, American, and Asian coastal zones: microanalytic study using secondary ion emission », Comptes rendus de l’Académie des sciences. Serie III, Sciences de la vie, vol. 299, no 18, , p. 719–24 (PMID 6440674).
- (en) Anke M, Arnhold W, Groppel U, Krause U, « The biological importance of lithium », Schrauzer GN, Klippel KF (eds) Lithium in biology and medicine, VCH Verlag, Weinheim, 1991, p. 149–167.
- (de) E. J. Verspohl, « Lithium in Biology and Medicine, Von G. N. Schrauzer und K. Klippel, VCH Verlagsges. mbH, Weinheim, 1991. 209 S., 64 Abb., 64 Tab., DM 96,– », Pharmazie in Unserer Zeit, vol. 21, no 1, , p. 45–45 (ISSN 0048-3664 et 1615-1003, DOI 10.1002/pauz.19920210119).
- (en) Gawain McColl, David W. Killilea, Alan E. Hubbard et Maithili C. Vantipalli, « Pharmacogenetic Analysis of Lithium-induced Delayed Aging in Caenorhabditis elegans », Journal of Biological Chemistry, vol. 283, no 1, , p. 350–357 (ISSN 0021-9258, DOI 10.1074/jbc.m705028200).
- (en) Kim Zarse, Takeshi Terao, Jing Tian et Noboru Iwata, « Low-dose lithium uptake promotes longevity in humans and metazoans », European Journal of Nutrition, vol. 50, no 5, , p. 387–389 (ISSN 1436-6207 et 1436-6215, PMID 21301855, PMCID PMC3151375, DOI 10.1007/s00394-011-0171-x).
- (en) « Mineral commodity summaries 2023 : Lithium » [PDF], sur Institut d'études géologiques des États-Unis, (consulté le ), pages 108-109.
- (en) BP Statistical Review of World Energy 2022 - 71st edition [PDF], BP, , pages 52-53.
- L'État tchèque reparle de l'exploitation des réserves de lithium..., Radio Prague, .
- Ministère marocain de l'équipement (2013), Appel à manifestation d'intérêt [PDF] (AMI) de 2014 « pour la concession de la recherche, l'extraction, le traitement, la valorisation et la commercialisation du Ghassoul dans la vallée de Ksabi Moulouya ».
- Les ressources limitées de lithium pourraient freiner l'essor des voitures électriques, Le Monde, .
- FMC Corporation Completes Acquisition of Cheminova A/S, communiqué, Société chimique de France, , Philadelphie.
- Jean-Louis Vignes, « Lithium », sur Société chimique de France, (consulté le ).
- Le Lithium du Tibet, sur Enerzine (consulté le ).
- (en) Lithium to be extracted from geothermal waste, sur Phys.org.
- (en) Simbol Materials. Files for Bankruptcy, Borrego Sun, le .
- « Québec lithium cesse sa production », Les Affaires.
- « Sayona Mining part à la rencontre de la communauté de Pikogan », sur ICI Abitibi-Témiscamingue, 14 mars 2018.
- (en) U.S. Identifies Vast Mineral Riches in Afghanistan, The New York Times, 13 juin 2010.
- « Un gigantesque gisement de lithium découvert en Inde », Les Échos, 14 février 2023.
- « Relocaliser l'extraction des ressources minérales : en Europe, les défis du lithium », The Conversation, .
- « L'Europe, un géant endormi du lithium », Les Échos, .
- « Rio Tinto gèle son projet de mine dans le lithium en Serbie », Les Échos, .
- « La Serbie enterre le plus grand projet de mine de lithium en Europe », Les Échos, .
- « En Espagne, la ruée controversée vers le lithium », Les Échos, 7 mars 2022.
- « Batteries : Stellantis sécurise ses approvisionnements en lithium », automobile-propre.com, .
- « Vulcan, l'expert du lithium vert qui a séduit Stellantis, Renault et Volkswagen », Les Échos, 24 juin 2022.
- « Vulcan, l'espoir d'un lithium européen », Les Échos, 7 septembre 2022.
- État d'alerte sur la dépendance européenne au lithium, Les Échos, 27 septembre 2022.
- Imerys se lance dans la ruée vers le lithium anglais, Les Échos, 29 juin 2023.
- Y. Lulzac, Les minéralisations à étain, tantale et lithium de Tréguennec (Finistère), rapport, Bureau de recherches géologiques et minières, 1986, DAM 011 OP4.
- Aplite de Tréguennec (Finistère) [PDF], fiche, SIG Mines France, BRGM.
- Fiche Lihium, Bérilyum [PDF], SIG Mines France, BRGM (consulté le ).
- Didier Déniel, « Sous le sol de Tréguennec, des milliers de tonnes de lithium, nouvel or blanc », sur LeTelegramme.fr, (consulté le ).
- Manuel Ruffez, Vanessa Descouraux, Philippe Bardonnaud, « Lithium en Bretagne, pour quelques batteries de plus… », sur Interception, France Inter, (consulté le ).
- « Gisement de lithium : "Tréguennec et le Pays bigouden ne sont pas à vendre" », sur LeTelegramme.fr, (consulté le ).
- Ressources métropolitaines en lithium et analyse du potentiel par méthodes de prédictivité [PDF], rapport final, BRGM, .
- « Ressources françaises en lithium sous la forme de roches dures », sur BRGM (consulté le ).
- « L'exploitation de nos ressources en lithium, une opportunité industrielle majeure pour la France », sur connaissancedesenergies.org, .
- « Du lithium dans le sous-sol alsacien », Dernières Nouvelles d'Alsace, .
- « En Alsace, l'espoir d'une nouvelle filière pour le lithium », Les Échos, .
- « Viridian va construire la première raffinerie de lithium en France », Les Échos, 24 juillet 2022.
- Selon l'Atlas of Europe, les températures de ce bassin à −5 000 m seraient comprises entre 180 et 200 °C.
- « Consultation sur la demande de permis exclusif de recherches de lithium et substances connexes dit "Permis de bassin de Limagne" présentée par la société par actions simplifiée Fonroche Géothermie », sur Ministère de l'Économie et des Finances (France) (consulté le ).
- « Lithium : la France prévoit d'ouvrir l'une des plus grandes mines d'Europe, dans le Massif central », Libération (consulté le ).
- « Batteries : Imerys annonce en France "l'un des plus grands projets d'extraction de lithium" européens », Le Figaro, le .
- « La France va ouvrir sa première grosse mine de lithium », Les Échos, 24 octobre 2022.
- Après l'Allemagne, Vulcan Energy s'intéresse au lithium alsacien, Les Échos, 2 novembre 2022.
- BRGM 2012, p. 90.
- « Eramet franchit une nouvelle étape dans la production de lithium alsacien », Les Échos, 26 janvier 2023.
- Stellantis et Vulcan Energy envisagent d'extraire du lithium à Mulhouse, Les Échos, 31 mai 2023.
- (en)2013 Minerals Yearbook, USGS, , pages 44.1 et 44.11.
- (en) Adnan Mazarei, « Who controls the world's minerals needed for green energy? », sur illuminem.com, (consulté le ) citant (en) Luc Leruth, Adnan Mazarei, Pierre Régibeau, Luc Renneboog, « Green energy depends on critical minerals. Who controls the supply chains? », sur Peterson Institute for International Economics, (consulté le ).
- « L'industrie minière repart en quête de lithium et de cobalt », Les Échos, .
- Muryel Jacque, « Le lithium, le petit métal qui flambe », Les Échos, (consulté le ).
- Les jours de l'oligopole des producteurs sont comptés, Les Échos, .
- Le lithium, un trésor qui divise l'Amérique du Sud, Les Échos, .
- Des milliers de tonnes de lithium à extraire proprement du Rhin par an, automobile-propre.com, .
- Le lithium bientôt extrait à partir de l'eau de mer ?, automobile-propre.com, .
- (en) Electrochemical cell harvests lithium from seawater, KAUST Discovery, .
- Métaux : une fusion à 10 milliards de dollars crée un nouveau géant du lithium, Les Échos, 11 mai 2023.
- (en) Air Liquide, « Nitrogen, N2, Physical properties, safety, MSDS, enthalpy, material compatibility, gas liquid equilibrium, density, viscosity, inflammability, transport properties », sur Encyclopedia.airliquide.com, Air liquide (consulté le ).
- (en) « Commodity Statistics and Information 2021 : Lithium » [PDF], sur United States Geological Survey, (consulté le ).
- Données, Société chimique de France.
- (en) J. M. Tarascon, « The Li-Ion Battery: 25 Years of Exciting and Enriching Experiences », Interface magazine, vol. 25, no 3, , p. 79–83 (ISSN 1064-8208 et 1944-8783, DOI 10.1149/2.f08163if, lire en ligne, consulté le ).
- (en) John Emsley, Nature's Building Blocks, Oxford, Oxford University Press, (ISBN 978-0-19-850341-5).
- (en) « Wayback Machine » [archive du ] [PDF], .
- (en) The Element Lithium, Thomas Jefferson National Accelerator Facility (consulté le ).
- (en) David R. Lide, Handbook of Chemistry and Physics : A Ready-Reference Book Chemical and Physical Data, CRC-Press, , 2556 p. (ISBN 978-0-8493-0481-1 et 0849304814).
- (en) TM. Verdura, G. Brunette et R. Shah, Fuels and Lubricants Handbook : Technology, Properties, Performance, and Testing, ASTM, , 16 p. (ISBN 978-0-8031-2096-9 et 0803120966), chap. 20 (« Lubricating Greases »).
- (en) Salvatore J. Rand, Significance of Tests for Petroleum Products, Astm International, , 258 p. (ISBN 978-0-8031-2097-6 et 0803120974).
- Yan Qing Lu, Guo Dong Zhang, Mao Fa Jiang, Hai Xiao Liu et Ting Li, « Effects of Li2CO3 on Properties of Mould Flux for High Speed Continuous Casting », Materials Science Forum, Trans Tech Publications, vol. 675-677, , p. 877-880 (ISSN 1662-9752, DOI 10.4028/www.scientific.net/msf.675-677.877, lire en ligne).
- (en) American Foundry Society, « Testing 1-2-3: Eliminating Veining Defects », sur web.archive.org, (version du 2 avril 2015 sur Internet Archive).
- Garrett 2004, p. 200.
- (en) Prasad, N. Eswara et Wanhill, R. J. H., Aluminum-Lithium Alloys : Processing, Properties, and Applications, , 608 p. (ISBN 978-0-12-401679-8, 0124016790 et 0124016987, OCLC 861537243, lire en ligne).
- (en) Joseph R. Davis, Aluminum and Aluminum Alloys, Materials park, (Ohio), ASM International, , 784 p. (ISBN 978-0-87170-496-2 et 087170496X, lire en ligne).
- (en) Martin B. Hocking et Diana Hocking, Air Quality in Airplane Cabins and Similar Enclosed Spaces, Springer Science & Business Media, , 410 p. (ISBN 978-3-540-25019-7 et 3540250190, lire en ligne).
- (en) Lithium Corporation of America & Aerospace Medical Research Laboratories, « Application of lithium chemicals for air regeneration of manned spacecraft » [PDF], sur Defense Technical Information Center, Département de la Défense des États-Unis, (consulté le ).
- (en) M. M. Markowitz, D. A. Boryta et Harvey Stewart, « Lithium Perchlorate Oxygen Candle. Pyrochemical Source of Pure Oxygen », Industrial & Engineering Chemistry Product Research and Development, American Chemical Society (ACS), vol. 3, no 4, , p. 321-330 (ISSN 0196-4321, DOI 10.1021/i360012a016, lire en ligne).
- John F. J. Cade, « Lithium salts in the treatment of psychotic excitement », Medical Journal of Australia, vol. 2, no 10, , p. 349–352 (ISSN 0025-729X et 1326-5377, DOI 10.5694/j.1326-5377.1949.tb36912.x).
- (en) E. Toffol, T. Hätönen, A. Tanskanen, J. Lönnqvist, K. Wahlbeck, G. Joffe et T. Partonen, Lithium is associated with decrease in all-cause and suicide mortality in High-risk bipolar patients: A nationwide registry-based prospective cohort study, Journal of Affective Disorders, 2015.
- Dr Elie Hantouche (psychiatre) et Régis Blain, La Cyclothymie, pour le pire et le meilleur, éditions Robert Lafont, 254 pages.
- Dr Christian Gay (psychiatre), Vivre avec un maniaco-dépressif, Hachette Littératures, 211 pages.
- Abdulsamet Erden, Hatice Karagöz, Mustafa Başak et Samet Karahan, « Lithium intoxication and nephrogenic diabetes insipidus: a case report and review of literature », International Journal of General Medicine, vol. 6, , p. 535–539 (DOI 10.2147/IJGM.S46383, lire en ligne, consulté le ).
- Stanley I. Rapoport, Mireille Basselin, Hyung-Wook Kim et Jagadeesh S. Rao, « Bipolar disorder and mechanisms of action of mood stabilizers », Brain Research Reviews, vol. 61, no 2, , p. 185–209 (ISSN 0165-0173, DOI 10.1016/j.brainresrev.2009.06.003).
- Andrea Cipriani, Heather Pretty, Keith Hawton et John R. Geddes, « Lithium in the Prevention of Suicidal Behavior and All-Cause Mortality in Patients With Mood Disorders: A Systematic Review of Randomized Trials », American Journal of Psychiatry, vol. 162, no 10, , p. 1805–1819 (ISSN 0002-953X et 1535-7228, DOI 10.1176/appi.ajp.162.10.1805).
- (en) Gerhard N. Schrauzer et Krishna P. Shrestha, « Lithium in drinking water and the incidences of crimes, suicides, and arrests related to drug addictions », Biological Trace Element Research, vol. 25, no 2, , p. 105–113 (ISSN 0163-4984 et 1559-0720, DOI 10.1007/bf02990271).
- Hirochika Ohgami, Takeshi Terao, Ippei Shiotsuki et Nobuyoshi Ishii, « Lithium levels in drinking water and risk of suicide », British Journal of Psychiatry, vol. 194, no 5, , p. 464–465 (ISSN 0007-1250 et 1472-1465, DOI 10.1192/bjp.bp.108.055798).
- Hugo Tiv, Antoine Vandelaer, Pierre Delanaye et Florence Forte, « Piège diagnostique : neurotoxicité au lithium avec lithémie normale », Néphrologie & Thérapeutique, vol. 18, no 7, , p. 650–654 (DOI 10.1016/j.nephro.2022.07.398, lire en ligne, consulté le ).
- (en) Rebecca F McKnight, Marc Adida, Katie Budge et Sarah Stockton, « Lithium toxicity profile: a systematic review and meta-analysis », The Lancet, vol. 379, no 9817, , p. 721–728 (ISSN 0140-6736, DOI 10.1016/s0140-6736(11)61516-x).
- (en) Birgitte Mønster Christensen, Young-Hee Kim, Tae-Hwan Kwon et Søren Nielsen, « Lithium treatment induces a marked proliferation of primarily principal cells in rat kidney inner medullary collecting duct », American Journal of Physiology-Renal Physiology, vol. 291, no 1, , F39–F48 (ISSN 1931-857X et 1522-1466, DOI 10.1152/ajprenal.00383.2005).
- (en) Yuedan Li, Stephen Shaw, Erik-Jan Kamsteeg et Alain Vandewalle, « Development of Lithium-Induced Nephrogenic Diabetes Insipidus Is Dissociated from Adenylyl Cyclase Activity », Journal of the American Society of Nephrology, vol. 17, no 4, , p. 1063–1072 (ISSN 1046-6673 et 1533-3450, DOI 10.1681/asn.2005080884).
- V. Baillif-Couniou, J.-M. Gaulier, K. Retornaz et J.-C. Dubus, « Administration volontaire de lithium chez un enfant de 4 mois », Toxicologie Analytique et Clinique, vol. 27, no 2, , S13–S14 (DOI 10.1016/j.toxac.2015.03.007, lire en ligne, consulté le )
- « Avantages de la fusion », ITER.
- ITER : Une énergie pour notre avenir, conférence AGORA de l'École Centrale de Lyon, .
- Article R1333-1 du code de la défense.
- « Cours du lithium », sur Metalary (consulté le ).
- Métaux : les besoins colossaux de la transition énergétique, Les Échos, .
- Pourquoi la fièvre retombe sur le lithium, Les Échos, .
- « Réserves de lithium : principaux pays du monde 2019 », sur Statista (consulté le ).
- La Chine prête à dézinguer le coût d'extraction du lithium, automobile-propre.com, .
- Après une flambée spectaculaire, les cours du lithium et du cobalt s'affaissent, Les Échos, 2 mars 2023.
- Le Mexique nationalise ses réserves de lithium, Les Échos, 20 avril 2022.
- « Mexique : le Lithium bientôt Nationalisé ? », sur Energynews.pro, (consulté le ).
- Le Mexique se dote d'une structure d'État pour chapeauter son industrie du lithium, Les Échos, 24 août 2022.
- Jeremy Fasquelle, « la France, pays du lithium », sur Les Échos, (consulté le ).
- Au Chili, l'État veut reprendre en main l'exploitation du lithium, Les Échos, 24 avril 2023.
- (en) Richard Heinberg, The End of Growth: Adapting to Our New Economic Reality, New Society Publishers, 2011 (ISBN 978-0-8657-1695-7), p. 142-143.
- (en) William Tahil, « The Trouble with Lithium : Implications of Future PHEV Production for Lithium Demand » [PDF], sur Meridian International Research, (consulté le ), p. 14.
- « Le secteur du lithium face à l'essor de la demande mondiale », Les Échos, .
- Nicolas Dupuy, Laetitia Minguez et C. Cossu-Leguille, « Le lithium dans les milieux aquatiques : Doit-on s'en inquiéter ? », Colloque conjoint EcoBIM - EcotoQ - Chapitre Saint-Laurent 2021, (lire en ligne, consulté le ).
- Hud Abderrezak, « Toxicité des sels de lithium », sur Analytical Toxicology, (consulté le ).
- « Le lithium, or blanc de la transition énergétique ? », Ressources et environnement, .
- « Le lithium, nouvel eldorado ou mirage éphémère ? », Enerzine, .
- Audric Doche, « L'extraction du lithium au Tibet extrêmement polluante », sur Caradisiac, (consulté le ).
- « Obsolescence des produits high-tech : comment les marques limitent la durée de vie de nos biens », Les Amis de la Terre, , p. 15.
- BE Japon, no 514, , ambassade de France au Japon / ADIT.
- « Récupyl », sur societe.com (consulté le ).
- SNAM va fabriquer des batteries recyclées, Les Échos, .
- (en) L. Yao, Y. Feng, G. X. Xi, « A new method for synthesis of LiNi1/3Co1/3Mn1/3O2 from waste lithium ion batteries », RSC Advances, 2015.
- Glencore veut créer le plus grand centre de recyclage de batteries au lithium d'Europe, Les Échos, 11 mai 2023.
- « Indicateur des échanges import/export », indiquer NC8=28252000, sur Direction générale des douanes (consulté le ).
Voir aussi
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
Articles de périodiques
- (en) Tyler B. Coplen, John Karl Böhlke, P. De Bièvre, T. Ding, N. E. Holden, J. A. Hopple, H. R. Krouse, A. Lamberty, H. S. Peiser, K. Revesz, S. E. Rieder, K. J. R. Rosman, E. Roth, P. D. P. Taylor, R. D. Vocke et Y. K. Xiao, « Isotope-abundance variations of selected elements (IUPAC Technical Report) », Pure and Applied Chemistry, Walter de Gruyter GmbH, vol. 74, no 10, (ISSN 1365-3075, DOI 10.1351/pac200274101987).

- (en) Conrad W. Kamienski, Daniel P. McDonald, Marshall W. Stark et John R. Papcun, « Lithium and Lithium Compounds », Kirk-Othmer Encyclopedia of Chemical Technology, Wiley-Blackwell, (ISBN 0471238961, DOI 10.1002/0471238961.1209200811011309.a01.pub2)
- (en) J.-M. Tarascon et M. Armand, « Issues and challenges facing rechargeable lithium batteries », Nature, Nature Publishing Group, vol. 414, no 6861, , p. 359-367 (ISSN 0028-0836, DOI 10.1038/35104644)
- (en) P. B. Tomascak, « Developments in the Understanding and Application of Lithium Isotopes in the Earth and Planetary Sciences », Reviews in Mineralogy and Geochemistry, GeoScienceWorld, vol. 55, no 1, , p. 153-195 (ISSN 1529-6466, DOI 10.2138/gsrmg.55.1.153)
- (en) G. Audi, F.G. Kondev, M. Wang, B. Pfeiffer, X. Sun, J. Blachot et M. MacCormick, « The NUBASE2012 evaluation of nuclear properties », Chinese Physics C, Science Press, vol. 36, no 12, , p. 1157–1286 (ISSN 1674-1137, lire en ligne [PDF]).

- (en) Daniel Werner, A. Loges, Oliver Heeg, Nic Sautter, Achim Wiebelt et T. Wetzel, « Thermal management of Li-ion batteries and its influence on electrical performance », Proceedings 15. Internationales Stuttgarter Symposium, Springer Science + Business Media, , p. 1535-1549 (ISBN 978-3-658-08843-9, ISSN 2198-7432, DOI 10.1007/978-3-658-08844-6_107)
Ouvrages
- [Garrett 2004] (en) Donald E. Garrett, Handbook of Lithium and Natural Calcium Chloride : Their Deposits, Processing, Uses and Properties, Burlington, Elsevier Academic Press, , 476 p. (ISBN 978-0-12-276152-2 et 0122761529, OCLC 469401760).

- [Krebs 2004] (en) Robert E. Krebs, The History and Use of Our Earth's Chemical Elements : A Reference Guide, Greenwood Publishing Group, , 2e éd., 422 p. (ISBN 978-0-313-33438-2 et 0313334382, lire en ligne)
- [Weeks 2003] (en) Mary Elvira Weeks, Discovery of the Elements 1933, Kessinger Publishing, , 380 p. (ISBN 978-0-7661-3872-8 et 0766138720).

Rapports
- J. F. Labbé et G. Daw, « Panorama 2011 du marché du lithium » [PDF], sur InfoTerre, Bureau de recherches géologiques et minières, (consulté le ).

Articles connexes
Liens externes
- Ressources relatives à la santé :
- DrugBank
- (en) Medical Subject Headings
- (en) NCI Thesaurus
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Dominique Larcher, « Le lithium : histoire, synthèse, réactivité, usages », conférence, Collège de France, (consulté le )
- (en) « Technical data for Lithium » (consulté le ) (donne en sous-pages les données connues pour chaque isotope)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||








