Nitrure de lithium
Le nitrure de lithium est un composé d'azote et de lithium. C'est une matière réactive inflammable qui réagit violemment avec l'eau en dégageant de l'ammoniac, un gaz toxique.
| Nitrure de lithium | |
| |
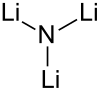
 __ Li+ __ N3− |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.043.144 |
| No CE | 247-475-2 |
| ChEBI | 30525 |
| SMILES | |
| InChI | |
| Apparence | poudre brun-rouge à odeur d'ammoniac[1] |
| Propriétés chimiques | |
| Formule | Li3N [Isomères] |
| Masse molaire[2] | 34,83 ± 0,006 g/mol Li 59,78 %, N 40,21 %, |
| Propriétés physiques | |
| T° fusion | 845 °C[1] |
| Solubilité | réagit violemment avec l'eau[1] |
| Masse volumique | 1,38 g·cm-3[1] |
| Cristallographie | |
| Symbole de Pearson | [3] |
| Classe cristalline ou groupe d’espace | P6/mmm (no 191)[3] |
| Précautions | |
| SGH[4] | |
  |
|
| SIMDUT[5] | |
 B6, |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Il se forme directement par réaction entre le lithium et le diazote atmosphérique, à température et pression ambiantes ce qui impose de stocker le lithium sous argon ou d'autres gaz nobles mais pas sous azote comme peuvent l'être les autres métaux alcalins.
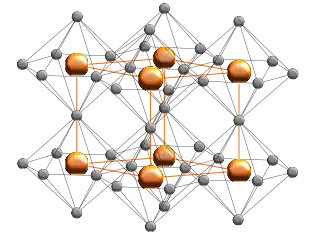
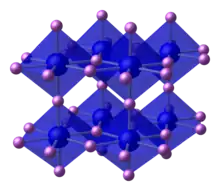
Structure
La phase α de Li3N est celle qui est stable à CNTP, elle a une structure inusuelle qui consiste en deux types de couches. D'une part, une couche de composition Li2N− contenant des centres Li hexa-coordonnés et d'autre part, l'autre couche constituée uniquement de cation lithium[6]. Une autre manière de voir cette structure est de remarquer que les atomes de lithium forment un réseau hexagonal comme celui du graphite au centre duquel se trouve un atome d'azote. Ces mêmes atomes d'azote forment un réseau cubique[7].
Deux autres polymorphes de Li3N sont connus : le β-nitrure de lithium, formé à partir de la phase α à 4200 bars est isomorphe avec la structure de l'arséniure de sodium (Na3As). Le γ-nitrure de lithium (même structure que Li3Bi) se forme à partir de la phase β de 35 à 45 gigapascals[8].
Notes et références
- Fiche Lithiumnitride chez AlfaAesar, consulté le 15/12/2010
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « The Li3N Crystal Structure », sur http://cst-www.nrl.navy.mil/ (consulté le )
- Fiche Sigma-Aldrich du composé Lithium nitride, consultée le 08/04/2011.
- « Nitrure de lithium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- M. G. Barker, A. J. Blake, P. P. Edwards, D. H. Gregory, T. A. Hamor, D. J. Siddons, S. E. Smith, Novel layered lithium nitridonickelates; effect of Li vacancy concentration on N co-ordination geometry and Ni oxidation state, Chem. Com., 1999, vol. (13), pp. 1187–1188. DOI 10.1039/a902962a
- Structure de Li3N.
- . Walker, Solid-State Hydrogen Storage: Materials and Chemistry, §16.2.1 Lithium nitride and hydrogen:a historical perspective, 2008.