Diazote
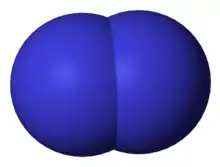
Le diazote, communément nommé azote, est une molécule diatomique composée de deux atomes d'azote. Elle est notée N2.
| Diazote | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Diazote | |
| No CAS | ||
| No ECHA | 100.028.895 | |
| No CE | 231-783-9 | |
| Code ATC | V03 | |
| No E | E941 | |
| SMILES | ||
| InChI | ||
| Apparence | gaz : incolore, inodore liquide : extrêmement froid, incolore, inodore[1]. |
|
| Propriétés chimiques | ||
| Formule | N2 [Isomères] |
|
| Masse molaire[2] | 28,013 4 ± 0,000 4 g/mol N 100 %, |
|
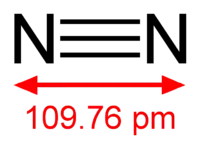
| Diamètre moléculaire | 0,315 nm | |
| Propriétés physiques | ||
| T° fusion | −210,01 °C[3] | |
| T° ébullition | −195,79 °C[3] | |
| Solubilité | 100 vol. d'eau absorbe 2,4 vol. de N2 (0 °C), 100 vol. d'eau absorbe 1,6 vol. de N2 (20 °C), |
|
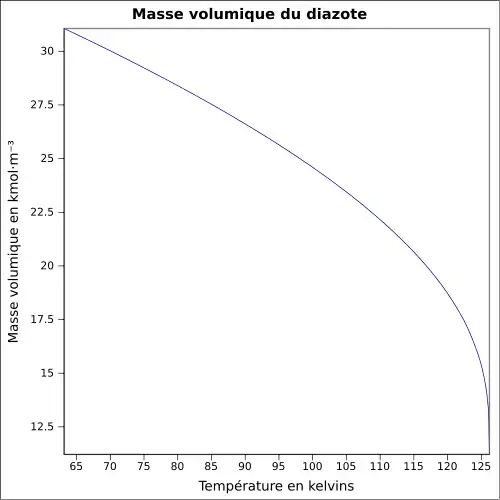
| Masse volumique | 0,808 kg·l-1 au point d'ébullition du liquide[1]
|
|
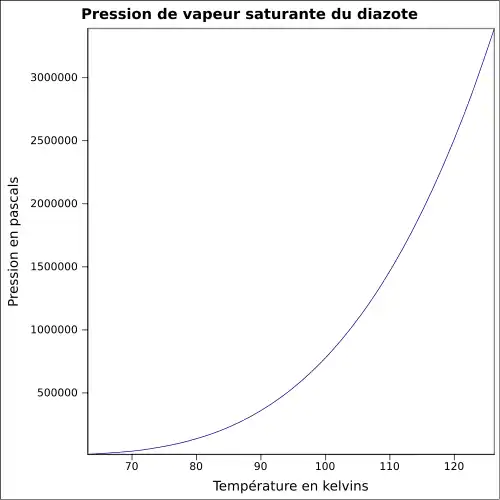
| Pression de vapeur saturante | 1 atm (−195,8 °C)[3]
|
|
| Point critique | −147,1 °C, 33,5 atm, 3,216 dm3·kg-1[3] | |
| Point triple | −210,05 °C, 0,127 atm[3] | |
| Vitesse du son | 336,96 m·s-1 (101,325 kPa, 0 °C)[3] | |
| Thermochimie | ||
| ΔvapH° | 5,57 kJ·mol-1 (1 atm, −195,79 °C)[5] | |
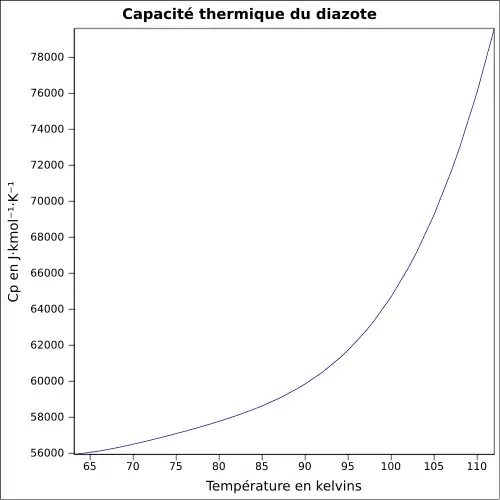
| Cp | ||
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 15,580 8 eV (gaz)[6] | |
| Constante diélectrique | 1,454 (−203 °C), 1,0005480 (20 °C, 101,325 kPa, gaz)[3] |
|
| Propriétés optiques | ||
| Indice de réfraction | 1,000 273 2 (101,325 kPa)[3] | |
| Précautions | ||
| SGH | ||
 Attention |
||
| SIMDUT[7] | ||
 A, |
||
| NFPA 704 | ||
| Transport | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
L'appellation « azote » sans autre précision est ambiguë parce que ce terme peut désigner l'élément azote (N) ou la molécule d'azote (N2).[alpha 1]
Dans les conditions normales de température et de pression, les molécules de diazote forment un gaz incolore constituant le principal composant de l'air, avec une concentration de 78,06 % en volume et de 75,5 % en masse.
Le diazote est à la source des principales réactions chimiques utilisée pour synthétiser industriellement des composés azotés, ainsi que dans de nombreuses réactions biochimiques.
On parle d'azote liquide quand le gaz diazote est refroidi en dessous de son point d'ébullition, et d'azote solide si on continue de refroidir, en dessous du point de fusion.
Histoire
La découverte du diazote est généralement attribuée au chimiste écossais Daniel Rutherford en 1772. Grâce à ses travaux entrepris à l'université d'Édimbourg, Rutherford le distingua du dioxyde de carbone, appelé alors air fixe ou air méphitique et précédemment identifié par son professeur Joseph Black[9]. Toutefois, le gaz n'est pas clairement identifié comme tel, mais plutôt comme une rémanence du fluide phlogistique, théorie en cours à l'époque pour expliquer la combustion des corps.
Six mois avant la publication de Rutherford, Joseph Priestley rapporta à la Société royale de Londres une expérience de Henry Cavendish qui met en évidence un gaz autre que le dioxygène et le dioxyde de carbone, sans toutefois tirer de conclusions apparentes[10].
À la même époque, à l'université d'Uppsala, Carl Wilhelm Scheele isole et identifie clairement le diazote et le dioxygène, qu'il nomme respectivement verdorbene Luft et Feuerluft mais ses travaux ne seront publiés qu'en 1777[11].
Ce n'est qu'en 1789 que l'azote est reconnu comme un élément à part entière, par Antoine Lavoisier[12].
Production
Au XXIe siècle, le diazote est généralement obtenu par liquéfaction de l'air, suivie d'une distillation fractionnée.
L'extraction du diazote hors de l'air peut également être réalisée au moyen de membranes semi-perméables alimentées en air comprimé. Ces membranes sont composées de faisceaux de fibres d'oxyde polyphénilique creuses à enveloppe perméable enduites d'une couche de 40 nm. La pureté du diazote produit par une membrane dépend du débit demandé : par exemple, l'obtention d'une pureté de 95 % permet des débits allant jusqu'à 5 000 Nm3/h, alors qu'une production d'azote à 99,5 % ne permet que 0,5 Nm3/h.
Une autre méthode pour produire de diazote à partir d'air comprimé est par adsorption : ce type de générateur de diazote est composé d'un tamis moléculaire à base de carbone (appelé CMS pour « Carbon Molecular Sieve »). La taille des micropores du CMS est ajustée pour adsorber les molécules comme le dioxygène, mais pas le diazote, légèrement plus gros. Après récupération du diazote non adsorbé, la pression est relâchée et le CMS libère le dioxygène. Le CMS est régénéré et le cycle peut reprendre[13].
Fixation biologique
Plusieurs bactéries sont capables de fixer le diazote moléculaire de l'air, première étape avant de pouvoir l'incorporer dans des molécules organiques comme les protéines ou les bases nucléiques constitutives des acides nucléiques support de l'hérédité comme l'ADN et l'ARN. On rencontre notamment ces bactéries en symbiose dans les racines des plantes de la famille des fabacées.
Stabilité
Le diazote, caractérisé par la présence d'une liaison covalente triple (une liaison σ et deux liaisons π), est une molécule très stable qui est pour cette raison utilisée comme gaz inerte pour remplacer l'atmosphère en synthèse chimique. Le diazote ne réagit directement qu'avec le lithium et le magnésium pour former les nitrures correspondants Li3N et Mg3N2.
La stabilité de la molécule de diazote est la force motrice, l'origine de l'instabilité, voire de l'explosivité des composés pouvant libérer une molécule de diazote : azotures, sels de diazonium, azodicarbonamide, etc.
Utilisation
Le diazote atmosphérique peut être converti en ammoniac grâce au Procédé Haber ou au procédé Frank-Caro suivi d'une hydratation. L'ammoniac ainsi produit sert surtout à la fabrication d'engrais[14].
Comme fluide frigorigène, le diazote porte la dénomination « R728 » dans la nomenclature des réfrigérants, régie par la norme 34-1992 d'ANSI/ASHRAE. Il est notamment employé dans les domaines suivants.
- Le diazote non liquide est utilisé comme gaz cryogénique.
- Le diazote gazeux est utilisé comme atmosphère inerte pour protéger des produits (sodium, composés organiques, par exemple vins et viandes), des objets ou des contenants (citernes) de l'oxydation, de la corrosion, des insectes, des champignons, etc.
- Le diazote sert à ajuster la composition des mélanges respiratoires dans les caissons de décompression ou les bouteilles de plongée sous-marine.
- Autres usages :
- pesticide doux pour éliminer par asphyxie les vers du bois ou certains organismes (exemple : petite vrillette) ayant colonisé des objets anciens fragiles (cadres, sculptures et objets de bois, incunables, parchemins, gravures, etc.) ;
- gaz de gonflage des accumulateurs hydrauliques en raison de sa passivité vis-à-vis des huiles ;
- agent de lutte contre les incendies : allié à 50 % d'argon et parfois avec du dioxyde de carbone, il est présent dans certaines installations d'extinction automatique à gaz protégeant des salles informatiques ou des stockages particuliers ne devant pas être endommagés par de la poudre ou de l'eau. Conservé dans des bonbonnes métalliques sous une pression d'environ 200 bars, il est libéré dans un local où un début d'incendie a été détecté. Le volume de diazote injecté remplace une partie de l'atmosphère de la pièce et entraîne une chute du taux d'oxygène dans l'air. Le niveau généralement retenu de 15 % de comburant interrompt le phénomène de combustion sans effet létal sur la respiration humaine ;
- gaz de gonflage de pneumatiques. Bien que l'air contienne déjà 78 % de diazote, certains professionnels de l'aviation, de l'automobile ou de la Formule 1, par exemple, augmentent cette proportion dans les pneumatiques jusqu'à atteindre de l'azote presque pur. Ce gaz, ayant la propriété d'être inerte et stable, conserve une pression plus constante même en cas d'échauffement intense du pneumatique. De plus, il fuit plus difficilement[15].
Le diazote, contrairement aux gaz inhibiteurs chimiques halogénés et aux CFC ne présente a priori aucun effet nocif pour l'environnement (pas d'impact sur l'effet de serre, ni sur la couche d'ozone). Mais il requiert des réservoirs volumineux, des canalisations adaptées et des mesures constructives pour faire face à la détente brutale d'un équivalent de 40 à 50 % du volume protégé.
Sécurité
Risque d'anoxie : le cas le plus fréquemment rencontré est celui de personnes pénétrant dans des réservoirs remplis d'azote sans s'en apercevoir, du fait que ce gaz est inodore et ne provoque pas de sensation de suffocation (causée par l'excès de dioxyde de carbone, et non par l'absence d'oxygène). Ces personnes sont alors prises de malaises, perdent connaissance, et, si on ne les retire pas très rapidement de cette situation, succombent. Il est nécessaire de vérifier la présence d'une proportion suffisante d'oxygène dans de tels espaces confinés avant d'y pénétrer, ou de s'équiper d'un appareil respiratoire autonome.
Référence ONU pour le transport de matières dangereuses
- Nom (français) : azote comprimé
- Classe : 2
- numéro : 1066
- Nom (français) : azote liquide réfrigéré
- Classe : 2
- numéro : 1977
Masse molaire du diazote 28,0 g mol−1
Notes et références
Références
- AZOTE (GAZ COMPRIME) et AZOTE (LIQUEFIE), Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Nitrogen », sur Hazardous Substances Data Bank (consulté le )
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Azote » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Office of Radiation, Chemical & Biological Safety (ORCBS) » (consulté le )
- (la) Daniel Rutherford, Dissertatio inauguralis de aere fixo dicto, aut mephitico, Balfour et Smellie, (lire en ligne)
- (en) « XIX. Observations on different kinds of air. », sur royalsocietypublishing.org (DOI 10.1098/rstl.1772.0021, consulté le )
- (de) Carl Wilhelm Scheele, Chemische Abhandlung von der Luft und dem Feuer, Verlegt von Magn. Swederus, Buchhändler zu finden bey S. L. Crusius, (lire en ligne)
- Antoine-Laurent de (1743-1794) Auteur du texte Lavoisier, Traité élémentaire de chimie , présenté dans un ordre nouveau, et d'après les découvertes modernes ; Avec figures ; Par M. Lavoisier,..., (lire en ligne)
- « Le "Carbon Molecular Sieve" est le coeur des générateurs d'azote Nitrocraft », sur Nitrocraft, (consulté le )
- Voir par exemple (en) Stephen A. Lawrence, Amines. Synthesis, Properties and Applications, Cambridge University Press, , 384 p. (ISBN 978-0-521-02972-8, lire en ligne), « An introduction to the amines ».
- Pourquoi gonfler ses pneus à l’azote ?, Norauto (consulté en septembre 2017).