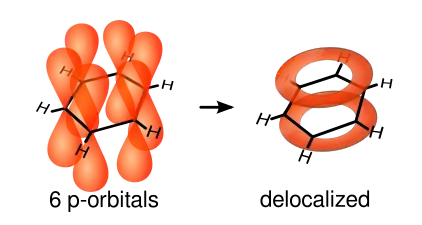Liaison π
Une liaison π (prononcé pi) est une liaison chimique covalente dans laquelle deux lobes d'une orbitale atomique occupée par un électron unique se recouvrent avec deux lobes d'une orbitale occupée par un électron d'un autre atome. Il existe un plan nodal unique passant par l'axe internucléaire dans lequel la densité électronique est nulle : le recouvrement des orbitales est latéral. De telles liaisons s'observent dans les doubles liaisons et les triples liaisons mais généralement pas dans les liaisons simples.
La lettre π fait référence aux orbitales p dans la mesure où la symétrie de ces liaisons est la même que celle des orbitales p si l'on se place dans l'axe de la liaison. L'une des formes de ce type de liaisons fait intervenir des orbitales p, mais des orbitales d peuvent également former des liaisons π, ce qui entre en jeu dans les liaisons multiples métal-métal.
 Les deux lobes des orbitales p sont parallèles et forment une liaison π de part et d'autre de l'axe internucléaire.
Les deux lobes des orbitales p sont parallèles et forment une liaison π de part et d'autre de l'axe internucléaire.
Propriétés
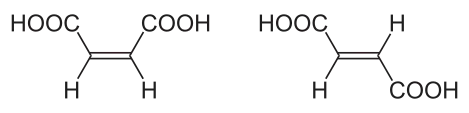
Les liaisons π sont généralement plus faibles que les liaisons σ. La double liaison C=C, formée d'une liaison σ et d'une liaison π[1], a une énergie de liaison inférieure au double de celle d'une liaison simple C–C, ce qui indique que la stabilité ajoutée par une liaison π est inférieure à celle d'une liaison σ. Du point de vue de la mécanique quantique, cette liaison plus faible s'explique par un recouvrement significativement moindre des orbitales p en raison de leur orientation parallèle. Les liaisons σ sont plus fortes car elles sont au contraire formées d'orbitales qui se recouvrent davantage le long de l'axe internucléaire. Les liaisons π sont également plus diffuses que les liaisons σ car les recouvrements sont réalisés dans un volume plus grand, de part et d'autre du plan nodal. La géométrie de ces liaisons fait qu'elles ne permettent pas la rotation des fragments moléculaires qu'elles unissent, car le recouvrement des orbitales p implique de conserver le parallélisme de ces dernières de part et d'autre de la liaison ; il en résulte une rigidité moléculaire à l'origine de la diastéréoisomérie des composés organiques présentant une telle liaison :
Dans les molécules diatomiques homonucléaires, les orbitales moléculaires π liantes ont un seul plan nodal passant par l'axe internucléaire et aucun plan nodal entre les atomes liés. L'orbitale antiliante correspondante, notée π*, contient en revanche un plan nodal entre les deux atomes liés.
On trouve des liaisons π par exemple dans les doubles liaisons des alcènes et dans les triples liaisons des alcynes. Ainsi, la liaison C=C de l'éthylène H2C=CH2 est constituée d'une liaison σ et d'une liaison π, tandis que la liaison C≡C de l'acétylène HC≡CH est constituée d'une liaison σ et de deux liaisons π dans deux plans orthogonaux contenant l'axe internucléaire. Il ne peut y avoir plus de deux liaisons π entre deux atomes. Les quadruples liaisons sont très rares et ne peuvent se former qu'entre atomes de métaux de transition susceptibles de former une liaison δ en plus des trois précédentes.
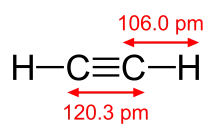
La liaison C≡C de l'acétylène (120 pm) est plus courte que la liaison C=C de l'éthylène (134 pm), qui est elle-même plus courte que la liaison C–C de l'éthane (154 pm[2] - [3]), ce qui illustre le renforcement de la liaison internucléaire avec l'addition de liaisons multiples.
 Éthane (σ).
Éthane (σ).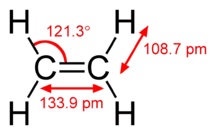
La présence d'une liaison π permet les additions électrophiles car elle peut être facilement rompue, contrairement aux liaisons σ. Ainsi l'addition d'iode I2 sur du propyne CH3C≡CH se fait par clivage des liaisons π.
Certaines molécules présentent une liaison π délocalisée : on dit qu'elles présentent un système conjugué. C'est par exemple le cas du benzène C6H6 :
Cas particuliers
Une liaison π peut exister entre deux atomes indépendamment de la présence d'une liaison σ. C'est par exemple le cas de l'hexacarbonyle de difer Fe2(CO)6, du carbone diatomique C2 et du diborane(2) HB=BH : dans ces structures, la liaison σ liante est accompagnée d'une liaison σ* antiliante qui l'annule, de sorte que ne restent que les liaisons π. Ces composés ont permis d'établir que la distance interatomique optimisant le recouvrement des orbitales p est sensiblement inférieure à la longueur des liaisons σ, ces dernières ayant donc pour effet d'affaiblir les liaisons π[4].
Certains complexes métalliques présentent des liaisons π issues d'interactions π entre un atome métallique et des orbitales π antiliantes d'alcène ou d'alcyne.
Notes et références
- (en) Andrew Streitwieser, Clayton H. Heathcock et Edward M. Kosower, Introduction to organic chemistry, 4e éd., Macmillan, New York, 1992, p. 250. (ISBN 978-0024181701) (OCLC 24501305)
- (en) A. Veillard, « Relaxation during internal rotation ethane and hydrogen peroxyde », Theoretica chimica acta, vol. 18, , p. 21-33 (DOI 10.1007/BF00533694, lire en ligne)
- (en) Marlin D. Harmony, « The equilibrium carbon–carbon single‐bond length in ethane », The Journal of Chemical Physics, vol. 93, no 10, , p. 7522-7523 (DOI 10.1063/1.459380, Bibcode 1990JChPh..93.7522H, lire en ligne)
- (en) Eluvathingal D. Jemmis, Biswarup Pathak, R. Bruce King et Henry F. Schaefer III, « Bond length and bond multiplicity: σ-bond prevents short π-bonds », Chemical Communications, no 20, , p. 2164-2166 (DOI 10.1039/B602116F, lire en ligne)