Éthane
L'éthane est un hydrocarbure de la famille des alcanes de formule brute C2H6. C'est un gaz combustible, incolore et inodore que l'on peut trouver dans le gaz naturel et aussi dans les gaz du pétrole.
| Éthane | |

| |
  |
|
| Molécule d'éthane | |
| Identification | |
|---|---|
| Nom UICPA | éthane |
| Synonymes |
diméthyle |
| No CAS | |
| No ECHA | 100.000.741 |
| No CE | 200-814-8 |
| PubChem | 6324 |
| SMILES | |
| InChI | |
| Apparence | gaz comprimé liquefié, incolore, inodore à l'etat pur[1]. |
| Propriétés chimiques | |
| Formule | C2H6 [Isomères] |
| Masse molaire[2] | 30,069 ± 0,002 g/mol C 79,89 %, H 20,11 %, |
| Propriétés physiques | |
| T° fusion | −183,3 °C[3] |
| T° ébullition | −88,6 °C[3] |
| Solubilité | 60,2 mg·l-1 (eau,25 °C) 460 ml·l-1 (éthanol,4 °C) |
| Paramètre de solubilité δ | 12,3 MPa1/2 (25 °C)[5] |
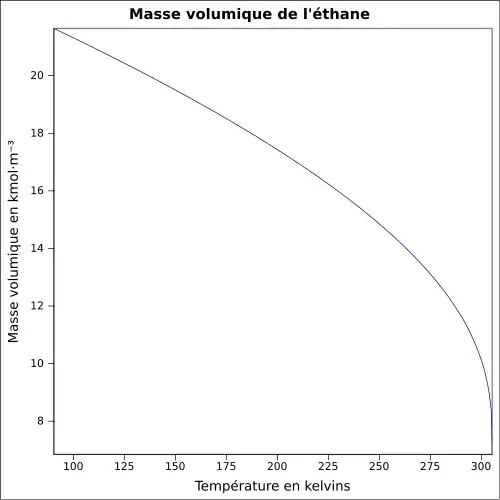
| Masse volumique | 1,355 1 kg·m-3 (0 °C, 1 013 mbar, gaz) 0,544 1 kg·l-1 (−88,6 °C, 1 013 mbar, liquide)[3] |
| T° d'auto-inflammation | 515 °C[3] |
| Point d’éclair | −135 °C[3] |
| Limites d’explosivité dans l’air | 2,4–14,3 %vol 31–182 g·m-3[3] |
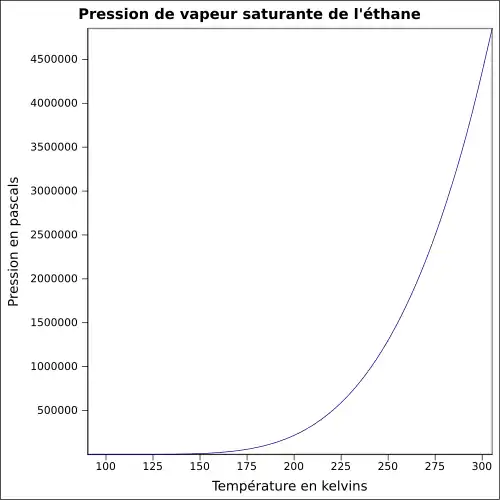
| Pression de vapeur saturante | 37,8 bar à 20 °C 46,9 bar à 30 °C[3] |
| Viscosité dynamique | 63,4 mPo à −78,5 °C[4] |
| Point critique | 32,15 °C 49 bar 0,147 l·mol-1[7] |
| Point triple | −182,15 °C 0,011 bar[7] |
| Vitesse du son | 1 326 m·s-1 (liquide,−88,6 °C) 312 m·s-1 (gaz,27 °C,1 atm)[8] |
| Thermochimie | |
| S0liquide, 1 bar | 126,7 J·mol-1·K-1[7] |
| ΔfH0gaz | −84,0 kJ·mol-1[7] |
| ΔfusH° | 0,583 kJ·mol-1 à −182,81 °C[7] |
| ΔvapH° | 9,76 kJ·mol-1 à 25 °C 14,703 kJ·mol-1 à −89,05 °C[7] |
| Cp | 52,49 J·mol-1·K-1 (25 °C, gaz) 68,68 J·mol-1·K-1 (−173,15 °C, liquide)[7] |
| PCS | 1 560,7 kJ·mol-1 (25 °C, gaz)[10] |
| PCI | 1 437,11 kJ·mol-1[7] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 11,56 ± 0,02 eV (gaz)[11] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P21/n[12] |
| Paramètres de maille | a = 4,226 Å b = 5,623 Å |
| Volume | 190,10 Å3[12] |
| Précautions | |
| SGH[13] | |
  Danger |
|
| SIMDUT[14] | |
  A, B1, |
|
| NFPA 704 | |
| Transport[3] | |
| Écotoxicologie | |
| LogP | 1,81[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Utilisation
L'éthane est le réactif de base pour la synthèse de l'éthylène via le vapocraquage, du monochloro-, du 1,1-dichloro-, et du 1,1,1-trichloroéthane par chloration. En combinant la chloration avec l'oxychloration, le chlorure de vinyle peut être synthétisé et la réaction de l'éthane avec l'acide nitrique en phase gazeuse permet la formation du nitrométhane et du nitroéthane[15].
L'éthane est un constituant du gaz de pétrole liquéfié qui est un combustible utilisé comme remplaçant du gaz naturel pour des applications particulières.
Propriétés physico-chimiques
L'éthane se décompose à partir d'une température de 500 °C. Sa solubilité dans l'eau et dans l'alcool est meilleure que celle du méthane puisque, à 20 °C, celle-ci est de 4,7 cm3 pour 100 cm3 d'eau et de 150 cm3 pour 100 cm3 d'alcool.
Production et synthèse
L'éthane est principalement issu de la purification du gaz naturel ou extrait du gaz de pétrole liquéfié, une fraction du pétrole[15].
Transport
Il est actuellement transporté liquéfié, mais pourrait aussi un jour l'être sous forme d'hydrate d'éthane (clathrate)[16].
Écologie
L'éthane est un polluant atmosphérique classé parmi les COV (Composé organique volatil).
C'est l'un des précurseurs de la pollution photochimique, qui conduit notamment à la pollution par l'ozone troposphérique.
Il est en outre considéré comme un traceur intéressant car il est associé aux émissions de méthane géologique (gaz de schiste, gaz naturel, émanations de pétroles légers), mais non aux émissions de méthane biogénique[17] (ce pourquoi il fait depuis quelques années l'objet d'un suivi (dont à partir de l'espace) et de modélisations).
Émissions naturelles et anthropiques
Sur Terre, on mesure des dégagements de l'ordre de quinze mégatonnes de ce gaz dans l'atmosphère par an :
- deux à quatre mégatonnes sont libérées par les volcans de boue, sources géothermales, bassins pétroliers et microfuites de gaz au fond des océans ;
- une dizaine de mégatonnes proviennent des feux de forêt, de l’activité biologique des océans, de la faune et des êtres humains[18].
- une quantité à ce jour non mesurée provient de fuites de forages, de gazoducs et canalisation d'installations pétrogazières et en particulier de gaz de schiste basées sur la fracturation hydraulique.
Éthane et gaz de schiste
Une étude[19] publiée en mai 2015 dans la revue Atmospheric Environment montre que l'éthane est un bon traceur des fuites de gaz liés à l'exploitation du gaz de schiste. Ces fuites peuvent être ainsi détectées à des centaines de miles sous le vent des zones d'extraction, y compris aux États-Unis dans les États qui interdisent ou contrôlent strictement le fracking[20].
Cette étude a fait suite à des anomalies détectées dans la teneur de l'air en éthane aux États-Unis à partir de 2010 où on l'a détecté en quantité importante dans des États où il n'était pas censé être émis : Alors qu'il y avait eu une diminution globale des émissions de COV non méthaniques et une amélioration de la qualité de l'air depuis 1996, le taux d'éthane dans l'air a, de 2010 à 2013, brutalement grimpé passant de 7 à 15 % du total du carbone organique non méthanique présent dans l'air[19], soit une augmentation « d'environ 30 pour cent de 2010 2013 »[20]. À cette époque, les émissions de méthane n'étaient pas assez suivies dans le pays pour que l'on puisse les lier à ces anomalies du taux d'éthane de l'air. Alors que rien ne pouvait dans le Maryland expliquer l'augmentation du taux d'éthane, il a rapidement été constaté que les valeurs horaires mesurées par les stations de surveillance photochimique de Baltimore et de Washington DC étaient fortement corrélées à la direction du vent et à l'évolution des activités de fracking dans le Bassin de Marcellus (où le gaz de schiste est massivement exploité depuis quelques années), à une grande distance en amont (par rapport au vent) du point de mesure. Les modèles météorologiques (appuyés sur la rose des vents, et la vitesse des vents) ont confirmé que le Maryland était exposé aux queues de panache d'émissions distantes provenant de Pennsylvanie, de Virginie-Occidentale et l'Ohio. Dans le Maryland, les vents dominants proviennent du Bassin de Marcellus les 2/3 du temps[20].
Les auteurs de l'étude ont pu exclure des causes toutes les sources capables d'expliquer l'apparition de ces pics d'éthane dans l'air (dont véhicules, fuites de gazoducs ou de stockage de gaz naturel dans le comté de Garrett, Md., Situé à 155 miles de la zone couverte par l'étude)[20]. Ils ont en outre constaté que la même analyse ne révélait pas ces pics d'éthane pour Atlanta, Ga. qui est situé dans une région non concernée par l'exploitation généralisée de gaz naturel et sans nouvelles opérations pétrogazières[21]. Cette étude confirme les travaux précédents montrant que l'on a sous-estimé la pollution par le méthane induite par l'exploitation des gaz de schiste, et elle montre que cette pollution peut avoir des effets distants (sachant que l'éthane est ici considéré comme traceur d'autres gaz plus nocifs (mercure) ou plus réactifs issus des puits, mais aussi des installations et travaux de forage, de complétion, réactivation et de mise en sécurité en fin de vie des puits (oxydes d'azote, pollution particulaire, dioxyde de soufre et vapeurs d'hydrocarbures également sources de pollution de l'air)[20].
Pour R. Subramanian (chercheur du Carnegie Mellon, spécialisé dans l'étude des particules atmosphériques, dont les travaux ont montré que l'éthane est un excellent marqueur des émissions de méthane provenant de l'exploitation et du transport de gaz naturel), cette étude montre la contribution potentielle de l'extraction de gaz de schiste en Pennsylvanie à la qualité de l'air dans les États sous le vent, et la nécessité d'envisager le transport inter-États de cette pollution dans la formulation de règlements environnementaux concernant la pollution particulaire et le contrôle de l'ozone troposphérique[20].
Pour Ehrman, ces résultats sont aussi des indices forts qu'on ne peut plus parler de pollution locale, mais qu'il y a un « problème régional ». Il ajoute que les auteurs ont voulu par cette publication « porter cette question à l'attention du public, et plaider en faveur d'une surveillance à long terme du méthane, et promouvoir la coopération régionale dans le suivi et la réduction des émissions provenant de la production de gaz naturel »[20].
Biodégradabilité dans la nature
On connait depuis quelques décennies des microbes méthanotrophes, notamment trouvés dans certains sédiments marins. Bien que la réaction biochimique nécessaire soit complexe et thermodynamiquement peu probable, des chercheurs pensaient donc qu'il peut aussi exister des microbes capables de consommer l'éthane (émis à hauteur de 10 % environ des panaches de gaz naturels localement trouvés dans les grands fonds marins et qui après remontée vers la surface composent 5% environ du méthane atmosphérique)[22].
Un premier microorganisme capable consommer de l'éthane en condition anaérobie a été découvert dans les fonds marins (publication 2019) : l'archée Argoarcheum ethanivorans ; il oxyde l’éthane grâce à une symbiose avec un autre microorganisme qui lui fournit du dioxygène, dans une action mutualiste (syntrophie), en réduisant le sulfate en sulfure[22] - [23].
Notes et références
- ETHANE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Ethane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19 avril 2009 (JavaScript nécessaire)
- « ETHANE », sur Hazardous Substances Data Bank (consulté le )
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) « Ethane », sur NIST/WebBook, consulté le 11 février 2010
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Ethane », sur www.reciprocalnet.org (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Éthane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry, Hydrocarbons, Wiley-VCH Verlag GmbH & Co,
- R. Kumar, P. Linga, I. Moudrakovski, J. A. Ripmeester, and P. Englezos, Structure and kinetics of gas hydrates from methane/ethane/propane mixtures relevant to the design of natural gas hydrate storage and transport facilities. AlChE J. 2008; 54 (8), 2132–2144.
- Looking to space to quantify natural gas leaks on Earth ; Phys.org 2015, Science X network, publié 24 mars 2015, consulté 2 mai 2015
- Science & Vie, On sait ce que la Terre dégaze d’hydrocarbures, nº 1098, mars 2009, p. 34.
- Vinciguerra, T & al. (2015) "Regional air quality impacts of hydraulic fracturing and shale natural gas activity: Evidence from ambient VOC observations," Atmospheric Environment, Volume 110, June 2015, Pages 144-150, ISSN 1352-2310, dx.doi.org/10.1016/j.atmosenv.2015.03.056 (résumé)
- News (1er mai 2015) Emissions from natural gas wells may travel far downwind, Phys.org, Science X network
- Timothy Vinciguerra, Simon Yao, Joseph Dadzie, Alexa Chittams, Thomas Deskins, Sheryl Ehrman, Russell R. Dickerson (2015), Regional air quality impacts of hydraulic fracturing and shale natural gas activity: Evidence from ambient VOC observations ; Atmospheric Environment Volume 110, June 2015, Pages 144–150
- (2019) Elusive microbe that consumes ethane found under the sea ; A microorganism that consumes ethane in the absence of environmental oxygen has been discovered. In the depths of the sea, this microbe, which oxidizes ethane, partners with another that reduces sulfate to sulfide, publié le 27 mars par la revue Nature
- Chen SC et al., Anaerobic oxidation of ethane by archaea from a marine hydrocarbon seep., 2019 DOI 10.1038/s41586-019-1063-0