Dioxyde de soufre
Le dioxyde de soufre, également appelé anhydride sulfureux (nom qui n’est plus employé en chimie), est un composé chimique de formule SO2. Il s'agit d'un gaz incolore, dense et toxique, dont l'inhalation est fortement irritante. Il est libéré dans l'atmosphère terrestre par les volcans et par de nombreux procédés industriels, ainsi que par la combustion de certains charbons, pétroles et gaz naturels non désulfurés. L'oxydation du dioxyde de soufre, le plus souvent en présence de catalyseurs tels que le dioxyde d'azote NO2, conduit au trioxyde de soufre SO3 et à l'acide sulfurique H2SO4, d'où la formation de pluies acides[15]. Elle a pour conséquence une inflammation de l'appareil respiratoire.
| Dioxyde de soufre | |
  Structure du dioxyde de soufre. |
|
| Identification | |
|---|---|
| Nom UICPA | dioxyde de soufre |
| Synonymes |
oxyde sulfureux, |
| No CAS | |
| No ECHA | 100.028.359 |
| No CE | 231-195-2 |
| No RTECS | WS4550000 |
| PubChem | 1119 |
| ChEBI | 18422 |
| No E | E220 |
| FEMA | 3039 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore ou gaz comprimé liquéfié, d'odeur âcre[1] |
| Propriétés chimiques | |
| Formule | SO2 |
| Masse molaire[2] | 64,064 ± 0,006 g/mol O 49,95 %, S 50,05 %, |
| Moment dipolaire | 1,633 05 D[3] |
| Diamètre moléculaire | 0,382 nm[4] |
| Propriétés physiques | |
| T° fusion | −75,5 °C[1] |
| T° ébullition | −10 °C[1] |
| Solubilité | dans l'eau à 25 °C : 85 ml·l-1[1] |
| Paramètre de solubilité δ | 12,3 J1/2·cm-3/2 (25 °C)[4] |
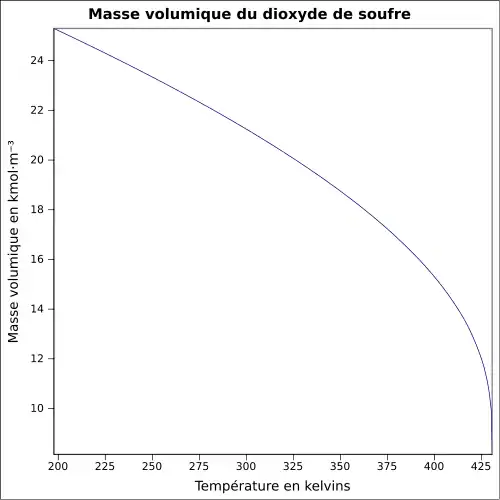
| Masse volumique | 1,354 g·cm-3 à −30 °C 1,434 g·cm-3 à 0 °C 1,25 g·ml-1 à 25 °C 2,26 à 21 °C par rapport à l'air |
| T° d'auto-inflammation | ininflammable |
| Point d’éclair | ininflammable |
| Limites d’explosivité dans l’air | non-explosif |
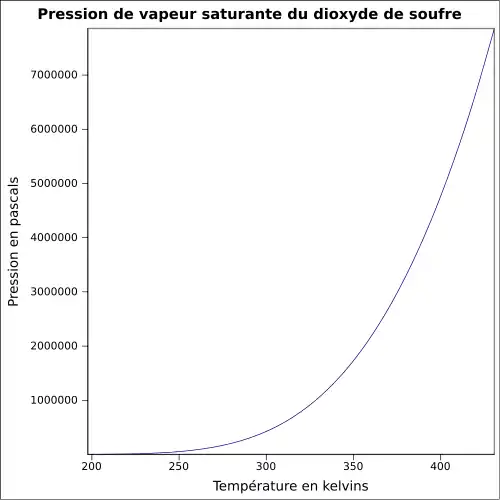
| Pression de vapeur saturante | −10 °C : 1,013 bar 20 °C : 3,3 bar 40 °C : 4,4 bar |
| Point critique | 78,9 bar, 157,45 °C[6] |
| Vitesse du son | 213 m·s-1 (0 °C,1 atm)[7] |
| Thermochimie | |
| S0gaz, 1 bar | 248,21 J/mol·K |
| ΔfH0gaz | −296,84 kJ·mol-1[8] |
| ΔvapH° | 24,94 kJ·mol-1 (1 atm, −10,05 °C); 22,92 kJ·mol-1 (1 atm, 25 °C)[9] |
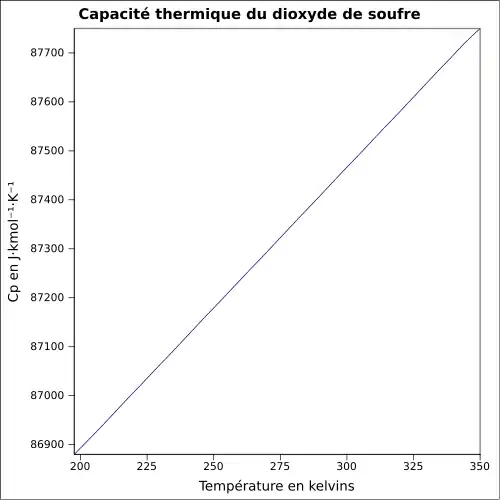
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 12,349 ± 0,001 eV (gaz)[10] |
| Propriétés optiques | |
| Indice de réfraction | 1,357[4] |
| Précautions | |
| SGH[11] | |
   Danger |
|
| SIMDUT[12] | |
   A, D1A, E, |
|
| NFPA 704 | |
| Transport | |
| Classification du CIRC | |
| Groupe 3 : inclassable quant à sa cancérogénicité pour l'humain[13] | |
| Inhalation | Très toxique, mort, produit de l'acide sulfureux dans les poumons. |
| Peau | Dangereux, corrosif, formation d'acide au contact de surfaces humides. |
| Yeux | Dangereux, corrosif, formation d'acide au contact de surfaces humides. |
| Ingestion | Toxicité relativement faible, effets à long terme inconnus. |
| Écotoxicologie | |
| CL50 | 3 000 ppm pendant 30 min (souris, inhalation) |
| Seuil de l’odorat | bas : 0,33 ppm haut : 5 ppm[14] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le dioxyde de soufre est utilisé comme désinfectant, antiseptique, antibactérien, gaz réfrigérant, agent de blanchiment, gaz catalyseur pour les noyaux de fonderie dans le procédé Ashland et comme conservateur de produits alimentaires, notamment pour les fruits secs, dans la production de boissons alcoolisées et dans l'élaboration du vin.
Structure de la molécule
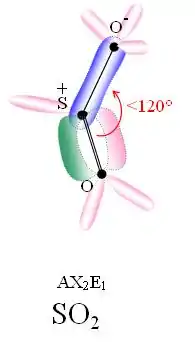
En rose, les doublets non liants ou hybridation s.
En vert, les orbitales des électrons liants (liaison πy).
SO2 est une molécule coudée dans laquelle l'atome de soufre est à l'état d'oxydation +4. Du point de vue de la théorie des orbitales moléculaires, la plupart des électrons de valence sont engagés dans une liaison S=O.
La longueur des liaisons S=O du SO2 est de 143,1 pm, inférieure à celle de cette liaison dans le monoxyde de soufre SO (148,1 pm).
Par analogie, les liaisons O-O dans l'ozone O3 (127,8 pm) sont plus longues que dans le dioxygène O2 (120,7 pm).
De même, l'énergie de liaison moyenne est plus élevée dans SO2 (548 kJ mol−1) que dans SO (524 kJ mol−1), alors qu'elle est plus faible dans O3 (297 kJ mol−1) que dans O2 (490 kJ mol−1).
Ces considérations ont conduit les chimistes à conclure que les liaisons S=O du dioxyde de soufre ont un ordre de liaison au moins égal à 2, contrairement aux liaisons O-O de l'ozone, qui sont d'ordre 1,5[16].
Production
Le dioxyde de soufre peut être préparé :
- par combustion du soufre élémentaire :
- par combustion de sulfure d'hydrogène ou de composés organosulfurés :
- par grillage des minéraux sulfurés comme la pyrite, la sphalérite ou le cinabre :
- 4 FeS2 (s) + 11 O2 (g) → 2 Fe2O3 (s) + 8 SO2 (g),
- 2 ZnS (s) + 3 O2 (g) → 2 ZnO (s) + 2 SO2 (g),
- HgS (s) + O2 (g) → Hg (g) + SO2 (g) ;
- comme produit résiduel de la fabrication du ciment : CaSiO3 et CaSO4 sont chauffés avec du coke et du sable (dioxyde de silicium) :
- 2 CaSO4 (s) + 2 SiO2 (s) + C (s) → 2 CaSiO3 (s) + 2 SO2 (g) + CO2 (g) ;
- par acide sulfurique chaud sur de la limaille de cuivre
- Cu(s) + 2 H2SO4 (aq) → CuSO4 (aq) + SO2 (g) + 2 H2O (l).
Le dioxyde de soufre dissous dans l'eau est un acide bifonctionnel, et se divise en trois fractions en fonction des équilibres suivants :
- H2O + SO2 H+ + HSO3− 2 H+ + SO32−.
Ces fractions dépendent de constantes thermodynamiques et du pH du vin.
On obtient également un dégagement de SO2 en mélangeant du métabisulfite de sodium Na2S2O5 avec de l'acide tartrique dans de l'eau, expérience proposée par certains coffrets d'initiation aux expériences de chimie.
Propriétés physiques
Pression de vapeur saturante[17] :
| Température | −103,15 °C | −98,15 °C | −93,15 °C | −88,15 °C | −83,15 °C | −78,15 °C | −73,15 °C |
|---|---|---|---|---|---|---|---|
| Pression | 0,1 kPa | 0,2 kPa | 0,3 kPa | 0,5 kPa | 0,8 kPa | 1,3 kPa | 2,0 kPa |
| Température | −68,15 °C | −63,15 °C | −58,15 °C | −53,15 °C | −48,15 °C | −43,15 °C | −38,15 °C |
|---|---|---|---|---|---|---|---|
| Pression | 3,0 kPa | 4,4 kPa | 6,3 kPa | 9,0 kPa | 12,6 kPa | 17,3 kPa | 23,3 kPa |
| Température | −33,15 °C | −28,15 °C | −23,15 °C | −18,15 °C | −13,15 °C | −8,15 °C | −3,15 °C |
|---|---|---|---|---|---|---|---|
| Pression | 31,1 kPa | 40,9 kPa | 53,2 kPa | 68,3 kPa | 86,7 kPa | 109 kPa | 136 kPa |
| Température | 1,85 °C | 6,85 °C | 11,85 °C | 16,85 °C | 21,85 °C | 26,85 °C |
|---|---|---|---|---|---|---|
| Pression | 168 kPa | 205 kPa | 249 kPa | 300 kPa | 359 kPa | 426 kPa |
Dans l'industrie
Dans l'industrie, le dioxyde de soufre sert surtout pour la production d'acide sulfurique. Ce dernier possède d'innombrables applications et est le produit chimique le plus utilisé seul ou combiné avec d'autres substances, comme le chlorure de thionyle SOCl2. Le dioxyde de soufre est obtenu par combustion de soufre ou de pyrites, puis transformé en trioxyde de soufre (SO3) très pur par oxydation avec de l'air, catalysée par le platine ou du pentoxyde de vanadium. Le SO3 ainsi obtenu permet la fabrication directe d'acide sulfurique très concentré par simple hydratation.
La pollution atmosphérique en dioxyde de soufre issue de l'industrie provient principalement de la consommation de combustibles fossiles. En effet, du soufre est naturellement contenu dans ces combustibles, et leur combustion génère du SO2. Il peut aussi provenir de l'industrie métallurgique, des procédés de fabrication d'acide sulfurique, de la conversion de la pulpe de bois en papier, de l'incinération des ordures et de la production de soufre élémentaire.
La combustion du charbon est la source synthétique la plus importante et représente environ 50 % des émissions globales annuelles. Celle du pétrole représente encore 25 à 30 %.
Les rejets industriels de dioxyde de soufre peuvent être réduits grâce à la mise en place de procédés de désulfuration.
Dans l'environnement

Le dioxyde de soufre naturel est produit par les volcans.
Le SO2 joue un rôle refroidissant pour la planète, car il sert de noyau de nucléation à des aérosols dont l'albédo est assez élevé, c'est-à-dire réfléchissant les rayons du Soleil sans les absorber, mais cet effet ne dure que quelques années, là où celui du CO2 atteint le siècle.
La dernière éruption majeure du Pinatubo a relâché jusqu'à 5 000 t de SO2 dans l'air (17 Mt au total, la quantité la plus importante jamais mesurée par des instruments modernes[18]), ce qui a affecté la couche d'ozone et modifié la météo en refroidissant significativement la planète et en modifiant la pluviométrie durant au moins deux ans. À noter toutefois qu'en 1986, les émissions anthropiques des seuls États-Unis (17,1 Mt) étaient comparables à cette émission-record du Pinatubo.
La géoingénierie solaire étudie l'utilisation du SO2 comme moyen d'enrayer le réchauffement climatique. Les modèles récents montrent que les aérosols issus de l'injection de SO2 dans la stratosphère basse pourraient compenser entièrement la monté des températures dans l'ensemble du système terrestre[19], en réfléchissant une partie du rayonnement solaire en dehors de l'atmosphère. Des incertitudes persistent sur l'impact local d'un tel procédé, notamment sur les modifications sur le cycle de l'eau. Par ailleurs, l'utilisation d'aérosols dans ce cadre ne permettrait pas de régler le problème d'acidification des océans[20].
Polluant atmosphérique
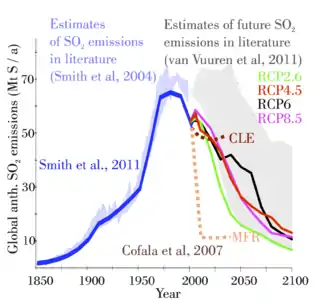
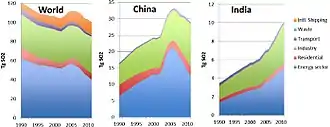
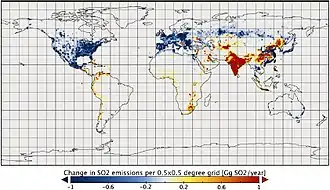
Le dioxyde de soufre est l'un des polluants majeurs de l'atmosphère depuis le début de la révolution industrielle, en raison des grandes quantités de charbon, puis de pétrole et de gaz brûlés par les humains, essentiellement dans l'hémisphère nord. Il a des effets significatifs sur la santé publique[21].
En outre, la concentration de dioxyde de soufre dans l'air dégrade les écosystèmes : c'est un acidifiant chronique des pluies et l'acidification des sols et des sédiments favorisent la libération de métaux toxiques (métaux lourds, métalloïdes, radionucléides, etc.) ainsi que leur biodisponibilité[22].
Les émissions de dioxyde de soufre sont (avec les nitrates) des précurseurs des pluies acides mais elles contribuent aussi à la formation d'aérosols atmosphériques qui modifient significativement le climat. En grande partie grâce au programme Acid Rain Program (en) de l'Environmental Protection Agency, les États-Unis qui comptaient parmi les plus gros émetteurs ont enregistré une diminution de 33 % des émissions de 1983 à 2002. Cette amélioration résulte essentiellement de la désulfuration des gaz de combustion, une technologie qui permet de récupérer du soufre dans les gaz de combustion des centrales au charbon et au pétrole en particulier en le faisant réagir avec de la chaux pour former du sulfite de calcium :
- CaO + SO2 → CaSO3
L'oxydation aérobie du CaSO3 donne du CaSO4, anhydrite.
La plus grande partie du gypse vendu en Europe provient maintenant de la désulfuration des gaz de combustion.
Dans une chaudière industrielle à lit fluidisé, le soufre peut être ôté du charbon au moment de sa combustion en ajoutant du calcaire comme matériau dans le lit. On parle de « combustion à lit fluidisé »[23].
Le soufre peut aussi être éliminé de certains combustibles (pétrole, gaz) avant même la combustion, ce qui empêche la formation de SO2 lorsque le combustible est brûlé et protège les installations des effets corrosifs du soufre. Le procédé Claus est utilisé dans les raffineries pour produire du soufre en tant que sous-produit. Le procédé de Stretford a aussi été utilisé pour éliminer le soufre du carburant. Les procédés reposant sur une réaction d'oxydoréduction à base d'oxydes de fer peuvent enfin être utilisés, par exemple, le procédé « Lo-Cat »[24] - [25].
L'utilisation obligatoire de carburants désoufrés pour certains usages a permis de diminuer les quantités émises dans l'air à partir des années 1970, mais des dérogations accordées au transport maritime et à certaines industries expliquent des émissions qui restent importantes. Par ailleurs au début du XXIe siècle, la Chine et l'Inde, en brûlant de grandes quantités de charbon, restent des émetteurs majeurs de gaz soufrés. Certains additifs pour carburants (ex à base de calcium et de carboxylate de magnésium) peuvent être utilisés dans les moteurs marins pour réduire les émissions de dioxyde de soufre dans l'atmosphère[26].
En 2006, la Chine était le plus grand pollueur au dioxyde de soufre au monde, en grande partie pour produire des biens de consommation utilisés dans d'autres pays (« émissions grises »). En 2005, les émissions chinoises étaient estimées à 23,1 Mt, presque comparables à celles des États-Unis en 1980, et étaient en forte augmentation (croissance de plus de 27 % en cinq ans de 2000 à 2005)[27]. Pour moins subir les retombées acides de la Chine, le Japon a décidé en 2007 de l'aider à développer les énergies propres[28].
Dans l'agroalimentaire
Il est largement utilisé dans l'agroalimentaire et l'agro-industrie et est principalement présent dans :
- les vins, essentiellement rosés et blancs qui présentent moins de tannins que les vins rouges et subissent donc une plus forte oxydation. Le dioxyde de soufre permet de réduire celle-ci ;
- les vinaigres ;
- les fruits secs ;
- les viandes, les gelées utilisées en charcuterie, les bières et autres boissons fermentées ;
- confiseries, confitures, fruits confits, gelées, marmelades, sirops, etc.
En vinification
Dans le vin, le dioxyde de soufre est présent sous forme libre hydratée : H2SO3 ou acide sulfureux, qui se combine aux 2/3 à des constituants du vin. On a ainsi SO2 total = SO2 libre + SO2 combiné.
Une partie de la portion libre assure le rôle de protecteur du vin vis-à-vis des microorganismes d'altération. Cette portion est appelée SO2 actif ou encore SO2 moléculaire. Le SO2 peut être sous forme combinée avec les aldéhydes (éthanal), les cétones (acide alpha-cétoglutarique) et certains sucres pour donner un composé stable. Le corps formé par combinaison entre l’anhydride sulfureux et l’éthanal est l’acide aldéhyde-sulfureux ou acide éthanolsulfonique, qui est un acide fort, selon la réaction suivante :
- CH3CHO + NaH SO3 → CH3CHOH-O-SO2Na
Selon la dose, le dioxyde de soufre inhibe ou arrête le développement des levures et bactéries, ce qui peut être mis à profit pour le mutage des vins moelleux ou liquoreux, ou simplement pour assurer la conservation du vin. Lors de la vinification, l'introduction de dioxyde de soufre permet de sélectionner les levures de l'espèce Saccharomyces cerevisiae qui sont plus résistantes au dioxyde de soufre que les levures d'autres genres comme Pichia anomala (en) (syn. Hansenula). Diverses méthodes analytiques existent pour doser le SO2 dans les vins.
Santé et règlementation
Le dioxyde de soufre ou E220 provoquerait un danger pour la santé dans les cas suivants[29] :
- lors de son inhalation ;
- lors de son ingestion ;
- lors du contact avec la peau et les muqueuses.
Au cours de son ingestion, les organes présentant des activités sulfites oxydases les plus élevées sont plus susceptibles de le détoxiquer par voie urinaire. La persistance des dérivés du SO2 peut être envisagée par un apport excessif. Pour l’utilisateur, les sulfites sont des nucléophiles très puissants qui ne donnent aucune toxicité aigüe mais peuvent provoquer de fortes ou sévères allergies. Il détruit la vitamine B1 (ou thiamine) vers pH = 6, peut provoquer des irritations gastriques, à éviter chez les malades des reins[30]. Ainsi, la DJA établie par l'OMS est de 0,7 mg kg−1 de poids par jour.
Dans la plupart des observations, les symptômes apparaissent quelques minutes après l’ingestion d’aliments contenant des sulfites. La pollution atmosphérique par le SO2 jouerait aussi un rôle dans l’apparition de ces réactions d’intolérance. De plus, les sujets asthmatiques sont beaucoup plus sensibles que la moyenne des gens.
La règlementation européenne oblige maintenant les producteurs à indiquer la mention « Contiennent des sulfites » s’il est à concentration de plus de 100 mg l−1. Au Canada, la SAQ limite la concentration à 50 ppm l’anhydride sulfureux à l’état libre et à 300 ppm l’anhydride sulfureux à l’état combiné[31].
Dans le contexte actuel où le respect de l’environnement et les aliments à caractère biologique sont de plus en plus prônés, les viticulteurs et même les consommateurs tendent à se tourner maintenant vers les vins biologiques dont les teneurs en SO2 sont moindres mais pour lesquels l'utilisation du SO2 reste autorisée[32]. À noter que, comparativement aux autres pays du monde (le Canada, la Suisse ou les États-Unis), les règles d’incorporation du SO2 au cours de la vinification sont beaucoup plus restrictives, voire plus sévères en Europe. Les producteurs de vins naturels se donnent pour objectif de réduire au maximum l'ajout de dioxyde de soufre.
Le tableau suivant montre les différences notables des concentrations de SO2 total dans ces différents pays :
| SO2 en mg/l | NOP (É.-U.) « Made with organic grapes » SO2 total |
Bio Canada | Bourgeon Suisse | Demeter SO2 total (5 ans) |
|---|---|---|---|---|
| Rouge sec (sucre < 5 g l−1) |
100 | 100 | 120 | 70 |
| blanc/rosé sec (sucre < 5 g l−1) |
100 | 100 | 120 | 90 |
| blanc/rosé sec (sucre < 5 g l−1) |
100 | 150 | 170 | 70 |
| Blanc/rosé (sucre > 5 g l−1) |
100 | 150 | 170 | 130 |
| Vin de liqueur (sucre > 5 g l−1) |
100 | 250 | 170 | 80 |
Incidents majeurs en France
Le à 7 h 45, un problème technique lors de la fermeture d'une vanne à la raffinerie de Feyzin (appartenant au groupe Total) laissa échapper un grand nuage de dioxyde de soufre poussé par un vent du sud au-dessus de l'agglomération lyonnaise. Plusieurs personnes furent hospitalisées et des entreprises évacuées[34].
La préfecture, qui cherchait à rassurer la population, recommanda « d’aérer les habitations et les bureaux », donnant ainsi des consignes opposées à celles des pompiers qui conseillaient aux personnes de « rester chez elles et de fermer les fenêtres »[35].
Notes et références
- DIOXYDE DE SOUFRE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of Chemistry and Physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- (en) « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) W. M Haynes, Handbook of Chemistry and Physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40.
- (en) Irvin Glassman et Richard A. Yetter, Combustion, Amsterdam/Boston, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0).
- (en) David R. Lide, Handbook of Chemistry and Physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 [PDF], 16 décembre 2008.
- « Dioxyde de soufre » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009.
- IARC_Working_Group_on_the_Evaluation_of_Carcinogenic_Risks_to_Humans2009">IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'humain, Groupe 3 : inclassables quant à leur cancérogénicité pour l'humain », sur monographs.iarc.fr, CIRC, (consulté le ).
- (en) « Sulfur dioxide », sur hazmap.nlm.nih.gov (consulté le ).
- (en) A. F. Holleman et E. Wiberg, « Inorganic Chemistry », Academic Press, San Diego, 2001 (ISBN 0-12-352651-5).
- (en) Norman N. Greenwood et A. Earnshaw, « Chemistry of the Elements », Butterworth-Heinemann 2e éd., p. 700, Oxford, 1997 (ISBN 0-08-037941-9).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0), p. 6-105.
- Stephen Self et al., The Atmospheric Impact of the 1991 Mount Pinatubo Eruption, Fire and Mud: Eruptions and Lahars of Mount Pinatubo, Philippines, 1997.
- (en) Peter J. Irvine, Ben Kravitz, Mark G. Lawrence et Helene Muri, « An overview of the Earth system science of solar geoengineering », WIREs Climate Change, vol. 7, no 6, , p. 815–833 (ISSN 1757-7780 et 1757-7799, DOI 10.1002/wcc.423, lire en ligne, consulté le ).
- Phillip Williamson et Carol Turley, « Ocean acidification in a geoengineering context », Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences, vol. 370, no 1974, , p. 4317–4342 (PMID 22869801, PMCID PMC3405667, DOI 10.1098/rsta.2012.0167).
- Sulfur Dioxide, EPA
- Hogan, C. Michael, « Abiotic factor » in Encyclopedia of Earth, 2010, Emily Monosson et C. Cleveland (éditeurs), National Council for Science and the Environment, Washington DC.
- (en) Michael R. Lindeburg, Mechanical Engineering Reference Manual for the PE Exam, Belmont, C.A., Professional Publications, Inc, , 1296 p. (ISBN 978-1-59126-049-3), p. 27–3.
- FAQ's About Sulfur Removal and Recovery using the LO-CAT Hydrogen Sulfide Removal System. gtp-merichem.com
- Process screening analysis of alternative gas treating and sulfur removal for gasification [PDF], décembre 2002, Report by SFA Pacific, Inc. prepared for U.S. Department of Energy (consulté le 31 octobre 2011).
- May, Walter R., Marine Emissions Abatement, SFA International, Inc., p. 6.
- China has its worst spell of acid rain, United Press International, 22 septembre 2006.
- Michel Temman, « Victime de ses rejets, Tokyo aide Pékin à se mettre au vert », Libération, 16 avril 2007, [lire en ligne].
- Centre canadien d'hygiène et de sécurité au travail.
- Lire en ligne.
- Lire en ligne.
- Règles de vinification bio en France et à l'étranger [PDF], sur millesime-bio.com.
- Lire en ligne.
- Lire en ligne.
- Lire en ligne, sur 20minutes.fr.
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- Ressource relative au vivant :
- (en) EPPO Global Database
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Institut français de l'environnement.
- Atmosphere, Climate & Environment Information Programme du gouvernement du Royaume-Uni.