Ozone
L'ozone (de l'allemand Ozon, dérivé du grec ozô « exhaler une odeur »), ou trioxygène, est une substance de formule chimique O3 : ses molécules sont triatomiques, formées de trois atomes d'oxygène. L'ozone est ainsi une variété allotropique de l'oxygène, mais bien moins stable que le dioxygène O2, en lequel il tend naturellement à se décomposer. Il se liquéfie à 161,3 K (−111,9 °C) sous forme d'un liquide bleu foncé et se solidifie à 80,7 K (−192,5 °C) en un solide pourpre[2]. À température ambiante, c'est un gaz bleu pâle, voire incolore, qui se démarque par son odeur[3]. L'ozone atteint son point critique à 5 460 kPa et −12,05 °C[4].
| Ozone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Trioxygène | |
| Synonymes |
ozone |
|
| No CAS | ||
| No ECHA | 100.030.051 | |
| No CE | 233-069-2 | |
| SMILES | ||
| InChI | ||
| Apparence | gaz incolore ou bleuâtre, d'odeur caractéristique | |
| Propriétés chimiques | ||
| Formule | O3 [Isomères] |
|
| Masse molaire[1] | 47,998 2 ± 0,000 9 g/mol O 100 %, |
|
| Moment dipolaire | 0,533 73 D | |
| Propriétés physiques | ||
| T° fusion | −192,5 °C | |
| T° ébullition | −111,9 °C | |
| Solubilité | dans l'eau à 0 °C : 1 g/l | |
| Masse volumique | 2,144 g/l (0 °C) | |
| Point critique | 55,7 bar, −12,05 °C | |
| Thermochimie | ||
| ΔfH0gaz | 142,67 kJ/mol | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 12,43 eV (gaz) | |
| Précautions | ||
| SGH | ||
    Danger |
||
| SIMDUT« Ozone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009 | ||
    A, C, D1A, D2A, D2B, F, |
||
| Directive 67/548/EEC | ||
| Signalisation indicative, non requise par la réglementation puisque l'ozone est toujours produit sur le lieu de son utilisation : | ||
| Écotoxicologie | ||
| CL50 | 8 à 12 mg/m3 | |
| Seuil de l’odorat | bas : 0,007 6 ppm haut : 0,03 ppm |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Son instabilité se manifeste à l'état condensé par une tendance à l'explosion lorsque sa concentration est significative[2]. L'ozone se décompose en dioxygène O2 à température ambiante : la rapidité de la réaction dépend de la température, de l'humidité de l'air, de la présence de catalyseurs (hydrogène, fer, cuivre, chrome, etc.) ou du contact avec une surface solide[4].
Contrairement au dioxygène inodore, l'ozone est perçu par l'odorat humain (décelable dès la concentration de 0,01 ppm[4] - [5]) ; son odeur caractéristique qui rappelle l'eau de Javel est perceptible dans les endroits confinés où règne un champ électrique important (transformateur haute tension, soudure à l'arc, tubes UV, allume-gaz piézo-électrique). Respiré en grande quantité, il est toxique et provoque la toux.
L'ozone est naturellement présent dans l'atmosphère terrestre, formant dans la stratosphère une couche d'ozone entre 13 et 40 km d'altitude qui intercepte plus de 97 % des rayons ultraviolets du Soleil, mais est un polluant dans les basses couches de l'atmosphère (la troposphère) où il agresse le système respiratoire des animaux et peut brûler les végétaux les plus sensibles. Cet oxydant énergique agresse les cellules vivantes et peut être responsable de phénomènes de corrosion accélérée de polymères (« craquelage d'élastomères par l'ozone »)[6].
Historique
.jpg.webp)
L'ozone a été découvert en 1789 par le chimiste néerlandais Martin van Marum en faisant passer un courant électrique à travers de l'oxygène enfermé dans une éprouvette. Il relève une odeur spécifique comparable à celle de l'acide sulfureux ou du phosphore. L'éprouvette trempée dans le mercure lui permet d'observer que le volume d'oxygène diminue presque de moitié et que le mercure est très rapidement oxydé. Sans savoir ce que révélait son travail, il définit cette odeur comme étant celle de l'électricité et l'espèce créée comme de l'acide azotique[7].
Cette étude est reprise en 1840 par le chimiste allemand Christian Friedrich Schönbein qui, en approfondissant les recherches de Van Marum, parvient à isoler la molécule[8]. Il la dénomma ainsi en se référant à la racine grecque ozein (exhaler une odeur, sentir). La formule de l'ozone, O3, n'a été déterminée qu'en 1865 par Jacques-Louis Soret[9] puis confirmée en 1867 par Christian Friedrich Schönbein. Par la suite, de nombreuses recherches sur le mécanisme de désinfection par l'ozone suivirent. Werner von Siemens fabriqua le tout premier générateur d'ozone[10]. Ce fabricant écrivit d’ailleurs un livre sur l'application de l'ozone dans l'eau, ce qui entraînera une multitude de projets de recherches sur la désinfection par l'ozone.
En 1907, le chimiste français Marius-Paul Otto, qui reçut un doctorat pour ses travaux sur l'ozone, créa une entreprise appelée Compagnie des Eaux et de l'Ozone[11].
La relation entre l’ozone et les oxydes d’azote a été mise en évidence dans les années 1970 par Paul Josef Crutzen, prix Nobel de chimie 1995[12].
Physico-chimie
Le potentiel d'oxydoréduction de l'ozone est de 2,07 V[13].
Enthalpie de formation : ΔfH0gaz = 142,67 kJ mol−1[14]
La première énergie d'ionisation est égale à 12,43 eV (gaz)[15]
L'odeur associée à l'ozone provient de l'ionisation due à la destruction de l'ozone. Sa couleur est due à la diffusion de Rayleigh qui donne une teinte bleutée en présence de hautes concentrations de la molécule[16].
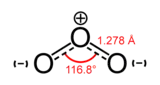
Structure de la molécule
La molécule d'ozone est une molécule coudée à symétrie moléculaire de type C2v (semblable à la molécule d'eau). L'angle entre les atomes d'oxygène est 116,78°[17]. L'ozone est une molécule polaire avec un moment dipolaire de 0,533 73 D[18].

Réactions
L'ozone est un oxydant très puissant, plus puissant que l'oxygène ou le chlore. Étant très instable, il se dégrade en O2 assez rapidement :
- 2 O3 ⟶ 3 O2.
Réactions avec les métaux
En présence d'humidité, l'ozone oxyde tous les métaux à l’exception de l'or, du platine et de l'iridium[4]. Ci-dessous, l'oxydation du cuivre par exemple :
Réactions avec les métaux alcalins
L'ozone réagit avec les métaux alcalins et métaux alcalino-terreux pour former des ozonides (M + O3 ⟶ MO3), instables et réagissant avec l’eau pour former du dioxygène. Cette succession de réactions chimiques explique pour la plus grande part le caractère de polluant qui est attribué à l’ozone quand celui-ci est présent dans l’atmosphère près du sol.
Réactions avec des composés azotés
L'ozone oxyde le monoxyde d'azote NO en dioxyde d'azote NO2 :
Le dioxyde d'azote NO2 peut à son tour être oxydé en nitrate NO3 :
L'ozone peut oxyder l'ammoniac NH3 en nitrate d'ammonium NH4NO3 :
Réactions avec des composés carbonés
L'ozone réagit avec le carbone pour former du dioxyde de carbone :
Réactions avec les composés soufrés
L'ozone oxyde les sulfures S2− en sulfates SO42−. Exemple avec le sulfure de plomb(II) :
L'acide sulfurique H2SO4 peut être produit avec de l'ozone, de l'eau et du soufre ou du dioxyde de soufre :
En phase gazeuse, l'ozone réagit avec le sulfure d'hydrogène pour former du dioxyde de soufre :
En solution aqueuse, deux réactions simultanées se produisent. La première produit du soufre, la deuxième produit de l'acide sulfurique :
Matières résistantes à l'ozone
- Matériaux résistants à l'ozone en phase gazeuse
- Verre
- Téflon (PTFE, PVDF, PFA)
- Aciers inox 316L
- Silicone
- Titane
- Polyuréthane
- Polycarbonate
- Matériaux résistants à l'ozone dissous dans l'eau
- Verre
- Téflon (PTFE, PVDF, PFA)
- Aciers inox 316L
- PVC
- Plexiglas
- Béton
- Silicone
- Aluminium
- Polysulfure
- Matériaux pour les joints d'étanchéité
- Téflon (PTFE, PVDF, PFA)
- Kynar, Viton, etc.
Matières non-résistantes à l'ozone (gazeux ou dissous dans l'eau)
- Polypropylène
- Acier, Zinc, Fer, Cuivre et autres métaux oxydables
- Nylon
- Magnésium
- Caoutchouc
- Néoprène
- Polyamide
Décomposition
L'ozone possède une demi-vie assez courte, encore plus dans l'eau (où il se décompose en radicaux -OH) que dans l'air. Différents facteurs influencent la vitesse de décomposition de l'ozone[19] :
- La température
| Dans l'air | Dans l'eau (pH 7) | ||
|---|---|---|---|
| Température (°C) | Demi-vie | Température (°C) | Demi-vie |
|
–50 |
3 mois |
15 |
30 minutes |
|
–35 |
18 jours |
20 |
20 minutes |
|
–25 |
8 jours |
25 |
15 minutes |
|
20 |
3 jours |
30 |
12 minutes |
|
120 |
1 heure et 30 minutes |
35 |
8 minutes |
|
250 |
1,5 seconde | ||
- Le pH
- Dissous dans l'eau, l'ozone se décompose partiellement en radicaux -OH. Si le pH augmente alors la formation des radicaux -OH augmentera[20].
- La concentration en solides dissous
- L'ozone dissous dans l'eau réagit avec une grande variété de matière (composés organiques, virus, bactéries, etc.) par un phénomène d'oxydation de ces matières. L'ozone se décomposera alors en dioxygène (O2). C'est ainsi que l'ozone se décompose beaucoup moins vite dans de l'eau distillée que dans une simple eau de ville[20].
- L'environnement
- L'ozone gazeux possède une demi-vie théorique (voir tableau ci-dessus) plus longue que l'ozone dissous dans l'eau. Mais en pratique, l'ozone gazeux va oxyder tout ce qu'il y a autour de lui (métaux, machines, murs, personnel ou même odeurs) réduisant ainsi sa demi-vie à seulement quelques secondes.
Toxicité
L'ozone est extrêmement nocif pour les poumons, les reins, le cerveau et les yeux. À titre d'exemple, une concentration de 9 ppm d'ozone dans l'air entraînera des œdèmes pulmonaires. Entre cette valeur et le seuil moyen de perception olfactive (0,1 ppm en moyenne), on retrouve sécheresse buccale, toux, hypersécrétion bronchique, dyspnée, douleur rétrosternale et anomalie du système respiratoire. Une simple concentration de 0,2 à 0,5 ppm d'ozone dans l'air peut déjà provoquer des troubles de la vision comme une diminution de la vision nocturne et une mauvaise adaptabilité à la lumière, une augmentation de la vision périphérique et une modification de la motricité oculaire. À cela s'ajoutent des troubles rénaux (néphrite aiguë) et neurologiques (vertiges, asthénies, altération du goût, trouble de la parole, mauvaise coordination du mouvement, etc.)[4].
La réglementation française et les directives européennes fixent un objectif de qualité au maximum journalier de la moyenne sur 8 heures à 120 µg/m3 (60 ppb soit 0,06 ppm) et le seuil d'alerte à 240 µg/m3. Cet objectif de qualité correspond aux niveaux 5 (indice français) ou 50 (indice européen) des informations diffusées par les organismes tels que Airparif[21], Airpaca[22], Atmo[23], etc.
Ozone atmosphérique
Ozone dans la haute atmosphère - La « couche d'ozone »


Dans la haute atmosphère terrestre, la couche d’ozone est une concentration d’ozone qui filtre une partie des rayons ultraviolets émis par le Soleil, ultraviolets notamment responsables du cancer de la peau. Cette couche protectrice est menacée par la pollution, en particulier par les émissions de gaz CFC (chlorofluorocarbure), qui montent dans la haute atmosphère et y catalysent la destruction de l’ozone en le transformant en dioxygène, étant ainsi à l’origine du trou dans la couche d’ozone[24].
Comme instrument de mesure, on peut noter l’instrument GOMOS du satellite ENVISAT.
Ozone dans la basse atmosphère - Pollution à l'ozone
Au-delà d'un certain seuil dans la basse atmosphère, l'ozone est l'un des polluants de l'air les plus dangereux pour la santé.
Causes naturelles :
- les feux de forêt en sont une source importante, à partir des hydrocarbures et des oxydes d’azote qu'ils libèrent. Sous le vent de ces feux, sur de longues distances, les taux d'ozone peuvent tripler et dépasser les seuils recommandés[25] ;
- l'ozone est aussi produit avec les éclairs de l'orage ainsi que, plus généralement, à partir de toute étincelle ou arc électrique ;
- lors de fortes températures, la dispersion de l'ozone vers les couches supérieures de l’atmosphère est freinée, induisant éventuellement des problèmes de santé chez les personnes fragiles. Ainsi, chaque été, en France, c'est la région Provence-Alpes-Côte d'Azur (et plus particulièrement les Bouches-du-Rhône), qui est la plus touchée par les pics de pollution à l’ozone ;
- dans la nature, en cas de canicule ou forte insolation, les arbres émettent de l'isoprène qui interagit avec l'ozone, et contribue à produire des aérosols, brumes et nuages protégeant les arbres d'un stress climatique excessif[26].
Causes humaines :
- l'ozone touche tout particulièrement les zones industrialisées ayant un fort ensoleillement (en été comme en hiver). Il est surtout produit par l'action du rayonnement solaire (UV) sur des produits chimiques dits précurseurs de l'ozone. Ces derniers sont des polluants industriels, issus des chaudières, des centrales électriques thermiques et des incinérateurs. Il est aussi produit directement en faibles quantités par certains matériels électriques ;
- l’ozone est aussi très présent autour des grands centres urbains, notamment lors des canicules où on le trouve en grandes quantités dans les basses couches de l’atmosphère. Il y est principalement produit par la réaction des polluants précurseurs : principalement les hydrocarbures imbrûlés et le dioxyde d’azote (NO2) des gaz d’échappement des véhicules, avec le dioxygène de l’air et sous l’influence de la lumière solaire ;
- photocopieuses et imprimantes laser ou moteurs électriques dégagent de l'ozone, pouvant conduire à des concentrations significatives dans un local mal ventilé.
Cette pollution dans son ensemble a un impact très important en agriculture (attaque des cuticules foliaires) avec perte de productivité, et pour la santé humaine. En effet, l'ozone irrite et attaque les muqueuses oculaires et des bronches et bronchioles, tout particulièrement chez les populations les plus sensibles. En 2010, une étude américaine[27] a confirmé que l’ozone, même à faible dose, était directement associé à la survenue des crises d’asthme chez l'enfant. Les pics de pollutions induisent une augmentation du nombre et de la gravité des crises d'asthme. Ces pics sont aussi associés à une surmortalité des personnes ayant des problèmes respiratoires (lors de canicules notamment, mais également en hiver par temps ensoleillé). La prévalence de l'asthme ainsi que la mortalité due à l'asthme a augmenté des années 1980 à 2000[28], en même temps qu'augmentaient les taux d'ozone près des axes routiers, dans les grandes zones industrialisées et urbanisées et loin sous leur vent, dans les campagnes et jusqu'au-dessus de l'océan : l'ozone et les précurseurs troposphériques de l'ozone produits au Canada sont exportés par le vent jusqu'au centre de l'atlantique Nord. Ces quantités dépassent largement celles qui proviennent de la stratosphère (principale source naturelle d'ozone). Les taux d'ozone peuvent aussi fortement augmenter dans le panache d'émission riches en oxydes d'azote des centrales thermiques[29]. Dans l'hémisphère nord au moins, la pollution anthropique par l'ozone a un effet qui dépasse l'échelle des continents[30].
Les enfants des populations urbaines pauvres y sont souvent plus vulnérables. En 1994, à Atlanta, une étude épidémiologique a montré que les jours où les taux d'ozone atteignaient ou dépassaient 0,11 ppm dans l'air, et jusqu'au lendemain du pic de pollution, le nombre moyen d'hospitalisation pour asthme ou difficultés respiratoires réactives était de 37 % plus élevé que les autres jours. De plus, cette étude a aussi montré que les enfants noirs de familles pauvres étaient les plus touchés[28].
C'est pour toutes ces raisons que l'Association santé environnement France (ASEF), qui réunit près de 2 500 médecins en France, a réclamé une prise en charge politique du problème[31].
L'ozone fait l'objet de modélisations et de prévisions accessibles depuis les années 1990[32].
Production
En laboratoire

Un appareil de laboratoire couramment utilisé pour la démonstration de production d'ozone était la machine électrostatique de Whimshurst : elle utilisait la mise en rotation par une manivelle de deux plateaux isolés identiques, mais tournant en sens inverse. Des balais collectent l'électricité statique produite par le frottement, ils déchargent les plaques en produisant un arc électrique autour duquel apparait de l'ozone (alors diffusé dans l'air)[33].
De l’ozone peut être produite par électrolyse en utilisant une batterie de 9 V, une cathode de graphite, une anode de platine et l’acide sulfurique comme électrolyte. Les demi-réactions qui ont lieu sont :
Trois équivalents d’eau sont utilisés pour produire un équivalent d’ozone. Cette réaction est en compétition avec celle de formation d’oxygène.
Production industrielle
Une production industrielle d'ozone est permise par plusieurs techniques :
- exposition d'air à des radiations ultraviolettes de courtes longueurs d’onde émises par une lampe à vapeur de mercure ;
- décharge à froid dite décharge corona ou décharge à effet corona, dans un champ électrique élevé (technique inspirée par la foudre).
L’appareil de décharge est constitué de deux plaques de métal séparées par une couche d’air et un isolant électrique de constante diélectrique élevée, comme le mica ou un verre borosilicaté. Une différence de potentiel élevée est appliquée entre les deux plaques, ce qui entraîne la dissociation des molécules d’oxygène de la couche d’air et leur recombinaison en ozone.
Une couronne peut être présente mais le champ électrique est maintenu à une valeur inférieure à celle qui entraînerait l’apparition d’un arc électrique et d’un plasma.
La concentration d'ozone produit est directement proportionnelle à la fréquence des décharges électriques entre électrodes.
Ainsi, on distingue les générateurs d'ozone à fréquence standard (50 Hz) et les générateurs à fréquence moyenne (200 - 400 Hz).
Les générateurs à fréquence moyenne sont les plus courants notamment dans le traitement de l'eau, ils peuvent atteindre 4 à 6 % d'ozone à partir d'air (6 à 12 % avec un concentrateur d'oxygène) contre 1,5 à 2,5 % (3 à 4 % à partir d'oxygène) d'ozone pour les générateurs à fréquence standard ; - certains générateurs d'ozone fonctionnent par électrolyse de l'eau. Son principal avantage est une taille réduite (parfois pas plus grand qu'un stylo).
Destruction
L'ozone se dégrade très vite (cfr. décomposition de l'ozone) mais il est néanmoins indispensable de pouvoir détruire l'ozone résiduel lorsque cette molécule est utilisée en industrie dans le but évident de protection du personnel. L'ozone peut être dégradé en dioxygène par différentes façons :
- destruction thermique : les destructeurs thermiques d'ozone sont utilisés pour de grandes concentrations d'ozone. Le principe est simple : l'ozone est chauffé jusqu'à la température de 350 °C pendant un certain temps, ce qui réduit sa demi-vie à quelques millisecondes[34]. Les molécules d'ozone sont alors dégradées en dioxygène[35] ;
- utilisation de catalyseurs : la destruction d'ozone au moyen de catalyseurs est la plus utilisée[36]. C'est une réaction catalytique exotherme[37]. L'oxyde de magnésium et une solution à 2 % de KI[38] sont parmi les catalyseurs les plus répandus ; la catalyse est le procédé qui permet de purifier l'air dans les avions de ligne[39], dont les trajets peuvent traverser le bas de la couche d'ozone.
- utilisation de charbon actif : celui-ci est utilisé pour des concentrations très basses (0,1 à 0,3 ppm d'ozone ambiant). En effet, avec des concentrations plus élevées en ozone ou lorsque l'ozone est produit à partir de dioxygène concentré, le charbon actif peut déclencher une combustion[36].
L'ozone résiduel peut également être rejeté dans l'atmosphère après dilution dans un grand volume d'air, opération réalisée par de puissants ventilateurs.
Injection d'ozone gazeux dans l'eau
L'injection d'ozone dans l'eau est assez compliquée car l'ozone est très peu soluble dans l'eau[3].
Diffuseur à poreux
Des diffuseurs appelés diffuseurs à poreux dont l'élément poreux est en verre de quartz permettent un rendement maximum de 20 %. Le principe des diffuseurs à poreux est de diffuser des bulles d'ozone gazeux d'une taille variant entre 0.5 et 2 mm dans l'eau à traiter. Ces systèmes sont idéaux pour de petites quantités d'eau à traiter.
Contacteur à membrane
Les contacteurs à membrane permettent d'obtenir une haute concentration d'ozone dissous dans l'eau. La membrane permet les échanges entre l'ozone gazeux et l'eau à traiter. Le principe du contacteur suit la loi de Henry en abaissant la pression de l'ozone gazeux en contact avec l’eau (qui circule transversalement) pour créer une force conductrice permettant l'injection de l'ozone dans l'eau.
Injecteur Venturi
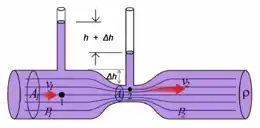
Un injecteur-venturi est utilisé le plus souvent pour obtenir une concentration maximale d'ozone dissous dans l'eau, en effet, un injecteur venturi permet un rendement d'environ 90 %. Le principe du venturi est une application de l'équation de Bernoulli[40] qui exprime le bilan hydraulique d'un fluide dans une conduite en régime permanent :
- où
- est la pression en un point (en Pa ou N/m²) ;
- est la masse volumique en un point (en kg/m³) ;
- est la vitesse du fluide en un point (en m/s) ;
- est l'accélération de la pesanteur (en N/kg ou m/s²) ;
- est l'altitude (en m).
Or, à débit constant : q (débit en m³/s) = S1v1 = S2v2 = constante, avec S : surface en un point (m²) et v : vitesse du fluide en un point (m/s). Ceci montre que si la surface diminue comme c'est le cas dans l'injecteur venturi, la vitesse augmente.
En reprenant l'équation simplifiée de Bernoulli : si la vitesse augmente, alors la pression diminue. Il y a donc une dépression dans la zone contractée du venturi (là où le tuyau d'ozone gazeux est raccordé) ce qui permet l'aspiration de l'ozone gazeux dans l'eau à ozoner.
Utilisations
L’ozone est un oxydant et un désinfectant puissant. Il présente certains avantages par rapport à d’autres oxydants habituellement utilisés dans l’industrie, en particulier le chlore.
- C'est l'un des désinfectants les plus puissants. Son potentiel d'oxydoréduction (ou potentiel redox) de 2,07 est très largement supérieur à celui du chlore qui est de 1,35. Cela revient à dire que l'ozone oxydera des éléments qui ne l'auraient pas été par le chlore, d'où des temps de contact bien plus courts pour un même résultat de désinfection.
- L'ozone est un assemblage de 3 atomes d'oxygène, qui une fois produit n'aura qu'une priorité : oxyder tout ce qu'il rencontre (murs, machines, sols, personnel et même bactéries ambiantes et odeurs) en se dégradant en dioxygène. D'où aucun résidu dû à la dégradation de l'ozone et surtout demi-vie extrêmement courte en industrie (quelques minutes voire quelques secondes en pratique). Dans l'eau, l'ozone tend à redevenir de l'oxygène ne laissant ici non plus aucun résidu, il peut dès lors être utilisé pour le traitement d'eau ultra-pure.
- Contrairement aux autres techniques de désinfection, l'utilisation d'ozone ne nécessite pas de stockage de produits dangereux puisqu'il est produit directement sur place et uniquement lorsque l'on en a besoin, conséquence directe de son instabilité.
De manière générale, les inconvénients en sont :
- le coût des équipements de production d'ozone, comparés à d'autres méthodes ;
- impossibilité de stocker l'ozone sous forme gazeuse ou dissous dans l'eau car il se dégrade très vite ;
- la toxicité de l'ozone, qui nécessite des mesures de sécurités plus strictes : détection d'ozone gazeux ambiant par un ozomètre à ozone gazeux capable d'arrêter la production du générateur dès que le seuil de 0,3 ppm dans l'air est dépassé, un destructeur d'ozone résiduel (thermique ou à catalyseur), voire des masques spécifiques pour la protection du personnel ;
- la consommation d'énergie due à la production d'ozone par décharge électrique.
Désinfection de l'eau potable
Pour la désinfection de l'eau potable, l’ozone présente des avantages par rapport au chlore : il ne reste pas présent dans l’eau et n'altère donc pas son goût, et ne provoque pas l’apparition de composés organochlorés, qui peuvent être cancérogènes.
Néanmoins, l'ozone ne permet pas d'inactiver tous les micro-organismes présents dans l'eau (comme les parasites Cryptosporidium[41], Giardia et Toxoplasma gondii), même s'il a une efficacité certaine contre Cryptosporidium et Giardia[42].
L’ozone est employé dans le traitement de l’eau pour plusieurs fonctions :
- oxydation du fer ;
- amélioration de la performance de filtres à sable ;
- amélioration de la floculation (appelée « ozofloculation ») ;
- élimination de composés organiques nocifs, en particulier pesticides et herbicides. Pour cette application l’ozone est en général injecté en amont d’un filtre à charbon.
L'ozone est devenue une référence de qualité pour l'eau potable dans beaucoup de communes et de villes à travers le monde :
- l'ozone est utilisé par la ville de Nice depuis maintenant 1907 (première usine au monde purifiant l'eau par l'ozone à Bon-Voyage et après à Rimiez)[43] ;
- l'ozone a permis à la ville de Marseille et à son agglomération d'être classée en 1998, à partir des normes de l'Organisation mondiale de la santé (OMS), par le magazine ça m'intéresse : première ville de France pour la qualité de son eau[44].
Traitement des eaux
L’ozone est utilisé dans des procédés de traitement des eaux usées, en particulier pour rendre digestible par des bactéries la demande chimique en oxygène (DCO) dite « dure », pour le traitement de la couleur, et pour la désinfection de l’eau en sortie de stations d’épuration (traitement dit tertiaire). Ces applications nécessitent la maîtrise de plusieurs techniques : ozonisation, mais aussi bioréacteurs. Parfois la performance de l'ozone peut être améliorée en combinant l’ozonisation à un traitement UV à haute dose d’irradiation. On parle alors de procédés d’oxydation avancés.
L'ozone est également une alternative aux agents chlorés (eau de javel) pour la désinfection des eaux de piscine.
Utilisations médicales
L'ozone est utilisé comme antiseptique et bactéricide dans le traitement des plaies[45].
Autres utilisations
Les propriétés oxydantes et désinfectantes de l'ozone sont encore mises à profit dans diverses situations.
- En blanchisserie, pour le lavage de linge blanc dans les installations commerciales ou hospitalières. Cette application est très répandue dans les pays anglo-saxons mais peu en Europe continentale.
- Dans l'industrie agroalimentaire, pour la désinfection des chambres froides ou de produits alimentaires comme des légumes, des fruits, de la viande ou du poisson par bain d’eau ozonée. L'utilisation d'eau ozonée permet de ne modifier ni le goût ni l'aspect des aliments.
- Dans l'agriculture pour l'éradication des insectes (Sitophilus sp., Tribolium sp., etc.) au niveau du stockage des grains (blé, orge, etc.) par ozone gazeux[46]. De plus, des recherches sont en cours pour la désinfection des grains au niveau des contaminants fongiques (Fusarium, Alternaria, etc.) ;
- En micro-électronique, les wafers destinés à la fabrication de circuits intégrés sont lavés avec de l’eau ozonée avec pour objectif l’élimination de traces éventuelles de matières organiques.
- En papeterie, l'ozone est employé comme agent de blanchiment alternatif au chlore.
- L'eau ozonée est un moyen simple à mettre en œuvre pour la destruction de biofilms dans des conduites.
Mesure de la concentration d'ozone
Dans l'eau
- Méthode colorimétrique
C'est la méthode la plus simple et la moins coûteuse. L'échantillon d'eau à analyser passe dans un tube contenant un réactif à l'ozone (réactif DPD ou dipropyl-p-phénylènediamine appelé aussi réactif indigo), la lecture de la concentration se fait grâce à un disque colorimétrique ou un spectrophotomètre. Le problème de cette technique est le manque de précision. De plus, cette méthode nécessite un personnel avec une formation de laborantin.
- Sondes électrochimiques
Les sondes électrochimiques contiennent un électrolyte qui est séparé de l'eau par une membrane sélective. On mesure alors un courant électrique entre ces deux électrodes placées de part et d'autre de la membrane. La concentration d'ozone dans l'eau fera varier ce courant électrique.
- Analyseur d'ozone
- Analyseur à mesure directe dans l'eau
Ces analyseurs utilisent la loi de Beer-Lambert. Une longueur d'eau connue est traversée par un rayon ultraviolet. On mesure l'absorption UV de l'échantillon et un simple calcul donne la concentration d'ozone dans l'eau.
- Analyseur utilisant la loi de Henry
Une colonne de dégazage extrait l'ozone de l'eau. La concentration d'ozone est alors mesurée dans l'air, par la suite la concentration d'ozone dans l'eau est déduite à l'aide de la loi de Henry. Le gros avantage de ces analyseurs est la possible utilisation sur des eaux non-traitées.
- Méthode de mesure de potentiel redox
C'est une méthode assez peu utilisée car elle s'appuie sur le fait que l'ozone, étant un puissant oxydant, fera varier le potentiel redox de l'eau. C'est vrai, mais il faudra alors que la qualité de l'eau reste parfaitement constante. Sans cela, les mesures de potentiel redox risquent d'être erronées. De plus, cette méthode nécessite un pré-étalonnage à l'aide d'une autre méthode (colorimétrique par exemple) pour pouvoir être utilisable en pratique.
Dans l'air
- Méthode colorimétrique
C'est la méthode la plus simple et la moins coûteuse. L'échantillon d'air à analyser passe dans un tube contenant un réactif à l'ozone (réactif DPD ou dipropyl-p-phénylènediamine), la lecture de la concentration se fait grâce à une échelle colorimétrique. Le problème de cette technique est le manque de précision.
- Système de capteurs à semi-conducteur
Ces appareils utilisent un matériau semi-conducteur dont les caractéristiques électriques varient en fonction de la concentration d'ozone dans l'air.
- Analyseur d'ozone
Les analyseurs d'ozone (ou ozomètre à ozone gazeux) calculent la concentration d'ozone dans l'air à l'aide de la loi de Beer-Lambert qui détermine la concentration d'ozone en fonction de l'absorption du rayonnement UV. Ces appareils, extrêmement coûteux par rapport aux autres systèmes, présentent de nombreux avantages comme une grande précision, aucune interférence avec d'autres éléments, une réponse très rapide et aucun consommable à prévoir[47]. À noter aussi, qu'étant donné la toxicité de l'ozone gazeux, la plupart des générateurs d'ozone sont couplés à un analyseur d'ozone gazeux qui arrête la production d'ozone lorsque la valeur seuil d'ozone dans l'air ambiant (généralement 0,3 ppm) est dépassée.
Les variations de concentration de la couche d'ozone stratosphérique se mesurent par spectroscopie.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Ozone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 janvier 2009 (JavaScript nécessaire)
- OZONE, Fiches internationales de sécurité chimique
- T. Clavel et al., Fiche Toxicologique no 43, INRS,
- « Ozone » [archive du ], sur hazmap.nlm.nih.gov (consulté le )
- Ozonolysis mechanism, sur organic-chemistry.org (consulté le 3 mai 2017)
- Petruus Isaacus Hollman, Mémoire sur l'équivalent calorifique de l'ozone, Utrecht, C, Van der Post Jr., , 78 p. (lire en ligne), p. 1-2
- Bull. Hist. Chem., vol. 26, no 1, 2001
- Recherche sur la densité de l'ozone, sur bnf.fr (consulté le 3 mai 2017)
- (en)Ernst Werner von Siemens Biography, sur madehow.com (consulté le 3 mai 2017)
- « Histoire de l'ozone », sur www.lenntech.fr (consulté le )
- (en) Paul J. Crutzen Biography, sur notablebiographies.com (consulté le 3 mai 2017)
- Non trouvé le 3 mai 2017, sur nutech-o3.com
- (en) Irvin Glassman et Richard A. Yetter, Combustion, Amsterdam/Boston, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6
- (en) David R. Lide, Handbook of Chemistry and Physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Where can I find information about the ozone hole and ozone depletion? », sur Global Change Master Directory, (consulté le )
- (en) Tanaka Takehiko et Morino Yonezo, Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states, Journal of Molecular Spectroscopy, 1970, vol. 33, p. 538–551
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- Non trouvé le 3 mai 2017, sur ozone.ch
- « Décomposition de l'ozone », sur lenntech.fr (consulté le )
- Airparif
- Airpaca
- Atmo
- De mystérieux CFC et HCFC menacent la couche d'ozone, sur futura-sciences.com, 10 mars 2014 (consulté le 23 mars 2017)
- (en) Impacts of the fall 2007 California wildfires on surface ozone: integrating local observations with global model simulations, Gabriele Pfister et al., Geophysical research letters (consulté le 23 octobre 2008)
- (en) A. Guenther, T. Karl, P. Harley, C. Wiedinmyer, P. I. Palmer et C. Geron, Estimates of global terrestrial isoprene emissions using MEGAN (Model of Emissions of Gases and Aerosols from nature), 2006, Atmos. Chem. Phys., vol. 6, p. 3181–3210
- (en) Matthew J Strickland, Lyndsey A Darrow, Mitchel Klein, W Dana Flanders, Jeremy A Sarnat, Lance A Waller, Stefanie E Sarnat, James A Mulholland et Paige E Tolbert, Short-term Associations between Ambient Air Pollutants and Pediatric Asthma Emergency Department Visits, Am. J. Respir. Crit. Care Med., 8 avril 2010, DOI 10.1164/rccm.200908-1201OC
- (en) White M. C., Etzel R. A., Wilcox W. D. et Lloyd C., Exacerbations of Childhood Asthma and Ozone Pollution in Atlanta; Epidemiology Study, Environmental Research, vol. 65, issue 1, avril 1994, p. 56-68, DOI 10.1006/enrs.1994.1021, Résumé
- (en) B. Ryerson, M. Trainer, J. S. Holloway, D. D. Parrish, L. G. Huey, D. T. Sueper, G. J. Frost, S. G. Donnelly, S. Schauffler, E. L. Atlas, W. C. Kuster, P. D. Goldan, G. Hübler, J. F. Meagher et F. C. Fehsenfeld, Report Observations of Ozone Formation in Power Plant Plumes and Implications for Ozone Control Strategies, Science, 27 avril 2001, vol. 292, no 5517, p. 719-723, DOI 10.1126/science.1058113
- (en) David D. Parrish, John S. Holloway, Michael Trainer, Paul C. Murphy, Fred C. Fehsenfeld et Gerry L. Forbes, Export of North American Ozone Pollution to the North Atlantic Ocean, Science, 5 mars 1993, vol. 259, no 5100, p. 1436-1439, DOI 10.1126/science.259.5100.1436 (Résumé)
- Notre santé, sur asef-asso.fr (consulté le 3 mais 2017)
- Exemple : Cartes PREV’AIR de simulation/prévision de l'ozone (incluant veille et lendemain), France et UE (utilisable par tous sous réserve que la marque PREV’Air et l’adresse www.prevair.org soient explicitement mentionnées dans toute publication)
- http://www.coe.ufrj.br/~acmq/wimshurst.html
- http://www.degremont-technologies.com/IMG/pdf/ODT_A4_EU-F.pdf
- http://www.trailigaz.com/fd_fr.htm
- http://www.lenntech.fr/destructeur-ozone.htm
- http://www.innovatec-rheinbach.de/KVM_Prospekt_francais.pdf
- Advanced oxidation processes for the organic matter removal of agro-food brine wastewater, M. Fiter et al., IOA Conference and Exhibition Valencia, Spain, 29-31 octobre 2007
- Site de l'industriel BASF
- Bruhat, G., Mécanique, 6e édition, Masson, 1967
- Les protozoaires : la Giardia et le Cryptosporidium, sur Santé Canada
- Protozoaires entériques : Giardia et Cryptosporidium, sur Santé-Canada
- http://www.nice.fr/Culture/Centre-du-patrimoine/Les-Fiches-Patrimoine-et-autres-publications/Gairaud-et-Rimiez-l-eau-des-collines-nicoises
- « L’eau à la bouche », sur Madame Figaro, (consulté le ).
- « Archive Larousse : Larousse Médical - oxyurose - ozone », sur larousse.fr (consulté le ).
- http://www.purdue.edu/uns/html4ever/030130.Mason.ozone.html
- http://www.airaq.asso.fr/mesures/techniques-de-mesure/fonctionnement-des-analyseurs/166-l-ozone-o3.html
Voir aussi
Articles connexes
Liens externes
- Cartes PREV'AIR de simulation/prévision de l'ozone (incluant veille et lendemain), France et UE (cartes utilisables par tous sous réserve que la marque PREV'Air et l'adresse www.prevair.org soient explicitement mentionnées dans toute publication)
- Fiche internationale de sécurité
- (fr) Pollution de l'air par l'ozone et santé, résumé de GreenFacts de rapports scientifiques de l'OMS
- Prévision de l'ozone, prévisions et observations de la qualité de l'air en France et en Europe
- (en) International Ozone Association - European African Asian Australasian Group
- Association des médecins suisses pour l'utilisation thérapeutique de l'ozone
- L'histoire de l'ozone révélée par des spores fossiles, sur futura-sciences.com





