Aluminium
L'aluminium est l'élément chimique de numéro atomique 13, de symbole Al. Il appartient au groupe 13 du tableau périodique ainsi qu'à la famille des métaux pauvres.
| Aluminium | |||||||||||
 Morceau d'aluminium. | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Al | ||||||||||
| Nom | Aluminium | ||||||||||
| Numéro atomique | 13 | ||||||||||
| Groupe | 13 | ||||||||||
| Période | 3e période | ||||||||||
| Bloc | Bloc p | ||||||||||
| Famille d'éléments | Métal pauvre | ||||||||||
| Configuration électronique | [Ne] 3s2 3p1 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 3 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 26,981 538 6 ± 8 u | ||||||||||
| Rayon atomique (calc) | 125 pm (118 pm) | ||||||||||
| Rayon de covalence | 121 ± 4 pm[1] | ||||||||||
| Rayon de van der Waals | 205 pm | ||||||||||
| État d’oxydation | +3 | ||||||||||
| Électronégativité (Pauling) | 1,61 | ||||||||||
| Oxyde | amphotère | ||||||||||
| Énergies d’ionisation[2] | |||||||||||
| 1re : 5,985 768 eV | 2e : 18,828 55 eV | ||||||||||
| 3e : 28,447 65 eV | 4e : 119,992 eV | ||||||||||
| 5e : 153,825 eV | 6e : 190,49 eV | ||||||||||
| 7e : 241,76 eV | 8e : 284,66 eV | ||||||||||
| 9e : 330,13 eV | 10e : 398,75 eV | ||||||||||
| 11e : 442,00 eV | 12e : 2 085,98 eV | ||||||||||
| 13e : 2 304,141 0 eV | |||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | solide | ||||||||||
| Masse volumique | 2,698 9 g·cm-3[3] | ||||||||||
| Système cristallin | Cubique à faces centrées | ||||||||||
| Dureté (Mohs) | 1,5 | ||||||||||
| Couleur | blanc lustre métallique | ||||||||||
| Point de fusion | 660,323 °C (congélation)[4] | ||||||||||
| Point d’ébullition | 2 519 °C[3] | ||||||||||
| Énergie de fusion | 10,79 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 294 kJ·mol-1 (1 atm, 2 519 °C)[3] | ||||||||||
| Volume molaire | 10,00×10-6 m3·mol-1 | ||||||||||
| Pression de vapeur | 2,42×10-6 Pa | ||||||||||
| Vitesse du son | 6 400 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 897 J·K-1·kg-1 (solide, à 298 K)[5]
|
||||||||||
| Conductivité électrique | 37,7×106 S·m-1 | ||||||||||
| Conductivité thermique | 237 W·m-1·K-1 | ||||||||||
| Solubilité | sol. dans NaOH, KOH ou Na2CO3 aqueux[6], HCl (catalysée par CuCl2, HgCl2 ou une goutte de Hg), |
||||||||||
| Divers | |||||||||||
| No CAS | [8] | ||||||||||
| No ECHA | 100.028.248 | ||||||||||
| No CE | 231-072-3 | ||||||||||
| Précautions | |||||||||||
| SGH[9] - [10] | |||||||||||
Pyrophorique : Danger Stabilisé :  Attention |
|||||||||||
| SIMDUT[11] | |||||||||||
 B6, |
|||||||||||
| Transport[9] - [10] | |||||||||||
| Pyrophorique : Stabilisé : |
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Le corps simple aluminium est un métal malléable, argenté, peu altérable à l'air [note 1] et peu dense. C'est le métal le plus abondant de l'écorce terrestre et le troisième élément le plus abondant après l'oxygène et le silicium ; il représente en moyenne 8 % de la masse des matériaux de la surface solide de la planète. Il est, en règle générale, trop réactif pour exister à l'état natif dans le milieu naturel [note 2] : on le trouve combiné à plus de 270 minéraux différents. Son minerai principal est la bauxite : il y est présent sous forme d’oxyde hydraté dont on extrait l’alumine. Il peut aussi être extrait de la néphéline, de la leucite, de la sillimanite, de l'andalousite et de la muscovite.
Le métal mis à nu s'auto-passive immédiatement par oxydation, même en condition défavorable : une couche d'alumine Al2O3 imperméable épaisse de quelques nanomètres le protège de la corrosion (les conditions favorables sont essentiellement : environnement peu chaud, peu humide, peu pollué, peu salé ; alliage de qualité adaptée). L'oxydabilité de l'aluminium doit être techniquement contrôlée dans les processus industriels ; elle est mise à profit dans certains d'entre eux (les deux principaux sont l'oxydation rapide amplifiée forcée anodique électrolytique et le colmatage rapide par hydratation à chaud).
Sa légèreté, sa résistance à la corrosion, sa mise en forme variée et sa coloration durable en font un matériau important et très utilisé dans l'industrie et l'artisanat, malgré la technicité de sa mise en œuvre, sous forme pure ou alliée, notamment dans l'aéronautique, les transports et la construction. Sa nature réactive en fait également un catalyseur et un additif dans l'industrie chimique ; il est ainsi utilisé pour accroître la puissance explosive du nitrate d'ammonium.
En 2010, 211 millions de tonnes de bauxite ont été extraites dans le monde[13], l'Australie en assurant 33,2 % devant la Chine (19,0 %), le Brésil (15,2 %), l'Inde (8,5 %) et la Guinée (8,2 %). La Guinée détient à elle seule plus du quart des réserves mondiales connues de bauxite, estimées fin 2010 à 28 milliards de tonnes. La production mondiale d'aluminium métallique s'est élevée à 41,4 millions de tonnes en 2010[14], dont la Chine a réalisé 40,6 % avec 16,8 millions de tonnes, loin devant la Russie (9,3 %) et le Canada (7,1 %). Ce n'est pas un oligoélément, et c'est un contaminant croissant de l'environnement et de l'alimentation[15].
Histoire



En 1807, Humphry Davy, après avoir découvert que le sodium et le potassium entraient dans la composition de l’alun (substance astringente servant à fixer les teintures), suppose qu’il s’y trouve aussi un autre métal, qu’il baptise « aluminium » (en latin, « alun » se dit alumen)[16]. Pierre Berthier découvre dans une mine près des Baux-de-Provence en 1821 un minerai contenant de 50 à 60 % d’oxyde d’aluminium. Ce minerai sera appelé bauxite.
En 1825, le chimiste et physicien danois Hans Christian Ørsted réussit à produire une forme impure du métal.
En 1827, Friedrich Wöhler approfondit les travaux d'Ørsted. Il isole l’aluminium par action du potassium sur le chlorure d’aluminium, obtenant une poussière grise d’aluminium. Il est le premier à mettre en évidence les propriétés chimiques et physiques de cet élément, dont la plus notable est la légèreté.
Le chimiste français Henri Sainte-Claire Deville améliore en 1846 la méthode de Wöhler en réduisant le minerai par le sodium. En 1854, il présente à l'Académie des sciences le premier lingot d'aluminium obtenu, à l'état fondu, par voie chimique[17]. Il publie ses recherches dans un livre en 1856. Cette méthode est utilisée de façon industrielle à travers toute l’Europe pour la fabrication de l’aluminium (notamment en 1859 par Henry Merle dans son usine de Salindres, berceau de la société Pechiney), mais elle reste extrêmement coûteuse, donnant un métal dont le prix était comparable à celui de l'or (1 200 et 1 500 F or/kg et l'argent 210 F/kg seulement). Le métal est alors réservé pour fabriquer des bijoux de luxe[18] ou de l’orfèvrerie réservée à une élite. Il en est ainsi pour les coupes d'honneur (réalisées notamment par Paul Morin et Cie)[19] et les objets d'art fabriqués pour la cour impériale de Napoléon III[20]. Ce dernier reçoit ses hôtes de marque avec des couverts en aluminium, les autres convives devant se contenter de couverts en vermeil[21] - [22].
Les progrès de l'électricité et la découverte, en 1886, d'une production de l'aluminium par électrolyse, permettent de baisser les coûts de manière importante. Dès lors, l'aluminium trouve de nouvelles applications dans les ustensiles de cuisine et, en alliage, dans l'industrie de l'aéronautique (alliage duralumin moins cassant créé en 1909) et le câblage électrique (almelec créé en 1921 et utilisé comme conducteur électrique). En 1888, Charles Martin Hall et Alfred Ephraim Hunt créent la Pittsburgh Reduction Company, la future Alcoa. En 1901 naît l’Aluminium Association (AA), cartel qui réunit les entreprises des quatre seuls pays producteurs au monde (France, États-Unis, Allemagne, Royaume-Uni) et qui maintient le prix de l'aluminium stable alors que le cours des métaux concurrents subissent de plus grandes fluctuations[23]. À la fin des années 1970, la production d’aluminium se contracte et l'arrivée de nouveaux concurrents (Canada, Australie, Russie) fait éclater le cartel qui ne contrôle plus son prix qui décline[24].
- 1855 : les nouveaux métaux sont exposés à l’Exposition universelle de Paris. La société Pechiney est créée en France.
- Le premier site industriel producteur d’aluminium au monde s’installe à Salindres dans le Gard, et commence son activité dès 1860.
- 1876 : William Frishmuth réalise la première coulée d’aluminium. En 1884, il réalise la coiffe du Washington Monument dans ce métal.
- 1886 : de manière indépendante, Paul Héroult et Charles Martin Hall, découvrent la méthode de production de l’aluminium en remarquant qu’il est possible de dissoudre l’alumine et de décomposer le mélange par électrolyse (procédé Héroult-Hall breveté) pour donner le métal brut en fusion. Pour cette découverte, Hall obtient un brevet (400655) la même année. Ce procédé permet d’obtenir de l’aluminium de manière relativement économique. La méthode mise au point par Héroult et Hall est toujours utilisée aujourd’hui.
- 1887 : Karl Josef Bayer décrit une méthode connue sous le nom de procédé Bayer pour obtenir de l’alumine à partir de la bauxite, en la dissolvant avec de la soude. Cette découverte permet de faire entrer l’aluminium dans l’ère de la production de masse.
- 1888 : les premières sociétés de production d’aluminium sont fondées en Suisse, France et aux États-Unis.
- Les premières pièces de monnaie circulantes en aluminium apparaissent en 1907, via la Royal Mint. De 1941 à 1959, la France a frappé des pièces de monnaie de 50 c, 1 F, 2 F et 5 F en aluminium. Auparavant, pendant la Première Guerre mondiale et dans les années 1920, de très nombreuses monnaies de nécessité avaient déjà été frappées en France et à l'étranger.
Isotopes
L'aluminium possède 22 isotopes connus, avec des nombres de masse entre 21 et 42, ainsi que quatre isomères nucléaires. Seul 27Al est stable, ce qui fait de l'aluminium un élément monoisotopique. De petites quantités du radioisotope 26Al, de demi-vie 0,717 Ma, existent dans la nature mais l'abondance de 27Al est telle qu'on considère l'aluminium comme mononucléidique ; on lui attribue une masse atomique standard de 26,981 538 6(8) u. Tous les autres isotopes de l'aluminium ont des demi-vies inférieures à 7 min, et la plupart des demi-vies inférieures à la seconde.
Datation par l'aluminium 26
- En géomorphologie et paléosismologie, l’isotope 26Al, créé sous l'action des rayons cosmiques, est utilisé pour la datation de surfaces ou la détermination de taux d’érosion.
- Le Système solaire provient d'une nébuleuse où l'aluminium 26 était autrefois réparti de manière homogène (à ± 10 %, d'après l'analyse des chondres et des enclaves réfractaires des météorites les plus primitives). Comme il se désintègre en magnésium 26 avec une demi-vie de 0,717 Ma, il permet de dater la formation des premiers solides du Système solaire[25].
Corps simple
Propriétés physiques
L’aluminium a une densité de 2,7 c'est-à-dire environ trois fois plus faible que celle de l’acier ou du cuivre.
L'aluminium pur est malléable (le second parmi les métaux) et ductile (le sixième parmi les métaux). Les alliages d'aluminium pour corroyage et pour fonderie ont des propriétés mécaniques améliorées par rapport à l'aluminium pur, tout en restant facilement usinables et moulables.
Les produits en aluminium, lorsqu'ils ne sont pas traités en surface, ont un aspect visuel argent-gris. Cette coloration est en partie due à une mince couche d’oxyde (alumine) de cinq à dix nanomètres qui se forme spontanément et rapidement dans un milieu oxydant comme l’oxygène de l’air. Dans des conditions normales d’exposition chimique, cette couche protectrice limite les différentes formes de corrosion (corrosion par piqûres, filiforme, feuilletante, galvanique, corrosion sous contrainte[26]). Il est possible d’augmenter artificiellement l’épaisseur de cette couche d’oxydation — tout en donnant une teinte colorée — par anodisation, ou d'améliorer la résistance à la corrosion à l'aide d'autres traitements de surface (e.g. thermolaquage[26]).
L’aluminium est un très bon conducteur électrique et thermique, contrairement à son oxyde qui est un excellent isolant. Il est paramagnétique et ne provoque pas d’étincelles.
L'aluminium est transparent aux neutrons[27], et devient transparent aux rayons ultraviolets extrêmes lorsqu'il est bombardé par un laser à électrons libres[28].
Propriétés chimiques
En solution, l’aluminium se trouve le plus généralement sous la forme d’ions Al3+. Il s’oxyde lentement à froid et rapidement à chaud pour former l’alumine Al2O3. L’action des acides sur l’aluminium produit l’ion cité plus haut.
La réaction de l'aluminium avec une solution aqueuse d'hydroxyde de sodium (soude) produit de l’aluminate de sodium et de l'hydrogène gazeux, selon une réaction exothermique d’équation :
- 2 Al + 2 (Na+, OH−) + 6 H2O ⟶ 2 (Na+, Al(OH)4−) + 3 H2.
Les hydroxydes d’aluminium s’obtiennent en général en précipitant une solution contenant des cations Al3+ à l’aide d’une base. Cette méthode permet de former selon les conditions de précipitation différentes phases cristallographiques telles que la bayérite, la boehmite, la gibbsite.
L’aluminium est aussi utilisé en tant que réducteur fort, notamment pour l’aluminothermie et en pyrotechnie dans les feux d'artifice, où il joue un rôle similaire au magnésium, à moindre coût et avec une puissance plus grande.
Propriétés biologiques
Teneur de l'organisme humain en aluminium
L'organisme d'un sujet contemporain de pays industriel contient de 30 à 50 mg d'aluminium selon l'ATSDR en 1999, ou 50 à 150 mg selon le Römpp Lexikon Chemie en 2013[29]. L'ATSDR en 1999 l'estimait surtout présent dans l’os (environ 50 %), le poumon (environ 25 %) et le foie (20 à 25 %), le reste étant partagé dans d'autres organes, dont le système nerveux central et la rate. Une source plus récente l'estime présent à environ 50 % dans les tissus pulmonaires, 25 % dans les tissus mous et 25 % dans les os. Les taux tissulaires (dont dans le poumon et le cerveau) augmentent avec l'âge (environ 35 à 50 mg d'aluminium s'accumuleraient ainsi dans le corps durant la vie)[30] - [31] - [32].
Cependant, comme pour d'autres métaux toxiques, chez l'homme et chez d'autres espèces de mammifères testées, pour une même dose standardisée ingérée, les valeurs d'absorption corporelle de l'aluminium varient significativement selon les individus (selon l'âge, l'état des reins, et selon la génétiques qui influe sur le niveau d'absorption gastro-intestinale de l'aluminium).
Après ingestion, le pic dans le plasma peut varier du simple au triple selon l'individu[33] - [34] - [35] - [36] - [37].
Pour l'aluminium injecté
Le traçage isotopique (isotope radioactif 26Al) démontre que 24 heures après l’injection, 99 % de l’aluminium sanguin est passé dans la fraction plasmatique. Peu à peu, le taux intra-érythrocytaire augmente pour atteindre 14 %. L'aluminium se lie, dans le plasma, préférentiellement à la transferrine (80 %), et à l'albumine à hauteur de 10 %, les 10 % restants sont transportés par des protéines de bas poids moléculaire (LMW). L'Al-transferrine se dépose surtout dans la rate et le foie (riches en récepteurs-transferrine), pendant que l'Al-LMW se fixe dans l’os (qui ne contient pas de récepteurs-transferrine)[38].
Pour l'aluminium ingéré
L'aluminium présent dans les aliments (10 à 40 mg par jour, voire plus) est à 99 à 99,9 normalement éliminé dans les fèces, sans être absorbé dans le tractus gastro-intestinal. Mais ce taux varie selon le composé chimique, sa solubilité, le pH du bol alimentaire et la présence éventuelle d'agents complexants chélateurs (tels que l'acide citrique du jus de citron peuvent augmenter l'absorption à 2 à 3 %). On estime que 1 ‰ et 3 ‰ de l'aluminium provenant de la nourriture et de l'eau potable sont absorbés dans le tractus gastro-intestinal[39], et plus chez des personnes dont la perméabilité intestinale est anormalement élevée (Cf. maladie cœliaque)[40].
Chez une personne en bonne santé, 83 % de cet aluminium ayant traversé la barrière intestinale sera ensuite peu à peu éliminé, essentiellement via les reins (un rein en bon état élimine de 3 à 20 µg l−1 d'urine)[41] - [42] - [43] - [44]. Des chélateurs (EDTA, déféroxamine, etc.) accélèrent cette élimination.
Demi-vie dans l'organisme
La demi-vie dans l'organisme varie selon l'importance et la durée d’exposition et selon la durée de la redistribution de l’aluminium à partir des organes qui l'ont stocké. Elle peut durer plusieurs années.
Elle est triphasique : en phase 1, la moitié de l'aluminium est éliminé en quelques heures, en phase deux, 50 % de ce qui reste est éliminé en quelques semaines, et il faut habituellement plus d'un an pour éliminer la moitié du reste[45].
Dans le compartiment osseux
Le système osseux est l'un des réceptacles de l'aluminium[40]. On peut l'y détecter en colorant la matrice osseuse non décalcifiée par l'azurine solochrome (colorant permettant la détection de l'aluminium atomique à des taux de 0,03 %[40].
L'« encéphalopathie aluminique » autrefois souvent associée à l'ostéomalacie[46] - [47] chez les personnes dialysées pour insuffisance rénale chronique a presque disparu après élimination de l'aluminium du dialysat, mais on retrouve parfois ensuite une partie de cet aluminium dans les os où il est associé à l'hydroxyapatite[40]. Il a aussi été associé à l'exostose, une tumeur osseuse bénigne fréquente[40].
Le taux d'aluminium augmente aussi dans l'os chez chez les personnes prenant régulièrement des médicaments anti-acides aluminiques et/ou ayant une perméabilité intestinale anormalement élevée (Cf. maladie cœliaque)[40].
Dans les cas d'hémochromatose et de drépanocytose, l'aluminium est colocalisé avec le fer, pour une raison encore à préciser au milieu des années 2010ref name=Chappard2016/>.
La corrosion des implants prothétiques composés de titane grade V (TA6V est un alliage contenant 6% d'aluminium et 4% de vanadium) a également été observée dans une série de reprises de hanche ou de genouref name=Chappard2016/>.
Dans le cerveau
Des expériences indépendamment conduites aux États-Unis en Australie et en France ont clairement montré que de l'Al radiomarqué est détecté dans le cerveau d'animaux de laboratoire 15 jour après qu'ils ont consommé une dose d'aluminium équivalente à celle consommée par des humains buvant un unique verre d'eau traitée à l'alun[48] - [49] - [50].
La demi-vie dans le sang est normalement d'environ 8 heures, mais si la fonction rénale est altérée, cette durée s'allonge, avec un risque accru d'accumulation délétère dans le corps (cerveau et os en particulier, par ex chez les dialysés)[31].
Voies d'exposition à l'aluminium et à ses divers composés
Les principales voies d'exposition sont les boissons et denrées alimentaires[51]. En particulier, les additifs alimentaires sont une source croissante d'exposition (chlorure d'aluminium, citrate d'aluminium, maltolate d'aluminium et autres complexes aluminium-acide alimentaire, phosphate d'aluminium, silicate d'aluminium, sulfate d'aluminium et autres espèces d'aluminium). Les additifs sont utilisés comme colorant de goûters et de desserts tels que croustilles de maïs, glaces, gâteaux, ou encore des bonbons et confitures[51]. On en retrouve dans l'enrobage de comprimés de vitamines et de médicaments et gélules para-médicales[51]. C'est aussi un anti-agglomérant ajouté au sel, au cacao en poudre ou au lait en poudre, ou encore un émulseur qui accroît la fondabilité des fromages, ou un agent levant des pains, gâteaux et d'autres produits de boulangerie industrielle. Il épaissit des crèmes ou sauces et sert de liant des viandes dans les saucisses et la charcuterie. Il sert d'agent stabilisant, tampon, neutralisant, texturant et durcisseur pour les légumes marinés ou les fruits confits[51]. Le fromage fondu de type pré-coupé, emballé individuellement en contient une quantité importante (jusqu'à 50 mg par tranche sont autorisés aux États-Unis et au Canada)[52], et de nouveaux produits alimentaires à base d'aluminium sont régulièrement mis sur le marché[51].
D'autres sources sont certains matériaux en contact avec les aliments, et divers produits cosmétiques (en vente libre) et pharmaceutiques ou chirurgicaux[15]. L'aluminium est aussi absorbé par la peau, lors d'applications topiques à base d'aluminium (dont via des écrans solaires et des déodorants, y compris à base d'alun)[51]. Il est enfin injecté dans le muscle dans le cas de nombreux vaccins injectables (à adjuvant vaccinal aluminique).
Les employés de l'industrie de l'aluminium (fonderie en particulier), de l'impression et de l'automobile y sont en outre professionnellement exposés[53].
Les usines de potabilisation d'eaux de surface et les stations d'épuration utilisent du sulfate d'alumine comme floculant et clarifiant[54] - [51]. Une directive européenne[55] a fixé un seuil de précaution de 200 µg/l à ne pas dépasser dans l'eau du robinet et les eaux de consommation[54]. En France en 2007, ce seuil était respecté dans plus de 97 % de 381 contrôles. Dans ce pays selon l'AFSSA, « la part de l'exposition à l'aluminium par l'eau de boisson constitue probablement moins de 5 % des apports quotidiens d'aluminium par voie alimentaire de la population »[56]. « Pour les eaux de dialyse, la limite de qualité fixée par la pharmacopée européenne et par la pharmacopée française est de 30 µg/l »[54].
Biodisponibilité pour l'organisme humain
Sa biodisponibilité et son taux d'absorption intestinale dépendent de divers facteurs :
- forme de l'aluminium : métal, vapeur, poudre ou nanoparticules (notamment évoquées depuis les années 2000 pour un usage potentiel comme agent clarificateur des eaux à potabiliser[57], dont lors de la désalinisation solaire[58]), composé organique, minéral ou organominéral, etc. ;
- type d'acquisition : par ingestion[59] (aliments ou boissons contaminés tels que cacao et produits à base de cacao (33 µg/g dans les années 1980 en Allemagne), les épices (145 µg/g) et les feuilles de thé noir (899 µg/g), la contamination augmentant en général (dans les aliments fréquemment consommés sur le marché allemand) selon l'ordre suivant : boissons > aliments d'origine animale > aliments d'origine végétale ; toujours à des taux réputés sans danger pour des personnes en bonne santé[60], éventuellement par de l'aluminium provenant de couverts, d'emballages, ustensiles et contenants[61] - [62]), par inhalation ou percutanée) ;
- pH : l'acidité, même légère favorise sa dissolution et son assimilation, par ex en présence d'acide citrique, de citrates[63] ou d'anions inorganiques) aini, éventuellement, que de la matrice (eau, aliments, médicament ou produit de soin, etc.). Ainsi dans l'eau de boisson, le taux d'« aluminium libre » dans une solution d'hydroxyde d'aluminium est mille fois plus élevé à pH 4,2 qu'à pH légèrement alcalin 7,4.
Au début des années 2000, l'eau du robinet, eau minérale plate et eau minérale gazeuse), des jus de fruits et de boissons gazeuses en Espagne en contenaient de 4,2 à 165,3 µg/l dans l'eau potable (n = 41) ; de 49,3 à 1 144,6 µg/l dans les jus de fruits (n = 47) et de 44,6 à 1 053,3 µg/l dans les boissons gazeuses (n = 88)[64]. Le matériau du contenant (bouteille de verre ou canette métallique) influait aussi sur ces teneurs (le verre étant moins contaminant)[64]. Au vu de la consommation individuelle quotidienne moyenne de ces boissons en Espagne, l'apport alimentaire quotidien en Al ainsi fourni est d’environ 156 µg/personne et par jour[64].
Une expérience a consisté à cuire dans une casserole en aluminium (telle qu'on en utilise fréquemment en milieu rural dans le monde) du chou rouge avec différents produits alimentaire acides (jus de citron à pH 2,6, vinaigre de vin et vinaigre de pomme à cidre)[60]. Résultat : même une faible acidité augmente la lixiviation de l'aluminium. Le jus de citron fait monter à 5,1 mg/100 g la teneur du chou rouge en Al[60]. La cuisson d'une sauce tomate (avec et sans sucre) fait respectivement grimper la teneur du chou en aluminium à 2,7±0,2 et 4,9±0,2 mg d'Al/100 g de sauce tomate[60] ; après 48 h en récipients d'aluminium au réfrigérateur, ces échantillons montent respectivement à 2,8±0,2 et 5,0±0,2 mg d'aluminium par 100 g de sauce tomate[60].
Ceci contribue à expliquer que l'absorption intestinale de l'aluminium soit supérieure dans le début du duodénum (là où le bol alimentaire est le plus acide), par rapport au reste de l'intestin[65] ; - présence ou absence de chélateurs naturels dans l'alimentation[66] - [67].
Écotoxicologie
Phytotoxicité
Dans le monde, environ 50 % des terres arables sont naturellement acides et plus ou moins riches en aluminium natif (latérite, argiles, etc.). Quand le pH est inférieur à 5,0, l'aluminium devient biodisponible pour les plantes : leurs racines absorbent alors des ions Al3+ phytotoxiques (hormis pour des espèces tolérante à l'aluminium) et à partir de 4,5, il commence à être mobile et biodisponible. L'aluminium perturbe le fonctionnement de nombreuses enzymes et protéines végétales, allant jusqu'à empoisonner la plante, par des mécanismes encore mal compris.
Dans les années 1960-1970 le phénomène de pluies acides a aggravés cette situation, dont en suracidifiant les eaux de surfaces et les lacs (d'Europe du nord notamment), provoquant la dissolution et la destruction d'un plus grand nombre d'ions Al3+, affectant les plantes aquatiques et palustres. En Suède[68] et Norvège[69], ce lien a été scientifiquement établi dès les années 1970. L'acide sulfurique (alors principalement issu de la combustion de charbons et fuels non désoufrés) en se combinant avec le soufre produisait de l'hydroxysulfate d'aluminium phytotoxique[68] selon la réaction suivante :
Dans ces contextes l'aluminium est un « facteur limitant majeur de la productivité des plantes dans les sols acides »[70]. Dans la cellule végétale, il interagit négativement aussi avec l'adénosine triphosphate (ATP) synthase, de même qu'avec des protéines liées à la paroi cellulaire ; et la glutathion S-transférase (GST6) et la glutathion S-transférase tau 19 (ATGSTU19) peuvent contribuer cette phytotoxicité.
L'antidote est un apport de calcium exogène. Dès que le pH remonte au-dessus de 5,0 l'aluminium se lie à la surface des silicates (sous forme de cation hydroxy polymère). Dans la plante, le calcium atténue en outre l'inhibition de la croissance végétale induite par l'Al et il diminue l'accumulation du métal dans la plante, via un processus lié à des protéines impliquées dans le cycle de l'acide tricarboxylique (dit TCA)[70]
Des variétés plus tolérantes à l'aluminium ont été sélectionnées par les agriculteurs traditionnels, et on a récemment produit des plantes transgéniques (ex. : Arabidopsis) rendues plus tolérantes à l'aluminium[71] - [72] - [73] - [74].
Toxicologie
Dans les années 1980, chercheurs et médecins s'inquiètent du risque sanitaire de l'aluminium[75] - [76], notamment dans les groupes vulnérables tels que les enfants[77], les personnes âgées et les personnes atteintes d'une néphropathie[78]. Ce métal est depuis les années 1990 considéré comme neurotoxique[79] - [80]
Mécanismes de toxicité
L'ion aluminium Al3+ est un pro-oxydant assez réactif :
- il induit des dommages oxydatifs seul (ou en synergie avec le fer, en créant des dommages peroxydants et un stress oxydatif, à la suite de l'augmentation du peroxyde intracellulaire[81]) ;
- il se combine à l'ion superoxyde en générant du superoxyde d'aluminium, une espèce plus réactive que le radical superoxyde[81] ;
- il stabilise l'ion ferreux (Fe2+), empêchant son oxydation en Fe3+[82], or Fe2+ induit une réaction de Fenton très cytotoxique[81] ;
- il interfère négativement avec l'électrophysiologie cérébrale[83] ;
- On sait que chez les ions de métaux toxiques, la similitude de taille est plus importante que la similitude de charge pour expliquer les mécanismes de substitution[84]. Or Al3+ est un petit ion à charge fixe élevée, dont la taille (Cf. rayon ionique efficace) permet qu'il se substitue au fer ferrique (Fe3+) et au magnésium (Mg2+), par exemple dans les enzymes et les protéines structurales qui intègrent des métaux essentiels tels que le magnésium (Mg2+) et le fer ferrique (Fe3+)[84].
On a ainsi montré que la substitution par Al3+ du Mg2+ dans les ATPases et d'autres des trois cents protéines dépendantes du Mg2+ modifie leur activité[85] - [86] - [87].
Ceci explique que dans le système circulatoire c'est une protéine de transport du fer qui transporte aussi 80 à 90 % d'aluminium plasmatique (le reste circulant sous une forme liée à l'albumine plasmatique, ou à des molécules de faible poids moléculaire tels que les citrates[88].
Tant qu'il est lié à ces protéines, Al3+ n'est plus filtré par le rein. De plus la transferrine l'aide à traverser la barrière hémato-encéphalique et à pénétrer les cellules dotées de récepteurs à cette protéine[89]. C'est ainsi que l'Al3+ perturbe le métabolisme intracellulaire du fer et du magnésium dans le cerveau[90] - [91] ; - Al3+ dégrade aussi le métabolisme du calcium (Ca2+) en interférant négativement avec les voies de signalisation du Ca2+, en bloquant les canaux du Ca2+. Et il entre en rivalité avec ce cation pour les petits ligant tels que les phosphates[92] ;
- son rapport charge/taille presque maximal implique que l'Al3+ se dissocie des ligands cellulaires 104 fois moins vite que Mg2+ et 108 fois moins vite que Ca2+[84] ;
- l'aluminium alkylé catalyse des polymérisation (à pression et température ambiante)[93], en produisant par exemple du polyéthylène à partir d'éthylène, comme l'a montré Karl Ziegler (récompensé par un prix Nobel de chimie en 1963), ce qui fait évoquer un rôle possible Dans la Maladie d'Alzheimer, où l'aluminium intracellulaire se lie aux peptides-tau et amyloïde (A) qui polymérisent pour former des filaments hélicoïdaux appariés à chaîne droite (PHF) et des filaments A, respectivement. Toutefois, les polyadditions étudiées par Ziegler sont très distinctes de la formation des liaisons peptides rencontrées dans les protéines, si bien qu'il reste, selon Walton (2014), « à déterminer si l'aluminium catalyse également la polymérisation dans les systèmes biologiques »[51].
Conséquences chez l'Humain
Une accumulation trop élevée d’aluminium dans l’organisme (et il tend à s'accumuler dans le cerveau avec l'âge) peut jouer un rôle dans divers maux comme :
- certaines encéphalopathie, dont l'« encéphalopathie des dialysés » (ou « démence des dialysés »)[94] observée dès 1972, qui a pu être attribuée en 1978 à l'aluminium contenu dans le dialysat (qui s'ajoute à un apport oral d'hydroxyde d'aluminium visant à contrôler l'hyperphosphorémie du patient)[95]. La réglementation européenne impose maintenant aux centres de dialyse de mieux contrôler l'exposition des dialysés à l'aluminium, ce qui s'est traduit par une diminution de leurs taux sériques moyens, avec une diminution de 61,8 ± 47,5 μg·l-1 en 1988 à 25,78 ± 22,2 μg·l-1 en 1996[95] - [96]. L'une de complications au niveau du système nerveux central peut être la myofasciite à macrophages[97] ;
- l’épilepsie[98], y compris (chez le chat en laboratoire) via une exposition externe (telle qu'une crème riche en aluminium)[99] ;
- des troubles de mémoire[100] et de l'apprentissage (selon le modèle animal[65]) ;
- le psoriasis ;
- les insuffisances hépatorénales chroniques ; le foie de rats nourris 1 mois avec des aliments contenant chaque jour 34 ou 50 mg de chlorure d'alumine (AlCl3) par kg de poids corporel présentent des altérations (« dommages pathologiques graves tels que : dilatation sinusoïdale, congestion de la Veine centrolobulaire, accumulation de lipides et infiltration lymphocytaire ») et une augmentation significative des MNHEP, de la phosphatase alcaline, des transaminases (AST et ALT) et de la lactate déshydrogénase (LDH)[101]. Selon cette étude la propolis peut « antagoniser » la toxicité d'AlCl3[101] ;
- l’anémie (en interférant avec le métabolisme du fer) [102] ;
- l’ostéomalacie (os cassants ou mous) [47] - [102] ;
- des troubles du métabolisme du glucose dans le cerveau[103] ;
- l'intolérance au glucose ;
- certaines pathologies cardiaques. Selon Novaes et al. (2018), l'aluminium bioaccumulé dans l'organisme est cardiotoxique ; avec des lésions cardiaques dose-dépendantes)[104]. Chez le rat l'exposition chronique à l'aluminium peut notamment induire une myocardite, une fibrose du cœur et un dépôt de glycoconjugués. L'aluminium induit un déséquilibre microminéral intense ainsi qu'une oxydation de l'ADN génomique, au sein du tissu cardiaque, de même qu'une dégénérescence étendue des organites dans les cardiomyocytes[104]. Ces anomalies (structurelles et ultrastructurales) du tissu cardiaque entraînant une large perte de parenchyme (qui induit en réaction une expansion stromale compensatoire), un infiltrat inflammatoire diffus, un dépôt anormal de glycoconjugué et de collagène, une subversion et un effondrement du réseau de collagène, des signes de vascularisation réduite du cœur, un gonflement mitochondrial, une désorganisation des sarcomères, une dissociation des myofilaments et une fragmentation dans les cardiomyocytes[104]. Ce remodelage pathologique continu du cœur exposé chroniquement à l'aluminium pourrait être associé à des effets pro-inflammatoires et pro-oxydants induits par ce métal, selon des mécanismes encore à préciser[104] mais pouvant conduire à l' arrêt cardiaque.
Ce métal commun est depuis plusieurs décennies soupçonné de jouer un rôle dans la maladie d'Alzheimer pour les patients soumis à une exposition chronique à ce métal[105] - [80]. Après 40 ans de recherche, en 2018, il n'y a pas de preuve d'association entre la maladie et ce métal[106] - [107].
Alimentation
Les apports quotidiens en aluminium varient considérablement selon l'âge et le type et la quantité d'aliments ingérés. La FDA a estimé qu'au début du XXIe siècle, un humain en ingère de 2 à 14 mg par jour (selon l'âge, le sexe et le type de régime alimentaire). À titre d'exemple, selon des estimations récentes :
- en Europe, un Allemand moyen subit un apport alimentaire égal à environ 50 % de l'apport hebdomadaire tolérable (AHT, établi à 1 mg/kg de poids corporel/semaine pour une personne en bonne santé par l'Agence européenne de sécurité des aliments, l'EFSA)[15]. Les nourrissons et jeunes enfants peuvent légèrement dépasser cet AHT, notamment les nourrissons qui ne sont pas exclusivement allaités au sein et les jeunes enfants soumis à un régime alimentaire riche en soja, sans lactose, ou hypoallergénique)[15]. En ajoutant l'aluminium issu des produits cosmétiques et pharmaceutiques et des matériaux de contact alimentaire composés d'aluminium non revêtu, un dépassement significatif de l'AHT fixé par l'EFSA (et même du taux provisionnel de 2 mg/kg de poids corporel/semaine proposé par un comité d'experts FAO/OMS sur les additifs alimentaires) peut se produire même chez l'adulte. Des taux élevés d'aluminium ont été constatés chez les adolescents (11-14 ans). Les auteurs de l'étude jugent ces chiffres représentatifs des consommateurs européens et d'autres pays dans le monde (dont en Belgique[108]). Ils rappellent qu'il est toxicologiquement souhaitable de ne pas régulièrement dépasser l'apport tolérable à vie ; il faut donc réduire l'exposition globale de la population générale à l'aluminium[15] ;
- aux États-Unis, au début des années 1990 selon le modèle d'exposition alimentaire de la Food and Drug Administration (FDA) Total Diet Study, l'apport journalier d'aluminium variait de 0,7 mg/j pour les nourrissons de 6 à 11 mois, à 11,5 mg/j pour les hommes de 14–16 ans. Et un homme adulte moyen en ingérait 8 à 9 mg/j, alors qu'une femme en ingérait un peu moins (7 mg/j). L'apport provenait surtout des aliments préparés avec des additifs alimentaires à base d'aluminium (produits céréaliers et les fromages fondus en particulier)[109]. Au début des années 1990 toujours, selon Greger[110] : 1 à 10 mg/j proviendraient d'aliments frais (fruits, légumes, viande et poisson non transformés), et 50 % des Américains ingéreraient en outre jusqu'à 24 mg/j d'aluminium sous forme d'additifs ; 45 % ingéreraient de 24 à 95 mg/j et environ 5 % en ingèreraient plus de 95 mg/j ; cette estimation étant alors la première[111] à tenir compte des taux d'aluminium déclarés ajoutés aux aliments par les fabricants eux-mêmes à la fin des années 1970[112] ;
- un Japonais moyen (en 2006-2010) ingère 41,1 µg/kg et par jour d'aluminium, soit respectivement 2 363 µg/personne et par jour, à comparer à 2,31 µg/kg de poids corporel/jour d'arsenic total, soit 138 µg/kg par personne/jour ; ou 0,260 µg/kg et par jour d'arsenic inorganique, soit 15,3 µg/kg par personne/jour ; ou 0,092 8 µg/kg et par jour de plomb, soit 5,40 µg/kg par personne/jour[113].
L'apport journalier variant selon le sexe (TA, Pb et Al) principalement en raison de la quantité d'aliments ingérés[113] ; - au début du XXIe siècle, 30 % des Chinois absorbaient trop d'aluminium, dépassant la ration hebdomadaire tolérable provisoire (PTWI)[114] ;
À Hong Kong, l'analyse de 256 échantillons de nourriture de plats préparés ou de boulangerie présentaient des taux élevés d'aluminium (pain / petit pain / gâteau cuit à la vapeur en contenaient en moyenne 100–320 mg/kg), et les muffins, crêpes / gaufres, tarte à la noix de coco et gâteaux en moyenne : 250, 160, 120 et 91 mg/kg respectivement ; les méduses (en plat préparé) en contenaient en moyenne 1 200 mg/kg. Des additifs alimentaires contenant de l'aluminium étaient souvent très utilisés dans ces produits. À ces sources s'ajoutent les sources alimentaires naturelles, les matériaux en contact avec les aliments ou d'autres tels que la boisson. Les auteurs ont conclu qu'« un risque pour certaines populations consommant régulièrement des aliments contenant des additifs alimentaires contenant de l'aluminium ne peut être exclu »[115].
On sait au moins depuis les années 1990 que la cuisson d'aliments acides en contact avec une feuille d'aluminium (en papillote…) ou le contact de marinades ou sauces acides (sauce tomate par ex.) avec ces feuilles est l'une des principales sources de contamination de nos aliments en aluminium[116] - [117] - [118] - [119] - [78].
L'aluminium est aussi abondamment utilisé comme additif et colorant (colorant alimentaire), son numéro SIN est E173[120] - [121].
Respiratoire
L'aluminium n'est pas classé comme substance cancerigène par le CIRC. Cependant, La production d'aluminium est classée comme cancérigène du groupe 1 (cancérigène avéré pour l'Homme) (c'est à dire pour les travailleurs réalisant la production d'aluminium et exposés à des fortes doses de manière chronique) [122].
Cosmétiques
On dénombre plus de 25 substances composées d'aluminium susceptibles d'être présentes dans des produits cosmétiques, notamment dans les déodorants (sous forme de sels d'aluminium). Parmi celles-ci, le chlorohydrate d’aluminium est l’une des plus utilisées pour ses propriétés antitranspirantes[102].
Rapport d'expertise de l'Afssaps (2011)
Un rapport de l'Afssaps publié en 2011 souligne le manque de données pertinentes quant au risque que représente l’absorption cutanée de l’aluminium contenu dans les produits cosmétiques. Il déplore la « qualité insuffisante des études publiées » et le fait que celles-ci ne répondent pas aux exigences actuelles[102]. Un autre rapport de la Commission européenne datant de 2014 va également dans de sens[123].
Cependant, sur la base de données chez l'Homme, le rapport de l'Afssaps détermine à 1,2 % la concentration maximale en aluminium ne présentant pas de risque osseux ou neurotoxique, pour une application quotidienne à long terme de produit cosmétique[102].
Il ajoute que les données épidémiologiques ne permettent pas d'établir un lien concluant entre exposition cutanée et orale à l'aluminium et l'apparition d'un cancer[102].
L'Afssaps recommande finalement :
- aux producteurs de cosmétiques, de limiter la concentration d'aluminium dans les produits déodorants et anti-transpiration à 0,6 % (la limite légale, concernant uniquement le chlorhydrate d'aluminium et le zirconium anhydre, est de 20 %)[102] ;
- aux consommateurs, d'éviter par précaution d'utiliser des cosmétiques contenant de l'aluminium sur des peaux lésées ou irritées (par exemple après le rasage, ou toute autre lésion cutanée de type micro-coupures). Le rapport préconise également que cette recommandation figure sur les conditionnements des produits concernés[102].
Dosage dans les emballages et substrats destinés au contact alimentaire
Pour ces produits, notamment quand ils sont destinés au contact alimentaire, le BFR allemand a récemment (mai 2021) proposé une méthode d'analyse de l'extrait à l'eau ultrapure (froide ou chaude, dans des récipients de verre préalablement plusieurs fois nettoyés à l'acide nitrique et plusieurs fois bien rincés à l'eau ultra pure) de résidus d'aluminium pour ces sources possible de contamination de l'alimentation ou de la peau humaine ; le BRF a aussi publié des conseils pour le traitement ultérieur des échantillons et demande que les produits analysés soient « utilisés en totalité ou dans une proportion représentative »[124].
Autres études
Une étude parue en dans la revue scientifique Journal of Applied Toxicology publiant des articles de recherches originales concernant la toxicologie montre in vitro les effets néfastes des sels d’aluminium (chlorhydrate d’aluminium et chlorure d'aluminium) sur les cellules épithéliales mammaires humaines[125].
Vaccins et dispositifs médicaux
Des cas particuliers sont certains adjuvants de vaccins, et l’eau pour la dilution des concentrés pour hémodialyse, lorsqu’elle provient d’une station de production inefficace, ainsi que les poches de nutrition parentérale. Dans ces derniers cas, l'aluminium est directement injecté dans le système sanguin ou dans le muscle (autrefois la vaccination pouvait être sous-cutanée, mais elle est devenue intramusculaire)[126].
La campagne massive de vaccination à la suite de la grippe A (H1N1) de 2009-2010 a relancé la polémique sur les risques de santé liés à cet élément, car 47 % des vaccins commercialisés contiennent comme adjuvant de l'aluminium[127].
En 2004, après une étude épidémiologique, le Conseil de l'AFSSAPS[128] conclut qu'en l'état actuel des connaissances, aucun syndrome clinique spécifique n'est retrouvé associé à la vaccination avec des vaccins contenant des adjuvants aluminiques.
En 2013, selon un rapport « Aluminium et vaccins » du Haut Conseil de la santé publique (HCSP), les données scientifiques disponibles ne permettent pas de remettre en cause la sécurité des vaccins contenant de l’aluminium. Le HCSP met en garde contre « les conséquences, en matière de réapparition de maladies infectieuses, […] résultant d’une remise en cause des vaccins contenant de l’aluminium en l’absence de justification scientifique[129] ».
En 2016, l'Académie de pharmacie a produit un rapport sur les adjuvants aluminiques de vaccins. Elle constate aussi que le lien de cause à effet entre la présence persistante de l'aluminium au niveau du site d'injection du vaccin et son incorporation du métal dans les macrophages, et la MFM n'est pas démontré[130].
Lors de certaines opérations chirurgicales ou médicales, des appareils réchauffent des fluides ou du sang à perfuser aux patients. Certains matériels (ex en 2019 : enFlow IV fabriqué par Vyaire Medical utilisent de plaques d'aluminium non revêtues ; à n'utiliser « que si aucune alternative n'est disponible en raison du risque de toxicité de l'aluminium, a averti l'agence britannique des dispositifs médicaux » ; ces plaques libèrent dans les solutions d'électrolyte équilibrées qui entrent en contact avec elles des taux d'aluminium potentiellement nocifs pour le patient[131].
The Keele Meetings on Aluminium
En Grande-Bretagne, à l'université de Keele, The Birchall Centre abrite, depuis 1992, The Bioinorganic Chemistry of Aluminium and Silicon research qui étudie les effets de l'aluminium sur la santé humaine, et organise, depuis 2005, un colloque annuel, le Keele meeting qui fait le point sur ses découvertes[132].
En 2015, le 11e Keele Meeting[133], tenu du au , à l'université de Lille, « alerte sur les risques croissant de l’aluminium sur la santé humaine. Les suspicions de toxicité deviennent des certitudes » :
« Il est essentiel que nous levions le sujet de l'écotoxicité de l'aluminium et de son rôle dans les maladies humaines et plus particulièrement celles du système nerveux central dont la maladie d'Alzheimer. Il est évident que nous sommes confrontés quotidiennement à l'aluminium dans des domaines où son innocuité n'a jamais été testée et encore moins démontrée comme la vaccination, l'immunothérapie et les cosmétiques »
— Christopher Exley (en), professeur en chimie bioinorganique à l'université de Keele et directeur scientifique du colloque)[134].
État des connaissances toxicologiques
- Le groupe Nerf-Muscle du département de pathologie de l'hôpital Henri-Mondor de Créteil, et le groupe d’études et de recherche sur les maladies musculaires acquises et dysimmunitaires (GERMMAD) de l’Association française contre les myopathies décèlent un syndrome qu'ils appellent « myofasciite à macrophages » (MFM), qui sera histologiquement défini en 1998 puis médicalement défini en 2003[135].
- , la direction générale de la Santé (DGS, ministère de la Santé) saisit les agences de sécurité sanitaire (Afssaps/Afssa/InVS) à propos des risques de l’aluminium pour la population (notamment concernant la maladie d'Alzheimer).
- Fin 2000, l’Agence nationale de sécurité du médicament et des produits de santé (Afssaps) décide de faire un point sur l'aluminium dans les produits de santé (voir rendu du rapport en 2003)
- En 2001, des indices forts penchent en faveur d'une hypothèse associant l'aluminium contenu dans les vaccins à la myofasciite à macrophages car il est retrouvé dans des biopsies musculaires[136].
- En 2003, dans le rapport « Évaluation des risques sanitaires liés à l’exposition de la population française à l’aluminium » (Afssaps/Afssa/InVS 2003), l'agence conclut qu'on manque encore de données pertinentes quant à l’absorption cutanée de l’aluminium contenu dans les produits cosmétiques. L'Afssaps décide de s'auto-saisir du sujet. L'InVS concluait à un manque de données suffisantes pour confirmer ou infirmer les conséquences de l’aluminium sur la santé. Par exemple, la qualité des eaux de boisson est très suivie, mais non les effets des emballages en aluminium[137].
- En 2004, une étude de Darbre et al. (2003) évoque un risque de cancérogénicité pour le sein chez les femmes utilisant des antitranspirants à base d’aluminium. La DGS interroge l'Afssaps à ce sujet.
- En , l'Afssaps, via un rapport[138] sur l'« Évaluation du risque lié à l'utilisation de l'aluminium dans les produits cosmétiques » demande aux fabricants de déodorants et d'antiperspirants de diminuer la teneur de ces produits en composés d'aluminium (l'industrie des cosmétiques est susceptible d'utiliser au moins vingt-cinq composés de l’aluminium, dont principalement le chlorohydrate d'aluminium comme antitranspirant. L'aluminium provoque une rétraction des pores et a une action bactéricide) ou de le remplacer par des alternatives. Selon l'Afssaps, 18 % des sels d’aluminium d'un déodorant traversent la peau blessée ou irritée (après rasage ou épilation par exemple). L'Agence demande qu'un avertissement figure sur les boites, et demande aux fabricants de ne pas dépasser 0,6 % du produit alors que certains déodorants contiennent jusqu'à plus de 20 % d'aluminium. En 2012, aucune de ces recommandations n'avait été suivie par les grands industriels de la cosmétique. L'Afssaps a intégré pour former son nouvel avis la « récente étude d’absorption cutanée fournie par les industriels du secteur cosmétique, donnée manquante dans le rapport de 2003 », et « une synthèse des données toxicologiques, en partie basée sur le récent avis émis par l'Autorité européenne de sécurité des aliments » (EFSA)[139] - [140].
- En , France 5 diffuse un documentaire, Aluminium, notre poison quotidien[141], qui fait le point sur l'exposition des populations aux sels d'aluminium solubles. À cette occasion, une association de médecins, l'Association Santé Environnement France, alerte sur l'importance de sensibiliser sur la toxicité de ce métal.
- Le , TF1 diffuse lors du Journal de 20 heures un reportage[142] qui indique que le Dr Olivier Guillard et le Pr Alain Pineau ont prouvé que les sels d'aluminium (chlorhydrate d’aluminium et chlorure d'aluminium) contenus dans les déodorants et antitranspirants passent dans le sang et ce d'autant plus facilement quand la peau est lésée, épilée ou rasée. Cette découverte a fait l'objet de plusieurs publication dans des revues scientifiques : Toxicology Mechanisms and Methods[143] et dans Journal of Inorganic Biochemistry[144] Selon ce même reportage, les industriels du cosmétique quant à eux considèrent qu'il n'y a aucune raison de remettre en cause leurs pratiques.
- En mars 2013, la chaîne Arte consacre une soirée Thema à la toxicité de l'aluminium[145] : effet des excipients dus à l'aluminium ; industrie des produits dérivés ; présence dans l'eau du réseau de ville ; effet sur les maladies du cerveau. Le film documentaire Planet Alu de Bert Ehgartner (en) est diffusé.
Alliages remarquables et utilisations

En tonnage et en valeur, l’aluminium est le métal le plus utilisé après le fer, grâce à sa légèreté et sa bonne conductivité électrique et thermique. L’aluminium pur est mou et fragile et donc facilement déformable, mais avec des petites quantités de cuivre, magnésium, manganèse, silicium et d’autres éléments, il peut former des alliages aux propriétés variées. On distingue deux grandes catégories : les alliages d'aluminium pour corroyage et les alliages d'aluminium de fonderie.
Parmi les secteurs utilisant l’aluminium métal, on peut citer :
- les transports[146] (automobiles, avions, camions, trains, bateaux, vélos, etc.) ;
- l'emballage[146] (boîtes de conserve, papier aluminium, canettes, barquettes, aérosols, etc.) et notamment les emballages alimentaires ;
- la construction[146] (fenêtres, portes, gouttières, etc.) ;
- les biens de consommation[146] (appareils, ustensiles de cuisine, miroirs, etc.) ;
- les câbles électriques[146] (l'aluminium nécessite 60% de section supplémentaire que le cuivre pour atteindre la même conductance électrique, mais il est trois fois moins dense et sensiblement moins cher au kilogramme) ;
- les surfaces brillantes (l’aluminium pur de 99,980% à 99,999 % est employé en électronique, pour les CD, ou encore pour les miroirs de télescopes comme ceux du VLT) ;
- la pyrotechnie[146] (pour la coloration blanche des feux d'artifice et pour les fumigènes) ;
- la soudure (aluminothermie) ;
- le développement de nouveaux alliages et procédés (par exemple le procédé de torsion sous haute pression (en) de l'aluminium, qui permet d'atteindre des limites d'élasticité similaires à celles des aciers[147]).
Production
Gisements
L’aluminium est le troisième élément le plus abondant dans la croûte terrestre (8 % de la masse) après l’oxygène et le silicium[148]. Il se trouve dans la plupart des roches classiques sous forme d'oxyde[note 3], et non sous forme métallique[148]. Le principal minerai de l'aluminium est la bauxite, qui contient environ 52 % d'alumine[148].
Extraction

La première étape consiste à extraire l'alumine (Al2O3) d'un minerai (habituellement la bauxite) selon le procédé Bayer ou le procédé Orbite. Dans le cas du procédé Bayer, la bauxite est traitée par une solution de soude.
On obtient un précipité de Al(OH)3 qui donne de l’alumine par chauffage.
L’aluminium est extrait par électrolyse : l’alumine est introduite dans des cuves d’électrolyse avec des additifs comme la cryolithe (Na3AlF6), le fluorure de calcium (CaF2), le fluorure de lithium et d’aluminium (Li3AlF6) et le fluorure d’aluminium (AlF3) afin d’abaisser le point de fusion de 2 040 °C à 960 °C.
La production d’une tonne d’aluminium nécessite de quatre à cinq tonnes de bauxite. Elle nécessite entre 13 000 et 17 000 kWh (entre 47 et 61 GJ). Lors de l’électrolyse, sont émis des gaz tels que du dioxyde de carbone (CO2), du monoxyde de carbone (CO), des hydrocarbures aromatiques polycycliques (HAP), et des fluorures gazeux. Dans les meilleures usines, le CO et les HAP sont brûlés ou recyclés comme source de carbone, et les fluorures sont retournés dans le bain d’électrolyse.
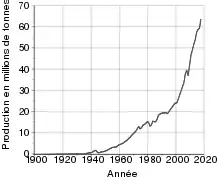
Statistiques de production
| Année | Afrique | Amérique du Nord |
Amérique latine |
Asie hors Chine |
Chine | Europe Ouest et Est |
Divers | Total mondial
moins la Chine |
Total
mondial |
|---|---|---|---|---|---|---|---|---|---|
| 1973 | 249 | 5 039 | 229 | 1 439 | ND | 2 757 | 2 304 | 12 017 | |
| 1980 | 437 | 5 726 | 821 | 1 567 | ND | 3 595 | 3 244 | 15 390 | |
| 1990 | 602 | 5 617 | 1 790 | 1 118 | ND | 3 561 | 6 826 | 19 514 | |
| 2000 | 1 178 | 6 041 | 2 167 | 2 221 | 2 794
(11,3 %) |
7 490 | 2 766 | 21 863
(88,7 %) |
24 657 |
| 2005 | 1 753 | 5 382 | 2 391 | 3 139 | 7 806
(24,5 %) |
8 546 | 2 888 | 24 099
(75,5 %) |
31 905 |
| 2010 | 1 742 | 4 689 | 2 305 | 2 500 | 17 331
(40,9 %) |
8 053 | 5 733 | 25 022
(59,1 %) |
42 353 |
| 2014 | 27 517
(51,9 %) |
25 523
(48,1 %) |
53 040 | ||||||
| 2015 | 1 687 | 4 469 | 1 325 | 3 001 | 31 672
(54,7 %) |
7 574 | 8 162 | 26 218
(45,3 %) |
57 890 |
| 2016 | 31 873
(54,2 %) |
26 927
(45,8 %) |
58 800 | ||||||
| 2017 | 32 600
(54,3 %) |
27 400
(45,7 %) |
60 000 | ||||||
| 2018 | 36 485
(56,7 %) |
27 851
(43,3 %) |
64 336 |
À la production primaire, il faut ajouter la production secondaire à partir de déchets recyclés (7,6 Mt en 2005).
Production d'aluminium primaire des principaux pays en 2014, en milliers de tonnes[151]
| Pays | Production | % mondial | |
|---|---|---|---|
| 1 | 27 517 | 51,9 | |
| 2 | 3 488 | 6,6 | |
| 3 | 2 858 | 5,4 | |
| 4 | 2 296 | 4,3 | |
| 5 | 1 767 | 3,3 | |
| 6 | 1 710 | 3,2 | |
| 7 | 1 704 | 3,2 | |
| 8 | 1 195 | 2,3 | |
| 9 | 962 | 1,8 | |
| 10 | 913 | 1,7 | |
| 11 | 749 | 1,4 | |
| 12 | 745 | 1,4 | |
| 13 | 665 | 1,3 | |
| 14 | 612 | 1,2 | |
| 15 | 567 | 1,1 | |
| Total monde | 53 040 | 100 | |
D'après mineralinfo.fr[152]
En 2022, la production d'aluminium primaire est arrêtée dans certaines usines européennes, notamment en Slovaquie, en raison de l'augmentation du coût de l'énergie[153].
Recyclage
L’aluminium a une excellente recyclabilité. Il nécessite 95 % d’énergie en moins, et 1 tonne d’aluminium recyclé permet d’économiser 4 tonnes de bauxite (l’électrolyse de séparation réclame en effet beaucoup d’énergie). L’aluminium est quasiment recyclable à l’infini sans perdre ses qualités, mais à une condition, ne pas fondre dans un même bain des alliages de composition différente. Les producteurs refusent souvent une partie significative de l’aluminium de collecte dans les déchets ménagers.
Il y a donc une certaine spécialisation des alliages en fonction des domaines d’application. Le recyclage de l’aluminium a commencé à être pratiqué dans les années 1900 et a régulièrement progressé : dans la consommation d’aluminium en Europe, la part d’origine recyclage est passée de 50 % en 1980 à plus de 70 % en 2000. Il existe différentes filières industrielles de récupération de l’aluminium.
Après la Seconde Guerre mondiale, une pénurie et les besoins de la reconstruction ont conduit à refondre des alliages d’aluminium pour en faire des pièces n’exigeant pas de caractéristiques mécaniques précises, et en particulier des ustensiles de cuisine. La composition des alliages obtenus n’était pas appréciée des fondeurs qui les qualifiaient de « cochonium ». Les casseroles et couverts ainsi réalisées se piquaient rapidement (corrosion par piqûre), sous l’effet de l’acidité de certains aliments.
Recyclage en France
En France, l’aluminium des décharges, des déchets industriels et assimilés est récupéré et broyé puis refondu par des affineurs d’aluminium pour produire l’« aluminium de seconde fusion ». Ce dernier est essentiellement utilisé pour fabriquer des pièces de fonderie pour l’automobile (blocs moteur, culasses, pistons, etc.). L’aluminium « ménager » est récupéré avec les emballages dans le cadre du tri sélectif. Dans les centres de tri (en France et dans le monde), l’aluminium est trié manuellement ou plus couramment grâce à des machines de tri par courants de Foucault inventées en 1984 par le thermodynamicien Hubert Juillet[154] - [155] - [156].
En 2009, en France, 32 % des emballages en aluminium ont été recyclés. Les petites canettes métalliques, les canettes écrasées, les feuilles d’aluminium froissées, les capsules de café, etc. étaient rejetées par le processus de tri du fait de leur taille, de même que le papier aluminium et divers composés contenant de l’aluminium (environ 50 000 t/an, rien que pour la France).
Afin d'améliorer le recyclage de ces emballages en aluminium, des industriels ont créé le Club de l’emballage léger en aluminium et en acier (CELAA)[157]. Ce dernier a réalisé des expérimentations dans quatre départements (Hauts-de-Seine, Var, Alpes-Maritimes et Lot) qui ont démontré qu'il était tout à fait possible de recycler des produits tels que les capsules de machines à café, les feuilles d’aluminium, les bouchons et couvercles. Les résultats obtenus montrent qu'on peut ainsi aller jusqu'à doubler les taux de recyclage de l'aluminium et augmenter le recyclage de l'acier de 10 %.
À la suite de ces expérimentations a été créé, en partenariat avec Eco-Emballages et l'Association des Maires de France, le projet Métal qui vise à améliorer le recyclage des emballages métalliques en fournissant des outils techniques et financiers aux centres de tri[158]. L'entreprise Nespresso accompagne ce projet avec la création du Fonds de dotation pour le recyclage des petits emballages métalliques qui apporte des soutiens financiers complémentaires pour recycler ces petits emballages. Plus de cinq cents collectivités et trois millions d'habitants participent d'ores et déjà à ce projet et peuvent ainsi recycler l'ensemble de leurs emballages métalliques. Depuis 2015, les centres de recyclage équipés peuvent recycler les canettes[159].
Autres pays
Dans certains pays en voie de développement, le recyclage non contrôlé de matières à base d’aluminium conduit encore de nos jours à réaliser des ustensiles alimentaires avec des teneurs en éléments nocifs (nickel, cuivre, etc.). Néanmoins, le recyclage des alliages d’aluminium, effectué sérieusement, avec un contrôle précis de la composition, donne d’excellents résultats[160].
Le recyclage de l’aluminium est une opportunité socio-économique, notamment celles des pays en voie de développement[161].
Les cinq premiers producteurs mondiaux
En 2006, les principaux producteurs d'aluminium primaire dans le monde sont : Rio Tinto, Rusal, Alcoa, Norsk Hydro et Chalco[162]. En 2018, Norsk Hydro sort de la liste des cinq principaux producteurs, qui devient, dans l'ordre : Chalco, Alcoa, Rio Tinto, Rusal et Xinfa[163].
Prix
Au , la tonne d'aluminium s'échange au London Metal Exchange (LME) à 1 465 USD, soit 1 345 €, d'où un prix au kilogramme de 1,35 €[164].
Au , la tonne d'aluminium s'échange au LME à 3 405 USD, soit 3,08 €/kg.
Dangers de la production d'aluminium
Pollutions dues au processus de production
Trois types de pollutions directes sont engendrées par la production de l’aluminium[165] :
- une pollution par les rejets de production d'alumine à partir de la bauxite, dites boues rouges stockées dans des aires protégées par des digues ; ces boues sont caustiques (soude) et contiennent divers métaux ;
- une pollution fluorée lors de la transformation de l’alumine en aluminium ;
- des rejets gazeux au-dessus des cuves d’électrolyse, qui doivent être captés.
La production d'aluminium aussi nécessite de grandes quantités d’électricité (deux fois plus que pour la production d'acier), produite souvent par des centrales polluantes. En Islande cette énergie est produite par la géothermie, mais le minerai doit être transporté car l'Islande ne possède pas de gisement de bauxite.
Alcoa et Rio Tinto ont annoncé le avoir mis au point, avec le soutien des autorités canadiennes et québécoises ainsi que d'Apple, un nouveau procédé « zéro émission » pour la production d'aluminium, qu'ils comptent utiliser à partir de 2024 dans une nouvelle usine au Québec ; alors que le procédé d'électrolyse classique utilise des électrodes à base de carbone, provoquant les émissions de gaz à effet de serre, les deux partenaires ont remplacé ce carbone par de nouveaux matériaux brevetés par Alcoa, dont le seul sous-produit est de l'oxygène pur ; pour développer ce nouveau procédé, ils ont créé une coentreprise baptisée « Elysis ». Selon leurs calculs, cette technologie permettrait d'éliminer 6,5 millions de tonnes de gaz à effet de serre si elle était implantée dans toutes les usines d'aluminium du Canada, soit l'équivalent de 1,8 million de voitures sur la route. Les émissions de CO2 lors de la production d'électricité subsisteront, mais au Canada la majeure partie est issue de l'hydroélectricité[166] - [167].
Incidents graves liés à l'industrie de l'aluminium
Le , un réservoir de l’usine de production de bauxite-aluminium, Ajkai Timfoldgyar Zrt, située à Ajka, à 160 kilomètres de Budapest, s’est rompu déversant entre 600 000 et 700 000 m3 de boue rouge toxique composée d’éléments nocifs et très corrosifs qui ont inondé trois villages dans un rayon de 40 km2 avant d’atteindre le Danube, menaçant l’écosystème du grand fleuve avec un taux alcalin légèrement au-dessus de la normale[168] - [169] - [170].
Le bilan des pertes humaines s’élève à 9 morts et plus de 150 blessés, l’écosystème à proximité de l’usine a été entièrement détruit, la marée rouge a emporté avec elle le bétail et les animaux de fermes, des milliers de poissons ont péri. Le gouvernement hongrois a décrété l’état d’urgence[171]. La région demeure sous le risque d’une deuxième inondation semblable après que plusieurs fissures ont été remarquées sur le réservoir nord menaçant de déverser 500 000 mètres cubes de boue rouge de plus[172] - [173].
Notes et références
Notes
- En fait il est recouvert d'une mince couche d'oxyde d'aluminium très dur, et stable (cf. Propriétés physiques) qui le protège.
- De l'aluminium natif a néanmoins été identifié en plusieurs endroits, notamment dans des sédiments en mer de Chine méridionale[12].
- Photo d’un fragment naturel de roche contenant de l’aluminium
Références
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, , 87e éd. (ISBN 0849304873), p. 10-202
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, p. T1-T21 (et p. T23-T42, version anglaise).
- (en) « Aluminum », sur NIST/WebBook, consulté le 28 juin 2010
- (en) Metals handbook, vol. 10 : Materials characterization, ASM International, , 1310 p. (ISBN 0-87170-007-7), p. 346
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0803120664, lire en ligne), p. 71
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Entrée « Aluminium powder (pyrophoric) » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 août 2018 (JavaScript nécessaire)
- Entrée « Aluminium powder (stabilised) » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 août 2018 (JavaScript nécessaire)
- « Aluminium (poudre) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Zhong Chen, Chi-Yue Huang, Meixun Zhao, Wen Yan, Chih-Wei Chien, Muhong Chen, Huaping Yang, Hideaki Machiyama et Saulwood Lin, « Characteristics and possible origin of native aluminum in cold seep sediments from the northeastern South China Sea », Journal of Asian Earth Sciences, (DOI 10.1016/j.jseaes.2010.06.006).
- (en) Bauxite and alumina, USGS Minerals, 2011
- (en) USGS Minerals – 2011 « Aluminum. »
- Tietz T, Lenzner A, Kolbaum A.E, Zellmer S, Riebeling C, Gürtler R, … et Merkel, S (2019), Aggregated aluminium exposure: risk assessment for the general population, Archives of Toxicology, 1-19, lire en ligne.
- Paul Depovere, La classification périodique des éléments. La merveille fondamentale de l'Univers, De Boeck Supérieur, , p. 98.
- Georges Chaudron, in « La préparation industrielle de l'aluminium et la découverte de ses propriétés par un illustre savant français, Henry Sainte-Claire Deville », Revue de l'aluminium no 211, juin 1954, p. 97, publié par l'Institut d'histoire de l'aluminium
- Histoire de l’aluminium
- Voir la coupe offerte par les habitants de Saint-Germain-en-Laye à leur maire Jules-Xavier Saguez de Breuvery.
- Comme le « surtout aux putti » offert à Napoléon III par Christofle en 1858, ou l'aiguière de l'Impératrice Eugénie en porcelaine de Sèvres à monture d'aluminium doré en 1859 et qui est alors l'objet le plus cher de la manufacture : 6 975 F, La Gazette Drouot, no 1622, 3 juin 2016, p. 24-25.
- (en) Fred Aftalion, A history of the international Chemical industry, Philadelphie, University of Pennsylvania Press, , p. 64
- (en) A. J. Downs, Chemistry of Aluminium, Gallium, Indium and Thallium, Springer Science & Business Media, , 526 p. (ISBN 978-0-7514-0103-5, lire en ligne), p. 15
- Ivan Grinberg, Cent ans d'innovation dans l'industrie de l'aluminium, Éditions L'Harmattan, (lire en ligne), p. 157-158
- Martin Brown et Bruce McKern, L'aluminium, le cuivre et l'acier dans les pays en développement, OECD Publishing, , p. 27-28
- (en) J. Villeneuve, M. Chaussidon et G. Libourel, « Homogeneous Distribution of 26Al in the Solar System from the Mg Isotopic Composition of Chondrules », Science, vol. 325, no 5943, , p. 985-988 (ISSN 0036-8075, DOI 10.1126/science.1173907).
- « Les formes de corrosion de l'aluminium »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur corrosion-aluminium.com
- CEA Laboratoire Léon Brillouin, La diffusion des neutrons thermiques (lire en ligne)
- (en) B. Nagler et al., « Turning solid aluminium transparent by intense soft X-ray photoionization », Nat. Phys., vol. 5, no 9, , p. 693-696 (ISSN 1745-2473, DOI 10.1038/nphys1341)
- Eintrag zu Aluminium. Dans Römpp Online. Georg Thieme Verlag, abgerufen am 12 juin 2013.
- Doris Oberle et al. (2019), Impfkomplikationen und der Umgang mit Verdachtsfällen. Dans Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz, Band 62, Nr. 4, 1. April, S. 450–461, DOI 10.1007/s00103-019-02913-1.
- Goullé J.P & Grangeot-Keros (2019) Aluminum and vaccines : Current state of knowledge. Dans Médecine et Maladies Infectieuses, 11 octobre 2019, DOI 10.1016/j.medmal.2019.09.012
- Markesbery WR, Ehmann WD, Alauddin M, Hossain TI (1984), Brain trace element concentrations in aging, Neuro-biol. Aging, 5, 19-28
- Edwardson JA, Moore PB, Ferrier IN, Lilley JS, Newton GWA, Barker J, Templar J, Day JP (1993) Effect of silicon on gastrointestinal absorption of aluminium, Lancet, 342, 211-212.
- Taylor GA, Ferrier IN, McLoughlin IJ, Fairbairn AF, McK- eith IG, Lett D, Edwardson JA (1992), Gastrointestinal absorption of aluminium in Alzheimer’s disease: Response to aluminium citrate, Age Ageing, 21, 81-90.
- Cam JM, Luck VA, Eastwood JB, de Wardener HE (1976), The effect of aluminium hydroxide orally on calcium, phosphorus and aluminium metabolism in normal subjects, Clin. Sci. Mol. Med., 51, 407-414.
- Slanina P, Frech W, Bernhardson A, Cedergren A, Matts- son P (1985), Influence of dietary factors on aluminum absorption and retention in the brain and bone of rats, Acta Pharmacol. Toxicol., 56, 331-336.
- Beynon H, Cassidy MJD (1990), Gastrointestinal absorption of aluminium, Nephron, 55, 235-236
- (en) J.-P. Day et al., « Biological chemistry of aluminium studied using 26Al and accelerator mass spectrometry », Nucl. Instrum. Methods Phys. Res., Sect. B, vol. 92, nos 1-4, , p. 463-468 (DOI 10.1016/0168-583X(94)96055-0)
- Aluminium in Impfstoffen, sur arznei-telegramm.de, 6 octobre 2018.
- (en) D. Chappard, P. Bizot, G. Mabilleau et L. Hubert, « Aluminum and bone: Review of new clinical circumstances associated with Al3+ deposition in the calcified matrix of bone », Morphologie, vol. 100, no 329, , p. 95–105 (DOI 10.1016/j.morpho.2015.12.001, lire en ligne, consulté le )
- (en) W. D. Kaehny, A. P. Hegg et A. C. Alfrey, « Gastrointestinal Absorption of Aluminum from Aluminum-Containing Antacids », N. Engl. J. Med., vol. 296, no 24, , p. 1389-1390 (ISSN 0028-4793, DOI 10.1056/NEJM197706162962407)
- (en) S. Valkonen et A. Aitio, « Analysis of aluminium in serum and urine for the biomonitoring of occupational exposure », Sci. Total Environ., vol. 199, nos 1-2, , p. 103-110 (ISSN 0048-9697, DOI 10.1016/S0048-9697(97)05485-5)
- Aitio A, Riihimäki V, Valkonen S. Aluminium. In Biological monitoring of chemical exposure in the wor place, WHO, Genève 1996; 2:1-17
- Lauwerys R.R, Hoet P., Industrial chemical exposure: Guidelines for biological monitoring, Lewis publishers, 3e éd., 2001, 638 p.
- Bismuth C (2000), Toxicologie clinique, Médecine-Sciences, éd. Flammarion, 1092 p.
- M. R. Wills et J. Savory, « Aluminium poisoning: dialysis encephalopathy, osteomalacia, and anaemia », Lancet (London, England), vol. 2, no 8340, , p. 29–34 (ISSN 0140-6736, PMID 6134894, DOI 10.1016/s0140-6736(83)90014-4, lire en ligne, consulté le ).
- W. J. Visser et F. L. Van de Vyver, « Aluminium-induced osteomalacia in severe chronic renal failure (SCRF) », Clinical Nephrology, vol. 24 Suppl 1, , S30–36 (ISSN 0301-0430, PMID 3915958, lire en ligne, consulté le ).
- Walton J, Tuniz C, Fink D, Jacobsen G, Wilcox D (1995) Uptake of trace amounts of aluminum into the brain from drinking water. Neurotoxicology 16, 187-190.
- Druëke TB, Jouhanneau P, Banide H, Lacour B (1997) Effects of silicon, citrate and the fasting state on the intestinal absorption of aluminium in rats. Clin Sci 92, 63-67.
- Zafar TA, Weaver CM, Martin BR, Flarend R, Elmore D (1997) Aluminum (26Al) metabolism in rats. Proc. Soc. Exp. Biol. Med., 216, 81-85.
- J.R Walton, « Chronic aluminum intake causes Alzheimer's disease: applying Sir Austin Bradford Hill's causality criteria », Journal of Alzheimer's Disease, vol. 40, no 4, , p. 765-838 (lire en ligne)
- A. Lione, « The prophylactic reduction of aluminium intake », Food Chem. Toxicol., vol. 21, , p. 103-109
- Nayak P (2002), Aluminum: Impacts and disease, Environ. Res., 89:101–15 (résumé)
- [Question écrite n° 14858 de M. Jean-Paul Virapoullé (La Réunion - UMP) et réponse], JO Sénat du 19 aout 2010, p. 2069.
- Directive n° 98/83/CE du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine
- Avis de l'AFSSA du 15 juillet 2008
- Theron J, Walker J.A et Cloete T.E (2008), Nanotechnology and water treatment: applications and emerging opportunities. Critical reviews in microbiology, 34(1), 43-69.
- Zhou, L. et al., 3D self-assembly of aluminium nanoparticles for plasmon- enhanced solar desalination. Nat. Photon. 10, 393–398 (2016).
- Greger J.L (1988) Aluminumin the diet and mineral metabolism in Metal ions in Biological Systems ; Ed : Sigel, N-Y : Marcel Dekker. 24:199-215
- Müller M, Anke M et Illing-Günther H (1998), Aluminium in foodstuffs. Food Chemistry, 61(4), 419-428 (résumé).
- Gramiccioni L, Ingrao G, Milana M.R, Santaroni P. et Tomassi G (1996) Aluminium levelsin ltalian diets and in selected foods from aluminium utensils, Food. Addit. Contam., I.3(7):767- 774
- Veríssimo M.I, Oliveira J.A et Gomes M.T.S (2006), Leaching of aluminium from cooking pans and food containers. Sensors and Actuators B: Chemical, 118(1-2), 192-197.
- Fulton et Jefiterye H (1990), Absorption and retention of aluminum from drinking water. 1. Effect of citrid and ascorbic acids on aluminium tissue levels in rabbits, Fundam. Appl. Roxicology, 1l.4:788-796
- López F.F, Cabrera C, Lorenzo M.L et López M.C (2002), Aluminium content of drinking waters, fruit juices and soft drinks: contribution to dietary intake, Science of the Total Environment, 292(3), 205-213.
- Jung P.H (1997), Étude des effets d'une intoxication au chlorure d'aluminium sur la consommation d'oxygène et les capacités d'apprentissage du rat Wistar (Doctoral dissertation, université Paul-Verlaine-Metz), lire en ligne.
- Graff L, Muller G et Burnel D (1995), In vitro and in vivo comparative studies on chelation of aluminum by some polyaminocarboxylicacids. Research Communication in Molecular Pathology and Pharmncology 8.8:27I-292.
- Graff L, Muller G et Burnel D (1995), In vitro and in vivo evaluation of potential aluminum chelators, Veterinary and Human Toxicology, 3.7:455-461
- Waldemar Ternes (2013) Biochemie der Elemente: Anorganische Chemie biologischer Prozesse, Springer DE (ISBN 978-3-8274-3019-9) (eingeschränkte Vorschau in der Google-Buchsuche).
- Norwegens Süßwasserfische sterben am sauren Regen (1981) Arbeiter-Zeitung. Wien 29 September, S. 10, unten links (arbeiter-zeitung.at – Archives en ligne)
- Chen J, Duan R.X, Hu W.J, Zhang N.N, Lin X.Y, Zhang J.H et Zheng H.L (2019), Unravelling calcium-alleviated aluminium toxicity in Arabidopsis thaliana: Insights into regulatory mechanisms using proteomics, Journal of Proteomics, 199, 15-30 (résumé).
- Hideaki Matsumoto (2000), Cell biology of aluminum toxicity and tolerance in higher plants. Dans International Review of Cytology. Band 200, 2000, S. 1–46, DOI 10.1016/S0074-7696(00)00001-2.
- Bunichi Ezaki et al. (2001), Different mechanisms of four aluminum (Al)-resistant transgenes for Al toxicity in Arabidopsis, Plant Physiology, Band 127, Nr. 3, S. 918–927, .
- Charlotte Poschenrieder et al. (2008), A glance into aluminum toxicity and resistance in plants, Science of the Total Environment, Band 400, Nr. 1–3, S. 356–368, DOI 10.1016/j.scitotenv.2008.06.003.
- Sanji Kumar et al. (2009), Aluminum stress signaling in plants. Dans Plant Signaling & Behaviour, Band 4, Nr. 7, S. 592–597, , PMC 2710549
- Ganrot P.O (1986), Métabolism and possible health effects of aluminum, Environ. Health Perspect., vol. 65, 363-44&
- Greger J.L et Baier M.J (1983), Effect of dietary aluminum on mineral metabolism of adult males A. mer, J. Clin. Nutr., 38:411-419
- Hewitt C.D, O'Hara M, Day J.P a Bishop N (1987), Exposure of infants to aluminumfrom milk formulae and intravenous fluids. Trade Elment, Analytical Chemistry in Medecinean Biology, Eds. Brätter P.& Schramelz P, Walter de Gruyter & Co., Berlin, vol. 4:382-388.
- Inan-Eroglu E, Gulec A et Ayaz A (2019), Effects of different pH, temperature and foils on aluminum leaching from baked fish by ICP-MS, Czech Journal of Food Sciences, 37(3), 165-172.
- Simonsen L, Johnsen H, Lund SP, Matikainen E, Midtgard U et Wennberg A (1994), Methodological approach to the evaluation of neurotoxicology data and the classification of neurotoxic chemicals, Scand. J. Work Environ. Health, 20, 1-12
- Walton J.R (2014), Chronic aluminum intake causes Alzheimer's disease: applying Sir Austin Bradford Hill's causality criteria, Journal of Alzheimer's Disease, 40(4), 765-838, lire en ligne.
- Exley C (2004), The pro-oxidant activity of aluminum, Free Radic. Biol. Med., 36, 380-387.
- Yang EY, Guo-Ross SX, Bondy SC (1999), The stabilization of ferrous iron by a toxic-amyloid fragment and by an aluminium salt, Brain Res., 839, 221-226
- Crapper DR, Tomko GJ (1975), Neuronal correlates of an encephalopathy associated with aluminum neurofibrillary degeneration. Brain Res 97, 253-264
- Martin RB (1986), The chemistry of aluminum as related to biology and medicine. Clin Chem 32, 1797-1806.
- Trapp GA (1986) Interactions of aluminium with cofactors, enzymes and other proteins. Kidney Int 29, S12-S16.
- Macdonald TL, Humphreys WG, Martin RB (1987) Promotion of tubulin assembly by aluminum ion in vitro. Science, 236, 183-186.
- Miller JL, Hubbard CM, Litman BJ, Macdonald TL (1989) Inhibition of transducin activation and guanosine triphosphatase activity by aluminum ion, J. Biol. Chem., 264, 243-250.
- Shirley DG, Lote CJ (2005), Renal handling of aluminium. Nephron Physiol., 101, 99-103.
- Roskams AJ, Connor JR (1990) Aluminum access to the brain: A role for transferrin and its receptor, Proc. Nat. Acad. Sci., USA 87, 9024-9027
- Yamanaka K, Minato N, Iwai K (1999), Stabilization of iron regulatory protein 2, IRP2, by aluminum. FEBS Lett 462, 216-220.
- Ward RM, Zhang Y, Crichton RR (2001) Aluminum toxicity and iron homeostasis, J. Inorg. Biochem., 87, 9-14
- Walton JR (2012), Aluminum disruption of calcium home- ostasis and signal transduction resembles change that occurs in aging and Alzheimer’s disease, J. Alzheimers Dis., 29, 255-273
- Karl, Ziegler (1963) Consequences and development of an invention. Nobel Lecture, Stockholm, http://www.nobel prize.org/nobel prizes/chemistry/laureates/1963/ziegler-lecture.pdf, consulté le 10 aout 2013
- (en) SakharamD. Mahurkar, Raul Salta, EarlC. Smith et SisirK. Dhar, « Dialysis démentia », The Lancet, vol. 301, no 7817, , p. 1412–1415 (DOI 10.1016/S0140-6736(73)91740-6, lire en ligne, consulté le )
- INVS (2003)Neuro toxicité de l'aluminium
- Alexandre Seidowsky, Emmanuel Dupuis, Tilman Drueke et Serge Dard, « [Aluminic intoxication in chronic hemodialysis. A diagnosis rarely evoked nowadays. Clinical case and review of the literature] », Nephrologie & Therapeutique, vol. 14, no 1, , p. 35–41 (ISSN 1872-9177, PMID 29174672, DOI 10.1016/j.nephro.2017.04.002, lire en ligne, consulté le )
- Michelle Coquet, Dossier : « Myofasciite à macrophages ; mise en évidence d’une nouvelle entité » ; Kinésithérapie, la Revue, vol. 8, issue 79, juillet 2008, p. 16–21, lire en ligne
- Davidson D.L.W & Ward N.I (1988) Abnormal aluminium, cobalt, manganese, strontium and zinc concentrations in untreated epilepsy. Epilepsy research, 2(5), 323-330.
- Velasco, M., Velasco, F., Pacheco, M. T., Azpeitia, E., Saldívar, L. et Estrada‐Villanueva, F. (1984), Alumina Cream‐Induced Focal Motor Epilepsy in Cat. Part 5, Excision and Transplant of the Epileptogenic Granuloma, Epilepsia, 25(6), 752-758.
- Association Santé Environnement France (ASEF), « L’aluminium, ce métal qui nous empoisonne : La synthèse de l’ASEF »
 , sur ASEF (Association Santé Environnement France), (consulté le )
, sur ASEF (Association Santé Environnement France), (consulté le ) - Türkez H, Yousef M.I et Geyikoglu F (2010), Propolis prevents aluminium-induced genetic and hepatic damages in rat liver, Food and Chemical Toxicology, 48(10), 2741-2746.
- Évaluation du risque lié à l’utilisation de l’aluminium dans les produits cosmétiques, Afssaps, (lire en ligne)
- Johnson GV et Jope RS (1986), Aluminum impairs glucose utilization and cholinergic activity in rat brain in vitro. Toxicology 40, 93-102.
- Novaes, R. D., Mouro, V. G., Gonçalves, R. V., Mendonça, A. A., Santos, E. C., Fialho, M. C. et Machado-Neves, M. (2018), Aluminum: A potentially toxic metal with dose-dependent effects on cardiac bioaccumulation, mineral distribution, DNA oxidation and microstructural remodeling, Environmental Pollution, 242, 814-826 (résumé).
- (en) C. R. Harrington, C. M. Wischik, F. K. McArthur, G. A. Taylor, J. A. Edwardson et J. M. Candy, « Alzheimer's-disease-like changes in tau protein processing: association with aluminium accumulation in brains of renal dialysis patients », Lancet, vol. 343, no 8904, , p. 993-997 (ISSN 0140-6736, DOI 10.1016/S0140-6736(94)90124-4)
- (en) M. Santibanez, F. Bolumar et A. M Garcia, « Occupational risk factors in Alzheimer's disease: a review assessing the quality of published epidemiological studies », Occupational and Environmental Medicine, vol. 64, no 11, , p. 723–732 (ISSN 1351-0711, PMID 17525096, PMCID PMC2078415, DOI 10.1136/oem.2006.028209, lire en ligne, consulté le )
- Lucija Tomljenovic, « Aluminum and Alzheimer's Disease: After a Century of Controversy, Is there a Plausible Link? », Journal of Alzheimer's Disease, vol. 23, no 4, , p. 567–598 (DOI 10.3233/JAD-2010-101494, lire en ligne, consulté le )
- Fekete Veronika, Vandevijvere Stefanie, Bolle Fabien, Van Loco Joris (2013) Estimation of dietary aluminum exposure of the Belgian adult population: Evaluation of contribution of food and kitchenware. Food and Chemical Toxicology, 55, 602-608, DOI 10.1016/j.fct.2013.01.059
- Pennington J.A et Schoen S.A (1995), Estimates of dietary exposure to aluminium. Food Additives & Contaminants, 12(1), 119-128 (résumé)
- Greger JL (1993), Aluminum metabolism, Annu. Rev. Nutr., 13, 42-63.
- Walton J.R (2014) Chronic aluminum intake causes Alzheimer's disease: applying Sir Austin Bradford Hill's causality criteria. Journal of Alzheimer's Disease, 40(4), 765-838. lire en ligne, p. 766
- Committee on the GRAS List Survey–Phase III (1984) The 1977 Survey of Industry on the Use of Food Additives. National Academy of Sciences, Washington, DC.
- Hayashi, A., Sato, F., Imai, T. et Yoshinaga, J. (2019), Daily intake of total and inorganic arsenic, lead, and aluminum of the Japanese: Duplicate diet study, Journal of Food Composition and Analysis, 77, 77-83 (résumé).
- Un tiers des Chinois consomment trop d'aluminium, selon un rapport, sur french.peopledaily.com.cn, 29 septembre 2012.
- Wong, W. W., Chung, S. W., Kwong, K. P., Yin Ho, Y. et Xiao, Y. (2010), Dietary exposure to aluminium of the Hong Kong population, Food Additives and Contaminants, 27(4), 457-463 (résumé).
- Bi Shuping (1996) A model describing the complexing effect in the leaching of aluminum from cooking utensils, Environmental Pollution, 92, 85-89, DOI 10.1016/0269-7491(95)00038-0.
- Bratakos S.M, Lazou A.E, Bratakos M.S et Lazos E.S (2012), Aluminium in food and daily dietary intake estimate in Greece, Food Additives & Contaminants: Part B, 5: 33–44.
- Bassioni G, Mohammed F.S, Al Zubaidy E et Kobrsi I (2012) Risk assessment of using aluminum foil in food preparation. International Journal of Electrochemical Science, 7: 4498–4509.
- Al Juhaiman Layla A. (2015), Estimating Aluminum Leaching into Meat Baked with Aluminum Foil Using Gravimetric and UV-Vis Spectrophotometric Method, Food and Nutrition Sciences, 06, 538-545, DOI 10.4236/fns.2015.65056.
- Codex alimentarius, « Noms de catégories et systèmes international de numérotation des additifs alimentaires », sur codexalimentarius.net, (consulté le )
- « Le E173 (aluminium) est autorisé en France sous conditions », sur les-additifs-alimentaires.com.
- « Agents Classés par les Monographies du CIRC, Volumes 1–129 – Monographies du CIRC sur l’Identification des Dangers Cancérogènes pour l’Homme », sur monographs.iarc.who.int (consulté le )
- (en) Scientific Committee on Consumer Safety (SCCS), Opinion on the safety of aluminium in cosmetic products, Commission européenne, (lire en ligne)
- BRF (2021) Methoden zur Untersuchung von Papier, Karton und Pappe Lebensmittelverpackungen und sonstige Bedarfsgegenstände https://www.bfr.bund.de/cm/343/vorbereitung-zur-bestimmung-von-aluminium-im-wasserextrakt.pdf
- (en) Sappino AP, Buser R, Lesne L, Gimelli S, Béna F, Belin D et Mandriota SJ (Division of Oncology, Faculty of Medicine, University of Geneva, Geneva, Switzerland), Aluminium chloride promotes anchorage-independent growth in human mammary epithelial cells, Journal of Applied Toxicology, 6 janvier 2012, DOI 10.1002/jat.1793
- AFFSSA (2003)Évaluation des risques sanitaires liés à l’exposition de la population française à l’aluminium : eaux, aliments, produits de santé, sur le site de l'OPAC & INVS.
- Virginie Belle, Quand l'aluminium nous empoisonne - Enquête sur un scandale sanitaire, Éd. Max Milo, 2010.
- ANSM. La myofasciite à macrophages-Point d'information
- « Aluminium et vaccins », sur hspc.fr, (consulté le )
- Rapport de l'Académie nationale de Pharmacie, Les adjuvants aluminiques : le point en 2016 (lire en ligne), p. 30, 35, 36.
- Pike H (2019) enFlow fluid warming device: warning over risk of aluminium toxicity. (résumé)
- https://www.keele.ac.uk/aluminium/
- http://www.univ-lille2.fr/actualites/detail-article/art/le-11eme-keele-meeting-sur-laluminium-le-plus-grand-evenement-scientifique-international-sur.html
- Loïc Chauveau, « Alerte à la toxicité de l'aluminium », sciencesetavenir.fr, 4 mars 2015.
- Gherardi R.K (2003) Myofasciite à macrophages et hydroxyde d'aluminium : vers la définition d'un syndrome des adjuvants — Lessons from macrophagic myofascitiis: towards definition of a vaccine adjuvant-related syndrome, Revue neurologique (ISSN 0035-3787), vol. 159, no 2, p. 162-164, 3 p., (résumé Inist-CNRS)
- F.-J. Authier, P. Cherin, A. Creange, B. Bonnotte, X. Ferrer, A. Abdelmoumni, D. Ranoux, J. Pelletier, D. Figarella-Branger, B. Granel, T. Maisonobe, M. Coquet, J.-D. Degos et R. K. Gherardi (2001), Central nervous system disease in patients with macrophagic myofasciitis, Oxford Journals, Medicine, vol. 124, issue 5, p. 974-983, en ligne (ISSN 1460-2156), imprimé (ISSN 0006-8950) (résumé)
- Claire Gourier-Fréry, Nadine Fréry, Claudine Berr, Sylvaine Cordier, Robert Garnier, Hubert Isnard, Coralie Ravault, Claude Renaudeau IVS, 2003, Aluminium - Quels risques pour la santé ? [PDF], InVS, 184 p.
- Rapport d'expertise : « Évaluation du risque lié à l’utilisation de l’aluminium dans les produits cosmétiques » [PDF], octobre 2012, 44 p.
- European Food Safety Agency (EFSA), Safety of aluminium from dietary intake - « Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact Materials (AFC) », The EFSA Journal, 2008, 754 : 1-34.
- European Food Safety Agency (EFSA), « Annex of the opinion on Safety of aluminium from dietary intake-Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact Materials (AFC) », Annex to the EFSA Journal, 2008, 754, 1-34 opinion Safety of aluminium from dietary intake.
- « Aluminium, notre poison quotidien », sur France 5, (consulté le )
- « Attention à l'alu dans les déodorants », .
- An analytical procedure for the determination of aluminum used in antiperspirants on human skin in Franz diffusion cell, Toxicol. Mech. Methods, avril 2012;22(3):205-10, DOI 10.3109/15376516.2011.610386. Guillard O, Fauconneau B, Favreau F, Marrauld A, Pineau A. (CHU Poitiers, Laboratoire de biochimie, Poitiers, France), lire en ligne
- In vitro study of percutaneous absorption of aluminum from antiperspirants through human skin in the Franz diffusion cell, J. Inorg. Biochem., vol. 110, mai 2012, p. 21–26. Pineau A, Guillard O, Favreau F, Marrauld A, Fauconneau B. (université Nantes, faculté de pharmacie, Laboratoire de toxicologie, Nantes, France), lire en ligne
- L'aluminium au quotidien
- Institut national de recherche et de sécurité, Base de données fiches toxicologiques : aluminium et ses composés minéraux - fiche n°306, (lire en ligne)
- (en) P. V. Liddicoat, X.-Z. Liao, Y. Zhao, Y. Zhu, M. Y. Murashkin, E. J. Lavernia, R. Z. Valiev et S. P. Ringer, « Nanostructural hierarchy increases the strength of aluminium alloys », Nat. Commun., vol. 1, (DOI 10.1038/ncomms1062)
- Encyclopædia Britannica, « aluminum processing », sur www.britannica.com (consulté le )
- Source : International Aluminium Institute.
- (en) International Aluminium Institute.
- « be3m | Minéralinfo », sur www.mineralinfo.fr (consulté le )
- mineralsinfo.fr mineralinfo.fr
- Michal Hudec, « Slovaquie : la plus grande usine d’aluminium du pays ferme ses portes face aux prix record de l’électricité », sur www.euractiv.fr, (consulté le )
- Séparateur à répulsion magnétique, sur espacenet.com (consulté le 21 janvier 2015)
- Système de séparation des métaux non ferreux., sur espacenet.com (consulté le 21 janvier 2015)
- Séparateur pour un mélange de particules ayant des caractéristiques différentes, sur espacenet.com (consulté le 27 janvier 2015).
- En quoi consiste le projet développé par le CELAA ?, sur celaa.fr.
- Trier et recycler les petits déchets aluminium directement dans les ordures ménagères, c'est rentable, sur actu-environnement.com (consulté le 21 janvier 2016).
- Bil Ta Garbi, « Le recyclage des canettes en aluminium » (consulté le )
- YouTube, « Ecotourisme au Bénin : fabrication d'une marmite en aluminium » (consulté le )
- Jean Merlin Etobe, Fabrication de marmites à partir d’aluminium récupéré, Yaoundé, ISF Cameroun, , 28 p. (ISBN 978-92-9081-659-1, lire en ligne)
- M. Prandi, « Rusal devient un actionnaire de référence de Norilsk Nickel », Les Échos, no 20074, , p. 26 (ISSN 0153-4831, lire en ligne).
- « Les plus grands producteurs d'aluminium de 2018 », sur greelane.com, (consulté le )
- (en) « LME Aluminium », sur London Metal Exchange (LME) (consulté le ).
- (en) « The Bauxite Mining and Alumina Refining Process » [PDF], sur emt-india.net.
- Alcoa et Rio Tinto vont produire de l'aluminium « zéro émission », Les Échos, 11 mai 2018.
- enApple paves the way for breakthrough carbon free aluminum smelting method, Apple, mai 2018.
- « Hongrie. Controverse autour des boues toxiques », La Dépêche du Midi, (lire en ligne).
- Hongrie : 1,1 million de mètres cubes de boue dans le Danube, sur afriqueactu.net, 7 octobre 2010.
- Boues rouges en Hongrie : une catastrophe européenne majeure et prévisible, sur cdurable.info, 7 octobre 2010.
- Hongrie/boues : 9 morts (nouveau bilan), LeFigaro.fr, 13 octobre 2010.
- La Hongrie s’attend à une nouvelle inondation de boue rouge toxique, Libération, 9 octobre 2010.
- Hongrie : une 2e marée rouge « probable », RTLinfo.be, 9 octobre 2010.
Voir aussi
Articles connexes
Métallurgie extractive de l'aluminium
Alliages d'aluminium
Transformation de l'aluminium
- Fonderie d'aluminium
- Fabrication des feuilles et bandes d'aluminium
- Fabrication de semi-produits en alliage d’aluminium : tôles, profilés et pièces de fonderie
- Satinage de l'aluminium, par microbillage avec des microbilles de verre
Liens externes
- (en) « Technical data for Aluminum » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- Informations de marché, sur le site de la Conférence des Nations unies pour le commerce et le développement
- Alu-Scout, La plateforme interactive d'information et d’échange du domaine de l'aluminium
- Espace Alu, Musée de l'épopée de l'aluminium dans les Alpes
- Micrographies comparant la surface brillante et la surface mate du papier aluminium
- aluMATTER, un site web librement accessible qui vise à fournir des outils de formation en ligne innovants et interactifs relatifs à la science et aux technologies de l’aluminium
- Site de l’Institut pour l’histoire de l’aluminium (IHA)
- Iconothèque de l'aluminium de l'IHA
- un dossier pluridisciplinaire sur l’aluminium
- Caractérisation de l’aluminium par Henri Sainte-Claire Deville (1854), article analysé sur le site BibNum
- Le brevet Héroult d’électrolyse de l’aluminium (1886) en ligne et analysé sur le site BibNum
- Fonderie non ferreux diffuse en ligne des informations techniques et économiques sur les alliages d'aluminium
- (en) Institut international de l’aluminium, avec données mensuelles de production par zone géographique
- INERIS, Fiche de données toxicologiques et environnementales de l'aluminium et de ses dérivés,
- Rapport d'expertise de l'Afssaps : évaluation du risque lié à l’utilisation de l’aluminium dans les produits cosmétiques
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||







