Acide citrique
L'acide citrique est un acide tricarboxylique α-hydroxylé présent en abondance dans le citron, d'où son nom. Il s'agit d'un acide faible qui joue un rôle important en biochimie comme métabolite du cycle de Krebs, une voie métabolique majeure chez tous les organismes aérobies. Les citrates émis par les racines de certaines plantes jouent aussi un rôle important en écologie et agroécologie, car ils rendent le phosphore plus facilement bioassimilable par les plantes.
| Acide citrique | ||
| ||
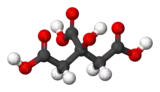 | ||
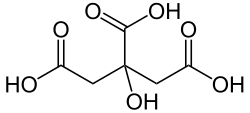
| Formule topologique et représentation 3D de l'acide citrique. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide 2-hydroxypropane-1,2,3-tricarboxylique | |
| Synonymes |
acide 3-carboxy-3-hydroxypentanedioïque |
|
| No CAS | (anhydre) (monohydrate) |
|
| No ECHA | 100.000.973 | |
| No CE | 201-069-1 | |
| No RTECS | GE7350000 | |
| DrugBank | DB04272 | |
| PubChem | 311 | |
| ChEBI | 30769 | |
| No E | E330 | |
| FEMA | 2306 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux incolores (anhydre)[1] cristaux blancs, faiblement déliquescents (monohydrate)[2] |
|
| Propriétés chimiques | ||
| Formule | C6H8O7 [Isomères] |
|
| Masse molaire[3] | 192,123 5 ± 0,007 5 g/mol C 37,51 %, H 4,2 %, O 58,29 %, |
|
| pKa | 3,13, 4,76, 6,40 à 25 °C[4] et 14,4[5] | |
| Propriétés physiques | ||
| T° fusion | 153 °C[6] | |
| T° ébullition | Se décompose au-dessous du point d'ébullition à 175 °C[2] | |
| Solubilité | Soluble dans l'eau (592 g l−1 à 20 °C)[6]. Soluble dans l'éther, l'acétate d'éthyle ; insoluble dans le benzène, le chloroforme[7]. |
|
| Masse volumique | 1,665 g cm−3 (20 °C)[7] | |
| T° d'auto-inflammation | 1 010 °C[2] | |
| Point d’éclair | 100 °C[1] | |
| Limites d’explosivité dans l’air | 0,28–2,29 %vol[1] | |
| Thermochimie | ||
| Cp | ||
| Cristallographie | ||
| Classe cristalline ou groupe d’espace | P21/a[9] | |
| Paramètres de maille | a = 12,817 Å b = 5,628 Å |
|
| Volume | 770,94 Å3[9] | |
| Précautions | ||
| SGH[10] | ||
 Attention |
||
| SIMDUT[11] - [12] | ||
Acide citrique : E, Acide citrique monohydraté :  E, |
||
| Inhalation | Toux. Essoufflement. Mal de gorge. | |
| Peau | Rougeur. | |
| Yeux | Rougeur. Douleur. | |
| Ingestion | Douleurs abdominales. Mal de gorge. | |
| autre | Combustible. Les particules finement dispersées forment des mélanges explosifs dans l'air[13]. | |
| Écotoxicologie | ||
| LogP | −1,7[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Plus d'un million de tonnes d'acide citrique de synthèse sont produites industriellement chaque année. Il est largement utilisé comme exhausteur de goût, comme régulateur alimentaire de pH et comme chélateur.
Propriétés

L'acide citrique a été isolé pour la première fois en 1784 par le chimiste suédois Carl Wilhelm Scheele à partir de jus de citron. Il peut exister sous forme anhydre ou monohydratée. La forme anhydre cristallise dans l'eau chaude tandis que le monohydrate se forme par cristallisation à partir d'une solution aqueuse froide. Le monohydrate peut être converti en forme anhydre à environ 78 °C. L'acide citrique est également soluble dans l'éthanol anhydre à raison de 76 parties d'acide citrique pour 100 parties d'éthanol à 15 °C. Il se décompose au-dessus de 175 °C en libérant du dioxyde de carbone (CO2), de l'eau (H2O) et les acides aconitique, citraconique et itaconique. Son oxydation avec des oxydants tels que des peroxydes, des hypochlorites, des persulfates, des permanganates, des periodates, des chromates, le dioxyde de manganèse et l'acide nitrique, produit de l'acide acétonedicarboxylique, de l'acide oxalique, du dioxyde de carbone et de l'eau[14].
L'acide citrique est un acide tricarboxylique dont les pKa à 25 °C valent 3,13, 4,76 et 6,40[4]. Le pKa du groupe hydroxyle a été mesuré par spectroscopie RMN au 13C à 14,4[5]. Le diagramme de spéciation montre que les solutions d'acide citrique sont des solutions tampon à pH compris entre 2 et 8. Il existe des tables de valeurs publiées à cet effet[15]. Dans les systèmes biologiques, à pH voisin de 7, les deux espèces présentes sont l'ion citrate et l'ion citrate mono-hydrogène.
Le pH d'une solution aqueuse d'acide citrique à 1 mmol/L est d'environ 3,2. Le pH des jus de fruits, tels que les jus d'orange et les jus de citron, dépendent de la concentration en acide citrique : le pH diminue lorsque la concentration en acide augmente.
Les sels d'acide citrique peuvent être préparés en ajustant avec précision le pH avant cristallisation du composé, comme c'est par exemple le cas du citrate de sodium.
L'ion citrate forme des complexes avec les cations métalliques. La constante de stabilité (en) de ces complexes est élevée en raison de l'effet de chélation. L'ion citrate forme par conséquent des complexes même avec les cations de métaux alcalins. Cependant, lorsqu'un chélate est formé avec les trois groupes carboxylate, les cycles du chélate comptent sept et huit atomes, ce qui les rend thermodynamiquement moins stables que des chélates plus petits. Par conséquent, lorsque le groupe hydroxyle est déprotoné, il forme un chélate plus stable avec un cycle de seulement cinq atomes, comme c'est le cas du citrate d'ammonium ferrique[16] (NH4)5Fe(C6H4O7)2·2H2O.
Abondance naturelle et production industrielle

L'acide citrique est présent significativement dans une grande variété de fruits et de légumes, notamment dans les agrumes. La concentration en acide citrique dans le citron et la lime (citron vert) est particulièrement élevée, et peut atteindre 8 % de la masse sèche de ces fruits, soit environ 47 g/L dans leur jus[17]. La concentration d'acide citrique dans les agrumes varie typiquement de 50 mmol/L dans les oranges à 300 mmol/L dans les citrons et les limes. Ces concentrations varient selon les cultivars et les conditions dans lesquelles les fruits sont cultivés.
La production industrielle de l'acide citrique a commencé en Italie dans les années 1890. Le jus de fruits y était traité avec de la chaux éteinte (hydroxyde de calcium Ca(OH)2) afin de précipiter le citrate de calcium (en), puis ce dernier était traité à l'aide d'une solution diluée d'acide sulfurique H2SO4 pour redonner l'acide citrique. En 1917, le chimiste américain James Currie découvrit que certaines souches d'aspergille noire pouvaient produire efficacement l'acide citrique, et la firme pharmaceutique Pfizer commença la production industrielle en utilisant cette méthode deux années plus tard, suivie par la société Citrique Belge (en) en 1929.
Dans ce mode de production, qui demeure encore aujourd'hui la principale voie de production industrielle de l'acide citrique, les moisissures sont cultivées sur un substrat contenant du saccharose ou du glucose. La source de glucides est généralement un sous-produit de l'industrie agroalimentaire riche en sucres[18]. La moisissure est ensuite filtrée de la solution produite, et l'acide citrique est isolé de la même façon qu'à partir du jus de citron : par précipitation avec de l'hydroxyde de calcium (chaux éteinte) sous forme de citrate de calcium, qui redonne l'acide citrique par traitement sous acide sulfurique dilué.
La production mondiale d'acide citrique s'élevait en 2007 à environ 1 600 000 t[19]. Plus de 50 % de ce volume était produit en Chine, et plus de 50 % était utilisé comme régulateur de pH pour les boissons, 20 % pour d'autres applications alimentaires, 20 % dans les détergents et 10 % pour des applications diverses telles que dans les cosmétiques, la pharmacie et l'industrie chimique.
Biochimie
Cycle de Krebs
L'acide citrique est un métabolite du cycle de Krebs, appelé « cycle de l'acide citrique » en anglais et dans les langues germaniques. Il est produit à la première étape du cycle par condensation du résidu acétyle de l'acétyl-CoA sur l'oxaloacétate pour former du citrate en libérant la coenzyme A sous l'action de la citrate synthase :
| + acétyl-CoA + H2O → CoA + | 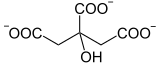 | |
| Oxaloacétate | Citrate | |
| Citrate synthase – EC | ||
Le citrate est ensuite progressivement dégradé par le cycle pour redonner de l'oxaloacétate en libérant deux molécules de CO2 et en réduisant une coenzyme Q10 en Q10H2 et trois NAD+ en NADH ; ces coenzymes réduites sont ensuite oxydées par la chaîne respiratoire pour produire de l'ATP par phosphorylation oxydative.
Certaines bactéries, notamment Escherichia coli, sont capables de produire et de consommer l'acide citrique dans le cadre du cycle de Krebs, mais sont incapables de s'en nourrir car elles sont dépourvues de la machinerie enzymatique nécessaire pour l'absorber dans la cellule. L'acquisition par ces bactéries de la capacité de se nourrir du citrate a été étudiée expérimentalement en les plaçant dans un milieu de culture contenant du citrate en abondance mais peu d'autres nutriments[20].
Autres rôles biochimiques
Le citrate peut être transporté hors des mitochondries jusque dans le cytosol pour y être dégradé en oxaloacétate et en acétyl-CoA pour permettre la biosynthèse des acides gras. Il agit de plus comme effecteur allostérique de l'acétyl-CoA carboxylase, qui est l'enzyme régulatrice de la conversion de l'acétyl-CoA en malonyl-CoA, étape d'engagement de la biosynthèse des acides gras.
Un taux de citrate élevé dans le cytosol peut inhiber la phosphofructokinase-1, enzyme régulatrice clé de la glycolyse. Ceci permet d'éviter la surproduction de métabolites lorsque la charge énergétique de la cellule est déjà élevée. Le citrate agit de plus en potentialisant l'effet inhibiteur de concentrations élevées d'ATP.
Le citrate est par ailleurs un constituant crucial des os, où il contribue à réguler la taille des nano-cristaux d'apatite[21].
Les citrates émis par les racines de certaines plantes facilitent la bioassimilation du phosphore par les plantes (phénomène notamment observé chez le lupin et certains blés (ex. : Carazinho, ancien cultivar de blé (Triticum aestivum) du Brésil, dont les apex radiculaires sécrètent naturellement un exsudat riche en citrates, ce qui lui permet de produire plus de biomasse sur des sols où le phosphore est peu biodisponible)[22].
Utilisations
Alimentation
L'acide citrique est un additif alimentaire (numéro E330[23]) préparé industriellement par fermentation fongique et utilisé dans l'industrie alimentaire comme acidifiant (soda, bonbons acidulés ), correcteur d’acidité, agent de levuration, dans la composition d'arôme (numéro FEMA/GRAS 2306).
E330 est biosynthétisé par des micro-organismes (moisissures comme Aspergillus niger) cultivés sur un substrat contenant habituellement de la mélasse et/ou du glucose. Les micro-organismes peuvent avoir été modifiés génétiquement pour augmenter le rendement. Le glucose peut être produit à partir de l'amidon de maïs, et donc être lui aussi d'origine transgénique[24]. L'utilisation éventuelle du maïs transgénique dans la fabrication de l'additif alimentaire E330 sans être signalé sur le produit final a été révélée dans le film documentaire Food, Inc..
Il peut être utilisé dans les boissons gazeuses sous forme de citrate de magnésium Mg3(C6H5O7)2, 4H2O.
Depuis les années 1970, une fausse information circule et réapparaît périodiquement malgré les démentis : un tract faussement attribué à l'institut Gustave Roussy (dit « tract de Villejuif ») accuse à tort l'additif E330 (acide citrique) d'être dangereux et cancérigène[25].
Médecine
- Produits cosmétiques et pharmaceutiques.
- Le citrate se lie au calcium sanguin, ce dernier étant nécessaire, entre autres, à la coagulation sanguine. Ceci est à l'origine de ses propriétés anticoagulantes, employées en laboratoire et pour la conservation des produits sanguins.
- Le citrate est utilisé en épuration extra-rénale continue en tant qu'anticoagulant régional dans le circuit d'épuration et surtout le filtre. Cette propriété est basée sur la chélation du calcium ionisé et rend nécessaire d'administrer du calcium en supplément.
- Le citrate est aussi utilisé sous forme de citrate de potassium ou de sodium pour l’alcalinisation des urines et la prévention des calculs urinaires, en particulier en cas d'hypocitraturie où leur utilisation réduit le risque de récidive de lithiases calciques en inhibant la croissance des calculs d'oxalate de calcium et de phosphate de calcium. Toutefois, du fait de ses effets secondaires, ce traitement n'est que peu toléré sur le long terme et on lui préfère souvent l’absorption de deux verres de jus d'orange par jour.
Autres
- Réduction de la rouille.
- En maçonnerie, en additif au ciment prompt quand on a besoin de ralentir la prise de celui-ci, en particulier par journée chaude où la prise peut être pratiquement instantanée (voir documentation technique Vicat, produit Tempo).
- Fabrication de pâte à modeler artisanale.
- Fongicide, bactéricide, anti-algues (lutte contre les lichens).
- Complexant du fer dans les vins pour retarder la casse ferrique.
- Nettoyant pour détartrer les cafetières (détartrant).
- Utilisation comme bain d'arrêt en photographie argentique.
- Pour diluer l’héroïne (pour transformer l'héroïne base insoluble en citrate d'héroïne soluble).
- Citrates organiques (ex. : citrate / acétylcitrate de triéthyle / tributyle) : plastifiants sûrs, à profil de toxicité favorable, pour les matières plastiques.
- Nettoyant pour circuits de refroidissement en mécanique automobile.
Propriétés physico-chimiques
Solubilité dans l'eau :
| Température | Solubilité (en % molaire)[26] |
|---|---|
| 10 °C | 54,0 %m |
| 20 °C | 59,2 %m |
| 30 °C | 64,3 %m |
| 40 °C | 68,6 %m |
| 50 °C | 70,9 %m |
| 60 °C | 73,5 %m |
| 70 °C | 76,2 %m |
| 80 °C | 78,8 %m |
| 90 °C | 81,4 %m |
| 100 °C | 84,0 %m |
Histoire et production
- L'acide citrique a été isolé du jus de citron pour la première fois en 1784, par le chimiste suédois Carl Scheele[27] (1742-1786).
- En 1869, en Angleterre, un médecin a obtenu, sous forme cristalline, de l'acide citrique. En mélangeant du jus de citron saturé avec de l'eau de chaux, que l'on décompose par de l'acide sulfurique, on obtient de l'acide citrique. L'intermédiaire de cette réaction est le citrate de calcium.
- Dès 1893, Wehmer a eu l'idée que des champignons filamenteux contenaient de l'acide citrique.
- En 1916, en Belgique, Alphonse Cappuyns, étudiant à Louvain, commença à étudier la production d'acide citrique par voie biologique. D'abord en cultivant des Citromyces (maintenant Penicillium) sur du sucre raffiné, ensuite avec des Aspergillus Niger-schimmel.
- En 1923, le citrate a été isolé d'une culture fongique fermentée. Cette méthode effectuée en laboratoire à petite échelle (sur pétris) a été élargie pour soutenir la demande d'acide citrique où il est maintenant produit dans de larges réservoirs rotatifs. On le prépare donc par fermentation d'une solution sucrée, telle la mélasse.
- En 1929, la production industrielle, économique, par voie biologique, devint possible et une société belgo-italienne, « La Citrique Belge », fut fondée.
Commerce
En 2014, la France est nette importatrice d'acide citrique, d'après les douanes françaises. Le prix moyen à l'import était de 1 100 €/t[28].
Acide citrique et vin
L’acide citrique est présent dans les raisins de tout cépage et en plus grande quantité dans les moûts concentrés par la pourriture ou le passerillage des raisins. Les teneurs en acide citrique des vins sont très variables. Beaucoup de vins rouges en sont dépourvus. En effet, parallèlement à la fermentation malolactique qu'elles provoquent, beaucoup de bactéries lactiques font fermenter l’acide citrique, en donnant lieu surtout à la formation d’acide acétique. L’acide citrique possède à un haut degré la propriété d’engager le fer ferrique dans un anion complexe double. Pour cette raison, il est utilisé de façon courante dans le traitement de la casse ferrique. On l’utilise encore pour remonter l’acidité fixe et ainsi améliorer l’acidité gustative d’un vin surtout dans les vins blancs secs. Son emploi dans les vins rouges appelle quelques réserves, car il n’y est pas très stable et risque d’être fermenté par bactéries lactiques avec augmentation d’acidité volatile.
Notes et références
- ACIDE CITRIQUE, Fiches internationales de sécurité chimique
- ACIDE CITRIQUE, MONOHYDRATE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Robert N. Goldberg, Nand Kishore et Rebecca M. Lennen, « Thermodynamic Quantities for the Ionization Reactions of Buffers », Journal of Physical and Chemical Reference Data, vol. 31, no 2, , p. 231-370 (DOI 10.1063/1.1416902, Bibcode 2002JPCRD..31..231G, lire en ligne).
- (en) Andre M. N. Silva, Xiaole Kong et Robert C. Hider, « Determination of the pKa value of the hydroxyl group in the α-hydroxycarboxylates citrate, malate and lactate by 13C NMR: implications for metal coordination in biological systems », BioMetals, vol. 22, no 5, , p. 771-778 (PMID 19288211, DOI 10.1007/s10534-009-9224-5).
- (en) Citric acid RN: 77-92-9 sur ChemIDplus (de).
- « CITRIC ACID », sur Hazardous Substances Data Bank (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., (ISBN 978-0-88415-858-5 et 0-88415-858-6, LCCN 96036328).
- « Citric Acid », sur reciprocalnet.org (consulté le ).
- Entrée « Citric acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 14 juillet 2016 (JavaScript nécessaire).
- « Acide citrique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- « Acide citrique monohydraté » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- Fiches internationales de sécurité chimique : Acide citrique - ICSC : 0855 sur NIOSH.
- (en) Gary Blair et Philip Staal, Kirk-Othmer encyclopedia of chemical technology, vol. 6, John Wiley & Sons, , 4e éd., 25 volumes (ISBN 978-0-471-52673-5, OCLC 23650978), « Citric acid ».
- (en) G. Gomori, « Preparation of buffers for use in enzyme studies », Methods in Enzymology, vol. 1, , p. 138-146 (DOI 10.1016/0076-6879(55)01020-3, lire en ligne).
- (en) M. Matzapetakis, C. P. Raptopoulou, A. Tsohos, V. Papaefthymiou, N. Moon et A. Salifoglou, « Synthesis, Spectroscopic and Structural Characterization of the First Mononuclear, Water Soluble Iron−Citrate Complex, (NH4)5Fe(C6H4O7)2·2H2O », Journal of the American Chemical Society, vol. 120, no 50, , p. 13266-13267 (DOI 10.1021/ja9807035, lire en ligne).
- (en) Kristina L. Penniston, Stephen Y. Nakada, Ross P. Holmes et Dean G. Assimos, « Quantitative Assessment of Citric Acid in Lemon Juice, Lime Juice, and Commercially-Available Fruit Juice Products », Journal of Endourology, vol. 22, no 3, , p. 567-570 (PMID 18290732, PMCID 2637791, DOI 10.1089/end.2007.0304, lire en ligne).
- (en) Walid A. Lotfy, Khaled M. Ghanem et Ehab R. El-Helow, « Citric acid production by a novel Aspergillus niger isolate: II. Optimization of process parameters through statistical experimental designs », Bioresource Technology, vol. 98, no 18, , p. 3470-3477 (PMID 17317159, DOI 10.1016/j.biortech.2006.11.032, lire en ligne).
- (en) Marin Berovic et Matic Legisa, « Citric acid production », Biotechnology Annual Review, vol. 13, , p. 303-343 (PMID 17875481, DOI 10.1016/S1387-2656(07)13011-8, lire en ligne).
- (en) Zachary D. Blount, Christina Z. Borland et Richard E. Lenski, « Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no 23, , p. 7899-7906 (PMID 18524956, PMCID 2430337, DOI 10.1073/pnas.0803151105, JSTOR 25462703, Bibcode 2008PNAS..105.7899B, lire en ligne).
- (en) Y.-Y. Hu, A. Rawal et K. Schmidt-Rohr, « Strongly bound citrate stabilizes the apatite nanocrystals in bone », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 52, , p. 22425-22429 (PMID 21127269, PMCID 3012505, DOI 10.1073/pnas.1009219107, lire en ligne).
- Ryan, P. R., James, R. A., Weligama, C., Delhaize, E., Rattey, A., Lewis, D. C., … et Fettell, N. A., Can citrate efflux from roots improve phosphorus uptake by plants? Testing the hypothesis with near‐isogenic lines of wheat, Physiologia Plantarum, 2014, 151 (3), 230-242, DOI 10.1111/ppl.12150.
- Parlement européen et Conseil de l'Europe, « La Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », Journal officiel de l'Union européenne, no L 61, , p. 1-56 (lire en ligne [PDF]).
- http://www.gmo-compass.org/eng/database/e-numbers/206.citric_acid.html
- « Le retour du « tract de Villejuif » sur le Web », sur INC 60 millions de consommateurs, .
- (en) Maryadele J. O'Neil, Ann Smith, Patricia E. Heckelman et Susan Budavari, The Merck Index: An Encyclopedia of Chemicals, Drugs and Biologicals, États-Unis, Merck & Co Inc, , 13e éd., 2564 p. (ISBN 978-0-911910-13-1), 2350.
- Maria Papagianni, « Advances in citric acid fermentation by Aspergillus niger: Biochemical aspects, membrane transport and modeling », Biotechnology Advances, vol. 25, no 3, , p. 244–263 (ISSN 0734-9750, DOI 10.1016/j.biotechadv.2007.01.002, lire en ligne, consulté le ).
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=29181400 (consulté le ).
Annexes
Articles connexes
Liens externes
- (en) Citric Acid Compendium of Food Additive Specifications - Addendum 7 - Joint FAO/WHO Expert Committee on Food Additives 53rd session - Rome, 1-10 juin 1999


