Eau de chaux
L’eau de chaux est une solution saturée d’hydroxyde de calcium Ca(OH)2, produite en mélangeant de la chaux aérienne à de l’eau. La chaux se dissout (faiblement) dans l’eau et le filtrat obtenu constitue l’eau de chaux.

L'eau de chaux se trouble en présence de dioxyde de carbone CO2, qu'elle met en évidence. Le précipité blanc ainsi formé est du carbonate de calcium CaCO3. La réaction est la suivante :
ou, en écrivant les espèces sous forme ionique :
Fabrication
On peut en produire en petite quantité rapidement en faisant chauffer un morceau de craie à l'aide d'une flamme puis en diluant la poudre obtenue dans de l'eau. Filtrer ensuite le mélange obtenu à l'aide d'un filtre à café, ou au travers de plusieurs épaisseurs de papier absorbant dans un entonnoir. Cette méthode est souvent utilisée par les préparateurs des laboratoires de sciences de la vie et de la Terre (SVT).
- Le chauffage à la flamme décompose le calcaire de la craie (carbonate de calcium CaCO3, solide) en dioxyde de carbone CO2, gazeux, et chaux vive (oxyde de calcium CaO, solide).
- L'hydratation de la chaux vive donne la chaux éteinte (hydroxyde de calcium Ca(OH)2, solide) suivant l'équation suivante : CaO + H2O → Ca(OH)2.
- L'hydroxyde de calcium est dilué dans de l'eau, où il ne se dissout que très peu, en donnant une solution vraie Ca2+ + 2 HO−, et un excédent d'hydroxyde de calcium Ca(OH)2 non dissous qui reste en suspension dans l'eau. Cette première étape aboutit à un mélange blanchâtre appelé « lait de chaux ». Pour éliminer la fraction non dissoute en suspension, il faut ensuite filtrer le lait de chaux. On arrive finalement à l'eau de chaux limpide.
- Il faut cependant veiller à ne pas trop charger la solution en dioxyde de carbone. Un grand excès de dioxyde de carbone peut en effet conduire le précipité de CaCO3 à se redissoudre sous forme de bicarbonate HCO3− à la suite de la réaction : CaCO3 + CO2 + H2O → Ca2+ + 2 HCO3− ; la solution s'éclaircit alors.
Utilisations
Pédiatrie
L'eau de chaux était utilisée en pédiatrie pour atténuer les coliques du nourrisson. Dorvault recommandait une petite cuillère à café diluée dans le biberon. Cet usage est aujourd'hui proscrit. L'eau de chaux a en effet un pH de 12,5, elle peut créer des graves brûlures : peau, cornée, œsophage[1].
Elle est également l'un des composants principaux du liniment oléo-calcaire, nettoyant naturel utilisé pour les fesses de bébé après le change. Il est fortement déconseillé aux patients d'utiliser des préparations de liniment oléo-calcaire fabriquées « maison », puisque le liniment ne serait pas stabilisé, c'est-à-dire les deux phases ne se mélangeraient pas, majorant encore le risque de brûlures par l'eau de chaux pour le nourrisson[2].
Dans la littérature médicale, les publications sur PubMed concernant les accidents par brûlures oculaires ou cutanées proviennent en général des services d'urgence[3] - [4].
Pédagogie
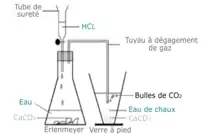
L'eau de chaux est fréquemment utilisée dans les cours et travaux pratiques de biologie, de géologie ou de chimie. Elle sert à la mise en évidence du dioxyde de carbone CO2 par barbotage (apparition d'un précipité blanc de carbonate de calcium CaCO3 (s)). On dit ainsi que « l'eau de chaux se trouble », mais cette expression révélatrice d'une conception répandue[5] est erronée puisque c'est le liquide contenant l'eau de chaux qui se trouble lors de l'apparition du précipité, l'eau de chaux ne pouvant changer de propriétés. Elle est également utilisée pour mettre en évidence la dissolution de carbonate de calcium (expérience de l'œuf cru qui rebondit[6], effervescence du calcaire, des coquillages, du corail et des écailles de moules, expérience du bâton de craie d'écolier qui mousse)[7], la présence de calcaire dans un sol[8].
Industrie
Le lait de chaux est beaucoup utilisé en traitement d'effluents industriels comme réactif de neutralisation des eaux acides permettant ainsi de précipiter les métaux lourds présents dans l'effluent.
En se dissociant, les ions HO− se lient aux métaux pour donner des hydroxydes métalliques insolubles en grande partie. Les ions Ca2+ peuvent se lier aux phosphates ou aux ions fluor éventuellement présents dans l'effluent pour donner du phosphate de calcium ou du fluorure de calcium CaF2.
De plus, le lait de chaux apporte une charge minérale qui permet d'obtenir des boues d'hydroxydes plus facilement filtrables dans un filtre-presse par exemple.
En terme pratique, le lait de chaux, utilisé en concentration de l'ordre de 50 à 70 g/L, par sa faible solubilité (de l'ordre de 1 g/L), oblige à mettre en œuvre des circuits de distribution en agitation constante pour éviter des dépôts qui durcissent et bouchent les tuyaux.
Construction
En construction, l’eau de chaux est intéressante pour l’humidification des supports, c’est particulièrement le cas, pour la réalisation des enduits fins (stucs, tadelakt…) ou d’un badigeon.
Horticulture
En horticulture, le lait de chaux appliqué sur le tronc des arbres est un excellent antiseptique qui détruit les larves des parasites nichant sous l'écorce des arbres fruitiers (notamment les carpocapses), ainsi que les champignons microscopiques, qui y passent également l'hiver en attendant de développer à la saison les redoutables maladies cryptogamiques (tavelure, cloque, moniliose, chancre, etc.).
Une application tous les deux ans au milieu de l'hiver sur les troncs pré-brossés et jusqu'aux premières branches constitue une protection efficace.
On le trouve en bidon prêt à l'emploi sous le nom de Blanc arboricole.
On l'applique aussi sur les parois en verre des serres pour baisser la luminosité en période estivale.
Cuisine
L'eau de chaux sert en outre dans un procédé culinaire, la nixtamalisation, pour améliorer la qualité nutritionnelle de certains aliments, comme le maïs. Les Asiatiques s'en servent pour préparer à la cuisson des fruits et des légumes qui, sans cette technique de trempage préalable, partiraient en compote. Cela permet aux légumes ou aux fruits, une fois cuits, de rester fermes donc présentables, tout en étant cuits à l'intérieur.
Autrefois, on conservait les œufs (pendant des mois) en les plongeant dans une solution de chaux aérienne.
Notes et références
- François-Laurent-Marie Dorvault, L'Officine, ou Répertoire général de pharmacie pratique, , 11e éd.
- Liniment oléo-calcaire, Pharmacopée française, 10e éd.
- (en) Shirzadeh E., « Bilateral chemical burns of the cornea due to limewater: a specific case », sur ncbi.nlm.nih.gov, (consulté le ).
- (en) Lipski M., Buczkowska-Radlińska J. et Góra M., « Loss of sight caused by calcium hydroxide paste accidentally splashed into the eye during endodontic treatment: case report », sur ncbi.nlm.nih.gov, (consulté le ).
- André Laugier et Alain Dumon, « Obstacles épistémologiques et didactiques à la construction du concept d'élément chimique : quelles convergences ? », Didaskalia, no 22, (ISSN 1250-0739, DOI 10.4267/2042/23921, lire en ligne, consulté le )
- « Comment un œuf cru peut-il rebondir? », sur wikidebrouillard.org, .
- L'expérience consiste à placer le coquillage, le corail, les écailles de moules ou la craie dans un verre rempli de vinaigre. Tous ces objets dégagent du CO2 qui « trouble l'eau de chaux ».
- G. Lannoy, Mon grand livre d'expériences, Chantecler, , p. 84.