Fluorure de calcium
Le fluorure de calcium est un composé inorganique de formule CaF2. Ce composé ionique constitué de calcium et de fluor est présent naturellement dans la nature sous la forme de fluorine (appelée aussi fluorite). C'est la principale source mondiale en fluor. C'est un solide insoluble dans l'eau, dont la structure est cubique où chaque atome de calcium est adjacent à huit atomes de fluor, et chaque atome de fluor à quatre atomes de calcium[3]. Si les échantillons purs sans défauts sont transparents (et utilisé en verrerie optique pour leur transparence dans la gamme allant des ultra-violets aux infra-rouge moyens), le minéral naturel est souvent profondément coloré à cause de la présence de centre de couleur.
| Fluorure de calcium | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | fluorure de calcium | |
| No CAS | ||
| No ECHA | 100.029.262 | |
| No CE | 232-188-7 | |
| No RTECS | EW1760000 | |
| PubChem | 24617 | |
| SMILES | ||
| InChI | ||
| Apparence | solide cristallin blanc | |
| Propriétés chimiques | ||
| Formule | CaF2 [Isomères] |
|
| Masse molaire[1] | 78,075 ± 0,004 g/mol Ca 51,33 %, F 48,67 %, |
|
| Propriétés physiques | ||
| T° fusion | 1 402 °C[2] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Cristallographie
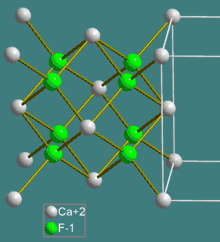
Le fluorure de calcium cristallise dans le système cristallin cubique, de groupe d'espace Fm3m (Z = 4 unités formulaires par maille conventionnelle)[4] :
- paramètre de maille : = 5,463 Å (volume de la maille V = 163,03 Å3) ;
- masse volumique calculée = 3,18 g/cm3.
La structure du fluorure de calcium correspond à un remplissage d'une structure hôte. Les anions F− forment un réseau cubique simple dans lequel les cations Ca2+ occupent la moitié des sites cubiques. Les cations et les anions ont à peu près la même taille. Il est aussi possible d'inverser les rôles des cations et des anions et de considérer que les cations Ca2+ forment un réseau hôte cubique à faces centrées et les anions F− occupent tous les sites tétraédriques. Ces deux visions sont équivalentes. La structure du fluorure de calcium peut être assimilée à deux sous-réseaux : les cations Ca2+ forment un sous-réseau cubique à faces centrées et les anions F− forment un sous-réseau cubique primitif.
Dans la structure :
- la coordinence des cations Ca2+ est de 8 : cubes CaF8 ;
- la coordinence des anions F− est de 4 : tétraèdres FCa4.
Synthèse
La fluorine est répandue, abondante, il y a donc en général peu de raisons de vouloir synthétiser le CaF2. Du CaF2 à haute pureté peut être produit en traitant le carbonate de calcium par l'acide fluorhydrique[5] :
Utilisations
En laboratoire, le fluorure de calcium est couramment utilisé comme matériau transparent pour les rayonnements infrarouges et ultraviolets car il est transparent dans ces régions (transparence d’environ 0,15 μm à 9 μm) et possède un très faible indice de réfraction. De plus, ce matériau n'est attaqué que par peu de réactifs, et contrairement à d'autres sels ioniques utilisés comme matériaux optiques, tels que le bromure de potassium (KBr), il n'est pas hygroscopique et ne se trouble donc pas au fil du temps en absorbant l'humidité de l'atmosphère. Il était autrefois utilisé comme matériau transparent en photolithographie-UV sur les semi-conducteurs utilisés pour la fabrication de circuits intégrés, mais à mesure que la taille des composés s'est réduite et donc que la longueur d'onde utilisée s'est réduite, il a été abandonné car son indice de réfraction présente pour des longueurs d'onde inférieures à 157 nm une non-linéarité importante pour des hautes densités de puissance, ce qui le rend inutilisable pour ce type d'application. Au début du XXIe siècle le marché du fluorure de calcium s'est effondré, et de nombreuses industries ont fermé. Canon et d'autres fabricants ont utilisé des cristaux synthétiques de fluorure de calcium pour faciliter la conception d'objectifs apochromatiques et réduire la dispersion de la lumière. Ce type de lentille a depuis largement été surpassé par de nouveaux types de verre et des conceptions assistées par ordinateur. Comme matériau optique infra-rouge, il reste couramment utilisé et été désigné par Kodak sous le nom commercial de « Irtran-3 », mais cette dénomination est à présent obsolète.
Le fluorure de calcium dopé à l'uranium a été le second laser solide (en) inventé dans les années 1960 : Peter Sorokin et Mirek Stevenson des laboratoires IBM de Yorktown Heights (US) ont réussi à obtenir avec ce matériau un laser d'une longueur d'onde de 2,5 μm, peu après le laser à rubis de Theodore Maiman.
Le fluorure de calcium est également utilisé comme flux de fusion et liquide traitement du fer, de l'acier et de leurs composites. Son action est basée sur son point de fusion similaire à celui du fer, sa capacité à dissoudre les oxydes et sa capacité à mouiller les oxydes et les métaux.
Source de HF
Le fluorure de calcium naturel est la principale source de fluorure d'hydrogène, un composé chimique utilisé dans la production de nombreux types de composés. Il est libéré du minéral après réaction avec de l'acide sulfurique concentré :
Le HF produit est ensuite converti en fluor, en fluorocarbures et autres composés fluorés.
Sécurité
Si les fluorures sont toxiques pour les humains, le CaF2 est considéré relativement inoffensif du fait de son extrême insolubilité dans l'eau. Cette situation est similaire au cas du BaSO4 où l'importante toxicité associé à la présence d'ions Ba2+ est diminué par la faible solubilité du composé.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « 7789-75-5 », sur http://www.chemicalbook.com
- G. L. Miessler and D. A. Tarr “Inorganic Chemistry” 3rd Ed, Pearson/Prentice Hall publisher, (ISBN 0-13-035471-6).
- (en) B.T.M. Willis, « The anomalous behaviour of the neutron reflexions of fluorite », Acta Cryst., vol. 18, no 1, , p. 75-76 (DOI 10.1107/S0365110X65000130)
- (en) Jean Aigueperse et Paul Mollard, Didier Devilliers, Marius Chemla, Robert Faron, Renée Romano, Jean Pierre Cuer, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a11_307), « Fluorine Compounds, Inorganic »
Liens externes
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Calcium fluoride » (voir la liste des auteurs).
