Uranium
L’uranium est l'élément chimique de numéro atomique 92, de symbole U. Il fait partie de la famille des actinides.
L'uranium est le 48e élément naturel le plus abondant dans la croûte terrestre, son abondance est supérieure à celle de l'argent, comparable à celle du molybdène ou de l'arsenic, mais quatre fois inférieure à celle du thorium. Il se trouve partout à l'état de traces, y compris dans l'eau de mer.
C'est un métal lourd radioactif (émetteur alpha) de période très longue (~ 4,468 8 milliards d'années pour l'uranium 238 et ~ 703,8 millions pour l'uranium 235). Sa radioactivité, additionnée à celle de ses descendants dans sa chaîne de désintégration, développe une puissance de 0,082 watt par tonne d'uranium, ce qui en fait, avec le thorium 232 (quatre fois plus abondant, mais trois fois moins radioactif) et le potassium 40, la principale source de chaleur qui tend à maintenir les hautes températures du manteau terrestre, en ralentissant de beaucoup son refroidissement.
L'isotope 235U est le seul isotope fissile naturel. Sa fission libère une énergie voisine de 202,8 MeV par atome fissionné dont 9,6 MeV d'énergie non récupérable, communiquée aux neutrinos produits lors de la fission. L'énergie récupérable est plus d'un million de fois supérieure à celle des combustibles fossiles pour une masse équivalente. De ce fait, l'uranium est devenu la principale matière première utilisée par l'industrie nucléaire.
La production mondiale d'uranium s'est élevée à 54 742 tonnes en 2019, réparties pour l'essentiel entre le Kazakhstan (41,7 %), le Canada (12,7 %), l'Australie (12,1 %), la Namibie (10 %), l'Ouzbékistan (6,4 %), le Niger (5,4 %), la Russie (5,3 %) et la Chine (3,4 %). En 2020, la production a chuté à 47 731 tonnes. Pour son utilisation dans les réacteurs nucléaires, les ressources récupérables à un coût inférieur à 130 dollars/kg d'uranium étaient estimées en 2019 par l'AIEA à 6,15 millions de tonnes dans le monde, réparties essentiellement entre l'Australie (28 %), le Kazakhstan (15 %), le Canada (9 %), la Russie (8 %) et la Namibie (7 %).
Uranium naturel
Le minerai d'uranium exploité dans des gisements granitiques ou sédimentaires possède une teneur moyenne en uranium pouvant varier de 0,1 % à 2 %[6], pouvant exceptionnellement approcher les 20 %[7]. L'uranium est dit naturel quand il est constitué d'isotopes dans leur proportion d'origine (identique pour tous les minerais d'uranium) : soit 99,2743 % d'uranium 238 accompagné de 0,7202 % d'uranium 235 et d'une quantité infime d'isotope 234 (0,0055 %).
Découverte


L'uranium fut mis en évidence en 1789 par le chimiste prussien Martin Heinrich Klaproth à partir de l'analyse d'un morceau de roche qu'on lui avait apporté de la mine de Saint Joachimsthal[8]. Cette roche était de la pechblende, un minerai d'uranium qui contient principalement de l'U3O8. Klaproth parvint en la chauffant à en extraire un corps gris métallique. Dans sa communication du à l'Académie royale prussienne des sciences et intitulée « Ueber den Uranit, ein neues Halbmetall[n 1] », il proposa le nom d'« urane » ou « uranite » au composé qu'il venait d'identifier (un oxyde d'uranium et non le corps pur), en référence à la découverte de la planète Uranus faite par William Herschel en 1781[9]. Cet oxyde, rebaptisé uranium en 1790, avait comme propriété de donner une fine fluorescence aux verres et une couleur jaune verdâtre aux émaux, si bien que la pechblende était extraite de la mine de Joachimsthal et de mines d'étain en Cornouaille et des uranates alcalins utilisés (diuranate d'ammonium et de sodium) par les verriers de Bohême et les céramistes saxons[10].

Ce n'est qu'en 1841 que le chimiste français Eugène-Melchior Péligot put l'isoler à l'état de pureté en réduisant le tétrachlorure d'uranium (UCl4) par le potassium. Il établit que l'urane était composé de deux atomes d'oxygène et d'un métal qu'il isola. L'uranium entra dans la nomenclature de la chimie. Il estima alors[11] la masse volumique de l'uranium à 19 g/cm3.
Le Français Henri Becquerel ne découvrit la radioactivité de l’uranium que beaucoup plus tard, le , lorsqu'il constata que des plaques photographiques placées à côté de sels d'uranium (extraits d'un lot de pechblende de Joachimsthal) avaient été impressionnées sans avoir été exposées à la lumière. Les plaques avaient été noircies par les rayonnements émis par les sels : c'était la manifestation d'un phénomène jusqu'alors inconnu, la radioactivité naturelle. Pierre et Marie Curie isolèrent deux éléments nouveaux naturellement radioactifs, le polonium et le radium.
Gisements et exploitation
Le minerai d'uranium est appelé uraninite, ou pechblende. Les cinq plus gros producteurs au monde sont le Kazakhstan, le Canada, l'Australie, le Niger et la Namibie. À proximité des mines, l'uranium est concentré sous forme de yellowcake[12]. Il est néanmoins trop peu concentré en isotope fissile pour être utilisé directement dans les centrales nucléaires de type à eau pressurisée (PWR, pour pressurized water reactor). C'est la raison pour laquelle il est souvent enrichi en uranium 235 par diffusion gazeuse ou centrifugation. Les centrales de type CANDU utilisent l'uranium non enrichi mais exigent beaucoup d'eau lourde comme modérateur.
Un Centre de recherche sur la géologie de l'uranium (Cregu) a été créé dans les années 1980, à Vandœuvre-lès-Nancy pour mieux connaitre la géologie et la géochimie de l'uranium et faciliter l'accès des prospecteurs à cette ressource[13], par exemple en le reliant aux discordances géologiques connues ou à découvrir[14].
Au niveau mondial, l'uranium est extrait à 57%[15] au moyen du procédé de lixiviation in situ qui consiste à injecter une solution acide dans le gisement, puis à la pomper par un autre puits[16].
Abondance et répartition
L'uranium est répandu dans les profondeurs du globe terrestre. La désintégration d'uranium 238 et 235 et d'autres radionucléides[n 2] comme le thorium 232 et le potassium 40 entretient encore en énergie thermique le noyau terrestre, mais surtout[n 3] le manteau rocheux terrestre, et donc toute la géothermie.
L'uranium est le 48e élément naturel le plus abondant dans la croûte terrestre[17]. Il est plus abondant dans la nature que l'or ou l'argent[18].
Il est également présent dans toute l'écorce terrestre, surtout dans les terrains granitiques et sédimentaires, à des teneurs d'environ 2,7 g/t[19] (soit 2,7 ppm). Ainsi, le sous-sol d'un jardin sur un carré de 20 m de côté peut-il en contenir, sur une profondeur de 10 m, environ 24 kg, ce qui fait de l'ordre du millier de milliards de tonnes rien que pour l'écorce terrestre, sans compter le manteau.
En termes de réserve mondiale, cependant, l'immense majorité de cette masse est inexploitable dans les conditions économiques actuelles. La teneur du minerai varie beaucoup selon les roches, de 0,1 ppm dans les carbonates à 350 ppm dans les phosphates[20].
L'eau de mer contient environ 3,3 mg d'uranium par mètre cube selon le CEA et la COGEMA[21], soit 4,5 milliards de tonnes d'uranium dissous dans les océans.
Les eaux douces en contiennent souvent aussi en diverses concentrations. La concentration moyenne du Rhône en uranium est de 0,5 μg/l (soit un demi-milligramme par mètre cube). La masse d’uranium transitant chaque jour dans le Rhône peut ainsi être estimée à environ 80 kg[22], soit près de trente tonnes par an, provenant essentiellement du ruissellement des roches uranifères des Alpes.
Les ressources dites « identifiées » récupérables à un coût inférieur à 260 dollars/kg U étaient évaluées en 2019 à 8 070 kt, dont 4 724 kt de réserves « raisonnablement assurées » et 3 346 kt de réserves « présumées » (en anglais : inferred). Les ressources récupérables à un coût inférieur à 130 dollars/kg U étaient évaluées à 6 148 kt[b 1], dont 27,5 % en Australie, 14,7 % au Kazakhstan, 9,2 % au Canada, 7,9 % en Russie, 7,3 % en Namibie, 5,2 % en Afrique du Sud, 4,5 % au Brésil, 4,5 % au Niger, 4 % en Chine, 2,3 % en Mongolie, 2,2 % en Ouzbékistan, etc (seulement 0,8 % aux États-Unis)[b 2]. Des ressources additionnelles (« présagées » et « spéculatives ») sont estimées à 5 614 kt, dont 23 % en Mongolie, 12,5 % au Canada, 12 % en Afrique du Sud, 9,6 % en Russie, 9 % au Brésil, 6,7 % en Ukraine et 5,7 % au Vietnam[b 3].
| Rang | Pays | Réserves 2007 | % | Réserves 2013 | % | Réserves 2019 | % |
| 1 | 725 | 22,0 | 1 706 | 29 | 1 693 | 28 | |
| 2 | 378 | 11,5 | 679 | 12 | 907 | 15 | |
| 3 | 329 | 10,0 | 494 | 8 | 565 | 9 | |
| 4 | 172 | 5,2 | 506 | 9 | 486 | 8 | |
| 5 | 176 | 5,3 | 383 | 6 | 448 | 7 | |
| 6 | 284 | 8,6 | 338 | 6 | 321 | 5 | |
| 7 | 157 | 4,8 | 276 | 5 | 276,8 | 4,5 | |
| 8 | 243 | 7,4 | 405 | 7 | 276,4 | 4,5 | |
| 9 | nd | nd | 199 | 4 | 249 | 4 | |
| 10 | nd | nd | nd | nd | 143 | 2 | |
| ... | |||||||
| 16 | 334 | 10,3 | 207,4 | 4 | 47,9 | 1 | |
| Total monde | 3 300 | 100 | 5 903 | 100 | 6 148 | 100 |
| Pays | 2004 | 2014 | Variation 2014/2004 (%) |
% 2014 | 2019 | Variation 2019/2014 (%) |
% 2019 | 2020 | |
| 1 | 3 719 | 23 127 | +522 | 41,1 | 22 808 | -1,4 | 41,7 | 19 477 | |
| 2 | 11 597 | 9 134 | −21 | 16,2 | 6 938 | -24 | 12,7 | 3 885 | |
| 3 | 8 982 | 5 001 | −44 | 8,9 | 6 613 | +32 | 12,1 | 6 203 | |
| 4 | 3 038 | 3 255 | +7 | 5,8 | 5 476 | +68 | 10,0 | 5 413 | |
| 5 | 2 016 | 2 400 | +19 | 4,3 | 3 500 | +46 | 6,4 | 3 500 | |
| 6 | 3 282 | 4 057 | +24 | 7,2 | 2 983 | -26 | 5,4 | 2 991 | |
| 7 | 3 200 | 2 990 | −7 | 5,3 | 2 911 | -3 | 5,3 | 2 846 | |
| 8 | 750 | 1 500 | +100 | 2,7 | 1 885 | +26 | 3,4 | 1 885 | |
| 9 | 800 | 926 | +16 | 1,7 | 800 | -14 | 1,5 | 400 | |
| 10 | nd | 573 | 1,0 | 346 | -40 | 0,6 | 250 | ||
| 11 | nd | 385 | 1,0 | 308 | -20 | 0,6 | 400 | ||
| 12 | nd | 573 | 1,0 | 71 | -88 | 0,1 | 71 | ||
| 13 | 878 | 1 919 | +119 | 3,4 | 58 | -97 | 0,1 | 6 | |
| Total mondial | 40 178 | 56 041 | +40 | 100 | 54 742 | -2,3 | 100 | 47 731 |
En 2017, la production mondiale est proche de 60 000 tonnes auxquels s'ajoutent 17 000 tonnes de ressources de « deuxième main » (combustible retraité MOX, militaire…), alors que la consommation d'uranium stagne autour de 65 000 tonnes/an ; le cours du minerai a été divisé par deux en 2016 et les principaux producteurs réduisent fortement leur production[25].
La production industrielle a commencé après 1945 pour atteindre 10 000 t/an dès 1953, 50 000 t en 1958, décroit jusqu'à 30 000 t en 1965, remonte jusqu’à un plateau de 65 000 en 1980, redescend jusqu’à 30 000 t dans les années 1990 et remonte dans les années 2000.
La production mondiale 2012 était estimée par l'AIEA à 58 816 tonnes d'uranium, dont 36 % extraites du Kazakhstan, 15 % du Canada, 12 % de l'Australie, 8,2 % du Niger, 7,9 % de Namibie, 5 % de Russie, 4 % d'Ouzbékistan et 3 % des États-Unis[26]. Des estimations plus récentes de l'Association nucléaire mondiale évaluent la production 2015 à 60 514 tonnes U, dont 39 % du Kazakhstan, 22 % du Canada, 9 % de l'Australie, 7 % du Niger, 5 % de Russie, 5 % de Namibie, 4 % d'Ouzbékistan, 3 % de Chine et 2 % des États-Unis[27].
Le Kazakhstan a connu une forte hausse de production dans les années 2000, passant de 3 300 t en 2001 à 17 803 t en 2003. Cette hausse s'est poursuivie en faisant du pays le leader du marché avec 33 % de la production mondiale (soit 17 803 tonnes en 2010)[28] et d'importantes réserves minières (17 % de la réserve mondiale). Selon l'OCDE, l'intensification de la production de ce pays a permis une augmentation de plus de 25 % de la production mondiale de 2008 à 2010[29].
L'uranium est une ressource non renouvelable (comme tous les métaux). Les réserves facilement accessibles sont en léger recul, mais il reste des réserves plus coûteusement accessibles pour 135 ans selon l'OCDE et l'AIEA[b 4]. La quantité d'énergie extractible à partir de l'uranium naturel pourrait théoriquement être multipliée jusqu'à près de cent fois[30] grâce à la surgénération et au retraitement, qui permettraient de fissionner l'uranium 238, beaucoup plus répandu que l'uranium 235.
Dans l'eau de mer et les eaux naturelles
Les concentrations en uranium (l'élément chimique uranium) dans les eaux « naturelles » sont les suivantes[31] :
- l'eau de mer : 3,3 µg/L ;
- le Rhône : 0,56 µg/L (débit annuel d’uranium = 29 t) ;
- l'Indus : 4,94 µg/L ;
- le Gange : 7 µg/L ;
- le fleuve Jaune : 7,5 µg/L.
Dans les eaux de boisson :
- eau de Badoit : 58 µg/L à la source, 5,45 µg/L après traitement[32] ;
- eau de Vichy : 20 µg/L[33].
Le seuil OMS pour les eaux de boisson était fixé jusqu'en 2011 à 15 µg/L[34], puis en 2011 la quatrième édition des « Directives pour la qualité de l'eau de boisson » l'a fixé à 30 µg/L[35].
Cinétique hydrogéologique
La solubilité de l’uranium est liée aux conditions d’oxydoréduction du milieu. Dans des conditions oxydantes (augmentation de la concentration en oxygène dissous), l’uranium devient plus facilement soluble (passage de la valence IV à la valence VI). Les conditions oxydantes favorisent la complexation de l’uranium en solution avec certains ligands[20]. Les principaux ligands sont, par ordre d’affinité décroissante :
- les carbonates ;
- les groupes hydroxyle ;
- les nitrates[36] ;
- les phosphates.
L’uranium présente une très forte affinité pour les oxyhydroxydes de fer[20]. Cette adsorption peut s’effectuer très rapidement lors de changements des conditions d’oxydoréduction, une diminution de la teneur en oxygène (condition réductrice) engendre une précipitation rapide de l’uranium sous forme d’oxyde (UO2)[20]. C'est une telle précipitation qui est par exemple à l'origine du gisement d'Oklo.
Synthèse chimique des fluorures d'uranium (UFx)
Deux étapes sont nécessaires à la synthèse :
- le raffinage :
- Le minerai d'uranium pulvérisé « yellowcake » — est dissous dans l'acide nitrique, fournissant une solution de nitrate d'uranyle UO2(NO3)2,
- Éventuellement filtration,
- Le nitrate d'uranyle pur est obtenu par extraction par solvant, avec une solution de TBP,
- cette étape permet d'obtenir un nitrate d'uranyle UO2(NO3)2 de grande pureté (>99,95 %) ;
- la conversion en elle-même :
- Précipitation du nitrate d'uranyle par l'ammoniac gazeux pour obtenir du diuranate d'ammonium (NH4)2U2O7 (DUA),
- Calcination du diuranate d'ammonium, vers 400 °C, pour produire l'UO3,
- Réduction de l'UO3 par l'hydrogène pour obtenir de l'UO2,
- Hydrofluoration d'UO2 par l'acide fluorhydrique HF dans un four pour produire du tétrafluorure d'uranium UF4,
- Réduction de l'UF4 avec du calcium finalement pour obtenir du métal pur.
 Yellowcake + nitrate d'uranyle.
Yellowcake + nitrate d'uranyle. + Diuranate.
+ Diuranate. + Dioxyde d'uranium.
+ Dioxyde d'uranium. Tetrafluorure d'uranium (UF4)
Tetrafluorure d'uranium (UF4) Uranium métallique
Uranium métallique
Propriétés
Propriétés radiologiques
L'uranium est un métal lourd radioactif (émetteur alpha) de période très longue (~ 4,468 8 milliards d'années pour l'uranium 238 et ~ 703,8 millions pour l'uranium 235). Sa radioactivité, additionnée à celle de ses descendants dans sa chaîne de désintégration, développe une puissance de 0,082 watt par tonne d'uranium, ce qui en fait, avec le thorium 232 (quatre fois plus abondant, mais trois fois moins radioactif) et le potassium 40, la principale source de chaleur qui tend à maintenir les hautes températures du manteau terrestre, en ralentissant de beaucoup son refroidissement[37].
Produit fissile naturel
L'uranium 235 est le seul nucléide naturel qui soit fissile (ou, très rarement, fissible), autrement dit il peut, par capture de neutron, se scinder en deux noyaux fils avec émission de neutrons (fission nucléaire). Par suite, l'uranium enrichi en cet isotope est aujourd'hui utilisé comme combustible nucléaire dans les réacteurs nucléaires (voir Cycle du combustible nucléaire) ou encore dans les armes nucléaires, que ce soient les bombes atomiques, ou comme amorce dans les bombes H.
Au contraire de l'uranium 235, l'uranium 238, lorsqu'il capture un neutron, ne fissionne pas (sauf neutrons rapides). Il devient de l'uranium 239 instable qui, par désintégration β−, va se transformer en neptunium 239. Or ce dernier est lui aussi radioactif β−, et va alors donner naissance à un nouveau noyau, le plutonium 239. Ce radioisotope est fissile, comme l'uranium 235. L'uranium 238 est un isotope fertile, qui peut produire des produits fissiles.
L'uranium 234 n'est, lui, ni fissile, ni fertile, et provient de la décomposition radioactive de l'uranium 238 comme indiqué dans la précédente section.
La fission d'un atome d'uranium 235 libère de l'ordre de 193,2 MeV[n 4] d'énergie récupérable en réacteur (la valeur exacte dépendant des produits de fission) et 9,6 MeV communiquée aux neutrinos inutiles et quasiment indétectables. De même, la fission d'un atome de plutonium 239 libère de l'ordre de 198,6 MeV[n 4] d'énergie récupérable et 8,6 MeV communiquée aux neutrinos. Ces valeurs sont à comparer avec celles de la combustion de carburants fossiles, qui libèrent de l'ordre de 5 eV par molécule de CO2 produit[38] : l'ordre de grandeur des énergies libérées par les combustibles nucléaires est un million de fois plus importante que celle des énergies fossiles chimiques.
Le potentiel d'énergie de l'uranium n'est exploité que très partiellement dans les réacteurs actuels, mais la différence reste nette : 1 kg d'uranium naturel permet la production d'environ 500 000 MJ[n 5] dans un réacteur conventionnel, à comparer avec les 49 MJ obtenus par 1 kg de gaz naturel, 45 MJ pour 1 kg de pétrole, et 20 à 30 MJ pour le charbon[39].
Isotopes de l'uranium naturel
L'uranium possède 26 isotopes connus, tous radioactifs, dont trois seulement sont présents à l'état naturel : 238U, 235U et 234U. On trouve dans une tonne d'uranium naturel pur 7,2 kg d'uranium 235 et 56 g d'uranium 234, le reste étant de l'uranium 238.
- Uranium 238 et uranium 235
Les isotopes 238U et 235U ont beaucoup d'applications, militaires notamment, mais aussi civiles, comme la datation de l'âge de la Terre à partir de la datation radiométrique par l'uranium-plomb ou par l'uranium-thorium.
Quelles que soient les teneurs en uranium des milieux, les proportions entre les deux principaux isotopes formant l'uranium naturel sont pratiquement les mêmes : 238U : 99,28 %, 235U : 0,72 %, 234U : 0,0056 %.
La proportion d'235U décroît à l'échelle des temps géologiques. Leur rapport de formation dans une supernova est de 1 à 1,65[40], c'était (approximativement) la proportion de l'uranium présent sur Terre il y a ~4,5 milliards d'années, ce qui est juste inférieur à l'âge de la formation de ces isotopes (voir Formation et évolution du système solaire).
Il y a deux milliards d'années, lors de la période de fonctionnement du réacteur nucléaire naturel d'Oklo, la proportion d'235U était encore de près de 4 %, ce qui a permis à ce gisement d'atteindre la criticité, lors de la précipitation des composés dissous formant le nouveau minerai.
- Uranium 234
Le troisième isotope, 234U, appartient à la chaîne de désintégration de l'238U.
L'isotope 234 est toujours présent sur Terre, à l'état de traces, bien qu'il ait une demi-vie de seulement 245 500 ans ; car il est constamment créé par désintégration radioactive de l'isotope 238 (après trois étapes : une transition α donnant 234Th, puis deux transitions β− donnant 234Pa, puis 234U). Quand il est à l'équilibre séculaire, la proportion entre 238U et 234U est égale au rapport des demi-vies, soit 0,0056 %.
Cependant, les rapports isotopiques peuvent varier légèrement d'un gisement à l'autre, entre 0,005 % et 0,006 % pour l'234U[41], du fait d'une légère différence de comportement dans le changement U6+↔ U4+[42]. Le rapport isotopique 234U/238U peut être perturbé par différents processus environnementaux, tandis que le rapport 235U/238U reste assez largement constant[18].
- Autres isotopes
L'industrie nucléaire produit deux autres isotopes artificiels de l'uranium, relativement stables à échelle humaine :
- l'isotope 236 est produit en réacteur par irradiation de l'isotope 235, qui dans près de 18 % des cas ne fissionne pas mais absorbe un neutron. Il tend à s'accumuler dans l'uranium de recyclage, dont il augmente fortement la radioactivité, et dont (étant neutrophage) il diminue le potentiel énergétique. Bien qu'ayant une demi-vie de 23 millions d'années, presque du centuple de celle de l'isotope 234, cet isotope a disparu depuis longtemps dans la nature. Son produit est du thorium 232, qui s'est « confondu » avec le thorium 232 « initial » et se trouve à présent majoritairement sous cette forme ainsi que des éléments de sa chaîne de désintégration ;
- l'isotope 233 est un élément fissile produit en réacteur par irradiation du thorium. Il est à la base du cycle du thorium. Sa demi-vie de 159 000 ans est largement supérieure à celle du plutonium.
Activité massique
L'uranium pur est radioactif, son activité massique dépendant à la fois de son enrichissement, et de la fraîcheur de sa purification chimique.
Si l'on considère les isotopes purs de l'uranium, 238U a une activité massique de 12,4 Bq/mg, 235U de 80 Bq/mg, et 234U de 230 Bq/µg, soit 230 000 Bq/mg — quatre ordres de grandeur au-dessus des précédents.
- L'uranium naturel, quand il est chimiquement purifié (essentiellement composé de 235U et de 238U en équilibre avec son descendant 234U), a une activité spécifique de l'ordre de 25 Bq/mg. En amont, à poids égal d'uranium, la radioactivité d'un minerai, où il est en équilibre avec tous les éléments radioactifs de sa chaîne de désintégration, est naturellement 3 (si le radon peut s'échapper) à 7 fois plus importante.
- L'uranium enrichi est plus actif, partiellement du fait de l'activité plus importante de 235U (6,33 fois plus radioactif que l'238U), mais surtout à cause de la concentration différentielle en 234U (10 000 fois plus radioactif que 238U), toujours présent à l'état de traces dans la chaîne de désintégration de l'isotope 238. Elle atteint typiquement 2 500 Bq/mg pour un enrichissement de 90 % (uranium dit de qualité militaire). Pour les enrichissements de l'ordre de 3 %, destinés aux centrales nucléaires, l'activité spécifique est de l'ordre de 60 Bq/mg.
- Inversement, l'uranium appauvri est presque entièrement débarrassé non seulement de sa fraction de l'isotope 235, mais également de son descendant l'isotope 234. Immédiatement après l'enrichissement, son activité massique tend à se rapprocher de celle de 238U pur, c'est-à-dire de l'ordre de 12,5 Bq/mg (en pratique, un peu plus du fait de la présence résiduelle d'235U). Cependant, l'équilibre entre 238U et ses deux premiers descendants (le thorium 234 de période 24 jours, et le protactinium 234) est atteint rapidement, en 2 mois. La radioactivité spécifique à l'équilibre (avec ses deux premiers descendants) étant déjà de 41,5 Bq/mg[43].
Sections efficaces
Aux neutrons thermiques, avec :
σa= section efficace d'absorption (= capture + fission le cas échéant)
σf= section efficace de fission
À 20 °C :
233U : σa = 585,9 barns ; σf = 532,8 barns
235U : σa = 676,1 barns ; σf = 568,4 barns
238U : σa = 2,72 barns
À 240 °C :
233U : σa = 587,3 barns ; σf = 534,9 barns
235U : σa = 647,0 barns ; σf = 543,1 barns
238U : σa = 2,60 barns
À 300 °C :
233U : σa = 588,9 barns ; σf = 536,1barns
235U : σa = 642,4 barns ; σf = 538,8 barns
238U : σa = 2,58 barns
Propriétés chimiques

De symbole U, l'uranium est le dernier élément naturel du tableau périodique. Chaque atome d'uranium possède 92 protons et entre 125 et 150 neutrons.
À l'état pur, l'uranium solide est un métal radioactif gris à blanc (voire argenté), qui rappelle la couleur du nickel. Il est dur et très dense. De plus, l'uranium est l'atome le plus lourd (qui contient le plus de nucléons) présent naturellement sur la Terre.
En raison de son affinité pour l'oxygène, l'uranium s'enflamme spontanément dans l'air à température élevée, voire à température ambiante lorsqu'il se trouve sous forme de microparticules. Il est pyrophorique.
L’uranium a quatre valences possibles (+III à +VI), les valences IV et VI étant les plus répandues dans les minerais. Les conditions de passage de la valence IV à la valence VI dépendent du potentiel d'oxydoréduction du milieu[20].
Ainsi dans la nature, l'élément uranium se retrouve toujours combiné à d’autres éléments, tels l'oxygène, l'azote, le soufre, le carbone sous forme d'oxydes, de nitrates, de sulfates ou de carbonates. On le trouve, par exemple, combiné à l'oxygène dans l'uraninite et la pechblende, deux des principaux minerais d'uranium, constitués d'oxyde uraneux (UO2).
Enfin, les ions uranyle UO22+ se dissolvent très bien dans la plupart des acides, comme dans l'acide nitrique HNO3 ou l'acide fluorhydrique HF en donnant des sels d'uranyle tels que le nitrate d'uranyle UO2(NO3)2. L'équation de la dissolution de l'ion uranyle en sel d'uranyle dans l'acide nitrique est la suivante :
Dérivés organo-uraniens
Comme la plupart des métaux, l'uranium a une chimie organométallique et de nombreux complexes organométalliques, tels l'uranocène, sont connus.
Applications
Utilisations historiques

Le minerai d'uranium a été utilisé comme pigment dans la verrerie, la céramique et la faïence, sous forme de diuranate de sodium ou d'ammonium[18]. Dans le verre, l'uranium est typiquement utilisé à des concentrations de 0,1 % à 2 % en masse pour produire de l'ouraline, solide d'un jaune fluorescent ou légèrement vert facile à identifier[18]. Il a été utilisé pour colorer des céramiques dentaires à de très faibles concentrations[18]. Il produit une pigmentation jaune à faibles concentrations, puis crème, orange, brune, verte, ou noire, quand la concentration augmente[18].
Il sert également de catalyseur dans certaines réactions chimiques spécialisées et dans des films photographiques[18].
L'uranium appauvri a également été utilisé pour ces emplois physico-chimiques[18]. Sous forme d'acétate d'uranyle et de zinc (réactif de Blanchetière), il donne des cristaux jaune-vert fluorescents avec les ions sodium Na+. Il permet donc de caractériser facilement ce métal lors des analyses en chimie minérale.
En métallurgie, il a été utilisé comme élément d’alliage dans la fabrication d'aciers rapides. D'appréciables quantités de ferrouranium ont été produites entre 1914 et 1916[44]. À la fin des années 1950, l'apparition d'importants stocks d'uranium appauvri aux États-Unis relance la recherche sur la production et l'utilisation d'alliages d'acier contenant de l'uranium, mais aucun débouché majeur n'est identifié[45].
Industrie nucléaire
Historiquement, la première utilisation du minerai d'uranium par l'industrie nucléaire a été d'en extraire le radium, pour des applications médicales.
Le principal usage contemporain de l'uranium exploite ses propriétés nucléaires.
- L'uranium 235 est le seul isotope fissile naturel, ce qui permet l'exploitation de l'uranium dans les réacteurs nucléaires (après un éventuel enrichissement), ainsi que pour la fabrication d'armes nucléaires (après un fort enrichissement).
- L'uranium 238 est à la fois fissible dans les réacteurs à neutrons rapides, et fertile : par capture neutronique, il se transforme finalement en plutonium 239, fissile. Il est envisagé d'exploiter cette double possibilité dans le cycle du combustible nucléaire, pour des cycles fondés sur la combustion du plutonium.
- L'uranium 233, qui peut être artificiellement produit par irradiation du thorium, est également fissile en neutrons thermiques. Cette possibilité est à la base d'un cycle surgénérateur fondé sur le thorium.
Contrôle des matières nucléaires
L'uranium est une matière nucléaire dont la détention est réglementée (Article R1333-1 du code de la défense).
Uranium appauvri
L'uranium appauvri, un sous-produit de l'enrichissement de l'uranium, est remarquable par sa dureté et sa densité.
Usage militaire
L'uranium appauvri n'est pas employé pour son aspect radioactif mais pour ses propriétés mécaniques. Il est pyrophorique, employé comme arme antichar dotée d'un fort pouvoir à la fois pénétrant et incendiaire : à très haute vitesse, il perfore aisément les blindages en s'enflammant lors de l'impact, provoquant un incendie qui fait exploser le véhicule touché. Ainsi, des munitions à base d'uranium appauvri (obus de 20 à 30 mm des avions ou hélicoptères chasseurs de chars) ont été utilisées lors des guerres du Golfe (guerre du Koweït et guerre en Irak) et du Kosovo. L'uranium appauvri est également utilisé pour faire des plaques de blindages[18].
Concernant sa toxicité, l'Organisation Mondiale de la Santé précise que "Dans les zones de conflit où l’uranium appauvri a été utilisé, il n’est pas nécessaire de soumettre les populations à un dépistage ou à un contrôle généralisé des effets éventuels sur leur santé. Les personnes qui pensent avoir été exposées à des doses excessives doivent aller consulter leur médecin qui les examinera, les traitera si elles ont des symptômes et assurera le suivi"[46]. Concernant les militaires, les études de suivi des vétérans blessés par des fragments d'uranium appauvri, encore inclus dans leur organisme, révèlent des "concentrations décelables d’uranium appauvri dans leurs urines, mais sans effet indésirable apparent pour la santé"[46]. Plus de 95% de l'uranium pénétrant dans l'organisme n'est pas absorbé et est éliminé via les selles et les urines (en 24 heures pour l'uranium sanguin)[46].
Usage civil
L'uranium appauvri constitue un combustible nucléaire appelé « combustible MOX » lorsqu'il est complété par du plutonium. Il sert d'élément fertile dans les réacteurs, où l'238U se transforme par irradiation en 239Pu fissile. Le MOX contribue ainsi au recyclage du plutonium.
L'uranium appauvri a autrefois été utilisé comme contrepoids en aviation, sur les premiers Boeing 747, les McDonnell Douglas DC-10, les Lockheed L-1011 TriStar par exemple[18], ce qui pose le problème du recyclage de ces avions qui, pour beaucoup, arrivent en fin de vie. Dans cet emploi, il est progressivement remplacé par le tungstène[18]. La quille de certains voiliers de compétition a contenu de l'uranium appauvri avant que la réglementation n'interdise son usage. Il enfin utilisé pour les écrans de protection radiologique où il est également plus efficace que le plomb[18].
Concernant sa toxicité, « l’exposition excessive des professionnels à l’uranium appauvri par ingestion est improbable là où des mesures de sécurité ont été prises pour le lieu de travail »[46]. « Les études à long terme portant sur des professionnels exposés à l’uranium ont signalé certains troubles de la fonction rénale selon l’intensité de l’exposition. Il semblerait néanmoins d’après certaines données que ces troubles puissent être transitoires et que la fonction rénale revienne à la normale après élimination de la source d’une exposition excessive »[46].
Imprégnation des populations humaines
Elle est a priori plus élevée dans les régions de mines d'uranium et chez les travailleurs de l’industrie nucléaire (en particulier impliqués dans l'extraction, le raffinage, la production de combustible nucléaire et son retraitement). Certains militaires (exposés aux vapeurs ou particules de munitions à uranium appauvri ont aussi été potentiellement exposés, sachant que par exemple 20 261 militaires français ont participé aux opérations extérieures dans le Golfe Persique en 1990-1991), potentiellement susceptibles d'avoir développé un « syndrome de la guerre du Golfe »[47] ; dans les années 1990-2000, les auteurs n’ont souvent pas particulièrement retenu le rôle de l’uranium appauvri dans ce syndrome [48] - [49] - [47]
Ces personnes sont plus exposés au risque d'incorporation d'uranium, principalement par inhalation, ingestion, ou à la suite d'une blessure[50]. On cherche rétrospectivement à reconstituer[51] leur niveau d'exposition à l'uranium pur, et/ou aux composés suivants : NU (Nitrate d'uranyle) ; UF6 (Hexafluorure d’uranium) ; UF4 (Tétrafluorure d'uranium) ; U – TBP (tributylphosphate d'uranium) ; DAU (Diuranate d'ammonium) ; UO2F2 (Fluorure d'uranyle) ; UO2 (Dioxyde d'uranium) ; UO3 (Trioxyde d'uranium) ; UO4 (Tétraoxyde d'uranium) ; UF6 (Hexafluorure d'uranium) ; Effluents uranifères acides ; U3O8 (Sesquioxyde d'uranium) ; UO2F2 (Fluorure d'uranyle...)[52].
Au milieu des années 2000-2010, si les effets de l’irradiation externe sont déjà bien explorés via l'épidémiologiques à grande échelle[53], les effets (en termes de risque de cancer notamment)[54] - [55] de l'exposition interne induite par l’incorporation des particules d'uranium (et d'autres éléments émetteurs alpha) sont encore mal évalués[56]. En France AREVA a développé en son sein le projet Alpha risk project dans cet esprit[57]. Le tabagisme et l'ingestion de boissons alcoolisées sont aussi des sources d'intégration d'uranium[54].
En 2018 en France le « Volet périnatal » du programme national de biosurveillance a publié une évaluation de l'imprégnation des femmes enceintes dont pour l'uranium (et douze autres métaux ou métalloïdes ainsi que quelques polluants organiques). Le dosage de l'uranium a été fait dans les urines de 990 femmes enceintes au moment de leur arrivée à la maternité. Elles faisaient toutes partie de la « Cohorte Elfe », un pannel ne comprenant que des femmes ayant accouché en France en 2011 hors Corse et TOM[58]. Seules 28 % de ces 990 femmes présentaient une quantité détectable d'uranium dans leurs urines (95e centile de la distribution : 20,8 μg/L, pour 29,5 μg/g de créatinine)[58]. Ces quantités évoquent les mêmes ordres de grandeur que d'autres études faites en France et à l’étranger chez les femmes adultes (à cause du faible taux de quantification de cet élément, l'étude de 2018 n'a pas recherché les déterminants d’imprégnation[58]).
Toxicité
Toxicité chimique
Elle est du même ordre que celle du plomb (autre métal lourd). La dose létale pour l'homme semble être de quelques grammes[59].
Chez un humain adulte et en bonne santé, le système digestif absorbe globalement entre 0,2 et 2 % de l’uranium présent dans l'eau et les aliments.
Les composés solubles de ce métal sont plus facilement absorbés que les composés insolubles[60]. Plus de 95 % de l'uranium ingéré ne sont pas absorbés par la muqueuse intestinale, éliminés dans les fèces. Puis environ 67 % de l'uranium passé dans le sang sera filtré par les reins et excrété dans les urines (dans les 24 heures)[60]. Les deux tiers de l'uranium restant seront intégré par l'organisme ; par accumulation dans les os et pour 16 % dans le foie, pour 8 % dans les reins et 10 % dans les autres tissus[60].
Selon l'OMS, le contenu attendu en uranium d'un corps humain en équilibre avec son environnement est d'environ 90 à 150 μg d'uranium[61]. Il résulte d'un apport journalier de l'ordre de 1 à 2 µg/jour par l'eau courante et l'alimentation.
Le rein est l'organe critique en termes de toxicité chimique. Le suivi de cohortes de professionnels exposés à l'uranium a mis en évidence des troubles rénaux (néphrites), avec une gravité dépendant de la dose[62].
À forte dose, l'uranium induit une néphropathie sévère, due à la dégradation des tubules proximaux, et à l'atteinte des structures glomérulaires[63] - [64] - [65]. L'observation histologique et morphologique montre que l'architecture de l'épithélium des structures glomérulaires est altérée[64]. Puis l'épithélium tubulaire proximale se nécrose[63]. Certaines données[60] - [63] ont un temps fait croire que ces troubles n'avaient qu'un caractère transitoire, car une expérience sur l'animal a montré un retour à une situation rénale apparemment normale après élimination de la source d’une exposition excessive. L'épithélium lésé peut effectivement se régénérer après la disparition des apports en uranium, y compris après plusieurs injections de fluorure d'uranyle UO2F2 (à 0,66 ou 1,32 mg U/kg de poids corporel (chez l'animal)[63] ; cependant l'observation histologique a montré (chez le rat) que les cellules mortes ou lésées sont remplacées par des cellules structurellement anormales, et dépourvues de certaines capacités fonctionnelles[66].
Le seuil de toxicité chimique rénale est estimé à 70 µg/kg de poids corporel ou 16 µg/g de rein (limite de 3 µg/g de rein pour la protection des travailleurs)[67]. La dose létale 50 (DL50) par voie orale est de 204 mg/kg chez le rat de laboratoire (la souris s'y montre un peu plus résistante avec de 242 mg/kg comme dose létale (DL50) par voie orale. En 1959, la Commission Internationale de Protection Radiologique (CIPR) recommandait de ne pas dépasser 3 μg/g dans le rein, mais cette valeur-seuil est aujourd'hui controversée, car des doses bien inférieures suffisent à induire des dégâts dans les tubules proximaux (avec protéinurie et enzymurie, par exemple pour 0,7 à 1,4 μg d'uranium par gramme de rein[63].
Dans tous les cas, c'est la toxicité chimique rénale (néphrite tubulaire aiguë) qui entraîne la mort de l'animal[68]. Le mécanisme toxique est expliqué comme suit : l'uranium non-excrété par le rein y est réabsorbé et s'y accumule, en se fixant sur les cellules tubulaires proximales[69] où en raison de l'acidité du milieu, le complexe uranium-uranyle se dissocie pour éventuellement se combiner avec certains composants de la membrane luminale. Les ions uranyle peuvent alors pénétrer la cellule. Ils s’accumulent notamment dans les lysosomes. Ils y forment des aiguilles de phosphate d’uranyle, ainsi que dans les mitochondries[69]. On a aussi montré in vitro que l'uranium à haute dose peut induire l'apoptose (suicide cellulaire) en activant certains enzymes (caspases 3 et 9, protéases à cystéine) via des signaux intrinsèques des mitochondries[70]. Les symptômes de la néphropatie sont accompagnés d'anomalies fonctionnelles (polyurie, enzymurie, protéinurie, élévation sanguine de la créatinine et de l'urée[68] - [63] - [71] - [72]. Les lésions sont moindres et plus réversibles si le taux rénal d'uranium est bas et le temps d’exposition court.
Perturbation endocrinienne : des expériences récentes (sur modèle animal) ont montré qu'une exposition chronique à de faibles doses d'uranium appauvri (ce n'est donc pas la radiotoxicité qui est ici en cause) se traduit par une diminution du taux de 1,24,25(OH)3D3 (ou 1,25-trihydroxyvitamine D3, une forme hormonalement active de la vitamine D)[62].
Cette diminution est accompagnée de modifications moléculaires des enzymes de types cytochromes P450 (CYPs), enzymes protéiques importantes pour le métabolisme, présente chez presque toutes les espèces animales, végétales, fongiques, et qui jouent un rôle important pour la détoxication de l'organisme. On observe aussi des modifications des récepteurs nucléaires associés[62]. La même étude que ci-dessus a montré que l'uranimum appauvri et – de la même manière – l'uranium enrichi affectent l'expression de VDR (vitamin D receptor) et de RXR α (retinoic X receptor alpha), ce qui signifie que l'uranimum (enrichi ou non) peut perturber l'expression des gènes cibles de la vitamine D (impliqués dans le transport du calcium au niveau rénal)[62].
Radiotoxicité
Contrairement à la radioactivité, qui se mesure en becquerels, la radiotoxicité de l'uranium (c'est-à-dire l'effet de son rayonnement ionisant sur l'homme) se mesure en microsieverts (μSv).
Quel que soit son enrichissement, la radioactivité de l'uranium est toujours du type alpha, de l'ordre de 4,5 MeV. Sa radiotoxicité dépend donc de son activité massique et faiblement de sa composition. Elle est de l'ordre de 0,6 µSv/Bq (F) à 7 µSv/Bq (S) en inhalation, 0,05 µSv/Bq (F) à 0,008 µSv/Bq (S) en ingestion, les poumons et les os étant alors les organes critiques[73].
La radiotoxicité de l'uranium serait du même ordre de grandeur que celle de la toxicité chimique : elle l'emporte pour des enrichissements supérieurs à 6 %, la toxicité chimique étant sinon prépondérante[43].
Effets sur la reproduction
L'uranium est aussi reprotoxique via notamment un effet délétère sur les organes reproducteurs ; soit du fait de sa radioactivité, soit du fait de sa chimiotoxicité, et peut-être des deux.
L'uranium a chez l'animal des effets démontrés ; sur le système reproducteur : chez le rongeur de laboratoire, la barrière hémato-testiculaire (ou BHT) qui était réputée protéger le testicule peut en être franchie par le plutonium, l'américium et le polonium au moins grâce à la transferrine.
- De l'uranium est significativement trouvé dans les testicules de rats ayant reçu un implant d'uranium dans le muscle d'une des pattes. Les récepteurs à la transferrine présent dans l'épithélium séminifère humain pourrait donc expliquer la présence d'uranium dans le sperme de soldats blessés par des munitions à l'uranium appauvri.
- Des rats ayant des implants sous-cutanés d'uranium, et des souris abreuvées d'eau contenant de l'uranium produisent des cellules de Leydig altérées, ce qui perturbe la production d'hormones stéroïdes et se traduit par un sperme dégradé (spermatozoïdes moins nombreux et moins mobiles), expliquant les observations faites dès 1949 de diminution du nombre de portées et du nombre de petits par portée chez plusieurs espèces d'animaux ayant régulièrement ingéré de faibles doses de nitrate d'uranyle[74] - [75].
Effets sur le développement
- Il induit une toxicité fœtale et embryonnaire chez la souris chez laquelle un implant d'uranium a été posé dans le muscle d'une patte.
- Il est tératogène à doses plus élevées, avec mort de l'embryon exposé à une concentration 50 mg·kg-1·j-1 durant 9 jours, 20 % inférieure à la dose létale pour l'adulte.
- Une souris gestante abreuvée avec une eau correspondant à une ingestion de 25 mg d'uranium/kg et par jour produit moins de jeunes. Ceux-ci ont ensuite des problèmes de développement et de survie[76].
La plupart des études et réglementations se fondent sur les effets sur l'animal, or les premières études ex vivo permises par les nouvelles techniques de cultures cellulaires laissent penser que les gonades humaines seraient plus sensibles à l'uranium que ne le sont celles des rongeurs utilisés en laboratoire. Le testicule fœtal humain pourrait aussi être plus sensible que ceux des rongeurs de laboratoire[77].
Normes
Il n'y a pas de consensus sur les normes ni la NOAEL (dose sans effet nocif observé) de l'uranium, certains estimant que les effets délétères de la radioactivité peuvent exister quelle que soit la dose.
Pour la potabilité de l'eau, l'OMS a fixé une teneur maximale de 1,4 mg·l-1[78], tout en recommandant dans ses lignes directrices une concentration en uranium cent fois plus faible, inférieure à 0,015 mg/l, pour les eaux de boisson courante[79]. Au Canada, l'eau potable possède une concentration maximale acceptable de 0,02 milligramme d'uranium par litre (mg/L)[80].
Prix

Le prix de l'uranium a baissé dans les années 1980 et 1990 pour plusieurs raisons :
- les politiques d'économie d'énergie ont permis de limiter la consommation d'électricité ;
- des gisements d'uranium économiquement exploitable ont été découverts ;
- les stocks d'uranium militaire constitués dans le contexte de la guerre froide ont été convertis en stocks civils et utilisés dans les réacteurs nucléaires à la suite de l'assouplissement des tensions américano-soviétiques.
Le prix de l'uranium a atteint un minimum en à 14,1 dollars par kilogramme de U3O8[82].
Le prix de l'uranium a progressivement augmenté depuis 2001 pour atteindre un pic à 298 $/kg en . Ce pic s'explique par la diminution des stocks, la faible augmentation de production, et par des événements ponctuels tels que l'inondation de la mine de Cigar Lake au Canada et l'incendie de la mine Olympic Dam en Australie[83].
L'uranium est redescendu à 102,5 $/kg en . En , il se situait à environ 138,9 $/kg. Il est à prévoir une tendance à la hausse en raison de l'épuisement des stocks militaires prévu vers 2015[84].
En le cours de l'uranium est au plus bas : aux alentours de 52,9 $/kg de U3O8. Ceci s'explique par le faible coût de production des mines du Kazakhstan et par l'offre qui surpasse la demande[85].
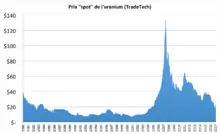
Le prix de revient du kWh est peu sensible au prix de l’uranium. Certes, le coût du cycle du combustible représente environ 20 % du prix de revient du kWh, mais ce cycle comprend toutes les transformations physiques et chimiques qu’il faut faire subir à l’uranium naturel pour en faire un combustible utilisable. Le coût du combustible nucléaire constitue environ 5 % du prix final du kWh nucléaire en 2014[86]. Cependant, des études économiques montrent que le prix de l'uranium commence à avoir un effet significatif sur le coût du kWh d'électricité nucléaire à partir de 110 ou 220 euros par kilogramme de U3O8[87].
Commerce
La France importe plus que la consommation d'uranium qui lui est nécessaire et exporte ses surplus sous différentes formes, d'après les douanes françaises. En 2014, le prix moyen à la tonne à l'export était de 36 000 €[88].
Notes et références
Notes
- « Au sujet de l'uranite, un nouveau métalloïde ».
- Avant la découverte de la radioactivité, Lord Kelvin avait estimé l'âge de la Terre à quelque 20 millions d'années, en supposant que la seule source d'énergie capable de s'opposer au refroidissement était la chaleur résiduelle, initialement produite lors de la formation de la Terre. Un âge de seulement quelques dizaines de millions d'années fut considéré beaucoup trop court par les géologues, et un vif débat s'ensuivit entre géologues et physiciens. Celui-ci ne devait prendre fin qu'une vingtaine d'années après la découverte de la radioactivité, trop tard pour Kelvin de faire amende honorable. Plus tard, les physiciens ont pu apporter aux géologues des méthodes de datation absolue des roches qui se basent sur la radioactivité et les abondances actuelles de certains radioéléments et de leurs produits de désintégration (voir Radiochronologie).
- L'uranium est présent sur Terre essentiellement sous forme d'oxydes, donc incorporé dans les roches et très peu dans le noyau métallique. Mais la chaleur dégagée dans le manteau retarde le refroidissement du noyau.
- Voir Fission nucléaire.
- « Théoriquement » la fission complète d'1 kg d'uranium libère une chaleur de 80 TJ. Mais dans un réacteur nucléaire, seulement environ 1 % (à quelques %) de l'uranium initialement présents subit réellement la fission, avant d'être remplacé.
Références
- (en) Uranium 2020: Resources, Production and Demand, p. 18-19, Agence pour l'énergie nucléaire (NEA-OCDE) et Agence internationale de l'énergie atomique, 23/12/2020.
- p. 15
- p. 18
- p. 32
- p. 14
- Autres références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- Entrée « Uranium, powder » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 juin 2018 (JavaScript nécessaire)
- « Uranium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Réserves d'uranium naturel dans le monde, Connaissance des énergies, 17 avril 2014.
- Cigar Lake, nouvel Eldorado de l’uranium canadien, Connaissance des énergies, 18 avril 2014.
- Erwin Erasmus Koch (trad. André Pougetoux), Uranium, Paris, André Bonne Paris, coll. « L'homme et l'univers », , 225 p., p. 15
- Jean Talbot, Les éléments chimiques et les hommes, EDP Sciences, , p. 92
- Michel Dumoulin, Pierre Guillen et Maurice Vaïsse, L'énergie nucléaire en Europe, Lang, , p. 11
- Guide de la technique : l'énergie, Presses polytechniques et universitaires romandes, 1993.
- Courrier international, no 1168 du 21 au 27 mars 2013, p. 46.
- Quelques publications (avec openlibrary.org)
- Les gisements d'uranium liés spatialement aux discordances (mémoire), 1983, dans la série Géologie et géochimie de l'Uranium, document présenté à un séminaire du Centre de recherche sur la géologie de l'uranium (Cregu, 26 au 28 octobre 1982), mis en ligne par l'AIEA
- « In Situ Leach Mining (ISL) of Uranium - World Nuclear Association », sur www.world-nuclear.org (consulté le )
- I'MTech, « Récupérer l’uranium sans creuser : la lixiviation in situ », sur I'MTech, (consulté le )
- (en) Argonne National Laboratory, Uranium Quick Facts
- Depleted Uranium: Sources, Exposure and Health Effects - Full Report WHO, Geneva 2001 (WHO/SDE/PHE/01.1)
- CNDP Commission particulière du débat public Gestion des Déchets Radioactifs : Débat public sur les déchets radioactifs ; Réponses aux questions
- Étude sur l’origine du marquage par l’uranium dans la nappe alluviale de la plaine du Tricastin, IRSN, septembre 2010
- « Uranium : l'abondance au rendez-vous »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) Les défis du CEA ; décembre-janvier 2002 no 94 p. 4-5 par Olivier Donnars.
- Étude sur l’origine du marquage par l’uranium dans la nappe alluviale de la plaine du Tricastin, IRSN, 2010.
- (en) Supply of Uranium - Uranium availability, World Nuclear Association, mis à jour en septembre 2021.
- (en) « Uranium production figures, 20011-2020 », World Nuclear Association, septembre 2021.
- L’industrie minière s’adapte aux niveaux bas des cours de l’uranium, Les Échos, 10 novembre 2017.
- (en) Uranium 2014: Resources, Production and Demand, p. 62, Agence pour l'énergie nucléaire (OCDE) et Agence internationale de l'énergie atomique, 2014.
- (en) World Uranium Mining Production, Association nucléaire mondiale, 19 mai 2016.
- (en) World Uranium mining, World Nuclear Association
- Communiqué OCDE, Des approvisionnements mondiaux en Uranium assurés à long terme ; Press Room NEA/COM(2012)5 Paris/Vienne, le 26 juillet 2012
- Superphénix, Connaissance des énergies (consulté le 5 juillet 2016).
- L’uranium de l’eau de mer : véritable ressource énergétique ou mythe ?, Revue des ingénieurs, janvier 2003.
- P. Doremus et J.-P. Pierre (IRSN), Retour d’expérience des interventions de l’IRSN – Présentation de quelques cas (chaufferie, industrie métallurgique, industrie du verre, eaux minérales) [PDF]
- Eaux minérales gazeuses, trop chargées en uranium ?, Principes de santé, 3 mars 2010.
- (en) Directives pour la qualité de l'eau de boisson, 3e éd.
- (en) Directives pour la qualité de l'eau de boisson, 4e éd.
- Jason Nolan et Karrie A. Weber, « Natural Uranium Contamination in Major U.S. Aquifers Linked to Nitrate », Environ. Sci. Technol. Lett., 2015, 2, 215−220.
- (en) J. Korenaga, « Earth's heat budget: Clairvoyant geoneutrinos », Nature Geoscience, vol. 4, no 9, , p. 581–582
- Données citées par la World Nuclear Association.
- (en) « The Strategic Importance of Australia’s Uranium Resources »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), débat parlementaire australien.
- The Cosmic Origins of Uranium, World nuclear association.
- Uranium isotopes, Globalsecurity.
- Mr Greg Brennecka, « Exploration of the mechanisms that cause uranium isotope fractionation and the implications for nuclear forensics »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Arizona State University, (consulté le ).
- « l'Uranium, propriété et toxicité. »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- (en) Marshall Cavendish Corporation, How It Works : Science and Technology, Marshall Cavendish, , 2880 p. (ISBN 0-7614-7314-9, lire en ligne), p. 2548
- [PDF](en) James C. O. Harris, Mineral yearbook, (lire en ligne), p. 631-632
- Uranium appauvri: sources, exposition et effets sur la santé - Organisation Mondiale de la Santé
- Salamon R (2004) [Rhttps://hal-lara.archives-ouvertes.fr/hal-01571608/document Rapport de l'enquête française sur la guerre du Golfe et ses conséquences sur la santé ; Répondant à la lettre de mission du 6 juin 2001 adressée par le cabinet du Ministre du Ministère de la Défense] ; [Rapport de recherche INSERM], 286 p., bibliographie p. 276-277, tableaux, graphiques. hal-01571608
- Gray GC, Kaiser KS, Hawksworth AW, Hall FW, Barrett-Connor E. Increased postwar symptoms and psychological morbidity among U.S. Navy Gulf War veterans. Am J Trop Med Hyg 1999;60(5):758-66.
- Kang HK, Mahan CM, Lee KY, Magee CA, Murphy FM. Illnesses among United States veterans of the Gulf War: a population-based survey of 30,000 veterans. J Occup Environ Med 2000;42(5):491-501.
- Guseva Canu, I. (2008). Etude épidémiologique des travailleurs exposés au risque d'incorporation d'uranium (Doctoral dissertation, Paris 6) (résumé).
- Boice JD, Leggett RW, Dupree Ellis ED, et al. A comprehensive dose reconstruction methodology for former rocketdyne/atomics international radiation workers. Health Phys 2006;90(5):409-30.
- IRSN (2007)Etude épidémiologique des travailleurs exposés au risque d’incorporation d'uranium. Reconstitution de l’exposition à l’uranium et aux produits chimiques associés ; Journées des thèses IRSN, 1-5 octobre 2007 Irina GUSEVA CANU, 2ème année de thèse
- Cardis E, Vrijheid M, Blettner M, et al. Risk of cancer after low doses of ionising radiation: retrospective cohort study in 15 countries. Br Med J 2005;331(7508):77
- Guseva Canu I, Dupree Ellis E, Tirmarche M. Cancer risk in nuclear workers occupationally exposed to uranium. Emphasis on internal exposure. Health Phys 2007
- Guseva Canu I, Rogel A, Samson E, et al. Cancer mortality risk among biology research workers in France: first results of two retrospective cohort studies. Int Arch Occup Environ Health 2007
- Cardis E, Vrijheid M, Blettner M, et al. The 15-Country Collaborative Study of Cancer Risk Among Radiation Workers in the Nuclear Industry: Estimates of radiation Related Cancer Risk. Radiat Res 2007;167(4):396-416.
- Alpha risk project (AREVA): http://www.alpha-risk.org/.
- : métaux et métalloïde des recherches de la cohorte Elfe ; Décembre 2016 ; SANTÉ PUBLIQUE France / Imprégnation des femmes enceintes par les polluants de l’environnement en France en 2011]. Volet périnatal du programme national de biosurveillance|PDF, 224p|aussi disponible à partir de l’URL : www.santepubliquefrance.fr
- Health Physics, résumé : vol. 94(2), février 2008, p. 170-179
- Uranium appauvri : sources, exposition et effets sur la santé, OMS 2001
- « Aide-mémoire OMS »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) sur l'uranium appauvri]
- Tissandie E., Étude des effets des radionucléides (uranium et césium 137) sur le métabolisme de la vitamine D chez le rat [PDF], thèse de doctorat (sciences de la vie et de la santé), université d'Auvergne, 8 novembre 2007
- Diamond G.L., Morrow P.E., Panner, B.J., Gelein R.M. et Baggs R.B. (1989), Reversible uranyl fluoride nephrotoxicity in the Long Evans, Rat. Fundam. Appl. Toxico. l13, 65- 78
- Kobayashi S., Nagase M., Honda N. et Hishida A. (1984), Glomerular alterations in uranyl acetate-induced acute renal failure in rabbits, Kidney Int. 26, 808-15
- Priest N.D. (2001), Toxicity of depleted uranium, Lancet 357, 244-6
- Wrenn, M.E., Durbin P.W., Howard B., Lipsztein J., Rundo J., Still E.T. et Willis D.L. (1985), Metabolism of in gested U and Ra, Health Phys. 48, 601-33
- Présentation de l'ISPN, « L'uranium, propriétés et toxicité »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- Domingo, J.L., Llobet, J.M., Tomas, J.M. et Corbella J. (1987), Acute toxicity of uranium in rats and mice, Bull. Environ. Contam. Toxico. l39, 168-74
- Leggett R.W. (1989), The behavior and chemical toxicity of U in the kidney: a reassessment, Health Phys. 57, 365-83
- Thiebault C., Carriere M., Milgram, S., Simon A., Avoscan L. et Gouget B. (2007), Uranium Induces Apoptosis and Is Genotoxic to Normal Rat Kidney (NRK- 52E) Proximal Cells, Toxicol. Sci. 98, 479-87
- Blantz, R.C. (1975), The mechanism of acute renal failure after uranyl nitrate, J. Clin. Invest. 55, 621-35
- Haley D.P. (1982), Morphologic changes in uranyl nitrate-induced acute renal failure in saline- and water-drinking rats, Lab. Invest. 46, 196–208
- Publication No 68 de la CIPR, citée par l'IPSN dans sa présentation.
- J.L. Domingo, 2001, Reprod Toxicol. 15, 603-9
- Arfsten D.P. et al., 2001, Toxicology in Health, 17 5610
- S. Barillet, M. Carrière, H. Coffigny, V. Rouiller Fabre, B. Lefèvre, R. Habert, Article de la Revue Biofutur, p. 35 du Dossier spécial Toxicologie nucléaire.
- S. Barillet, M. Carrière, H. Coffigny, V. Rouiller Fabre, B. Lefèvre, R. Habert, Article de la Revue Biofutur, in Conclusion p. 37 du Dossier spécial Toxicologie nucléaire.
- LENNTECH, « Comparaison de normes sur l'eau potable »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- Tableau des recommandations de l'OMS.
- « Parlons d'eau : L'uranium dans l'eau potable », sur hc-sc.gc.ca (consulté le ).
- NUEXCO Exchange Value (Monthly Uranium Spot)
- « Impact des cours de l'uranium sur les prix de l'électricité »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- « L'impact des cours de l'uranium sur les prix de l'électricité »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- « Production et consommation d'uranium dans le monde », sur natura-sciences.com (consulté le )
- « Areva ou la fin du rêve nucléaire », JeuneAfrique.com, (lire en ligne, consulté le )
- D’où vient l’uranium naturel importé en France ?, Connaissance des énergies, 12 mai 2014.
- Prix de l'uranium et coût de l'électricité nucléaire
- Douane française, Statistiques nationales du commerce extérieur
Voir aussi
Bibliographie
- (en) Tom Zoellner, Uranium : War, Energy, and the Rock that Shaped the World, New York, Penguin, , 354 p. (ISBN 978-0-14-311672-1, OCLC 430052044)
- (en) Richard Rhodes, The Making of the Atomic Bomb : 25th Anniversary Edition, New York, Simon & Schuster Paperbacks, (1re éd. 1986), 838 p. (ISBN 978-1-4516-7761-4, OCLC 764385315, lire en ligne)
Articles connexes
Liens externes
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (no + nn + nb) Store medisinske leksikon
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Note d'information. L'uranium et les risques associés [PDF], IRSN,
- (en) Uranium resources and nuclear energy [PDF] (Ressources d'uranium et énergie nucléaire)
- Tableau des données concernant l'uranium
- « Caractéristiques de l'uranium »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- (en) Toxicological Profile for Uranium, ATSDR, U.S. Department of Health and Human Services
- (en) « Technical data for Uranium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||



