Carbonate
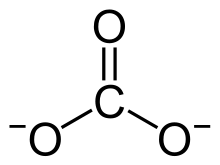
L'ion carbonate est l'ion polyatomique de formule chimique CO32−. En chimie, un carbonate est un sel associant cet anion à un ou plusieurs cations. En minéralogie, les carbonates sont des minéraux dont la composition chimique est celle d'un carbonate : aragonite et calcite CaCO3, dolomite CaMg(CO3)2, etc.
Sur Terre, à long terme, les carbonates jouent un rôle majeur dans le rétrocontrôle du climat et des gaz à effet de serre via le cycle du carbone. Ils constituent (dans le manteau terrestre, après sédimentation dans les océans et surtout sous forme de carbonate de calcium) l'essentiel des puits (« durables ») de carbone[1].
Quelques exemples de carbonates :
Structure
Dans l'ion carbonate CO32−, chaque atome de carbone se trouve au centre d'un triangle équilatéral dont chaque sommet est occupé par un atome d'oxygène.
Aucun ion oxygène n'est commun à deux groupements triangulaires carbone-oxygène ; ceux-ci doivent être considérés comme des unités distinctes dans la structure des minéraux carbonatés et ils sont en grande partie responsables des propriétés particulières de ce groupe.
La liaison entre le carbone central et les oxygènes est moins forte que dans le dioxyde de carbone. En présence de l'ion hydrogène, le radical carbonate devient instable et se brise. Cette instabilité est à l'origine des tests à l'acide qui permettent de reconnaître les carbonates dans un composé organique ou inorganique. Au contact d'une solution d'acide chlorhydrique HCl, les ions CO32− forment du dioxyde de carbone CO2, dont le dégagement gazeux est observable sous forme d'effervescence.
Lorsque l'ion carbonate est combiné avec les cations divalents (Ca2+, Fe2+, etc.), il forme des composés de structure géométrique simple, généralement rhomboédrique ou orthorhombique. Le carbonate de calcium cristallise à la fois avec la structure rhomboédrique de la calcite et la structure orthorhombique de l'aragonite.
Propriétés
Les carbonates sont des minéraux que l'on trouve en abondance à la surface de la Terre. Le carbonate de calcium est le constituant principal des coquilles de nombreux organismes. On le retrouve surtout dans la lithosphère sous forme de roches dites calcaires, les plus abondantes parmi les roches sédimentaires. Ce stock considérable de carbone est alimenté par le métabolisme des êtres vivants sous forme de dioxyde de carbone, lequel donne notamment, en se combinant avec les métaux divalents, des composés insolubles dans les conditions normales de la lithosphère : les carbonates. Des dissociations ultérieures peuvent cependant intervenir, à la faveur desquelles le carbone mis en réserve est restitué à la biosphère et à l'atmosphère. Ainsi les carbonates se trouvent à la croisée des cycles biochimique et géochimique du carbone, localisés essentiellement dans la zone superficielle de la lithosphère. La présence des carbonates dans les roches d'origine interne est, en effet, exceptionnelle et elle pose l'un des problèmes les plus intéressants de la pétrologie, celui de l'origine « primaire » du carbone en profondeur.
Les carbonates alcalins ne se dissocient qu'à très haute température, les carbonates alcalino-terreux et le carbonate de lithium à température moins élevée ; la température à laquelle une pression déterminée de dioxyde de carbone est atteinte décroît du carbonate de baryum au carbonate de magnésium, en passant par le strontium puis le calcium. Les carbonates alcalins solubles dans l'eau sont hydrolysés. Le point de fusion du carbonate de sodium anhydre atteint 851 °C alors qu'il se dissout dans son eau de cristallisation à partir de 34 °C.
Carbonate de calcium
Les roches carbonatées sont des roches sédimentaires composées d'une grande proportion de carbonate ; souvent du carbonate de calcium (CaCO3).
Exemples :
Il existe plusieurs variétés minéralogiques du carbonate de calcium, ces deux types diffèrent par leur système cristallin. il s'agit de la calcite (système rhomboédrique) qui est la forme la plus stable et l'aragonite (système orthorhombique) qui est la forme qui cristallise naturellement dans les océans actuels. Une autre variété est la vatérite, mais cette forme est rare car très instable dans les conditions de pression et de température normales.
Différents types de carbonates
- carbonate de calcium et de magnésium : dolomite ;
- carbonate de fer : sidérite ;
- carbonate de cuivre : malachite ;
- carbonate de sodium et bicarbonate de sodium : natron ;
- carbonate de calcium, fer, manganèse et magnésium : ankérite ;
- carbonate d'uranyle ;
- carbonate de plomb : cérusite. Le carbonate de plomb, de formule (PbCO3)2 Pb(OH)2, appelé blanc de plomb ou céruse, est utilisé depuis plus de deux mille ans comme pigment blanc. Il sert également d’enduit pour la céramique et pour la fabrication d’autres pigments. Du fait des dangers d’empoisonnement par le plomb, l’utilisation des peintures à base de ce produit pour la décoration intérieure a été en grande partie interdite.
Notes et références
- Claudine Biellmann, Stabilité et réactivité des carbonates à très hautes pression et température : Implications pour le stockage du carbone dans le manteau terrestre, Rennes, Université de Rennes I, coll. « Mémoires de géosciences Rennes », , 230 p. (ISBN 978-2-905532-54-1).