Uranocène
L'uranocène U(C8H8)2 est le complexe cyclooctatétraénure des éléments du bloc f le plus connu et est l'un des tout premiers composés de la chimie des organo-uraniens à avoir été synthétisé. L'uranocène est un composé sandwich mais, contrairement à ce que ce nom pourrait laisser croire, ce n'est pas un métallocène, puisque ses ligands sont des cyclooctatétraènes (COT), et non pas des cyclopentadiènes (Cp). Il est le système bis[8]annulène-métal le plus étudié.
| Uranocène | |
    |
|
| Identification | |
|---|---|
| Nom UICPA | uranocene, bis(η8-cyclooctatetraenyl) uranium |
| Synonymes |
U(COT)2 |
| No CAS | |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | cristaux verts[1] |
| Propriétés chimiques | |
| Formule | C16H16U [Isomères] |
| Masse molaire[2] | 446,327 2 ± 0,014 g/mol C 43,06 %, H 3,61 %, U 53,33 %, |
| Précautions | |
 Composé radioactif |
|
| SGH[3] | |
   Danger |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
L'uranocène a été préparé, la première fois, par réaction entre le tétrachlorure d'uranium (IV) et le cyclooctatétraènure de potassium comme suit :
- 2 K + C8H8 → K2(C8H8)
- 2 K2(C8H8) + UCl4 → U(C8H8)2 + 4 KCl[4].
Propriétés
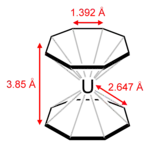
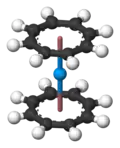
L'uranocène est un solide vert paramagnétique et il s'enflamme quand il est exposé à l'air, mais il est stable vis-à-vis de l'hydrolyse. Les groupes η8-cyclooctatétraènyl sont plans, comme attendu pour un cycle contenant 10 électrons π. Les deux cycles sont éclipsés, conférant une symétrie D8h à la molécule d'uranocène. En solution, les cycles peuvent tourner car la barrière d'énergie pour la rotation est basse.
La nature de la liaison uranium-COT est un sujet continuel de recherches et débats[5]. La spectrométrie photoélectronique UV indique que les orbitales atomiques 5f et 6d de l'uranium ont une contribution dans cette liaison. Ces orbitales f de l'uranium interagissent substantiellement avec les cycles aromatiques COT, tout comme les orbitales d du fer avec les ligands Cp dans le ferrocène. L'uranocène diffère cependant du ferrocène du fait que ses orbitales frontières (HO et BV) sont centrées sur le métal et non sur les cycles, et du fait que toutes les réactions impliquant le métal résultent souvent au clivage de la liaison ligand-métal.
Les uranocènes réduisent facilement les composés U(IV) en composés U(III), mais sont sinon plutôt chimiquement inertes.
Composés analogues
Certains exemples de composé analogues de la forme M(C8H8)2 existent pour M = Nd, Tb, Pu, Pa, Np, Th et Yb. D'autres composés analogues sont le dérivé stable à l'air U(C8H4Ph4)2 et les espèces cycloheptatriényl comme [U(C7H7)2]−[6].
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Uranocene » (voir la liste des auteurs).
- Bis(cyclooctatetraenyl)uranium (uranocene). A new class of sandwich complexes that utilize atomic f orbitals; A. Streitwieser and U. Mueller-Westerhoff; J. Am. Chem. Soc., 1968, 90(26), pp 7364–7364. DOI 10.1021/ja01028a044
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Raman under nitrogen. The high-resolution Raman spectroscopy of crystalline uranocene, thorocene, and ferrocene, J. S. Hager, J. Zahardis, R. M. Pagni, R. N. Compton and J. Li; The Journal of Chemical Physics, 2004, 120(6), pp 2708–2718. DOI 10.1063/1.1637586
- (en) Lanthanides & Actinides: Organoactinides
- Uranocene. The First Member of a New Class of Organometallic Derivatives of the f Elements, D. Seyferth, Organometallics, 2004, 23(15), pp 3562–3583. DOI 10.1021/om0400705