Terbium
Le terbium est un élément chimique, de symbole Tb et de numéro atomique 65. C'est un métal gris argenté de la famille des lanthanides appartenant au groupe des terres rares.
L'appellation terbium, provient de l'endroit, Ytterby près de Stockholm en Suède, où l'on a découvert le minerai dans lequel ont également été identifiées plusieurs autres terres rares. Les éléments chimiques yttrium, erbium et ytterbium partagent la même étymologie.
On extrait aujourd'hui le terbium du sable de monazite (teneur d'environ 0,03 %) comme beaucoup d'autres lanthanides.
Le terbium est une ressource non renouvelable. Une publication du Centre national de la recherche scientifique français avait même prévu son épuisement pour 2012[6].
Histoire
Première découverte

(1797-1858).
| Découvertes des terres rares. | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Diagrammes des découvertes des terres rares. Les dates entre parenthèses sont les dates d'annonces des découvertes[7]. Les branches représentent les séparations des éléments à partir d'un ancien (l'un des nouveaux éléments conservant le nom de l'ancien, sauf pour le didyme). |
En 1789, le chimiste finlandais Johan Gadolin identifie un nouvel oxyde (ou « terre ») dans un échantillon d'ytterbite (rebaptisée plus tard « gadolinite » en son honneur). Cette nouvelle roche avait été découverte deux ans auparavant par le lieutenant Carl Axel Arrhenius près du village d'Ytterby en Suède. Ces travaux sont confirmés en 1797 par Anders Gustaf Ekeberg qui baptise le nouvel oxyde yttria[8].
Près d'un demi-siècle plus tard, le Suédois Carl Gustav Mosander parvient à isoler plusieurs terres rares (cérium, lanthane et didyme) grâce à de nouveaux procédés de cristallisation fractionnée[9]. Convaincu que l'yttria extraite de la gadolinite est également un mélange, il décide d'y chercher certains de ces nouveaux composés. À l'automne 1842, il parvient à isoler deux oxydes, l'un blanc (donnant des sels incolores), qu'il considère comme le véritable yttrium, et l'autre jaune (donnant des sels roses), qu'il décide de nommer « odinium » en l'honneur du dieu Odin de la mythologie nordique. Avant de publier les résultats de ces recherches en 1843, Mosander achève une étape supplémentaire de fractionnement des oxalates de ces composés et découvre un troisième oxyde. Il décide de conserver le terme yttria pour la fraction incolore (oxyde d'yttrium pur) et nomme la fraction jaune « erbine » et la fraction rose « terbine », toujours en rappel du village d'Ytterby[10].
Controverses et confusions
Durant les décennies qui suivent, les découvertes de Mosander sont remises en question. En 1860, son compatriote Nils Johan Berlin reprend l'étude de l'yttria brute et parvient à en isoler deux oxydes. Il en considère un comme étant de l'oxyde d'yttrium pur et identifie l'autre comme l'erbine de Mosander, malgré le fait qu'il donne des sels colorés en rose. Il ne trouve par contre aucune trace de la terbine[11]. Ces expériences sont répétées en 1864 à Göttingen par Friedrich Otto Popp et à Genève par Marc Delafontaine, avec des conclusions opposées : le premier ne trouve aucun autre élément que l'yttrium et prétend que les autres composés sont des oxydes déjà connus (du cérium et du didyme)[12], alors que le second soutient l'existence à la fois de l'erbine et de la terbine[13]. Puis en 1866, c'est au tour de Robert Bunsen et de son assistant Johan Bahr de l'Université d’Heidelberg de réitérer le processus de séparation. Ils reconnaissent que les sels d'yttrium sont incolores et que leurs solutions ne présentent pas de bandes d'absorption, alors que les sels d'erbium ont une belle coloration rose et que leurs solutions donnent un spectre d'absorption tout à fait différent de celui du didyme. Mais ils ne trouvent aucun autre composé[14].
Ainsi, la confusion s'installe et les noms choisis par Mosander sont intervertis. Delafontaine a beau rétorquer que l'erbine de Berlin et de Bahr et Bunsen n'est autre que la terbine de Mosander, et qu'il détient les preuves de l'existence de la vraie erbine (celle de Mosander), il n'est pas entendu. Pendant plusieurs années, le terbium disparaît de la liste des éléments connus et se trouve ainsi absent de la première version du tableau périodique des éléments de Dmitri Mendeleïev en 1869[9]. Les Suédois Per Teodor Cleve et Otto Magnus Höglund (de) tentent de vérifier en 1872 l'hypothèse de Delafontaine, mais échouent une fois de plus à isoler autre chose que l'erbium (au sens de Bahr et Bunsen)[15]. L'existence de ce dernier fait bientôt l'unanimité au sein de la communauté scientifique, grâce à sa détection dans le spectre solaire par l'astronome américain Charles Augustus Young la même année[16].
Confirmations
C'est finalement dans un autre minerai, la samarskite, que Delafontaine finit par retrouver la trace de l'erbine jaune de Mosander. Il pense un temps la renommer « mosandrium » en l'honneur du chimiste suédois, puis s'accorde avec son compatriote Jean Charles Galissard de Marignac pour conserver le nom de terbine :
« Dans une note antérieure, j'ai proposé d'appliquer au radical de cette terre jaune, le nom de Mosandrium, quoique ce soit le vrai erbium de Mosander ; ce changement me semblait justifié par la notoriété qu'ont les travaux de M. Bunsen et de M. Cléve et qui rend impossible d'enlever à leur terre rose son nom impropre d'erbine, sans créer une confusion regrettable. M. Marignac pense qu'il serait préférable de ne pas créer un nouveau nom et qu'il vaut mieux compléter l'interversion des noms en appelant terbine la terre jaune (erbine Mosander non Bunsen), et erbine la terre rose (terbine de Mosander). Je me rangerai volontiers à cet avis [...] »
— Marc Delafontaine[17]
En 1878, ses travaux sont confirmés par Marignac, qui isole lui-même le terbium de la gadolinite. Parallèlement, l'Américain John Lawrence Smith publie la découverte d'une nouvelle terre jaune dans la samarskite, à laquelle il choisit de donner le nom de « mosandrum »[18]. Marignac l'analyse et déclare qu'elle n'est rien d'autre que la terbine dont Delafontaine et lui-même viennent de prouver l'existence[19], ce qui donne lieu à une vive dispute entre les trois scientifiques[20]. Ces découvertes sont définitivement ratifiées par la publication en 1882 des 194 lignes du spectre du terbium par le chimiste britannique Henry Enfield Roscoe[16].
Caractéristiques
Propriétés physiques
Le terbium est un métal d'aspect gris argenté. Comme les autres membres de la famille des lanthanides, il est malléable, ductile et assez mou pour être coupé avec un couteau. Il est assez stable dans l'air, et existe sous deux formes allotropiques, avec un changement de phase à 1 289 °C[21].
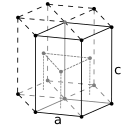
Comme toutes les terres rares lourdes, le terbium présente une structure cristalline en empilement compact hexagonal. En dessous de son point de Curie (−54,15 °C), il montre un agencement ferromagnétique simple avec les moments alignés selon l'axe b du plan basal. Au-dessus de Tc, l'élément ne devient pas immédiatement paramagnétique, mais atteint plutôt un état antiferromagnétique particulier qui persiste jusqu'à sa température de Néel (−43,15 °C). Cet agencement, connu sous le nom d'antiferromagnétisme hélicoïdal, est caractérisé par le fait que tous les moments magnétiques d'une même couche sont parallèles et orientés selon un angle fixe par rapport aux moments des couches adjacentes. Ils tournent ainsi autour de l'axe c à la manière d'une vis ou d'une hélice. Le dysprosium partage ces caractéristiques particulières pour d'autres températures[22]. Ces deux éléments présentent de plus une magnétostriction élevée[10].
Le cation terbium(III) exhibe une importante fluorescence de couleur verte. Elle implique une transition 5D4 → 7F5 dont la bande d'émission principale est située à 545 nm, avec un temps de vie de 0,1 à 2 ms[23].
Propriétés chimiques et composés
La valence la plus commune dans les composés solides est de III. Un valence de IV est connue pour le métal dans son dioxyde (TbO2) et son tétrafluorure (TbF4). Le terbium forme également plusieurs oxydes non stœchiométriques de composition approximative Tb4O7. En solution, le métal existe seulement à l'état trivalent : [Tb(H2O)n]3+ .
Le terbium forme un certain nombre de composés binaires avec des éléments comme l'oxygène (TbO2, Tb2O3, Tb7O12, Tb11O20), l'hydrogène (TbH2, TbH3), les halogènes (TbF3, TbF4, TbI3), l'azote (TbN), le phosphore (TbP), le soufre (TbS), le sélénium (TbSe) et le tellure (TbTe), ainsi qu'avec le carbone, le silicium, le bore, l'arsenic et l'antimoine[24].
Isotopes
À l'état naturel, le terbium ne possède qu'un seul isotope stable : 159Tb. C'est donc un élément mononucléidique et monoisotopique.
Trente-six radioisotopes synthétiques ont été caractérisés, du terbium 135 au terbium 171. Les plus stables sont le terbium 158, avec une demi-vie de 180 ans, et le terbium 157, avec une demi-vie de 71 ans. Les deux modes de désintégration principaux sont la capture électronique, qui se traduit par la production d'isotopes du gadolinium, et la désintégration bêta moins, résultant en isotopes du dysprosium[25].
L'élément possède également 27 isomères nucléaires, dont le plus stable, 156mTb, a une demi-vie de 24,4 heures[25].
Abondance naturelle et production
Le terbium est présent en combinaisons avec d'autres terres rares dans plusieurs minéraux, comme le xénotime (1 % d'oxyde de terbium), l'euxénite (1,3 %), ou encore la cérite, la monazite et la gadolinite. L'élément a également été détecté dans la matière stellaire. Son abondance dans la croûte terrestre est estimée à 1,2 mg/kg[24], il est donc deux fois plus commun que l'argent[8].
En 2018, les principales ressources minières sont situées en Chine, aux États-Unis, au Brésil, en Inde, au Sri Lanka et en Australie. Les réserves en terbium étaient estimées à 300 000 tonnes et la production mondiale est d'environ 10 tonnes par an (donnée 2001)[8], mais en avril dans la revue Nature des chercheurs japonais estiment que les gisements nouveaux détectés et explorés à l'Est du Japon depuis quelques années représentent sur 2 500 km2 environ 16 millions de tonnes de terres rares, situées dans le sédiment marin, à plus de 5 000 mètres de profondeur ; sur 2 499 km2, le fond contiendrait là plus de 16 millions de tonnes d'oxydes de terres rares, soit 420 ans d'approvisionnement mondial de terbium (et aussi 620 ans d'approvisionnement mondial d'Europium, 780 ans de réserve d'yttrium, 730 ans pour dysprosium, selon une publication d'avril 2018 dans Scientific Reports[26] ; cette ressource ne pourrait toutefois pas être exploitée avant 2023 étant donné les coûts et difficultés d'accès[27].
Terbium dans l'univers
Si rare sur la terre, le terbium est un élément qui se trouve dans les objets célestes.
Du terbium a été détecté dans le Soleil par spectroscopie[28], depuis Charles Augustus Young (au-dessus).
En 2023, du terbium une fois ionisé (Tb II en notation spectroscopique, Tb+ en notation chimique) a été détecté, sous forme gazeuse, dans l'atmosphère de KELT-9 b, une exoplanète de type Jupiter ultra-chaud dont la température atteint 4 000 °C. Il semble que l'analyse de cette existence puisse contribuer à déterminer l'âge et l'origine de cette planète particulière[29].
Extraction
.jpg.webp)
Les procédés d'extraction du terbium sont similaires à ceux des autres lanthanides. L'élément est séparé des autres terres rares par des méthodes basées sur l'échange d'ions, qui sont relativement faciles et plus rapides que les techniques de cristallisation fractionnée. Le métal est obtenu à partir de son trifluorure (TbF3) ou de son trichlorure (TbCl3) anhydres par réduction thermique avec le calcium métallique dans un creuset en tantale. Il peut ensuite être purifié par refusion sous vide[24].
Le prix d'un gramme de terbium pur à 99,9 % était d'environ 40 dollars américains en 2015[21].
Utilisations
Propriétés optiques
Les composés des ions trivalents de plusieurs lanthanides fluorescent après stimulation par des rayons UV ou une décharge électrique. Cette particularité en fait des composants de choix pour la conception des luminophores. Ainsi, la fluorescence verte du terbium connaît trois principales applications industrielles : tubes cathodiques des téléviseurs et des écrans d'ordinateurs, tubes fluorescents trichromatiques pour l'éclairage et radiographie médicale (transformation des rayons X en lumière visible)[30].

| Luminophore | Excitation | Application |
|---|---|---|
| Gd2O2S:Tb3+ | Rayons X | Écrans renforçateurs de rayons X |
| Rayon cathodique | Tubes cathodiques (vert) | |
| ZnS:Tb3+ | Électrons | Panneaux électroluminescents |
| LaPO4:Ce,Tb | Rayons UV | Composante verte des tubes fluorescents trichromatiques |
| (Ce,Tb)MgAl11O19 | ||
| (Gd,Ce,Tb)MgB5O10 |
À plus petite échelle, les propriétés optiques du terbium sont également utilisés en biochimie. Ainsi, une méthode spectrophotométrique de détection des spores bactériennes a été proposée. Elle repose sur l'addition de chlorure de terbium à un lysat d'endospores. L'acide dipicolinique, qui est un marqueur chimique unique des spores, chélate l'ion terbium(III) et forme un complexe qui montre une fluorescence intense dans le spectre visible[31].
Enfin, de manière plus anecdotique, la fluorescence verte du terbium est utilisée comme moyen de protection contre la contrefaçon des billets de la monnaie européenne[32].
Autres
- Pile à combustible : stabilisateur des cristaux de ZrO2 dans des cellules.
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- SIGMA-ALDRICH
- Épuisement des ressources naturelles sur eco-info.org et références en fin d'article.
- (en) Episodes from the History of the Rare Earth Elements, Springer Netherlands, coll. « Chemists and Chemistry », (ISBN 9789401066143 et 9789400902879, DOI 10.1007/978-94-009-0287-9), xxi.
- (en) John Emsley, Nature's building blocks : an A-Z guide to the elements, Oxford, Oxford University Press, , 240–242 p. (ISBN 0-19-850341-5, lire en ligne).
- (en) Pieter Thyssen et Koen Binnemans, « Accommodation of the Rare Earths in the Periodic Table », dans Handbook on the Physics and Chemistry of Rare Earths, vol. 41, Elsevier, , 560 p. (lire en ligne).
- (en) Per Enghag, Encyclopedia of the Elements : Technical Data - History - Processing - Applications, John Wiley & Sons, , 1309 p. (lire en ligne).
- (sv) Nils Johan Berlin, « Om de i den blandade ytterjorden befintliga oxider », Forhandlinger ved de skandinaviske Naturforskeres, ottende Møde, Copenhague, , p. 448-454 (lire en ligne).
- (de) Friedrich Otto Popp, « Untersuchung über die Yttererde », Annalen der Chemie und Pharmacie, Justus Freiherr von Liebig, vol. 55, , p. 179-201 (lire en ligne).
- Marc Delafontaine, « Sur les métaux de la gadolinite », Bulletin de la Société chimique de Paris, t. 3, , p. 415-418, lire en ligne sur Gallica.
- (de) Johan Bahr et Robert Bunsen, « Ueber Erbinerde Und Yttererde », Annalen der Chemie und Pharmacie, vol. 61, , p. 1-34 (lire en ligne).
- Per Teodor Cleve et Otto Magnus Höglund, « Sur les combinaisons de l'yttrium et de l'erbium », Bulletin de la Société chimique de Paris, t. 18, , p. 193-201 (lire en ligne).
- (en) C.H. Evans, Episodes from the History of the Rare Earth Elements, Springer Science & Business Media, , 268 p. (lire en ligne).
- Marc Delafontaine, Archives des sciences physiques et naturelles, (présentation en ligne), p. 184.
- John Lawrence Smith, « Le Mosandrum, un nouvel élément », Comptes rendus hebdomadaires des séances de l'Académie des sciences, t. 87, , p. 148-151, lire en ligne sur Gallica
- Jean Charles Marignac, « Observation sur la découverte, annoncée par M. L. Smith, d'une nouvelle terre appartenant au groupe du cérium », Comptes rendus hebdomadaires des séances de l'Académie des sciences, t. 87, , p. 281-283, lire en ligne sur Gallica
- Marc Delafontaine, « Sur le Mosandrum, de M. Lawrence Smith », Comptes rendus hebdomadaires des séances de l'Académie des sciences, t. 87, , p. 600-602, lire en ligne sur Gallica
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 96e éd., 2677 p. (ISBN 9781482260960)
- (en) Mike Jackson, « Magnetism of Rare Earth », The IRM quarterly, vol. 10, no 3, , p. 1-8 (lire en ligne [PDF]).
- (en) Pekka Hänninen et Harri Härmä, Lanthanide Luminescence : Photophysical, Analytical and Biological Aspects, Springer Science & Business Media, , 388 p. (lire en ligne).
- (en) Pradyot Patnaik, Handbook of Inorganic Chemicals, McGraw-Hill, , 1086 p. (ISBN 978-0-07-049439-8, présentation en ligne).
- (en) Georges Audi, O. Bersillon, J. Blachot et A.H. Wapstra, « The NUBASE Evaluation of Nuclear and Decay Properties », Nuclear Physics A, vol. 729, no 3, , p. 3–128 (lire en ligne [PDF]).
- (en)The tremendous potential of deep-sea mud as a source of rare-earth elements, Nature, 10 avril 2018.
- Science (2018), Global trove of rare earth metals found in Japan’s deep-sea mud par Roni Dengler | 13 avril 2018
- Observatoire du Mont Wilson, Contribution from the Mount Wilson Observatory, p. 372, Carnegie Institution of Washington, 1929 [lire en ligne]
- Morgane Gillard, « Des pluies d'un métal très rare découvertes sur la planète la plus chaude de la Galaxie », Futura Sciences, (lire en ligne)
- (en) NPCS Board of Consultants & Engineers, Handbook on Rare Earth Metals and Alloys : Properties, Extraction, Preparation and Applications, Asia Pacific Business Press Inc., , 688 p. (ISBN 978-81-7833-120-1, lire en ligne).
- (en) D.L. Rosen, C. Sharpless et L.B. McGown, « Bacterial spore detection and determination by use of terbium dipicolinate photoluminescence », Analytical Chemistry, no 69, , p. 1082–1085.
- (en) Brian Wardle, « Lanthanide luminescence », dans Principles and Applications of Photochemistry, John Wiley & Sons, , 264 p., p. 74-76.
Voir aussi
Liens externes
- (en) « Technical data for Terbium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||


