Silicium
Le silicium est l'élément chimique de numéro atomique 14, de symbole Si. Ce métalloïde tétravalent appartient au groupe 14 du tableau périodique. C'est l'élément le plus abondant dans la croûte terrestre après l'oxygène, soit 25,7 % de sa masse[8], mais il n'est comparativement présent qu'en relativement faible quantité dans la matière constituant le vivant. Il n'existe pas dans la nature à l'état de corps simple, mais sous forme de composés : sous forme de dioxyde de silicium (SiO2), d'origine biogénique (fabriqué par un organisme vivant comme les diatomées ou les radiolaires), on le trouve sous forme de silice amorphe (dans le sable), ou d'origine lithogénique lorsqu'il est sous la forme de silice minérale (le quartz, la cristobalite, etc.) ou d'autres silicates (dans les feldspaths, la kaolinite…).
| Silicium | |||||||||||
Morceau de wafer poli et bloc de silicium pur. | |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Si | ||||||||||
| Nom | Silicium | ||||||||||
| Numéro atomique | 14 | ||||||||||
| Groupe | 14 | ||||||||||
| Période | 3e période | ||||||||||
| Bloc | Bloc p | ||||||||||
| Famille d'éléments | Métalloïde | ||||||||||
| Configuration électronique | [Ne] 3s2 3p2 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 4 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 28,085 5 ± 0,000 3 u[1] | ||||||||||
| Rayon atomique (calc) | 110 pm (111 pm) | ||||||||||
| Rayon de covalence | 111 ± 2 pm[2] | ||||||||||
| Rayon de van der Waals | 210 pm | ||||||||||
| État d’oxydation | +1, +2, +3, +4 | ||||||||||
| Électronégativité (Pauling) | 1,90 | ||||||||||
| Oxyde | amphotère | ||||||||||
| Énergies d’ionisation[3] | |||||||||||
| * 1re : 8,151 68 eV | * 8e : 303,54 eV | ||||||||||
| * 2e : 16,345 84 eV | * 9e : 351,12 eV | ||||||||||
| * 3e : 33,493 02 eV | * 10e : 401,37 eV | ||||||||||
| * 4e : 45,141 81 eV | * 11e : 476,36 eV | ||||||||||
| * 5e : 166,767 eV | * 12e : 523,42 eV | ||||||||||
| * 6e : 205,27 eV | * 13e : 2 437,63 eV | ||||||||||
| * 7e : 246,5 eV | * 14e : 2 673,182 eV | ||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | solide diamagnétique | ||||||||||
| Autres allotropes | Silicène | ||||||||||
| Masse volumique | 2,33 g·cm-3 (25 °C)[1] | ||||||||||
| Système cristallin | Cubique diamant | ||||||||||
| Dureté (Mohs) | 6,50 | ||||||||||
| Couleur | gris foncé | ||||||||||
| Point de fusion | 1 414 °C[1] | ||||||||||
| Point d’ébullition | 3 265 °C[1] | ||||||||||
| Énergie de fusion | 50,55 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 384,22 kJ·mol-1 | ||||||||||
| Volume molaire | 12,06×10-6 m3·mol-1 | ||||||||||
| Pression de vapeur | 4,77 Pa | ||||||||||
| Vitesse du son | 8 433 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 700 J·kg-1·K-1
|
||||||||||
| Conductivité électrique | 2,52×10-4 S·m-1 | ||||||||||
| Bande interdite à 300 K | 1,12 eV | ||||||||||
| Conductivité thermique | 148 W·m-1·K-1 | ||||||||||
| Divers | |||||||||||
| No CAS | [5] | ||||||||||
| No ECHA | 100.028.300 | ||||||||||
| No CE | 231-130-8 | ||||||||||
| Précautions | |||||||||||
| SGH[6] | |||||||||||
État pulvérulent : Attention |
|||||||||||
| SIMDUT[7] | |||||||||||
 B4, |
|||||||||||
| Transport[6] | |||||||||||
État pulvérulent :
|
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Sous sa forme amorphe, la silice (SiO2) provenant généralement de la terre de diatomées, est utilisée depuis très longtemps comme composant essentiel du verre. Il a depuis le milieu du XXe siècle de nouveaux usages en électronique (transistor), pour la production de matériaux tels que les silicones ou, pour fabriquer des panneaux solaires photovoltaïques et en tant que biominéral, la silice amorphe est actuellement étudiée pour ses utilités en nanotechnologie[9].
Le nom dérive du latin silex, silicĭs qui signifie caillou ou silex[10] - [11].
Histoire
En raison de l'abondance de silicium dans la croûte terrestre, des matériaux naturels à base de silicium sont utilisés depuis des milliers d'années. Les cristaux de roche de silicium sont connus de diverses civilisations anciennes, comme les Égyptiens prédynastiques qui les utilisaient pour fabriquer des perles et des petits vases, ainsi que les Chinois de l'Antiquité. Du verre contenant de la silice est fabriqué par les Égyptiens depuis au moins 1500 av. J.-C. ainsi que par les anciens Phéniciens. Les composés de silicate naturel sont également utilisés dans divers types de mortier pour la construction des premières logements[12].
Découverte

En 1787, Antoine Lavoisier soupçonne que la silice pourrait être l'oxyde d'un élément chimique fondamental, mais l'affinité chimique du silicium pour l'oxygène est trop élevée pour qu'il puisse réduire l'oxyde et isoler l'élément[13]. Après une tentative d'isolement du silicium en 1808, Sir Humphry Davy propose le nom anglais de « silicium », du latin « silex », « silicis » pour silex, et en ajoutant la terminaison « -ium » parce qu'il croit qu'il s'agit d'un métal[14]. La plupart des autres langues utilisent dès lors des formes translitérées du nom de Davy, parfois adaptées à la phonologie locale (par exemple, en allemand : Silizium ; en turc : silisyum ; en catalan : silici). Quelques autres utilisent plutôt un calque de la racine latine (par exemple, en russe : кремний, de « кремень », « silex » ; en grec moderne : hπυρίτιο de « πυρ », « feu » ; en finnois : pii de « piikivi », « silex » ; en tchèque : křemík de « křemen », « quartz » ou « silex »)[15].
En 1811, Joseph Louis Gay-Lussac et Louis Jacques Thénard auraient préparé du silicium amorphe impur en chauffant du potassium métallique récemment isolé avec du tétrafluorure de silicium, mais ils n'ont ni purifié et caractérisé le produit, ni identifié comme un nouvel élément[16]. En anglais, le silicium est renommé « silicon » en 1817 par le chimiste écossais Thomas Thomson, qui pense qu'il s'agit d'un non-métal comme le bore (« boron » en anglais) et le carbone (« carbon »)[17]. En 1824, Jöns Jacob Berzelius prépare du silicium amorphe en utilisant une méthode similaire à celle de Gay-Lussac, mais il purifie le produit par des lavages répétés pour obtenir une poudre brune[18]. Il est ainsi généralement considéré comme celui qui a découvert le silicium[19] - [20].
Le silicium sous sa forme cristalline plus courante n'a été préparé que 31 ans plus tard, par Henri Sainte-Claire Deville[21]. En électrolysant un mélange de chlorure de sodium et de chlorure d'aluminium contenant environ 10 % de silicium, il obtient un allotrope légèrement impur de silicium en 1854[22]. Par la suite, des méthodes plus rentables sont mises au point pour isoler plusieurs formes d'allotrope, la plus récente étant le silicène en 2010[23] - [24]. Pendant ce temps, la recherche sur la chimie du silicium se poursuit : Friedrich Wöhler découvre les premiers hydrures volatils de silicium, synthétisant le trichlorosilane en 1857 et le silane lui-même en 1858, mais une étude détaillée des silanes n'est menée qu'au début du XXe siècle par Alfred Stock, malgré des spéculations sur le sujet remontant aux débuts de la chimie organique synthétique dans les années 1830. De même, le premier composé organosilicié, le tétraéthylsilane, est synthétisé par Charles Friedel et James Mason Crafts en 1863, mais la caractérisation détaillée de la chimie des organosiliciés n'est réalisée qu'au début du XXe siècle par Frederic Kipping[13].
À partir des années 1920, les travaux de William Lawrence Bragg sur la cristallographie aux rayons X permettent d'élucider les compositions des silicates, qui étaient auparavant connues par la chimie analytique mais n'avaient pas encore été comprises, ainsi que le développement de la cristallochimie par Linus Pauling et celui de la géochimie par Victor Goldschmidt. Le milieu du XXe siècle voit le développement de la chimie et de l'utilisation industrielle des siloxanes et l'utilisation croissante des polymères, élastomères et résines de silicone. À la fin du XXe siècle, la complexité de la chimie cristalline des siliciures est cartographiée, ainsi que la physique de l'état solide des semi-conducteurs dopés[13].
Semi-conducteurs en silicium
Les premiers composants semi-conducteurs n'utilisaient pas de silicium, mais de la galène[25] - [26]. Le premier dispositif semi-conducteur en silicium est un détecteur à cristal radio en silicium, mis au point par l'ingénieur américain Greenleaf Whittier Pickard en 1906[26].
En 1940, Russell Ohl découvre la jonction p-n et les effets photovoltaïques du silicium. En 1941, des techniques de production de cristaux de germanium et de silicium de haute pureté (en) sont mises au point pour les cristaux des détecteurs radar à micro-ondes pendant la Seconde Guerre mondiale[25]. En 1947, le physicien William Shockley théorise un transistor à effet de champ fabriqué à partir de germanium et de silicium, mais il ne réussit pas à construire un dispositif fonctionnel, avant de travailler finalement avec du germanium. Le premier transistor fonctionnel est un transistor à contact ponctuel (en) construit par John Bardeen et Walter Brattain plus tard dans l'année alors qu'ils travaillent sous la direction de Shockley[27]. En 1954, le physico-chimiste Morris Tanenbaum fabrique le premier transistor bipolaire en silicium aux laboratoires Bell[28]. En 1955, Carl Frosch et Lincoln Derick découvrent par hasard aux laboratoires Bell que le dioxyde de silicium (SiO2) peut être obtenu sur du silicium[29], et ils proposent en 1958 que cela puisse masquer les surfaces de silicium pendant les processus de diffusion (en)[30].
Âge du silicium
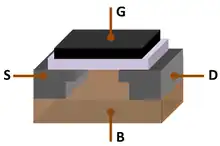
L'« âge du silicium » fait référence à la fin du XXe siècle et au début du XXIe siècle[31] - [32] - [33], car le silicium est le matériau dominant de l'ère de l'information, également connue sous le nom d'ère du numérique, de la même manière que l'âge de la pierre, l'âge du bronze et l'âge du fer ont été définis par des matériaux dominants au cours de la Préhistoire[31].
Le silicium étant un élément important des dispositifs semi-conducteurs de haute technologie, de nombreux endroits dans le monde portent son nom. Par exemple, la vallée de Santa Clara en Californie a acquis le surnom de Silicon Valley, car cet élément est le matériau de base de l'industrie des semi-conducteurs dans cette région[34]. Depuis, de nombreux autres endroits ont été surnommés de la même manière, notamment Silicon Wadi en Israël, Silicon Forest en Oregon, Silicon Saxony en Allemagne, Silicon Valley Bangalore en Inde, Silicon Fen à Cambridge en Angleterre, Silicon Alley à New York et Silicon Beach à Los Angeles en Californie[35] - [36] - [37] - [38] - [39].
Isotopes
Il existe trois isotopes naturels du silicium, tous stables : 28Si (92,18 %), 29Si (4,71 %) et 30Si (3,12 %). Il existe également des isotopes artificiels, instables : 25Si, 26Si et 27Si qui sont émetteurs β+, ainsi que 31Si à 34Si qui sont émetteurs β−.
Corps simple
Le silicium est solide dans les conditions normales de température et de pression, avec sous 1 atm un point de fusion de 1 414 °C et un point d'ébullition de 3 265 °C. Comme l'eau, il est plus dense à l'état liquide[40] qu'à l'état solide, contrairement à la plupart des autres substances. C'est par ailleurs un assez bon conducteur de la chaleur (conductivité thermique : 149 W m−1 K−1).
Sous forme cristalline, le silicium pur est gris avec des reflets métalliques bleutés. Comme le germanium, il est peu déformable et très cassant. Comme le carbone et le germanium, il cristallise dans le système cubique (structure diamant). Les cristaux de silicium sont gris à noirs, en forme d'aiguilles ou d'hexaèdres. Le silicium est semi-conducteur, sa conductivité électrique est très inférieure à celle des métaux.
Il existe deux autres allotropes du silicium : le silicyne où les atomes de silicium sont reliés en chaînes, et le silicène où ils forment des couches planes.
Le silicium existe aussi à l'état amorphe, sous la forme d'une poudre marron foncé.
Le silicium s'oxyde très vite à l'air pour former une couche de silice en surface, qui isole l'échantillon de l'oxygène et le protège d'une oxydation plus poussée (passivation) ; cette couche d'oxyde peut être éliminée par de l'acide fluorhydrique HF ou par abrasion thermique. Insoluble dans l'eau sauf à haute température, le silicium est attaqué par l'acide fluorhydrique HF ou par un mélange acide fluorhydrique/acide nitrique (HNO3) en fonction de la phase.
 Poudre de silicium.
Poudre de silicium. Échantillon monolithique de silicium (polycristallin).
Échantillon monolithique de silicium (polycristallin).
Cristallographie
Le silicium a une structure de type diamant (comme le germanium et la forme diamant du carbone), avec un paramètre de maille de 0,543 071 0 nm[41].
Occurrence

Le silicium est le huitième élément le plus abondant dans l'univers, après l'hydrogène, l'hélium, le carbone, l'azote, l'oxygène, le fer et le néon. Ces abondances ne sont pas bien reproduites sur Terre en raison de la séparation des éléments qui a eu lieu pendant la formation du système solaire. Le silicium constitue 27,2 % de la masse de la croûte terrestre, juste derrière l'oxygène à 45,5 %, avec lequel le silicium est toujours associé dans la nature. La différenciation planétaire à la formation de la Terre a donné lieu à une répartition des éléments encore plus fractionnée : le noyau terrestre, qui représente 31,5 % de la masse de la Terre, a une composition approximative de Fe25Ni2Co0.1S3 ; le manteau, qui représente 68,1 % de la masse de la Terre, est composé principalement d'oxydes et de silicates plus denses, comme l'olivine, (Mg,Fe)2SiO4 ; des minéraux siliceux plus légers, tels que les aluminosilicates, forment la croûte terrestre, qui représente 0,4 % de la masse de la Terre[42].
La cristallisation des roches ignées à partir du magma dépend d'un certain nombre de facteurs, parmi lesquels la composition chimique du magma, la vitesse de refroidissement et certaines propriétés des minéraux individuels à former, comme l'énergie réticulaire, le point de fusion et la complexité de leur structure cristalline. Au fur et à mesure que le magma se refroidit, l'olivine apparaît en premier, suivie par le pyroxène, l'amphibole, le mica biotite, le feldspath orthoclase, le mica muscovite, le quartz, les zéolithes et, enfin, les minéraux hydrothermaux. Cette séquence montre que la complexité des unités contenant du silicium augmente avec le refroidissement et l'introduction d'anions hydroxydes et fluorures en plus des oxydes ont un impact. De nombreux métaux peuvent remplacer le silicium. Après que ces roches ignées ont subi la météorisation, le transport et le dépôt, des roches sédimentaires comme l'argile, le schiste et le grès se forment. Le métamorphisme peut également se produire à des températures et des pressions élevées, créant une variété encore plus grande de minéraux[43].
Il existe quatre sources de flux de silicium dans l'océan : l'altération chimique des roches continentales, le transport fluvial, la dissolution des silicates terrigènes continentaux et la réaction entre les basaltes sous-marins et les fluides hydrothermaux qui libèrent du silicium dissous. Ces quatre flux sont interconnectés dans le cycle biogéochimique de l'océan car ils ont tous été initialement formés à partir de l'altération de la croûte terrestre[44].
Environ 300 à 900 mégatonnes de poussière sont déposées dans les océans du monde par le vent chaque année. De cette valeur, 80 à 240 mégatonnes se présentent sous la forme de particules de silicium. La quantité totale de particules de silicium déposée dans l'océan par le vent est inférieure à la quantité de silicium introduite dans l'océan par le biais du transport fluvial[45]. Les apports du vent de particules de silicium lithogénique dans l'océan Atlantique Nord et l'ouest du Pacifique Nord proviennent respectivement du Sahara et du désert de Gobi[44]. Le transport fluvial est la principale source d'introduction de silicium dans l'océan dans les régions côtières, tandis que le dépôt de silicium en haute mer est grandement influencé par le dépôt de la poussière par le vent[44].
Production industrielle
Le silicium d'une pureté de 96 à 99 % est obtenu en réduisant du quartzite ou du sable avec du coke très pur. La réduction s'effectue dans un four à arc électrique, un excès de dioxyde de silicium étant utilisé pour empêcher l'accumulation de carbure de silicium[46] :
- SiO2 + 2 C → Si + 2 CO
- 2 SiC + SiO2 → 3 Si + 2 CO
Cette réaction, connue sous le nom de réduction carbothermique du dioxyde de silicium, est généralement réalisée en présence de ferraille contenant de faibles quantités de phosphore et de soufre, produisant ainsi du ferrosilicium, un alliage fer-silicium qui contient des ratios variables de silicium élémentaire et de fer[46]. En 2021, le ferrosilicium a représenté près de 70 % de la production mondiale de silicium élémentaire et la Chine a fourni près de 70 % du silicium mondial, soit six millions de tonnes. Le deuxième plus gros producteur est la Russie (580 000 t), suivi par le Brésil (390 000 t), la Norvège (350 000 t), et les États-Unis (310 000 t)[47]. Le ferrosilicium est principalement utilisé par l'industrie du fer et de l'acier, notamment comme addition d'alliage dans le fer ou l'acier et pour la désoxydation de l'acier dans les aciéries intégrées[46]. Une autre réaction parfois utilisée est la réduction aluminothermique du dioxyde de silicium, comme suit[48] :
- 3 SiO2 + 4 Al → 3 Si + 2 Al2O3
La lixiviation à l'eau de silicium pur à 96-97 % en poudre permet d'obtenir un silicium pur à 98,5 %, qui est utilisé dans l'industrie chimique. Cependant, une pureté encore plus grande est nécessaire pour les applications de semi-conducteurs, et celle-ci est produite à partir de la réduction du tétrachlorosilane ou du trichlorosilane. Le premier est obtenu en chlorant des déchets de silicium et le second est un sous-produit de la production de silicone. Ces composés sont volatils et peuvent donc être purifiés par distillation fractionnée répétée, suivie d'une réduction en silicium élémentaire avec du zinc métallique très pur comme agent réducteur. Les morceaux de silicium spongieux ainsi produits sont fondus puis cultivés pour former des monocristaux cylindriques, avant d'être purifiés par raffinage en zone. D'autres méthodes utilisent la décomposition thermique du silane ou du tétraiodosilane. Un autre procédé utilisé est la réduction de l'hexafluorosilicate de sodium, un déchet commun de l'industrie des engrais phosphatés, par le sodium métallique : ce procédé est hautement exothermique et ne nécessite donc aucune source de combustible extérieure. Le silicium hyperfin est fabriqué à un degré de pureté supérieur à celui de presque tous les autres matériaux : la production de transistors exige des niveaux d'impureté dans les cristaux de silicium inférieurs à 1 partie par 1010, et dans des cas particuliers, des niveaux d'impureté inférieurs à 1 partie par 1012 sont nécessaires et atteints[46].
Utilisations et applications
Synthèse des silicones
La synthèse des silicones représente également une utilisation importante du silicium (environ 40 % de la consommation). Ces polymères [(CH3)2SiO]n sont utilisés dans des mastics pour joint, des graisses résistantes à l'eau ou conductrices de la chaleur, les poudres lessivielles ou les shampoings conditionneurs, etc.
Semi-conducteur
Les propriétés de semi-conducteur du silicium ont permis la création de la deuxième génération de transistors, puis les circuits intégrés (les « puces »). C'est aujourd'hui encore l'un des éléments essentiels pour l'électronique, notamment grâce à la capacité technologique actuelle permettant d'obtenir du silicium pur à plus de 99,999 99 % (tirage Czochralski, zone fondue flottante).
Photovoltaïque

En tant que semi-conducteur, le silicium est aussi l'élément principal utilisé pour la fabrication de cellules solaires photovoltaïques. Celles-ci sont alors montées en panneaux solaires pour la génération d'électricité.
Composants mécaniques
Le silicium présente à l'état pur des caractéristiques mécaniques élevées qui le font utiliser pour la réalisation de petites pièces destinées à certains micromécanismes et même à la fabrication de ressorts spiraux destinés à des montres mécaniques haut de gamme[49].
Alliages aluminium-silicium
La principale utilisation du silicium en tant que corps simple est comme élément d'alliage avec l'aluminium. Les alliages aluminium-silicium (AS ou série 40000 suivant NF EN 1780-1, également appelés « sialumins ») sont utilisés pour l'élaboration de pièces moulées, en particulier pour l'automobile (par exemple jantes en alliage) et l'aéronautique (par exemple éléments de moteurs électriques embarqués). Les alliages aluminium-silicium représentent à peu près 55 % de la consommation mondiale de silicium. L'alliage le plus connu est l'Alpax, proche de la composition eutectique (env. 13 %m de Si).
Micro et nanostructure
Du fait de la performance des procédés de gravure et de formation de forme avec le silicium, le silicium est utilisé pour :
- la formation de silicium nanoporeux pour dissocier l'hydrogène de l'oxygène de molécule d'eau dans les piles à combustibles ;
- la formation de nanopics sur une surface de silicium par Gravure Ionique Réactive (RIE) en vue de relier des puces de semi-conducteur[50].
Composés
Outre les propriétés du silicium élémentaire, de nombreux composés du silicium possèdent des applications. Parmi les plus connus :
- la silice se trouve dans la nature sous forme compacte (galets, quartz filonien par exemple), ou sous forme de sable plus ou moins fin. On l'obtient aussi industriellement, sous forme pulvérulente (silice synthétique). Elle a de nombreux usages :
- le verre est fabriqué depuis des millénaires en faisant fondre du sable principalement composé de SiO2 avec du carbonate de calcium CaCO3 et du carbonate de sodium Na2CO3. Le verre peut être amélioré par différents additifs,
- le sable de silice est un des composants des céramiques,
- le quartz forme de superbes cristaux. Il est utilisé comme matériau transparent, plus résistant à la chaleur que le verre (ampoule de lampes halogènes). Il est également beaucoup plus difficile à fondre et à travailler,
- la silice intervient aux côtés du noir de carbone dans la fabrication des pneumatiques économes en énergie (pneus « verts »),
- la silice très fine est utilisée comme adjuvant pour les bétons à haute performance ;
- le ferrosilicium et le silico-calcium sont utilisés comme éléments d'addition dans l'élaboration d'aciers ou de fontes ;
- le carbure de silicium possède une structure cristalline analogue à celle du diamant ; sa dureté en est très proche. Il est utilisé comme abrasif ou sous forme céramique dans les outils d'usinage ;
- le silicate de calcium CaSiO3 est un des composants des ciments.
Datation
Le silicium 32 peut être utilisé en datation radiométrique pour déterminer des âges de l'ordre du siècle[51].
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, , 87e éd. (ISBN 0849304873), p. 10-202
- (en) « Silicon », sur NIST/WebBook, consulté le 28 juin 2010
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Fiche Sigma-Aldrich du composé Silicon powder, 99.9995% trace metals basis, consultée le 23 août 2018.
- « Silicium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- WebElements Periodic Table of the Elements — Silicon
- (en) Kröger, N., and E. Brunner. 2014. Complex-shaped microbial biominerals for nanotechnology: Complex-shaped microbial biominerals for nanotechnology. Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol. 6: 615–627.
- Jean-Louis Vigne, « Silicium », sur lelementarium.fr, Société Chimique de France & France Chimie (consulté le )
- Dictionnaire Gaffiot Latin-Français 1934, entrée silex, p. 1442.
- (en) « Silicon »
 , sur www.britannica.com (consulté le ).
, sur www.britannica.com (consulté le ). - Greenwood et Earnshaw 1997, p. 328.
- (en) Humphry Davy, « Electro chemical researches, on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia », Philosophical Transactions of the Royal Society of London, W. Bowyer and J. Nichols, vol. 98, , p. 353 (lire en ligne).
- (en) « 14 Silicon »
 , sur Elements.vanderkrogt.net (consulté le ).
, sur Elements.vanderkrogt.net (consulté le ). - Joseph Louis Gay-Lussac et Louis Jacques baron Thénard, Recherches physico-chimiques, faites sur la pile: sur la préparation chimique et les propriétés du potassium et du sodium; sur la décomposition de l'acide boracique; sur les acides fluorique, muriatique et muriatique oxigéné; sur l'action chimique de la lumière; sur l'analyse végétale et animale, etc, Deterville, (lire en ligne), p. 313-314.
- Thomas Thomson, Charles Baldwin, William Blackwood et Cradock Baldwin, A system of chemistry : in four volumes, (lire en ligne), p. 252.
- (en) « On the mode of obtaining silicium, and on the characters and properties of that substance », The Philosophical Magazine and Journal: Comprehending Various Branches of Science, the Liberal and Fine Arts, Agriculture, Manufactures, and Commerce, Richard Taylor and Company, vol. 65, , p. 254-267 (lire en ligne).
- (en) Mary Elvira Weeks, « The discovery of the elements: XII. Other elements isolated with the aid of potassium and sodium: beryllium, boron, silicon, and aluminum », Journal of Chemical Education, vol. 9, no 8, , p. 1386-1412 (DOI 10.1021/ed009p1386, Bibcode 1932JChEd...9.1386W)
- (en) M.G. Voronkov, « Silicon era », Russian Journal of Applied Chemistry, vol. 80, no 12, , p. 2190 (DOI 10.1134/S1070427207120397, S2CID 195240638)
- (en) « Information on silicon - history, thermodynamic, chemical, physical and electronic properties »
 , sur Etacude (consulté le ).
, sur Etacude (consulté le ). - (en) « Silicon: History » [archive du ]
 , sur Nautilus.fis.uc.pt,
, sur Nautilus.fis.uc.pt, - (en) B. Aufray, A. Kara, S. B. Vizzini, H. Oughaddou, C. LéAndri, B. Ealet et G. Le Lay, « Graphene-like silicon nanoribbons on Ag(110): A possible formation of silicene », Applied Physics Letters, vol. 96, no 18, , p. 183102 (DOI 10.1063/1.3419932, Bibcode 2010ApPhL..96r3102A, lire en ligne).
- (en) B. Lalmi, H. Oughaddou, H. Enriquez, A. Kara, S. B. Vizzini, B. N. Ealet et B. Aufray, « Epitaxial growth of a silicene sheet », Applied Physics Letters, vol. 97, no 22, , p. 223109 (DOI 10.1063/1.3524215, Bibcode 2010ApPhL..97v3109L, arXiv 1204.0523, S2CID 118490651).
- (en) « Timeline »
 , sur The Silicon Engine, Musée de l'Histoire de l'ordinateur (consulté le ).
, sur The Silicon Engine, Musée de l'Histoire de l'ordinateur (consulté le ). - (en) « 1901: Semiconductor Rectifiers Patented as "Cat's Whisker" Detectors »
 , sur The Silicon Engine, Musée de l'Histoire de l'ordinateur (consulté le ).
, sur The Silicon Engine, Musée de l'Histoire de l'ordinateur (consulté le ). - (en) « 1947: Invention of the Point-Contact Transistor »
 , sur The Silicon Engine, Musée de l'Histoire de l'ordinateur (consulté le ).
, sur The Silicon Engine, Musée de l'Histoire de l'ordinateur (consulté le ). - (en) « 1954: Morris Tanenbaum fabricates the first silicon transistor at Bell Labs »
 , sur The Silicon Engine, Musée de l'Histoire de l'ordinateur (consulté le ).
, sur The Silicon Engine, Musée de l'Histoire de l'ordinateur (consulté le ). - (en) Ross Knox Bassett, To the Digital Age: Research Labs, Start-up Companies, and the Rise of MOS Technology, Johns Hopkins University Press, , 22-23 p. (ISBN 978-0-8018-8639-3, lire en ligne).
- (en) A. Saxena, Invention of integrated circuits: untold important facts, World Scientific, coll. « International series on advances in solid state electronics and technology », , 96-97 p. (ISBN 978-981-281-445-6, lire en ligne).
- (en) Leonard C. Feldman, Fundamental Aspects of Silicon Oxidation, Springer Science+Business Media, , 1–11 p. (ISBN 978-3-540-41682-1, lire en ligne), « Introduction »
- (en) Jarek Dabrowski et Hans-Joachim Müssig, Silicon Surfaces and Formation of Interfaces: Basic Science in the Industrial World, World Scientific, , 3-13 p. (ISBN 978-981-02-3286-3, lire en ligne), « 1.2. The Silicon Age »
- (en) Paul Siffert et Eberhard Krimmel, Silicon: Evolution and Future of a Technology, Springer Science+Business Media, (ISBN 978-3-662-09897-4, lire en ligne), « Preface »
- (en) T. Uskali et D. Nordfors, « The role of journalism in creating the metaphor of Silicon Valley » [archive du ], Innovation Journalism 4 Conference, Stanford University, (consulté le ).
- « Semi-conducteurs : la « Silicon Saxony », en Allemagne, espère profiter du plan européen »
 , sur Le Monde.fr, (consulté le ).
, sur Le Monde.fr, (consulté le ). - Sophie GUILLERMIN-GOLET, « Bangalore, la Silicon Valley indienne »
 , sur Les Yeux du Monde, (consulté le ).
, sur Les Yeux du Monde, (consulté le ). - « La Silicon Valley n’est plus ce qu’elle était »
 , sur Courrier international, (consulté le ).
, sur Courrier international, (consulté le ). - « A New York, la "Silicon Alley" rivalise de séduction face à la "Silicon Valley" »
 , sur La Tribune, 2013-11-06cet15:52:00+0100 (consulté le ).
, sur La Tribune, 2013-11-06cet15:52:00+0100 (consulté le ). - « La Silicon Beach essaie de détrôner la Silicon Valley »
 , sur Le Temps, (ISSN 1423-3967, consulté le ).
, sur Le Temps, (ISSN 1423-3967, consulté le ). - L'anomalie dilatométrique : l'eau, le silicium, le bismuth...etc...(site futura-sciences)
- (en) William C. O'Mara, Robert B. Herring et Lee P. Hunt, Handbook of semiconductor silicon technology, Park Ridge, N.J, Noyes Publications, , 795 p. (ISBN 978-0-8155-1237-0, OCLC 20825221), p. 349-352.
- Greenwood et Earnshaw 1997, p. 329-330.
- Greenwood et Earnshaw 1997, p. 329.
- (en) Paul J. Tréguer et Christina L. De La Rocha, « The World Ocean Silica Cycle », Annual Review of Marine Science, vol. 5, no 1, , p. 477-501 (PMID 22809182, DOI 10.1146/annurev-marine-121211-172346).
- (en) Ina Tegen et Karen Kohfeld, Atmospheric transport of silicon, Island Press, , 81-91 p. (ISBN 1-59726-115-7).
- Greenwood et Earnshaw 1997, p. 330-331.
- (en) Mineral Commodity Summaries 2022 - Silicon, Reston, Institut d'études géologiques des États-Unis, (présentation en ligne, lire en ligne).
- Zulehner, Neuer et Rau 2000, p. 574.
- Voir le document .
- Article de la Vigie Optoélectronique de l'Agence pour la Diffusion de l’Information Technologique (Adit), numéro 116, octobre 2006, Lire en ligne
- Étienne Roth (dir.), Bernard Poty (dir.), Robert Delmas et al. (préf. Jean Coulomb), Méthodes de datation par les phénomènes nucléaires naturels, Paris, Éditions Masson, coll. « Collection CEA », , 631 p. (ISBN 2-225-80674-8), chap. 17 (« Silicium 32 et argon 39 »)
Voir aussi
Bibliographie
- Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 978-0-08-037941-8).

- (en) Werner Zulehner, Bernd Neuer et Gerhard Rau, « Silicon », dans Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a23_721).

Articles connexes
- Silicène et Silicyne
- Silicium amorphe
- Silicium monocristallin
- Silicium polycristallin
- Silicium 42
- Silicium poreux
- Silicium noir
- Biochimies hypothétiques
- Silsesquioxane
Liens externes
- Un site consacré à la biologie du silicium
- (en) « Technical data for Silicon » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- (en) Solar Grade Silicon: Show stopper or infinite source, sur le site jointsolarpanel.nl
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||




