Zinc
Le zinc (prononciation /zɛ̃g/ en France[7], /zɛ̃k/ au Canada, /zɛ̃/ en Suisse) est l'élément chimique de numéro atomique 30 et de symbole Zn. Le corps simple zinc est un métal.
| Zinc | |||||||||||

| |||||||||||
| |||||||||||
| Position dans le tableau périodique | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Zn | ||||||||||
| Nom | Zinc | ||||||||||
| Numéro atomique | 30 | ||||||||||
| Groupe | 12 | ||||||||||
| Période | 4e période | ||||||||||
| Bloc | Bloc d | ||||||||||
| Famille d'éléments | Métal pauvre ou métal de transition | ||||||||||
| Configuration électronique | [Ar] 3d10 4s2 | ||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 2 | ||||||||||
| Propriétés atomiques de l'élément | |||||||||||
| Masse atomique | 65,409 ± 0,004 u[1] | ||||||||||
| Rayon atomique (calc) | 135 pm (142 pm) | ||||||||||
| Rayon de covalence | 122 ± 4 pm[2] | ||||||||||
| Rayon de van der Waals | 139 pm | ||||||||||
| État d’oxydation | 2 | ||||||||||
| Électronégativité (Pauling) | 1,65 | ||||||||||
| Oxyde | amphotère | ||||||||||
| Énergies d’ionisation[1] | |||||||||||
| 1re : 9,394 199 eV | 2e : 17,964 39 eV | ||||||||||
| 3e : 39,723 eV | 4e : 59,4 eV | ||||||||||
| 5e : 82,6 eV | 6e : 108 eV | ||||||||||
| 7e : 134 eV | 8e : 174 eV | ||||||||||
| 9e : 203 eV | 10e : 238 eV | ||||||||||
| 11e : 274 eV | 12e : 310,8 eV | ||||||||||
| 13e : 419,7 eV | 14e : 454 eV | ||||||||||
| 15e : 490 eV | 16e : 542 eV | ||||||||||
| 17e : 579 eV | 18e : 619 eV | ||||||||||
| 19e : 698 eV | 20e : 738 eV | ||||||||||
| 21e : 1 856 eV | |||||||||||
| Isotopes les plus stables | |||||||||||
| Propriétés physiques du corps simple | |||||||||||
| État ordinaire | solide (diamagnétique) | ||||||||||
| Masse volumique | 7,134 g·cm-3 (25 °C)[1] | ||||||||||
| Système cristallin | Hexagonal compact | ||||||||||
| Dureté (Mohs) | 2,5 | ||||||||||
| Couleur | Gris-bleuté | ||||||||||
| Point de fusion | 419,527 °C (congélation)[3] | ||||||||||
| Point d’ébullition | 907 °C[1] | ||||||||||
| Énergie de fusion | 7,322 kJ·mol-1 | ||||||||||
| Énergie de vaporisation | 115,3 kJ·mol-1 | ||||||||||
| Volume molaire | 9,16×10-6 m3·mol-1 | ||||||||||
| Pression de vapeur | 192,2 Pa à 419,53 °C |
||||||||||
| Vitesse du son | 3 700 m·s-1 à 20 °C | ||||||||||
| Chaleur massique | 390 J·kg-1·K-1 | ||||||||||
| Conductivité électrique | 16,6×106 S·m-1 | ||||||||||
| Conductivité thermique | 116 W·m-1·K-1 | ||||||||||
| Solubilité | sol. dans HCl[4] | ||||||||||
| Divers | |||||||||||
| No CAS | [5] | ||||||||||
| No ECHA | 100.028.341 | ||||||||||
| No CE | 231-175-3 | ||||||||||
| Précautions | |||||||||||
| SGH[6] | |||||||||||
État pulvérulent :  Danger |
|||||||||||
| Transport[6] | |||||||||||
| État pulvérulent : |
|||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||
Généralités sur l'élément zinc, histoire et lexicographie
Le zinc est par certains aspects semblable au magnésium dans la mesure où son état d'oxydation courant est +2, donnant un cation de taille comparable à celle de Mg2+. C'est le 24e élément le plus abondant dans l'écorce terrestre. Il possède cinq isotopes naturels stables.
Le zinc est un élément du groupe 12 et de la période 4. Stricto sensu, c'est un métal pauvre, qui ne répond pas à la définition des éléments de transition par l'IUPAC[8] ; en pratique cependant, il est très souvent assimilé aux métaux de transition dans les manuels et de très nombreux ouvrages. Il fait partie du « groupe du zinc », ou groupe IIB, qui comprend, par numéro atomique croissant, 30Zn, 48Cd et 80Hg, éléments caractérisés par deux électrons sur la sous-couche s au-delà d'une sous-couche d complète. La configuration électronique du zinc est [Ar] 3d10 4s2. Zinc et cadmium Cd sont des métaux électropositifs assez semblables, alors que le mercure Hg présente une réactivité encore plus faible et un caractère métallique encore plus noble. Pour les chimistes, le groupe du zinc se distingue nettement des alcalino-terreux, avec des métaux insolubles dans l'eau, ayant des points de fusion et d'ébullition assez bas, de faibles rayons ioniques, et ayant tendance à former des complexes.
Dans le milieu naturel, le zinc est environ 600 fois plus abondant que le cadmium, environ 1 500 fois plus abondant que le mercure.
Histoire
Les minéralogistes considèrent l'espèce minérale, le corps simple ou « métal au sens moderne » connu avant l'Antiquité. Le zinc cassant à température ambiante et qui s'oxyde facilement n'a jamais été considéré comme un « métal antique ». De plus, il n'avait pas grand intérêt directement. De manière pratique, les métallurgistes de l'Antiquité employaient ses minerais mélangés à d'autres minerais de cuivre et/ou d'étain qui permettaient de fabriquer divers laitons et/ou des bronzes ou airains sophistiqués.
Les Anciens qui connaissaient la cadmeia (en grec ancien : καδμεία), petra cadmeïana ou pierre cadméenne, la cadmia déjà extraite dans les mines de la cité thébaine, dénommée en français du XVIIIe siècle la « cadmie », pierre calaminaire ou « calamine », un minéral ou minerai carbonaté de zinc, paraissent avoir connu le corps simple zinc obtenu dans des conditions strictement réductrices[9]. Homère cite ce composant du laiton, et, des idoles principalement à base de zinc probablement mises en forme à chaud ne sont pas inconnues aux temps homériques en Grèce continentale ou îlienne. Il existe aussi des bracelets remplis de zinc, par exemple ceux découverts sur l'île de Rhodes dans l'antique cité de Camiros ou Cadmeiros détruite au Ve siècle av. J.-C., ce qui a permis de donner une estimation bornée sur la période de leur fabrication[10].
La métallurgie indienne produit abondamment du zinc purifié dès le XIIe siècle, à partir de carbonate de zinc et de matières organiques réductrices, comme de la laine usagée. Les marchands arabes, en contact avec les Indiens du Nord l'exportent vers l'Occident et l'Orient. L'Indonésie, puis la Chine semblent en fabriquer de même qualité respectivement un et deux siècles plus tard. Les navigateurs portugais cassent le monopole des caravaniers ou navigateurs arabes. Ils sont bientôt concurrencés par les compagnies hollandaises.
Ce corps simple, autrefois confondu parfois avec de mauvaises variétés d'étain, mais permettant la fabrication directe des laitons, est présenté dans le « livre des forges » de Georgius Agricola qui l'observe fondu près des mines de Silésie en 1546, comme il semble aussi apparaître dans les écrits abscons de Basile Valentin, vers 1650. Il faut attendre en 1695 la préparation publique du zinc à partir de la calamine ou carbonate de zinc, ou à défaut la blende, par le chimiste batave Guillaume Homberg, professeur de chimie du généreux futur duc d'Orléans, et futur régent Philippe. Au XVIIe siècle, la plupart des bronzes d'art sont des « bronzes au zinc », en réalité des bronzes fortement cuivrés avec plus de zinc que d'étain ou de plomb[11]. Le métal zinc favorisant le coulage dans des moules est souvent présent, mais en faible quantité, dans les objets d'art obtenu par moulage
L'industrie du zinc se développe progressivement du milieu du XVIIIe siècle à 1820, où il existe une véritable industrie du zinc[12]. La première fonderie de zinc, procédant par réduction d'oxyde de zinc à l'abri de l'air, est installée par Andreas Margraff entre 1746 et 1749[13]. Les métallurgistes anglais investissent dans la production du zinc, à l'exemple de William Champion fabricant de laitons. Le chimiste liégeois Jean-Jacques Dony perfectionne avant 1810 les procédés à l'usine de la Vieille-Montagne près de Liège.
- ZnO poudre blanche à froid, jaune à chaud + C charbon de bois, chauffage minimal vers 950 °C[14] → Zn métal distillé en retour, puis obtenu à l'état fondu + CO gaz monoxyde de carbone
Le métal zinc est utilisé comme anode dans les premières piles à empilement métallique, par exemple les piles voltaïques au début du XIXe siècle. Les premiers alliages de zinc, plomb et étain sous pression sont mis au point entre 1804 et 1814 : ils permettent d'obtenir des caractères d'imprimerie plus résistants.
Le chimiste britannique Edward Frankland découvre les premiers composés organométalliques à base de zinc (à liaison C - Zn) vers 1850, en appliquant et maîtrisant des techniques de chauffage à reflux et de distillation sous vide ou atmosphère inerte.
L'utilisation du zinc pour le zincage du fer par bain liquide de Zn fondu ou par galvanisation (dépôts d'électrolyse), comme matériau en feuille ou plaque de couverture ou pour système d'évacuation d'eaux de pluie, a permis l'essor de l'architecture de fer, ainsi les halles centrales de Paris, le palais de l'industrie, les nombreux théâtres et gares monumentales de chemin de fer entre 1860 et 1880. Encore dans les années 1980, la moitié du zinc employé dans le monde servait à protéger le fer, aisément dégradé par la corrosion. La recherche sur les alliages de zinc sous pression se poursuit durant l'entre-deux-guerres et débouchent sur des applications industrielles massives.

L'adjectif zincifère qualifie un corps ou une matière qui contiennent du zinc de manière significative, par exemple un minerai zincifère, un sol zincifère. Le zinc est une ressource non renouvelable. Le zingueur, souvent un couvreur-zingueur dans le secteur du bâtiment est l'ouvrier qui manipule et façonne à la bonne mesure les feuilles ou plaques de zinc. Il taille ou coupe avec une pince coupante, maintient avec une pince large, plie à la plieuse ou à la presse-plieuse lourde, martèle ou façonne, met en forme et soude, adapte ces montages à un support plan léger, par exemple sur les tasseaux en bois, en fixant avec des crampons sur rails ou par des lamelles chevauchantes, avec le moins de clous possibles pour éviter les contraintes de dilatation[15]. Le plombier-zingueur désigne un plombier qui est également zingueur, la zinguerie désigne l'ensemble des activités concernant le zinc[16].
Lexicographie
Ce métal importé d'Asie lointaine dès le XIIe siècle se nommait en pratique « étain des Indes ».
C'est le savant Paracelse, tenant de l'iatrochimie, qui donne avant 1526 le nom latin et savant zincum, à ce qu'il affirme désormais être un métal par l'étude de ses qualités chimiques et sa nouvelle classification. Le mot latin est le décalque du terme alémanique Zinke ou Zinken qui signifie « pointe acérée » ou « dent » dans la théorie iatrochimique des pointes acides (expliquant l'acidité avec la sensation sur la langue), et « fourchon », « structure fourchée » ou « forme hachée, découpée ou hachurée » dans la vie paysanne[17]. Une autre explication complémentaire proposée par Paracelse, friand d'association de « morphologies naturelles », est liée à l'apparence de la matière fondue après refroidissement, le zinc refroidi dans un récipient de coulée présentant ces excroissances nommées aujourd'hui dendrites. Ces dépôts de zinc métallique en forme de dendrites ou Zinken, bien connus sous le nom de barbes en cristallographie, apparaissaient lors de la fusion réductrice des minerais de plomb.
Si le mot allemand Zink provient du latin zincum, le mot français est emprunté à l'allemand. Jean de Thévenot, dans ses Relations de divers voyages curieux en 1666, le nomme zinch. Le dictionnaire de Richelet, en respectant la prononciation française courante vers 1680, le simplifie provisoirement en zin ou zain.
Mais la prononciation académique ou technique zɛ̃ɡ (« zing' ») s'impose et se retrouve dans la famille de ce mot qui s'élargit de la fin du XVIIIe siècle au début du XXe siècle, avec le verbe « zinguer », les mots dérivés (parfois de plus en plus polysémiques) zingueur, zinguerie (1870, Larousse), « zincage » ou zingage, zincographie (1852, Dumont), l'adjectif zincifère (1840, Académie)... sans oublier les termes de minéralogie zincite, zincosite, et surtout de chimie comme zincate (prononcé zɛ̃ɡat, « zingat' »), zincide, zincique[18].
Dans les années 1873 à 1876, les écrivains français consignant l'expression populaire, aussi bien Zola que Huysmans, nomment zinc la surface propre des bars anglais ou le revêtement brillant des comptoirs souvent étamés ou cuivrés, plus rarement zingués.
Il est possible que le mot persan zangâr : rouille ; vert-de-gris [Azagar, asugar, asingar, zingar, ziniar (vert-gris) ; de ar. al-zanjâ, qui est le persan zangâr, même signification, puisse être associé à la même racine indo-européenne.
Isotopes
Le zinc possède 30 isotopes connus, de nombre de masse variant de 54 à 83, ainsi que dix isomères nucléaires. Parmi ces isotopes, cinq sont stables[19], 64Zn, 66Zn, 67Zn, 68Zn et 70Zn, et constituent l'ensemble du zinc, le plus abondant étant 64Zn (48,6 % d'abondance naturelle). Sa masse atomique standard est de 65,409(4) u.
Vingt-cinq radioisotopes ont été caractérisés, le plus abondant et le plus stable étant 65Zn avec une demi-vie de 244,26 jours, suivis du 72Zn avec une demi-vie de 46,5 heures. Tous les autres radioisotopes ont une demi-vie de moins de 14 heures, la majorité d'entre eux inférieure à une seconde.
Occurrences dans les milieux naturels, minéralogie et géologie, gîtes et gisements
Le zinc est un élément moyennement abondant dans l'écorce terrestre. Le clarke s'élève entre 70 g et 132 g par tonne selon les estimations[20]. L'élément zinc est présent dans de très nombreux minéraux.
Le zinc natif est un métal natif très rare. Au milieu du XIXe siècle, il est recensé en Australie.
Le sulfate de zinc figure parmi les sulfates d'altération les plus solubles, provenant par exemple des couches oxydées de roches sulfures portées en surface. Il percole dans ce cas sous le « chapeau de fer » et entre dans des réactions complexes au voisinage de la zone de cémentation, fournissant le plus souvent du gypse, et aussi du carbonate de zinc, qui correspond à l'antique « cadmeïa » ou à notre minéral smithsonite[21].
Le principal minerai de zinc est la « blende » au sens générique, minerai à base de sphalérite, le sulfure de zinc ZnS α.
Minéraux de base et minerais de zinc
Le minerai qui est le plus utilisé est à base de sulfure de zinc appelé sphalérite ou autrefois blende (ZnS). Ce mot de mineur blende est désormais abandonné par la littérature minéralogique[22]. Ce sulfure — le plus répandu dans la lithosphère — cristallise dans le système cubique. Il peut contenir des impuretés métalliques, telles que celles du fer (blendes foncées) : la marmatite, (Zn, Fe)S, contient jusqu’à 14 % de fer. Dans la nature, la sphalérite est associée à d’autres sulfures, comme la galène (sulfure de plomb : PbS).
La wurtzite ZnS β a la même composition chimique mais cristallise dans le système hexagonal : c'est le polymorphe de haute température de ZnS.
%252C_Sterling_Hill_NJ.jpg.webp)
Sous l'ancien vocable de calamine, par ailleurs impropre en minéralogie, ont été rassemblées la smithsonite (carbonate de zinc : ZnCO3) et l'hémimorphite (silicate de zinc : Zn4Si2O7(OH) 2, H2O), mais aussi l'hydrozincite Zn5(CO3)2(OH)6, autrefois parfois dénommée zinconise, ou des willemites hydratée ou altérée[23]. Les deux premiers minéraux peuvent être associés. Si historiquement la calamine fut utilisée au début du développement industriel de ce métal, elle est maintenant peu exploitée.
Parmi la soixantaine de minéraux, plus rares, autrefois recherchés ou aujourd'hui moins facilement exploitables par leurs minerais, citons la franklinite (Zn, Fe, Mn)(Fe, Mn)2O4, de structure spinelle, la willemite Zn2SiO4 ou 2(ZnO) . SiO2 un nésosilicate, la zincite ou oxyde de zinc ZnO, encore dénommée « zinc rouge ».
Il reste le sulfate naturel de zinc zincosite, les carbonates minrecordite, aurichalcite et claraïte, les phosphates hopéite et tarbuttite, les arséniates adamite, austinite, legrandite, leiteite, stranskiite, tsumcorite et warikahnite, le silicate hodgkinsonite, le sulfure kësterite, voire les cuivres gris...
Gisements de zinc
Ce sont des gisements d'origines magmatiques, dits primaires ou bien sédimentaires, dits secondaires. Les minerais de zinc sont souvent associés à ceux de plomb, de cuivre, de fer. Les principaux gisements de minerais de zinc se situent en Chine et en Australie.
En 1990, les gisements exploités se situaient également au Pérou, aux États-Unis (notamment la mine de Red Dog en Alaska), au Canada, au Mexique, en Russie (CEI), en république démocratique du Congo, au Zimbabwe et en Afrique du Sud, au Japon, au Maroc, en Espagne, en Irlande, en Suède, en Suisse, en Pologne et dans les Balkans, comme en Bulgarie. Leurs teneurs minimales étaient de 40 kg par tonne.

Au XIXe siècle, les minerais de zinc, à base de carbonates de zinc ou de blende, encore dénommée autrefois « fausse galène », était considérés comme abondants en Europe, notamment en Angleterre, en Allemagne et en Belgique, en particulier entre Liège et Aix-La-Chapelle, en Haute-Silésie, mais aussi en France dans le département du Lot ou au sud des Cévennes, dans le département du Gard.
Propriétés physiques et chimiques, préparation du corps simple, alliages
Caractéristiques notables du corps simple métal
Le zinc est un métal brillant, gris bleuté à blanc légèrement teinté en bleu-gris, de blanc bleuâtre à gris blanc métallique. Sa texture cristalline est nette, le cristal a une maille hexagonale compacte, sa densité avoisine 7,14. Le réseau hexagonal est souvent allongé, ce qui confère au corps simple des propriétés anisotropes.
Allotropie
On connaît trois allotropes du zinc : le zinc α (dont le zinc natif), stable à basse pression aux températures inférieures à 175 °C, le zinc β stable entre 175 °C et 300 °C, et le zinc γ stable aux plus fortes températures.
Le métal est dur et assez peu tenace, fragile et cassant à température ordinaire[24]. Le métal est cassant à froid. Les couvreurs zingueurs savent en outre que les larges plaques ou les feuilles en zinc autrefois pur des toitures manipulées en période de gel, vers −10 °C, se déchirent.
Il n'est ductile, malléable et laminable qu'entre 105 °C et 130 °C, voire 150 °C. Dans ces domaines contrôlé de température, le laminage en feuille mince s'opère facilement. Dans la pratique, la densité d'un morceau de zinc obtenu après fusion avoisine 6,8 et elle peut s'élever par martelage jusqu'à 7,2 (zinc écroui, martelé à chaud), valeur légèrement supérieure à la densité normale. Mais au-delà de 200 °C, la matière zinc redevient cassante et il est alors aisé vers 250 °C de la pulvériser dans un mortier.

Le polissage du métal permet d'obtenir de belles surfaces réfléchissantes, avec une réflectance visible de l'ordre de 57 % et assez constante. Ce métal est inaltérable à l'air sec et même dans le gaz dioxygène, en absence stricte d'humidité et de dioxyde de carbone. Il est assez bon conducteur de la chaleur et de l'électricité, de l'ordre de 27 % des conductivités thermique et électrique du cuivre.
Le corps simple zinc fond au-dessus de 419 °C et bout vers 907 °C. La plage liquide assez étendue s'explique par la force interatomique non négligeable et les possibilités de caténation.
Chauffé à l'air, largement au-dessus de sa température de fusion, il brûle générant une lumière bleue-verte caractéristique du test de flamme, laissant un oxyde ZnO infusible sous forme de flocons légers dans l'air, blanc à basses températures, jaunes à hautes températures. Les vapeurs de zinc s'enflamment à l'air vers 500 °C en laissant des flammèches blanches éclatantes qu'utilisent les « étoiles » des feux d'artifice.
- 2 Zn solide cristal + O2 gaz → 2 ZnO flocons blancs légers dans l'air ou poudre blanche dans les parties froides confinées avec

Les poussières de zinc qui apparaissent par condensation des vapeurs de zinc dans une phase gazeuse chimiquement inerte, comme l'azote ou le dioxyde de carbone, peuvent avoir de grandes surfaces spécifiques. Ces poudres de zinc présentent alors une réactivité accrue ou exacerbée par rapport au zinc métal, corps solide compacte ou matière condensée massive. C'est ce zinc pulvérisé à plus grande réactivité qui est employé pour produire les « étoiles brillantes » des feux d'artifice.
Dissolution en milieu aqueux
L'eau distillée apparaît sans action sur le zinc, même à ébullition[25].
Il est insoluble dans l'eau, mais assez facilement soluble dans les acides et les alcalis, de même que dans l'acide acétique. Les solutions aqueuses de chlorure de sodium NaCl, des sulfates alcalins ou alcalino-terreux, comme Na2SO4 ou CaSO4 attaquent le métal.
Le zinc est soluble facilement dans les bases fortes, avec dégagement de gaz hydrogène. Il l'est aussi soluble dans les acides forts. Il peut être assez facilement soluble dans les acides faibles surtout si le zinc n'est pas très pur (effet de pile en milieu aqueux)[26].
Lorsque le zinc est très pur, la réaction est lente, mais elle peut être vive avec quelques impuretés :
- Zn corps simple métal blanc + 2 HClaqueux liquide acide fumant → ZnCl2 aqueux + H2 gaz
- 2 Zn corps simple métal blanc + 2 NaOH aqueux soude caustique en excès + 2 H2O → Zn(OH)2 aqueux + 2 NaOH aqueux + H2 gaz
Le dégagement de gaz dihydrogène est plus important en cas de chauffage à ébullition avec la soude ou la potasse caustique. Poussé jusqu'à dessication du mélange, il ne reste plus que ce qu'on prenait autrefois pour un résidu d'oxyde de zinc et d'alcalis solides (soude ou potasse caustique), mais qui est en fait un zincate soluble de formule type Na2ZnO2 ou K2ZnO2.
Le zinc réagit avec l'eau bouillante sous pression, à une température supérieure à 100 °C ou bien avec la vapeur d'eau surchauffée en libérant de l'hydrogène.
- 2 Zn corps simple métal + H2O vapeur d'eau très chaude sous pression (steam) → H2 gaz + ZnO oxyde de zinc
La réaction de décomposition existe pourtant à froid dans l'eau, mais elle est très lente, elle n'est concrètement observée qu'en présence d'acide. En réalité, la passivation est d'abord due à des bulles d'hydrogène qui empêche la poursuite de la réaction, c'est une passivation par adsorption du gaz hydrogène en surface du métal (potentiel hydrogène).
Pour favoriser la réaction par exemple avec l'eau acidulée à l'acide sulfurique, il suffit de mettre le zinc au contact du cuivre ou du plomb, en créant un effet de pile. Le résultat est le même si le métal ordinaire zinc employé contient des impuretés significatives de métaux plus électronégatifs.
L'addition de copeaux de zinc à une solution aqueuse stable d'ions métalliques, par exemple de cuivre, de plomb, de mercure ou d'argent, métaux plus nobles que le zinc, provoque par un effet redox la précipitation des métaux nobles et la dissolution du zinc en solution. C'est le principe des réactions de cémentation.
Corrosion et couches passivantes d'hydroxy-carbonates de zinc
Le zinc est inaltérable à froid dans l'air sec. La surface du zinc se ternit à l'air, du fait de la présence de dioxyde de carbone et de vapeur d'eau (humidité relative). Le zinc peut réagir avec les facteurs ambiants : vapeur d'eau ou humidité, condensat aqueux, oxygène, dioxyde de carbone, carbonate basique formé en milieu aqueux, etc., pour former une patine ou couche blanche couvrante. Cette patine se traduit par une diminution progressive de l'éclat métallique de la surface. La couche formée, insoluble, adhérente et protectrice, a comme constituant principal du carbonate basique de zinc.
L'altération superficielle à l'air humide est drastiquement limitée, voire arrêtée par une patine légèrement grise ou blanchâtre que les Anciens appelaient « hydrocarbonate d'oxyde de zinc ». Cette couche passivante est formée de carbonates basiques ou hydroxy-carbonates de zinc peu soluble, couvrant, de formule générique Zn(OH)x(CO3)y. Le composé le plus connu est l'hydrozinguite Zn5(OH)6(CO3)2[27]. La couche formée est en pratique passivante parce qu'elle présente une bonne adhésion au support métallique, stable autant en milieu aqueux salé qu'en milieu acide et que son coefficient de dilatation reste proche de celui du métal.
Cette propriété justifie l'usage du zinc en feuille mince ou plaque en zinguerie et en zingage des couvertures de toit, en gouttière pour l'évacuation des eaux, en baignoire ou bassin de rétention d'eau ou bien son emploi pour la protection anti-corrosion du fer, par exemple le « fer galvanisé » (obtenu par immersion de pièce dans un bain de zinc fondu ou par dépôts électrochimiques)[28].
En contact avec de l'eau stagnante, il forme des taches blanchâtres constituées notamment d'hydroxyde et d'oxyde de zinc, produits pulvérulents généralement peu adhérents et non protecteurs, parfois appelés rouille blanche.
L'altération d'une couche de zinc pur à l'air sec est plus nette car la surface de zinc résiste modérément à la corrosion en milieu neutre ou alcalin.
Production de zinc
La métallurgie ancienne du zinc comportait trois étapes clefs, après l'extraction du minerai, puis triage et broyage fin :
- le grillage à l'air pour obtenir l'oxyde de zinc. Le carbonate de zinc dégage de la vapeur d'eau et du dioxyde de carbone. Mais la blende grillée relargue du gaz dioxyde de soufre, qui pouvait être utilisé par une « chambre de plomb » ou une unité de production associée d'acide sulfurique.
- 2 ZnS blende + O2 gaz oxygène de l'air, chauffage minimal vers 900 °C → 2 ZnO oxyde de zinc + SO2 gaz anhydride sulfureux
- la réduction de l'oxyde de zinc plus ou moins impur par le carbone (charbon de bois, charbon ou houille sèche avec quelques fragments) à plus de 1 200 °C avec libération de monoxyde de carbone[29].
- la distillation en cornues ou fours spécifiques du zinc impur selon deux grandes techniques dénommées per ascensum (cornues de cylindres de terres réfractaires de l'usine de la Vieille-Montagne, près de Liège, cornues en forme de moufles en Silésie) ou per descensum (Angleterre)[30].
La production de zinc à partir de minerai (blende), préalablement broyé et concentré par différents procédés, est aujourd'hui effectuée dans deux filières technologiques distinctes[31]:
- la pyrométallurgie ;
- l’hydrométallurgie suivie d’une électrolyse.
Les opérations du procédé pyrométallurgique sont :
- grillage du minerai type blende ou sulfure de zinc (ZnS) pour obtenir idéalement l'oxyde de zinc ZnO et en réalité un mélange d'oxydes (ZnO impur, avec l'oxyde de cadmium CdO, l'oxyde de plomb PbO, les oxydes de fer) ;
- réduction par exemple par le carbone C, de la masse d'oxyde pour obtenir du zinc métallique (Zn) ;
- affinage du zinc par liquation et distillation fractionnée pour en séparer les impuretés comme le plomb, le cadmium ou le fer.
Les opérations du procédé hydrométallurgique sont :
- grillage du sulfure de zinc (ZnS) pour obtenir un oxyde de zinc (ZnO) et supprimer certaines impuretés (fer) ;
- lixiviation pour solubiliser le zinc sous forme de sulfate de zinc (ZnSO4) ;
- cémentation pour éliminer les impuretés : cobalt, nickel, plomb, cadmium et cuivre de la solution de sulfate de zinc[32] ;
- électrolyse pour transformer le sulfate de zinc en zinc métal.
Cuivre, cadmium, plomb, cobalt et nickel peuvent être des sous-produits de la production de zinc.
L'injection d'air inerte dans les étapes ultimes de fusion permet d'obtenir des poussières de zinc. De même l'injection d'eau produit des granulés de zinc.
Le zinc peut être filé et vendu en bobines de fil de différents diamètre. Le zinc est laminé en feuilles minces, qui peuvent atteindre 0,87 mm d'épaisseur. Il peut alors être vendu en feuilles, en bobines de diverses caractéristiques, en profilés, en pièces spécifiques, en éléments ou composants de surface prépatinés...

Les tôles minces ou feuillards de zinc peuvent être caractérisées par un coefficient d'anisotropie moyen rm de l'ordre d'un demi (0,5) et un coefficient d'écrouissage d'un dixième (0,1). Le premier coefficient indique que le zinc est très peu apte à l'emboutissage profond, à l'instar des plus médiocres feuillards d'aluminium soumis à une mise en forme à froid. Le second coefficient montre la faible déformation plastique du zinc dans les mêmes conditions. Les alliages métalliques s'imposent, en particulier, pour garantir des propriétés mécaniques convenables ou même inespérées, comme avec les matériaux superplastiques obtenus avec le cuivre.
Alliages
Il existe des alliages importants, comme les laitons ou le cuivre jaune principalement à base de cuivre et de zinc, le tombac, les maillechorts ZnCuNi, le virenium à base de cuivre, nickel et zinc, le bronze doré ou ormolu à base de cuivre, zinc et étain, le zicral à base d'aluminium et de zinc, le prestal Zn0.78Al0.22 très résistant, le zamak alliage à base de zinc, aluminium, magnésium et cuivre comme le rappelle la concaténation des initiales formant la dénomination des alliages en métallurgie allemande, voire les nombreux alliages pour soudures ou pour les caractères d'imprimerie à base de plomb, de bismuth et d'étain, les zinc alliés, les alliages de zinc à très faibles teneurs de titane et de cuivre pour le bâtiment, le « chrysocale » ou « chrysocalque » à base de cuivre, étain et zinc, l'« argentan » à base de cuivre, nickel et zinc ou encore le « pacfung » ou « cuivre chinois » à base de cuivre, zinc et nickel en bijouterie et orfèvrerie, les bronzes au zinc.
La formation d'amalgame est facile.
Certains alliages sont conçus pour le moulage sous pression, par exemple dans l'industrie automobile. Les alliages de cuivre, d'argent, d'étain et de cadmium sont employés pour certaines brasures, ainsi le Cu0.45Zn0.30Ag0.20Cd0.05 fond vers 615 °C ou le Ag0.35Cu0.26Ag0.22Cd0.18 à 607 °C.
L'alliage « gun metal », appelé aussi bronze autrichien, mis au point au XIXe siècle sous l'autorité de l'amirauté britannique était un bronze technique au zinc du type Cu0.88Sn0.10Zn0.02. Mais la Royal Navy constate assez vite l'usure de l'alliage d'armement, la perte de résistance et même la lente perte systématique du zinc au contact de l'eau de mer et des embruns. Une solution métallurgique fut l'addition de 0,04 % d'arsenic à l'alliage pour restreindre l'évolution néfaste.
Les pièces britanniques d'un penny ou deux pennies, à valeur de pence(s), étaient également du cuivre légèrement bronzé au zinc et à l'étain Cu0.97Zn0.025Sn0.005
Chimie, corps composés, complexes de l'élément zinc
Le zinc existe principalement aux états d'oxydation 0, I et II.
À l'état 0, c'est presque exclusivement un réducteur. L'état I concerne quelques composés organozinciques.
À l'état II, l'élément possède des propriétés acidobasiques, il intervient dans des complexes et de nombreux composés, et possède encore une plus vaste chimie organométallique.
Le zinc est moyennement réactif, il se combine assez facilement avec l'oxygène, vigoureusement avec le soufre et d'autres non-métaux comme le phosphore et les halogènes. Le zinc est chalcophile. Il réagit avec des acides dilués en dégageant de l'hydrogène.
L'état d'oxydation le plus commun du zinc est +II, l'ion Zn2+ de faible rayon ionique 0,74 Å est parfois appelé ion zincique[33]. Il est incolore et peu acide. Dans le solvant eau, le cation zinc divalent est présent sous forme d'un hydrate complexe Zn(H2O)42+
L'obtention d'un précipité de ZnS, par exemple par ajout d'une solution d'hygrogénosufure d'ammonium à un échantillon de zinc solubilisé, permet une analyse pondérale de la quantité de zinc de l'échantillon.
Zinc métal réducteur
Avec un potentiel d'électrode normal d'hydrogène (ENH) E° = -0,7628 volt en solution aqueuse à 24,85 °C pour la réaction
- Zn2+ + 2 e− → Zn0 solide,
le zinc est un métal plus réactif que le mercure[34]. Il peut réduire l'eau et de nombreux autres ions métalliques. La réduction est lente à pH neutre, mais assez rapide en milieux très acides ou très basiques, comme décrit précédemment.
La réduction d'autres ions métalliques est utilisée dans les piles (anode des piles Daniell et Leclanché, premières piles alcalines avec cathodes CuO, MnO2, AgO, Ag2O, HgO, ONi(OH) notamment; en termes de puissance unitaire développée ou de densité énergétique, les piles zinc-air l'emportent devant les piles AgZn puis NiZn...
- Zn0 anode consommée + Cu2+ aqueux environnant la cathode → Zn2+ aqueux environnant l'anode + Cu0 métal déposé sur la cathode avec Δε0 de la pile mesuré à l'équilibre ≈ 1,10 V[35]
Notons aussi l'intérêt de cette propriété dans des procédés industriels d'hydrométallurgie ou avec les plaques pour clichage galvanoplastique...
Comme le zinc est souvent le premier métal présent à réagir, il peut protéger d'autres métaux plus nobles, ainsi les anodes sacrificielles en zinc.
Chimie acidobasique à l'état II
Les ions Zn2+ réagissent vers pH 5 - 6 avec les ions hydroxydes pour donner un précipité d'hydroxyde de zinc Zn(OH)2. L'hydroxyde formé réagit avec des ions H+ pour redonner Zn2+ (à ce titre Zn(OH)2 est une base) mais aussi avec des ions HO− pour donner l'ion zincate Zn(OH)42− (à ce titre Zn(OH)2 est un acide).
- ZnO oxyde blanc + 2 OH− aqueux soude caustique en excès + H2O → Zn(OH)42−aqueux
L'hydroxyde de zinc (et l'oxyde ZnO dont il dérive par hydratation) est donc un hydroxyde (un oxyde) amphotère.
Précipitation de Zn2+ et test d'identification
Quelques anions précipitent les ions Zn2+, comme les anions HO− (sans excès), CO32−, S2−, PO42−...
De même, l'ion ferrocyanure Fe(CN)64− et l'ion potassium K+ piègent fortement le cation zincique.
- 3 Zn2+ ion zincique aqueux + 2 Fe(CN)64− + 2 K+ → K2Zn3[Fe (CN)6]2 précipité avec pKs = 95
Mais les précipités du cation zinc avec l'ion tétracyanatomercurate constituent un test d'identification décisif, à condition d'avoir des traces d'ions cobalt Co2+ (précipité de couleur bleu) ou d'ions cuivre Cu2+ (couleur mauve).
Complexation de Zn2+
Les ions Zn2+ peuvent donner des complexes généralement incolores avec des corps solvants, eau H2O, ammoniac NH3... avec la plupart des ligands ou agents complexants courants que sont les amines, les anions cyanures CN−, les anions halogénures, les anions thiocyanates SCN−, oxalates, tartrates, l'EDTA...
Ainsi les ions complexes Zn(NH3)42+, Zn(CN)42−, Zn(C2O4)22−, Zn(C4H4O6)22−, Zn(EDTA)2−...
L'ion Zn2+ existe également dans des métalloprotéines, telles que certaines histone désacétylases.
Corps composés
L'oxyde de zinc est plus stable que l'oxyde de cadmium. L'oxyde de zinc est amphotère, c'est-à-dire qu'il se dissout dans les solutions d'acides forts et les solutions de bases fortes, alors que l'oxyde de cadmium est basique[36]. Mais les deux corps (à caractères covalents croissants) se subliment alors que l'oxyde de mercure HgO se décompose vers 500 °C en libérant son oxygène et le corps simple mercure métal.
Le zinc n'est attaqué par les corps simples halogènes qu'à des températures assez élevées. Les halogénures de zinc ont une structure ionique, un point de fusion assez peu élevé et un net caractère hygroscopique. Ces corps ioniques à lacunes tétraédriques sont des conducteurs à l'état fondu.
Les corps composés les mieux connus sont :
- oxydes
- oxyde de zinc ZnO hexagonal ou minéral naturel zincite
- oxyde de zinc ZnO amorphe

- oxydes
- peroxyde de zinc ZnO2
- hydroxydes
- hydroxyde de zinc Zn(OH)2 blanc gélatineux
- hydroxyde de zinc tétragonal ou minéral naturel sweetite
- hydroxyde de zinc tétragonal ou minéral naturel ashoverite
- hydroxyde de zinc orthorhombique ou minéral naturel wülfingite
- fluorures
- fluorure de zinc ZnF2 monoclinique ou triclinique, minéral correspondant « fluorine de zinc »
- Dihydrate de fluorure de zinc ZnF2. 2 H2O orthorhombique
- chlorures
- chlorure de zinc ZnCl2
- bromures
- bromure de zinc ZnBr2
- iodures
- iodure de zinc ZnI2 hexagonal
- hydrures
- ZnH2
- sulfures
- sulfure de zinc ZnS amorphe (artificiel)
- sulfure de zinc ZnS hexagonal (minéral naturel alias wurtzite)
- sulfure de zinc ZnS cubique (minéral naturel alias sphalérite)
- séléniures
- séléniure de zinc ZnSe cubique
- tellurures
- tellurure de zinc ZnTe
- nitrures
- nitrure de zinc Zn3N2
- phosphures
- phosphure de zinc Zn3P2
- silicates
- silicate de zinc ZnSiO3 orthorhombique
- hexafluorosilicate de zinc[37]
- aluminates
- aluminate de zinc ZnAl2O4 cubique (minéral naturel alias gahnite)
- alun naturel de zinc ou zincalaluminate
- chromates
- chlorates
- chlorate de zinc Zn(ClO3)2
- chlorate de zinc tétrahydraté Zn(ClO3)2. 4 H2O cubique
- perchlorates
- Zn(ClO4)2
- Zn(ClO4)2. 6 H2O
- bromates
- bromate de zinc Zn(BrO3)2
- bromate de zinc heptahydraté Zn(BrO3)2. 6 H2O cubique
- borates
- Zn(BO2)2
- carbonates
- carbonate de zinc ZnCO3 trigonal

- nitrates
- Zn(NO3)2
- Zn(NO3)2. 6 H2O quadratique
- sulfates
- sulfate de zinc ZnSO4
- ZnSO4. H2O
- ZnSO4. 6 H2O
- ZnSO4. 7 H2O (naturel alias goslarite). Il s'agit du vitriol blanc ou couperose blanche des Anciens.
- sulfites
- sulfite de zinc ZnSO3
- sulfite de zinc hydraté ZnSO3. 5/2 H2O monoclinique
- phosphates
- phosphate de zinc ZnPO4[39]
- orthophosphate hydraté de zinc Zn3(PO4)2. 4 H2O orthorhombique (minéral naturel alias α hopéite)
- phosphate hydraté de zinc Zn3(PO4)2. 4 H2O orthorhombique (minéral naturel alias β hopéite)
- phosphate hydraté de zinc Zn3(PO4)2. 4 H2O triclinique (minéral naturel alias parahopéite)
- pyrophosphates
- arséniates
- arséniate de zinc Zn3(AsO4)2 monoclinique
- Zn3(AsO4)2. 2 H2O triclinique ou minéral warikahnite
- Zn3(AsO4)2. 4 H2O orthorhombique ou minéral arsénohopéite
- arsénites
- méta-arsénite de zinc Zn(AsO2)2
- molybdates
- ZnMoO4
- cyanures
- cyanure de zinc Zn(CN)2 orthorhombique
- thiocyanates
- thiocyanate de zinc Zn(SCN)2
- formiates
- formiate de zinc Zn(HCO2)2
- formiate de zinc dihydraté Zn(HCO2)2. 2 H2O monoclinique

- acétates
- acétate de zinc Zn(CH3COO)2 monoclinique
- acétate de zinc dihydraté Zn(CH3COO)2. 2 H2O monoclinique
- stéarates
- oxydes de mercapto-2 pyridine
- zinc pyrithione ou Pyridine-2-thiol-1-oxyde de zinc
Chimie organométallique ou organozinciques
Le zinc fut un des tout premiers métaux dont la chimie organométallique fut en particulier étudiée en France à la suite de Philippe Barbier. Il permet par exemple la réaction éponyme.
Citons parmi les corps organozinciques :
- diméthylzinc Zn(CH3)2
- diéthylzinc Zn(C2H5)2 autrefois zinc-éthyl
- dibenzylzinc Zn(C6H5)2
Utilisations

Les utilisations peuvent être classées en fonction de leur importance décroissante du zinc exploité dans le monde[40] :
- galvanisation (protection du fer) : 50 % ;
- fabrication de laiton et du bronze : 17 % ;
- alliages d'aluminium (Zamaks, Kayems) : 17 % ;
- produits semi-finis à base de zinc : 6 %
- produits chimiques : 6 %
- autres : 4 %
Protection du fer
Le dépôt d'une mince couche de zinc en surface de l'acier ou du matériau fer le protège de la corrosion : c'est le zingage ou zincage, voire au sens générique la galvanisation. L'acier galvanisé est utilisé dans l'automobile, la construction, l'électroménager, les équipements industriels, etc. Le zingage du fer est la plus grosse utilisation du zinc.
Les deux principales techniques qui permettent de produire l'acier zingué ou du fer galvanisé sont :
- Le zincage ou « galvanisation à chaud » de produits finis correspond au trempage de l'acier ou du fer préalablement décapé, dans un bain de métal fondu, ici du zinc en fusion à 450 °C[41]. Ce procédé d'immersion dans le métal fondu, analogue au principe traditionnel d'étamage, a été adapté, amélioré, et breveté par l'ingénieur français Stanislas Sorel en 1837[42] ; l'alliage de surface a une épaisseur de 40 à 200 μm en quelques minutes ; la couche ainsi formée est dure mais ne supporte pas d'être déformée, par exemple par pliage ou emboutissage.
- L'électrozingage, ou zincage par galvanoplastie ou encore « galvanisation » au sens strict ou premier, consiste en une électrolyse en solution aqueuse où l'acier ou le fer à zinguer sont placés à la cathode (pôle négatif) dans un bain type de chlorure de zinc contenant des ions Zn2+, très souvent complexés par un ligand type cyanure, à une concentration allant de 30 à 40 g·L−1. Les cations conducteurs du bain d'électrolyse se déposent sous forme de zinc à la surface de l'acier (et non d'un alliage comme avec le processus du trempage). Les cations Zn2+ sont régénérés à l'anode de zinc qui s'oxydent simultanément au cours du processus. Ce procédé de dépôt d'une mince couche de zinc sur une tôle ou plaque de fer s'est surtout développé après 1880. Son intérêt est de maîtriser l'épaisseur de la couche de zinc qui se dépose, souvent limitée à 10 µm, au choix sur une seule face de la pièce ou sur les deux[43].
Citons également parmi d'autres techniques de dépôt, la shérardisation, c'est-à-dire le chauffage du fer dans du zinc pulvérulent, c'est-à-dire de la poudre fine de zinc, et la « métallisation Schoop », c'est-à-dire la pulvérisation de fines particules chauffées de zinc sur le métal à recouvrir[44].
La phosphatation au zinc ou « phosphatation cristalline » consiste à effectuer un dépôt superficiel d'une couche, protectrice et adhérente au métal, de phosphate de zinc. La pièce métallique d'acier ou à base de fer est par exemple placée en immersion dans une solution aqueuse acide d'hydrophosphate de zinc Zn(H2PO4) et d'acide phosphorique H3PO4, bain préalablement chauffé à une température entre 40 °C et 100 °C, en présence d'agent(s) oxydant(s).
Piles et batteries électriques
Le corps simple métal zinc est un des deux composants permettant le fonctionnement des piles tant salines qu'alcalines. Une batterie zinc-ion (aussi dite batterie Zn-ion ou ZIB en abrégé) est en développement depuis les années 2010, à base d'ions zinc (Zn 2+) comme porteurs de charge[45]. Plus précisément, les ZIB utilisent du Zn comme anode, des matériaux d'intercalation de Zn comme cathode et un électrolyte, éventuellement aqueux contenant du Zn offrant une sécurité très élevé, une faible toxicité et laissant espérer des coûts finaux plus bas.
Monnaie
Des pièces de monnaie ont été ou sont encore en zinc ; ce sont surtout des pièces frappées pendant la Seconde Guerre mondiale et des monnaies de nécessité.
En 1943, la pièce américaine d'un penny est simplement une rondelle d'acier emboutie et zinguée. Au cours des décennies de croissances ultérieures, le « one pence » est entièrement en cuivre pur. Après 1982, la petite pièce pesant 2,5 g n'est plus fabriquée seulement en cuivre. Il s'agit d'un cœur en zinc, en réalité un alliage de zinc à 0,8 % de cuivre, placé dans une coquille protectrice de cuivre, le zinc représentant 97,5 % de la masse totale.
Alliage
Le zinc est utilisé pur ou bien pour réaliser divers alliages, dont les principaux sont :
- avec le cuivre : le laiton connu depuis la préhistoire[46] ; les maillechorts avec le nickel.
- avec l'aluminium : le Zamak nom déposé avec le brevet en 1926 par la New Jersey Zinc Company[47] - [48] ou le Kayem de l'Imperial Smelting Company[48]. Ces produits ne diffèrent que par leur teneur en cuivre et la présence ou non de magnésium. Ils sont utilisés pour confectionner des pièces moulées (automobile, équipements ménagers, pièces industrielles, carters).
Couverture et construction

On emploie et façonne le zinc pour la couverture des bâtiments et en zinguerie, pour les abergements, brisis, les chéneaux et les descentes d'eaux pluviales, les faîtières, les gouttières, les noues, les revêtements de toit ou couverture en joint debout, les rives, les solins.
Agriculture
Il est aussi utilisé en agriculture, comme apport d'oligo-élément, essentiellement en zone de sols fortement calcaires.
La culture la plus sensible à la carence ou insuffisance en zinc est probablement le maïs.
Des symptômes d'insuffisance apparaissent aussi sur la plupart des arbres fruitiers, plus rarement sur la vigne. Les légumes sont moins sensibles, hormis les asperges, les aubergines, les oignons et les pommes de terre.
Les apports, préventifs ou curatifs, se font sur le sol — et il faut alors veiller à la durée de la disponibilité pour les plantes — ou par pulvérisation foliaire.
Pour exemple, les besoins annuels pour le maïs se situent autour de 300 à 500 grammes de zinc par hectare.
Traitement du bois
L'arséniate de cuivre et de zinc ammoniacal ACZA ou d'autres dérivés similaires sont utilisés en traitement du bois pour sa préservation.
Thérapeutique
Grâce à ses vertus thérapeutiques, le zinc peut être utilisé pour le traitement des dermatoses (acné, érythème fessier), en particulier sous forme d'oxyde de zinc, car il possède des propriétés cicatrisantes et anti-inflammatoires.
Sous le nom de zincum metallicum, il est utilisé en homéopathie.
Matériau pour récipients et ustensiles divers
Le zinc a été utilisé pour transporter divers liquides ou solides.

Agent métallique réducteur
Le zinc peut précipiter l'or ou l'argent des cuves de cyanuration, lors des traitements métallurgiques finaux du minerai aurifère ou argentifère. Il s'agit d'une réaction de déplacement.
- 2 Na[Ag(CN)2] complexe de cyanure d'argent + Zn métal poudre → Na2[Zn(CN)4] complexe de zn + 2 Ag argent métal naissant qui précipite
Le zinc est faiblement présent, souvent à hauteur d'une teneur de 1 % à 2 %, dans certaines préparations d'alliages dentaires, du type Ag3Sn[49]. Le zinc présent durant le procédé d'élaboration, piège l'oxygène.
Toxicologie, écotoxicologie
Tous les sels de zinc, obtenus par contact du métal avec des acides ou matières organiques, sont toxiques. C'est pourquoi le métal zinc a été proscrit très tôt en cuisine.
Si le zinc est un oligoélément à faible dose, il reste un élément toxique à fortes doses, autant que par ses poussières métalliques, ses vapeurs d'oxyde de zinc, le chlorure de zinc irritant pour les muqueuses et la peau, ses divers sels solubles vénéneux qui induisent par ingestion diarrhées, vomissements, nausées...
Un jus de fruit stocké inconsidérément au frais plus d'une journée dans un bac en tôle galvanisé ou en zinc peut capter par une lente action des acides organiques jusqu'à 500 mg de Zn assimilable par kilogramme. Ce qui est suffisant pour provoquer vomissement et nausées chez les enfants qui ont bu le breuvage.
L'oxyde de zinc dégagé lors de soudure provoque souvent des fièvres de métaux. Certains composés de zinc sont cancérigènes à fortes doses.
Le zinc est un élément trace dans les sols. Il est important pour la vie végétale. Mais un excès d'engrais superphosphates sur des sols pauvres amène immanquablement une déficience en zinc. Dans les terrains souillés par une surconcentration de zinc et/ou ses sels, voire dans les terrains gorgés d'engrais ou de composés zincifères, il est rare que la végétation puisse reprendre un aspect normal. Plutôt que de laisser des dépôts sauvages, il est impératif de recycler ce matériau, par ailleurs facilement recyclable.
En 2004, on a récemment découvert (à Lommel sur un site pollué par une ancienne raffinerie de zinc, la Société Métallurgique de Lommel dite «de Maatheide ») qu'il existe au moins un variant génétique d'un champignon (Suillus bovinus), naturellement résistant au zinc, et que ce champignon symbiote protège alors aussi les pins de l'écotoxicité de ce métal. Cette découverte a confirmé le rôle de champignons et des microbes symbiotes racinaires adaptés à la pollution comme « composante majeure de la stratégie de survie des arbres qui colonisent des sols contaminés »[50].
Oligo-élément indispensable à faible dose à la vie animale et humaine
En très faible quantité, le zinc sous forme assimilable est un oligo-élément important, indispensable aux organismes végétaux et animaux. Dûment assimilé par les organismes, il active en particulier les enzymes, influence la croissance, favorise les réactions et contrôles biochimiques au niveau des surfaces pulmonaires. Le corps humain en contient 2 g à 4 g. Les besoins journaliers peuvent être estimés au moins à 15 mg pour un homme normal, et jusqu'à deux fois plus pour une femme allaitante[51].
Le zinc est contenu dans diverses levures (jusqu'à 100 mg par kilogramme), dans la viande rouge bovine (de l'ordre de 50 mg à 120 mg par kilogramme), mais aussi dans une multitude d'aliments commercialisés[52]. La biodisponibilité du zinc d'origine végétale est parfois remise en cause. Or s'il est vrai que les végétaux contiennent des antinutriments qui diminuent l'absorption du zinc, les carences en zinc ne semblent pas plus courantes pour les véganes[53].
Les légers excès de Zn sont éliminés par la sueur, il ne semble pas exister de forme de stockage de ce métal dans l'organisme humain. Une carence patente en zinc est notée dans près d'un tiers de la population mondiale, essentiellement liée à la sous-nutrition[54].
Des données récentes montrent qu'il peut aussi y avoir des carences dans les populations de pays riches[55] lié une alimentation mal équilibrée, chez l'enfant et la personne âgée[56]. De jeunes américains, refusant la consommation de viandes sans rechercher les apports d'oligo-éléments appropriés et complémentaires des végétariens et végétaliens, présentaient une déficience en zinc avant les années 1990[57]. Mais la plus grande zone de carences concernait les territoires ruraux de l'Égypte et de l'Iran où l'alimentation traditionnelle à base de céréales et de légumes rejetait l'intervention intermédiaire des levures et ferments (pain azyme, sans levain, pâtes non levées ou non fermentées). Certains composés chimiques des céréales, les composés phosphorés de fibres nommés phytates, tendent en effet à complexer différents métaux oligo-éléments comme le zinc, qui, même présent dans l'aliment céréale, ne devient plus assimilable (ou très peu assimilable). Les ferments agissant en amont libèrent a contrario le zinc des céréales et légumes.
Dès les années 1980, le déficit en zinc est reconnu pour un problème de santé publique mondiale.
Un déficit, même léger, a un impact sur certaines fonctions, dont immunitaires[58] responsable de la défense vis-à-vis de certaines infections. Concrètement, les blessures guérissent difficilement. Le déficit chronique peut induire une sensibilité accrue à certaines infections bactériennes (pneumonie) ou virales (diarrhées, infections des voies respiratoires), des troubles de la croissance des enfants et adolescents, des retards sexuels[59].
Le zinc est important pour la santé reproductive (spermatogenèse) et peut être un traitement efficace dans certaines formes d'acné[60].
Les déficiences en zinc sont souvent préoccupantes dans les élevages de porcs et de volailles[61].
Enfin, les carences en zinc infligent une double peine aux patients exposés à la pollution des sols remis en culture par forçage productif, car le cadmium et autres métaux lourds fortement toxiques prennent facilement sa place dans l'organisme. Ainsi les premières victimes nippones de la maladie de itai-itai étaient d'abord des pauvres personnes déficientes en Zn, risquant la dénutrition complète s'ils ne suivaient l'ordre autoritaire de production moderne par des moyens chimiques et artificiels.
Toxicité : au-delà d'une certaine dose, le zinc est toxique et polluant

Le zinc est l'un des éléments traces métalliques qui devient un contaminant et un polluant au-delà des doses qui le rendent écotoxiques (qui varient selon les espèces, et le contexte ; par exemple il est plus mobile et biodisponible en milieu acide qu'en milieu basique). On l'a d'abord constaté dans et autour des raffineries de zinc où seules quelques espèces résistent bien aux sols contaminés par ce métal. Le zinc du sol (ou apporté par l'eau, l'air ou des boues d'épuration)[62] - [63] peut à certaines doses s'avérer écotoxique pour des plantes cultivées PM(soja par exemple[64]).
Des inquiétudes ont récemment émergé quant aux effets de nanoparticules d'oxyde de zinc sur les cultures. Elles se sont montrées (chez le soja) expérimentalement exposé — sous serre — à des nanoparticules de zinc) non toxiques pour la plante (à la différence du dioxyde de cérium), mais capables de s'y bioaccumuler dans les parties comestibles (feuilles et graine)[65].
Le zinc est détecté et quantifié dans le sol, par des moyens de plus en plus précis[66] - [67].
Difficulté de la bioindication : cas des moules et des huîtres
Les huîtres, aux chairs à hautes teneurs en calcium, révèlent un puissant pouvoir de (sur)concentration des oligoélements et autres éléments disséminés dans les eaux de nourrissage[68]. Au contraire, les moules, à l'instar d'autres coquilles, stockent le calcium dans leurs coquilles. Les deux espèces régulent parfois efficacement les teneurs des éléments en excès, surtout si ceux-ci sont potentiellement des oligo-éléments et non des éléments toxiques à facteur d'accumulation irrémédiable comme le plomb, le mercure ou le cadmium.
Le chimiste australien Ben Selinger a rapporté les rejets de zinc toxiques de la raffinerie industrielle de la compagnie Electrolytic Zinc Co, installée sur la rivière Derwent, près d'Hobart, en Tasmanie. En 1972, les eaux de la rivière étaient alors également polluées à moindre mesure par le cadmium (compagnon minier du zinc), le mercure des quelques industries papetières en amont. Et les huîtres à l'embouchure avaient mauvaise réputation, puisqu'une demi-douzaine bien fraîches pouvaient causer en pratique vomissements et nausées. La cause du rejet de l'organisme était la présence de Zn, en moyenne jusqu'à un maximum autour de 1 000 mg par kg, comme le prouvait l'analyse chimique[69].
Malgré le déni des autorités, l'accident du minéralier « Lake Illawara » s'écrasant le contre le pont de la Derwent et se cassant en deux alors qu'il était chargé de minerais enrichis de zinc n'était pas sans action sur le taux de polluants des eaux. Les milliers de tonnes de matière non draguées et dispersées contribuaient alors à augmenter, par dissolution et dilution lentes, la teneur du milieu ripuaire en aval du port, et surtout du milieu marin, parfois à des centaines de kilomètres via les courants, malgré la mise en place de zones théoriques d'observations et de contrôle biologiques considérablement plus réduites. En 1988, les concentrations des eaux dûment surveillées de l'estuaire du Derwent étaient redevenues officiellement légales, et les coquilles et mollusques consommables, d'après les mesures référentielles des moules affichant un supremum de zinc légèrement inférieur 40 mg par kg. En réalité, l'écosystème était revenu peu ou prou à l'état de pollution d'avant l'an 1975. Et le plus surprenant est que la population des huîtres de l'estuaire, dont une partie étaient toujours aussi immangeables à l'instar de celles de 1972, n'étaient pas mortes. Tout s'était passé comme si les fortes concentrations de Zn et de cuivre avaient protégées la population des mollusques bivalves des effets des teneurs en éléments encore plus toxiques, tels que le cadmium, mercure.
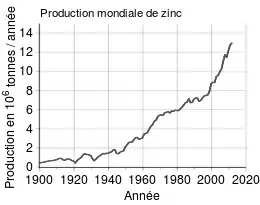
Économie du zinc : réserve, production
Le zinc est aujourd'hui un métal non-ferreux commun et important, mais souvent lointain troisième ou quatrième après l'aluminium, le cuivre et le plomb.
Les réserves mondiales estimées de zinc étaient de 250 millions de tonnes en 2010[70], détenues notamment par l'Australie (21,2 %) et la Chine (16,8 %). La production mondiale s'est élevée en 2010 à 12 millions de tonnes, assurée essentiellement par la Chine (29,2 %), le Pérou (12,7 %) et l'Australie (12,1 %). La mine de Red Dog, en Alaska, est l'une des plus grandes exploitation de zinc à ciel ouvert.
Environ 30 % du zinc mondial provient du recyclage[71].
Quelques données économiques
La production métallurgique mondiale en 2013[72] :
| Pays | Production | % mondial | |
|---|---|---|---|
| 1 | Chine | 5 300 000 t | 40,8 % |
| 2 | Corée du Sud | 885 000 t | 6,8 % |
| 3 | Inde | 760 000 t | 5,8 % |
| 4 | Canada | 651 600 t | 5 % |
| 5 | Japon | 587 300 t | 4,5 % |
| 6 | Espagne | 521 000 t | 4 % |
| 7 | Australie | 504 000 t | 3,9 % |
| 8 | Pérou | 346 800 t | 2,7 % |
| 9 | Mexique | 322 800 t | 2,5 % |
| 10 | Kazakhstan | 320 100 t | 2,5 % |
| 11 | Finlande | 311 700 t | 2,4 % |
| 12 | Pays-Bas | 257 000 t | 2 % |
| 13 | Belgique | 252 000 t | 2 % |
| 14 | Brésil | 242 000 t | 1,9 % |
| 15 | États-Unis | 233 000 t | 1,8 % |
| Total monde | 13 000 000 t | 100 % | |
La production minière mondiale en 2013[72]:
| Pays | Production | % mondial | |
|---|---|---|---|
| 1 | Chine | 5 000 000 t | 37,3 % |
| 2 | Australie | 1 523 000 t | 11,4 % |
| 3 | Pérou | 1 351 300 t | 10,1 % |
| 4 | Inde | 793 000 t | 5,9 % |
| 5 | États-Unis | 784 000 t | 5,8 % |
| 6 | Mexique | 642 500 t | 4,8 % |
| 7 | Canada | 426 100 t | 3,2 % |
| 8 | Bolivie | 407 300 t | 3 % |
| 9 | Kazakhstan | 361 500 t | 2,7 % |
| 10 | Irlande | 326 700 t | 2,4 % |
| 11 | Turquie | 200 000 t | 1,5 % |
| 12 | Russie | 191 000 t | 1,4 % |
| 13 | Namibie | 184 100 t | 1,4 % |
| 14 | Suède | 176 400 t | 1,3 % |
| 15 | Brésil | 152 400 t | 1,1 % |
| Total monde | 13 400 000 t | 100 % | |
La consommation mondiale de zinc en 2004 a été de l'ordre de 10 millions de tonnes[73] :
- Asie 5 057 kt (kt = milliers de tonnes)
- Europe 2 840 kt
- Amériques 2 113 kt
- Océanie 263 kt
- Afrique 193 kt
- Total 10 466 kt
Au début des années 1990, le quart de la production mondiale de minerais de zinc était assuré par l'Amérique du Nord. La Chine, avec 16 % et l'Australie représentaient le second théâtre de cette production minière mondiale. Les premières places pour la production mondiale de zinc revenaient alors à la Chine avec 18 % et au Canada, avec 10 % de l'ensemble, deux pays par ailleurs fortement exportateurs.
Durant ces années, les États-Unis représentaient le premier consommateur et importateur de zinc, suivi par l'Europe occidentale avec en premier, l'Allemagne, en second l'Italie, en troisième place, la France.
Commerce
Le zinc est un des métaux non ferreux cotés à la bourse des métaux de Londres[74]. Son prix au comptant, exprimé en $, est cyclique : entre 1994 et 2005, il a varié entre 725 $/t et 1 760 $/t. En 2006, il a dépassé les 3 000 $/t.
En 2014, la France est nette importatrice de zinc, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 600 €[75].
Calendrier
Dans le calendrier républicain, Zinc était le nom donné au 28e jour du mois de nivôse[76].
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, pp. T1-T21 (et pp. T23-T42, version anglaise).
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0803120664, lire en ligne), p. 71
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Entrée « Zinc powder (pyrophoric) » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28 août 2018 (JavaScript nécessaire)
- se prononce comme une consonne occlusive vélaire sonore ([ɡ] en API)
- (en) « transition element », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8) :
« Transition element: an element whose atom has an incomplete d sub-shell, or which can give rise to cations with an incomplete d sub-shell. »
- Rappelons la polysémie des termes cadmie, calamine, qui peuvent aussi bien désigner divers oxydes. Il faut à chaque fois définir un champ d'activité et un registre de langue, à une époque donnée, pour ne pas se perdre.
- Joseph William Mellor (en), The history of zinc and cadmium, in A comprehensive treatise of inorganic and theoretical chemistry, volume 4, Longmans, Green et Co Ltd, Londres, 1929, pages 298-405 (partie Zn Cd Hg). Zinc NSCEP in texto sur le site EPA US Environmental Protection Agency
- Les bronzes des ateliers Keller peuvent être du cuivre à 91,4 % du zinc à 5,53 %, de l'étain à 1,7 % et du plomb à 1,35 %. Cité dans la courte histoire de la fonderie de Zn (techniques sous pression après 1805)
- D'un point de vue scientifique, il faut attendre la systématique de Lavoisier en 1787, pour que le zinc soit unanimement reconnu comme élément chimique.
- Les pharmaciens et chimistes Margraff père et fils s'inspirent des travaux du chimiste suédois Anton Swab.
- La température de chauffage est en pratique entre 1 200 °C et 1 400 °C, pour sublimer ou volatiliser l'oxyde de zinc tout en le rendant réactif.
- Quelques-unes de ses réalisations sont présentées dans les applications et usages du zinc infra.
- Le zinc dans le "Trésor de la langue française"
- L'alémanique est le dialecte allemand de Paracelse. Il est proche des dialectes souabes ou de nombreux dialectes alsaciens.
- Le verbe zinguer signifie d'abord couvrir de zinc, par exemple « zinguer un toit », puis galvaniser avec du zinc, par exemple « zinguer du fer ». La zinguerie, terme polysémique, peut être l'atelier où l'on prépare le zinc, désigne également un lieu de commerce de la matière zinc, parfois en partie mise en forme, et enfin peut représenter tous les objets de zinc. La zincographie est un type de procédé de reproduction utilisant des plaques de zinc, analogues de la « pierre lithographique » en lithographie. Zincographier signifiait reproduire par zincographie, le zincographeur étant l'ouvrier en zincographie. Un corps ou une matière est zincide si elle ressemble au zinc, par quelques-uns de ses aspects ou formes (suffixe grec eidos). Zincique est un adjectif qui s'applique à l'oxyde de zinc, à ses sels et parfois au cation zinc divalent.
- mais deux d'entre eux sont suspectés d'être très légèrement radioactifs, avec des demi-vies supérieures à un million de fois l'âge de l'univers
- Alain Foucault, opus cité.
- André Jauzein, article sur les sulfates naturels, Encyclopædia Universalis, Corpus 21, 2002, page 835
- Il proviendrait selon une tradition savante récente, par exemple reportée par Yves Gautier, article Encyclopædia Universalis sur la « blende ou sphalérite » du mot allemand blenden : « aveugler, éblouir, tromper ». Mais il s'agit d'une racine très lointaine, concernant peut-être uniquement l'époque antique. L'expression technique de mineur germanique « die Blende » est déjà concrètement employé au début de l'époque moderne pour désigner pour signaler soit une variété cristalline massive soit une formation typique et compacte (à base de cristaux), révélées lors des entaillages de la roche veine. La sphalérite n'est qu'un cas particulier. L'expression « die Schalenblende » désigne encore aujourd'hui par exemple des associations sphalérite/wurtzite à structures multiples en couches concentriques, réniformes ou diversement stratifiées, bien connue des collectionneurs, . Elles peuvent aussi être à base de pyrite et de galène.
- La zinconise était aussi un « oxyde hydraté naturelle de zinc » et pas seulement un hydroxycarbonate.
- La ténacité est inférieure à celle des corps simples métalliques fer ou nickel. Ces caractéristiques mécaniques expliquent que les classifications antiques aient négligés cette matière impropre, non assimilé à un vrai « métal » au sens des anciens.
- La molécule eau à chaud n'est pas sans action. Lire infra.
- En réalité, les réactions avec l'acide nitrique et l'acide sulfurique dépendent de nombreux paramètres, état de dilution ou concentration de l'acide, chauffage, impuretés éventuelles... Les quatre réactions types pour HNO3 concerne le milieu extrêmement dilué ou aérien qui produit du nitrate de zinc et du nitrate d'ammonium, le milieu très dilué qui commence à dégager le protoxyde d'azote N2O, le milieu dilué qui libère 2 NO et le milieu concentré qui rejette 2 NO2. Les trois réactions types avec H2SO4 diffère selon la dilution et le chauffage de l'acide, d'abord en milieu dilué à froid,
- Zn solide + H2SO4 aqueux dilué → ZnSO4 aqueux + H2 gaz
- 4 Zn solide + 5 H2SO4 aqueux acide peu concentré → 4 ZnSO4 aqueux + H2S gaz + H2O vapeur ou liquide
- Zn solide + 2 H2SO4 concentré à chaud → ZnSO4 aqueux + 2 H2O vapeur ou liquide + SO2 gaz sulfureux
- Dieter Landolt, Corrosion et chimie de surfaces des métaux, page 327-328.
- Dès ses premiers emplois importants, par exemple dans les fils télégraphiques, le fer galvanisé, c'est-à-dire recouvert de couches de zinc, s'est révélé bien supérieur au « fer blanc » ou fer étamé, c'est-à-dire recouvert d'étain. Notons que la surcharge de toiture en zinc sur les structures portantes est faible, de l'ordre de 6 kg par mètre carré, voire 8 kg par mètre carré avec les accessoires de couverture. Ce n'est pas une toiture couverte d'ardoises ou de lauzes, véritables pierres…
- L'équation de la réaction est dans l'introduction.
- Le zinc impur contient encore du fer, du cuivre, du plomb, du cobalt, de l'arsenic, du soufre, du carbone selon les lieux ou les procédés. Le procédé de distillation batch réalisé à Vieille-Montagne, comporte 48 cornues légèrement inclinées, placées symétriquement deux par deux de chaque côté, dans des tours surmontant quatre fours de chauffage adossés. Elles sont placées à l'extrémité inférieure d'un tuyau de fonte, muni d'une allonge en tôle pour condenser le zinc. Après un cycle de deux heures de chauffe, les ouvriers métallurgistes enlèvent les allonges, laissent s'écouler le métal liquide déjà condensé dans les tubes de fonte vers des poches, avant de remettre les allonges du dispositif. Lorsque le zinc est épuisé, les cornues sont rechargées par du zinc impur. Le procédé anglais per descensum utilise un tampon de bois carbonisé qui laisse efficacement filtrer la vapeur de zinc vers un creuset placé en contrebas.
- Le procédé de flottation le plus commun utilise une phase à base d'huile de pin avec injection d'air, créant une mousse stabilisée par des tensio-actifs ou agents moussants spécifiques.
- Cette technique est aussi adaptée aux boues de zinc, obtenue par les différents procédés de recyclage. L'étape suivante est la revalorisation électrolytique du zinc.
- Cette sphère ionique théorique est comparable à celle de l'ion magnésium Mg2+ 0,72 Å ou cuivre divalent 0,73 Å, mais elle est petite comparée à Cd2+ 0,95 Å, Ca2+ 0,99 Å ou Hg2+ 1,02 Å.
- Il est aussi plus électropositif que Hg. Les données électrochimiques précises avec la constante d'équilibre sont E° = -0,7628 volt avec log K0 = - 25,788. Bernard M. et Busnot F., Usuel de chimie générale et minérale. Dunod, Paris, 1996, en particulier les tableaux de potentiels d'électrode normaux en section électrochimie.
- Les deux milieux salins sont reliés par un bout ou tampon salin.
- Ces deux oxydes sont très peu solubles dans l'eau. Le mercure, dernier élément du groupe du zinc, n'engendre qu'un oxyde peu basique.
- Composant de produit antimite
- revêtement de protection anti-corrosion ou couche primaire pour adhésion
- Utilisé dans les ciments dentaires
- « CNUSED - Métaux Minéraux - Zinc - Secteurs d'utilisation », sur http://www.unctad.info/, (consulté le )
- Certains techniciens, s'étant tellement approprié ce sens technique déjà ancien, considèrent qu'il n'existe pas de galvanisation à froid. Accaparé par leurs affirmations techniques, ils oublient le lointain hommage porté par la dénomination au scientifique italien Luigi Galvani, précurseur de l'électrochimie.
- Les premières mise au point du zincage sont plus anciennes, mais souvent artisanales ou pour des besoins spécifiques, évidemment sans brevet industriel de protection.
- Données industrielles, économiques, géographiques sur les principaux produits chimiques, métaux et matériaux
- Aperçu des technologies et des procédés de revêtement de Zn
- (en-US) « A cheap, long-lasting, sustainable battery for grid energy storage | KurzweilAI », www.kurzweilai.net, (consulté le )
- « Histoire du zinc - Partie I », sur http://souspression.canalblog.com, (consulté le )
- « Histoire du zinc - Partie III », sur http://souspression.canalblog.com, (consulté le )
- « Kayem », sur http://www.usinages.com/, (consulté le )
- Par exemple, préparation initiale de Ag0,667 à 0,745Sn0,253 à 0,27Cu0 à 0,06Zn0 à 0,019
- Adriaensen, K., Van Der Lelie, D., Van Laere, A., Vangronsveld, J., & Colpaert, J. V. (2004). A zinc‐adapted fungus protects pines from zinc stress. New Phytologist, 161(2), 549-555 |URL:https://nph.onlinelibrary.wiley.com/doi/full/10.1046/j.1469-8137.2003.00941.x
- La fourchette des recommandations oscille entre 15 mg et 11 mg par jour pour un homme de 75 kg, 12 mg par jour et 8 mg pour une femme de 70 kg.
- Voici des teneurs optimales en Zn d'aliments en milligramme ou mg pour 100 g) : noix de cajou 5,8 mg à 5,7 mg, amandes 3,1 mg à 3 mg, pois chiches 1,53 mg, épinards 0,8 mg. Les divers pois secs, les graines de citrouille, le blé complet, le riz brun, les huîtres (à teneur élevée et variable dépassant souvent une médiane de 20 mg) et diverses coquilles, les homards, les yaourts ou les fromages à pâtes pressées cuites, comme le gruyère français ou le gruyère suisse sont des aliments à bonne teneur en Zn, mais à teneurs plus variables suivant les milieux. Il est possible de retrouver une présentation de teneurs moyennes sur le site « guide des vitamines », en section sources alimentaires du Zn.
- (en) Vesanto Melina, Winston Craig et Susan Levin, « Position of the Academy of Nutrition and Dietetics: Vegetarian Diets », Journal of the Academy of Nutrition and Dietetics, vol. 116, no 12, , p. 1970–1980 (ISSN 2212-2672, PMID 27886704, DOI 10.1016/j.jand.2016.09.025, lire en ligne, consulté le ).
- Lazzerini M, Effect of zinc supplementation on child mortality, Lancet, 2007; 370:1194-1195.
- Sandstead HH et al. Zinc deficiency in Mexican American children: influence of zinc and other micronutrients on T cells, cytokines, and antiinflammatory plasma proteins Am J Clin Nutr 2008;88:1067–73
- Meydani SN et al, Serum zinc and pneumonia in nursing home elderly Am J Clin Nutr 2007;86:1167–73.
- Leurs consommations de viande étaient systématiquement inférieures à 30 g de viande par jour.
- Dardenne M, Zinc and immune function European Journal of Clinical Nutrition (2002) 56, Suppl 3, S20 – S23. doi:10.1038=sj.ejcn.1601479
- Patricia Mariana, « Statut en zinc d'enfants présentant un retard de croissance », Mémoire soutenu à l'UFR de Pharmacie de Grenoble, , p. 108 (lire en ligne, consulté le )
- Traitement oral de l'acné sévère par le zinc sur acne.comprendrechoisir.com.
- (en) Forrest H. Nielsen, « History of Zinc in Agriculture », Advances in Nutrition, vol. 3, no 6, , p. 783–789 (ISSN 2161-8313 et 2156-5376, DOI 10.3945/an.112.002881, lire en ligne, consulté le )
- Smith SR., A critical review of the bioavailability and impacts of heavy metals in municipal solid waste composts compared to sewage sludge. Environ Int. 2009 Jan; 35(1):142-56. Epub 2008 Aug 8.
- Heemsbergen DA, McLaughlin MJ, Whatmuff M, Warne MS, Broos K, Bell M, Nash D, Barry G, Pritchard D, Penney N., Bioavailability of zinc and copper in biosolids compared to their soluble salts. Environ Pollut. 2010 May; 158(5):1907-15. Epub 2009 Nov 22.
- Borkert CM, Cox FR, & Tucker MR (1998) Zinc and copper toxicity in peanut, soybean, rice, and corn in soil mixtures. (résumé, en anglais). Soil Sci. Plant Anal. 29(19-‐20):2991-3005.
- Priester JH et al. (2012) Soybean susceptibility to manufactured nanomaterials with evidence for food quality and soil fertility interruption ; Proc Natl Acad Sci Unit States Am, doi:10.1073/pnas.1205431109 ; Proceedings of the National Academy of Sciences, étude coordonné par John Priester de l'Université de Californie de Santa Barbara (Résumé en anglais et appendice)
- Sarret G, Balesdent J, Bouziri L, Garnier JM, Marcus MA, Geoffroy N, Panfili F, Manceau A. (2004), Zn speciation in the organic horizon of a contaminated soil by micro-X-ray fluorescence, micro- and powder-EXAFS spectroscopy, and isotopic dilution. ; Environ Sci Technol. 2004 May 15; 38(10):2792-801.
- Donner E, Ryan CG, Howard DL, Zarcinas B, Scheckel KG, McGrath SP, de Jonge MD, Paterson D, Naidu R, Lombi E.(2012), A multi-technique investigation of copper and zinc distribution, speciation and potential bioavailability in biosolids; Environ Pollut. 2012 Jul; 166:57-64. Epub 2012 Apr 3. (résumé)
- Le facteur d'enrichissement en Zn est de l'ordre de 110 000 et en Hg de 166 000.
- (en) Ben Selinger, Chemistry in the Marketplace : 5e éd., Sydney, Harcourt Brace, , 588 p. (ISBN 0-7295-3300-X), en particulier sur le zinc et les huîtres pp 280-282.
- (en) USGS Minerals – 2011 « Zinc. »
- (en) « Le recyclage du zinc », International Zinc Association (consulté le )
- Jozef Plachy, « USGS Minerals Information: Zinc », sur minerals.usgs.gov (consulté le )
- International Lead Zinc Study Group
- London Metal Exchange
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=26080000 (consulté le )
- Aubin-Louis Millin, Annuaire du républicain, ou légende physico-économique, Paris, Marie-François Drouhin, (lire en ligne)
Bibliographie
- David Van Reybrouck (trad. du néerlandais par Philippe Noble), Zinc [« Zink »], Arles, Actes Sud, , 80 p. (ISBN 978-2-330-06920-9)
- Noël Dreulle, Paule Dreulle, Bernard Wojciekowski, article « zinc », Encyclopædia Universalis, 2002, en particulier sur le raffinage du zinc, sur les propriétés physiques et chimiques... Quelques parties en ligne
- Paule Dreulle, Dossier sur le Zinc, Techniques de l'Ingénieur, 1983.
- Alain Foucault, Jean-François Raoult, Fabrizio Cecca, Bernard Platevoet, Dictionnaire de Géologie - 8e édition, Français/Anglais, édition Dunod, 2014, 416 pages. Avec la simple entrée « zinc » p. 373.
- Paul Pascal, Nouveau traité de chimie minérale, Paris, Masson, (réimpr. 1966), 32 vol. (BNF 37229023)
« 5. Zinc, cadmium, mercure ; 20.1. Alliages métalliques ; 20.2. Alliages métalliques (suite) ; 20.3 Alliages métalliques (suite) »
- (en) Frank C. Porter (dir.), Zinc Handbook: Properties, Processing, and Use In Design, CRC Press, 1991, 648 pages, (ISBN 9780824783402)
Voir aussi
Articles connexes
- Acétate de zinc
- Acétate d'uranyle et de zinc
- Accumulateur nickel-zinc
- Anode sacrificielle
- Bromure de zinc
- carence en zinc : dysgueusie, polydipsie
- Réaction carbothermique
- Chlorure de zinc
- Couvreur zingueur
- Dialkyldithiophosphate de zinc
- Diméthylzinc
- Diéthylzinc
- Doigt de zinc
- Élément trace métallique
- Extraction du zinc
- Galvanisation,
- Galvanisation à chaud, Procédé de Sendzimir
- Finition organo-minérale sur zinc
- Hydroxycarbonate de zinc
- Hydroxyde de zinc
- Iodure de zinc
- Iodate de zinc
- ions zinc piégés dans l'acide phytique
- Ionomère
- Isotopes du zinc
- Mancozèbe
- Métalloprotéinase
- Monnaie en zinc ou alliages non-ferreuxː Couronne de Bohême-Moravie, Kopecks, Pfennig, Groschen ou Schilling
- Nitrate de zinc
- firme suisse Nyrstar
- Oligo-élément
- Oxyde de zinc
- Pensée calaminaire parmi d'autres métallophytes
- Peroxyde de zinc
- Peste du zinc, corrosion destructrice
- Pile alcaline
- Pile au bichromate
- Pile au mercure
- Pile Leclanché
- Pile oxyde d'argent
- Pile voltaïque, Pile à auge
- Pile Zamboni
- Pile zinc-air
- Préparation de Dalibour
- Pollution des sols
- Protoporphyrine zinc
- Phosphure de zinc
- Réaction de Barbier
- Réduction de Clemmensen
- Rouille blanche
- S.A. des Usines à Cuivre et à Zinc de Liège
- Séléniure de zinc
- Séléniate de zinc
- Société des Mines et Fonderies de Zinc de la Vieille-Montagne
- Stéarate de zinc
- Sulfate de zinc
- Sulfure de zinc
- Toiture
- Umicore
- Zinc (nutriment)
- Zinc allié
- Zinc natif
- Zinc pyrithione
- Zincographie
- Zingage ou Zincage
Liens externes
- Ressources relatives à la santé :
- DrugBank
- (en) Medical Subject Headings
- (en) National Drug File
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Ressource relative aux beaux-arts :
- (en) Grove Art Online
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (fr) Informations de marché sur le site de la Conférence des Nations unies sur le commerce et le développement : description, qualité, secteurs d'utilisation, marché, filière, sociétés, techniques, prix, politiques économiques
- (fr) Tableau périodique des éléments : Zn
- (fr) Propriétés chimiques
- (fr) Courte présentation de l'élément zinc, propriétés, effet sur la santé, impact sur l'environnement
- (fr) Zinc sur Futura Sciences
- (en) International Zinc Association
- (en) ressource sur le zinc par le service géologique américain
- (en) Données sur le zinc
- (en) Images de zinc sous différentes formes
- (fr) Sculptures en fonte de zinc
- (en) « Technical data for Zinc » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- (fr) Une petite histoire du zinc par un producteur européen
- (en) Petite initiation à la chimie du zinc, par exemple réaction du Zn avec S et I2
- (en) Initiation au zinc pour anglophones, nommé "extraction of zinc" et commençant par l'extraction du minerai zincifère
- (en) Zinc works at Swansea, film britannique sur les anciennes techniques de fusion et la pénibilité du travail en procédé batch vers 1950
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||


