Organozincique
Un organozincique est un composé organométallique contenant une liaison carbone–zinc[1]. Ce sont des composés réactifs qui sont sensibles à l'air et à l'eau. Ils interviennent dans diverses réactions chimiques importantes telles que la réaction de Réformatski et le couplage de Negishi.
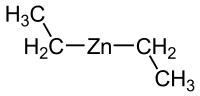
Les organozinciques ont été parmi les premiers composés organométalliques connus avec une liaison σ entre un atome de carbone et un atome métallique. Ils sont moins réactifs que les organométalliques analogues, comme les organomagnésiens et les réactifs de Grignard. Le diéthylzinc Zn(CH2CH3)2 fut le premier organozincique synthétisé, en 1848 par le chimiste britannique Edward Frankland, en chauffant de l'iodoéthane CH3CH2I en présence de zinc élémentaire[2] : la réaction produisit un liquide incolore volatil qui s'enflamma spontanément au contact de l'air ; auparavant, on ne connaissait que des complexes organiques de l'arsenic et du sel de Zeise ayant des ligands organiques sur un atome métallique.
En raison de leur nature pyrophorique, les organozinciques sont généralement préparés à l'abri de l'air. Ils sont instables dans les solvants protiques. Ils sont la plupart du temps préparés in situ pour être immédiatement utilisés sans être isolés spécifiquement, mais certains ont été isolés comme substances pures et ont été caractérisés en détail[3].
Parmi les organozinciques, on peut distinguer les catégories suivantes en fonction du nombre de liaisons Zn–C[4] :
- les diorganozinciques R2Zn, dans lesquels deux ligands alkyle sont liés à l'atome de zinc ;
- les hétéroleptiques, dans lesquels un ligand électronégatif ou monoanionique, par exemple un halogénure X, est lié à l'atome de zinc, lui-même lié à un ligand alkyle ou aryle ;
- les organozinciques ioniques, qui comprennent les organozincates RnZn− et les cations organozinciques RZnLn+, où L est un ligand.
Liaisons
Dans ses complexes, le zinc(II) adopte plusieurs géométries, généralement octaédrique, tétraédrique, ainsi que plusieurs géométries pentacoordonnées. Cette flexibilité structurale peut être attribuée à la configuration électronique du zinc, qui peut s'écrire [Ar] 3d10 4s2. L'orbitale 3d est complète, de sorte qu'il n'y a pas d'effet de champ de ligand. La géométrie de coordination est par conséquent largement déterminée par des interactions électrostatiques et stériques[4]. Les organozinciques sont généralement bi- ou tricoordonnés, ce qui reflète le fait que les carbanions sont fortement donneurs d'électrons.
Les complexes diorganozinciques sont typiquement de la forme R2Zn. Les composés de type dialkylzinc sont monomériques avec une coordination linéaire sur l'atome de zinc[5]. La liaison covalente entre les atomes de carbone et de zinc est polarisée vers l'atome de carbone en raison de la différence d'électronégativité entre les deux (2,55 pour le carbone contre 1,65 pour le zinc sur l'échelle de Pauling). Le moment dipolaire des réactifs diorganozinciques symétriques peut être considéré comme nul dans ces complexes linéaires, ce qui explique leur solubilité dans les solvants apolaires comme le cyclohexane. Contrairement à d'autres alkyles binaires métalliques, les espèces diorganozinciques ont une faible affinité pour la complexation avec les solvants de type éther. Les liaisons dans les composés R2Zn sont décrites comme mettant en œuvre des hybridations sp sur l'atome de zinc[4].
L'atome de zinc a par conséquent deux orbitales d liantes et trois orbitales d non liantes disponibles pour établir des liaisons. En l'absence de ligands donneurs d'électrons, l'atome de zinc ne peut compléter ses orbitales, de sorte qu'il se lie à un nombre relativement restreint de groupes alkyle et aryle. La liaison d'un halogène à l'atome de zinc accentue le caractère donneur et accepteur de ces orbitales, ce qui permet la formation de clusters, par exemple en faisant intervenir des ligands pontants[4].
Synthèse
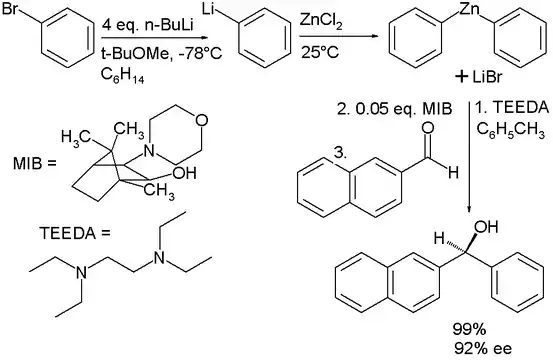
Il existe plusieurs méthodes pour obtenir des organozinciques. Les composés de type diorganozinc disponibles dans le commerce sont le diméthylzinc Zn(CH3)2, le diéthylzinc Zn(CH2CH3)2 et le diphénylzinc Zn(C6H5)2. Ce sont des réactifs chers et difficiles à manipuler. Il est également possible de produire ses organozinciques in situ à partir de précurseurs organobromés qui sont meilleur marché[6] :
Dans l'exemple ci-dessus, le bromobenzène C6H5Br est converti en phényllithium C6H5Li par réaction avec quatre équivalents de n-butyllithium CH3CH2CH2CH2Li. Une transmétallation avec le chlorure de zinc ZnCl2 donne ensuite le diphénylzinc Zn(C6H5)2.
À partir de zinc élémentaire
La méthode de synthèse du diéthylzinc Zn(CH2CH3)2 par Edward Frankland mettait en œuvre de l'iodoéthane CH3CH2I avec du zinc. Ce dernier doit être activé pour faciliter la réaction d'oxydoréduction. L'une des formes activées du zinc utilisées par Frankland était le couple zinc-cuivre[2] :
- 2 CH3CH2I + 2 Zn0 ⟶ Zn(CH2CH3)2 + ZnI2.
Le zinc peut également être activé sous forme de métal de Rieke par réduction du chlorure de zinc ZnCl2 avec du potassium. Cette forme s'est révélée utile pour des réactions telles que le couplage de Negishi et le couplage de Fukuyama. La formations de réactifs organozinciques est facilitée lorsque les halogénoalcanes ou les halogénures d'aryle portent des substituants attirant les électrons, comme les nitriles et les esters[7] - [8].
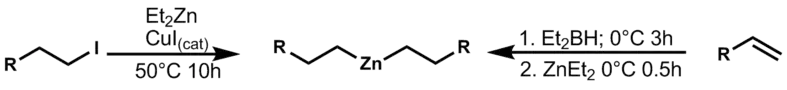
Echange de groupes fonctionnels
Les deux interconversions les plus courantes de groupes fonctionnels du zinc sont avec les halogénures et le bore, qui sont catalysées avec de l'iodure de cuivre(I) CuI et des bases. L'intermédiaire boré est produit par une hydroboration suivie par un traitement au diéthylzinc. Cette synthèse met en évidence l'intérêt des organozinciques en soulignant leur sélectivité pour le site le plus réactif de la molécule tout en formant des agents de couplage utiles[9].
Cette réaction de transfert de groupes fonctionnels peut être utilisée pour des allylations, ou d'autres réactions de couplage, comme celui de Negishi[10].
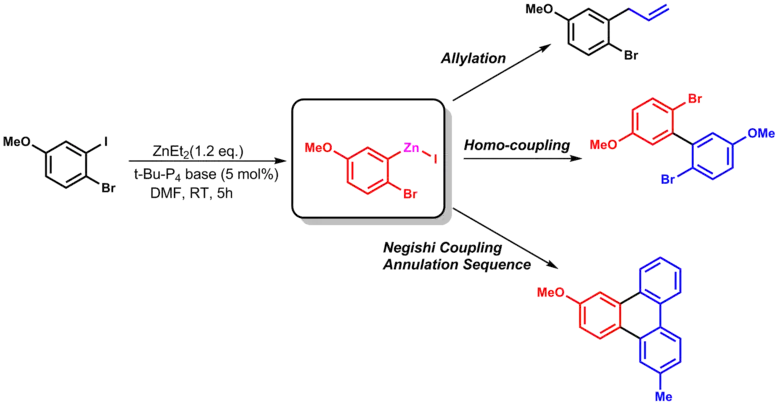 (en) Exemples de transferts de groupes fonctionnels.
(en) Exemples de transferts de groupes fonctionnels.
Notes et références
- (en) Paul Knochel, Nicolas Millot, Alain L. Rodriguez et Charles E. Tucker, « Preparation and Applications of Functionalized Organozinc Compounds », Organic Reactions, (DOI 10.1002/0471264180.or058.02, lire en ligne)
- (de) Edward von Frankland, « Ueber die Isolirung der organischen Radicale », Justus Liebigs Annalen der Chemie, vol. 71, no 2, , p. 171-213 (DOI 10.1002/jlac.18490710205, lire en ligne)
- (en) Christoph Elschenbroich, Organometallics, 3e éd., Wiley-VCH, Weinheim, 2006. (ISBN 978-3-527-29390-2)
- (en) The Chemistry of Organozinc Compounds, John Wiley & Sons, 2006. (ISBN 978-0-470-09337-5)
- (en) John Bacsa, Felix Hanke, Sarah Hindley, Rajesh Odedra, George R. Darling, Anthony C. Jones et Alexander Steiner, « The Solid‐State Structures of Dimethylzinc and Diethylzinc », Angewandte Chemie International Edition, vol. 50, no 49, , p. 11685-11687 (PMID 21919175, PMCID 3326375, DOI 10.1002/anie.201105099, lire en ligne)
- (en) Jeung Gon Kim et Patrick J. Walsh, « From Aryl Bromides to Enantioenriched Benzylic Alcohols in a Single Flask: Catalytic Asymmetric Arylation of Aldehydes », Angewandte Chemie International Edition, vol. 45, no 25, , p. 4175-4178 (PMID 16721894, DOI 10.1002/anie.200600741, lire en ligne)
- (en) Reuben D. Rieke, « Preparation of Organometallic Compounds from Highly Reactive Metal Powders », Science, vol. 246, no 4935, , p. 1260-1264 (PMID 17832221, DOI 10.1126/science.246.4935.1260, Bibcode 1989Sci...246.1260R, lire en ligne)
- (en) Ei-ichi Negishi, « A genealogy of Pd-catalyzed cross-coupling », Journal of Organometallic Chemistry, vol. 653, nos 1-2, , p. 34-40 (DOI 10.1016/S0022-328X(02)01273-1, lire en ligne)
- (en) Falk Langer, Lothar Schwink, Arokiasamy Devasagayaraj, Pierre-Yves Chavant et Paul Knochel, « Preparation of Functionalized Dialkylzincs via a Boron−Zinc Exchange. Reactivity and Catalytic Asymmetric Addition to Aldehydes », The Journal of Organic Chemistry, vol. 61, no 23, , p. 8229-8243 (PMID 11667810, DOI 10.1021/jo961129n, lire en ligne)
- (en) Hiroshi Naka, Keisuke Ito, Masahiro Ueno, Koji Kobayashia et Yoshinori Kondo, « Generation of arylzinc reagents through an iodine–zinc exchange reaction promoted by a non-metallic organic superbase », New Journal of Chemistry, vol. 34, no 8, , p. 1700-1706 (DOI 10.1039/C0NJ00202J, lire en ligne)
Liens externes
| C-H | He | |||||||||||||||||
| C-Li | C-Be | C-B | C-C | C-N | C-O | C-F | Ne | |||||||||||
| C-Na | C-Mg | C-Al | C-Si | C-P | C-S | C-Cl | C-Ar | |||||||||||
| C-K | C-Ca | C-Sc | C-Ti | C-V | C-Cr | C-Mn | C-Fe | C-Co | C-Ni | C-Cu | C-Zn | C-Ga | C-Ge | C-As | C-Se | C-Br | C-Kr | |
| C-Rb | C-Sr | C-Y | C-Zr | C-Nb | C-Mo | C-Tc | C-Ru | C-Rh | C-Pd | C-Ag | C-Cd | C-In | C-Sn | C-Sb | C-Te | C-I | C-Xe | |
| C-Cs | C-Ba | * | C-Lu | C-Hf | C-Ta | C-W | C-Re | C-Os | C-Ir | C-Pt | C-Au | C-Hg | C-Tl | C-Pb | C-Bi | C-Po | C-At | Rn |
| Fr | C-Ra | * * |
Lr | Rf | Db | C-Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | C-La | C-Ce | C-Pr | C-Nd | C-Pm | C-Sm | C-Eu | C-Gd | C-Tb | C-Dy | C-Ho | C-Er | C-Tm | C-Yb | ||||
| * * |
Ac | C-Th | C-Pa | C-U | C-Np | C-Pu | C-Am | C-Cm | C-Bk | C-Cf | C-Es | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, peu d'usages courants | Liaison inconnue / non évaluée |
![Le zinc de Rieke donne une forme activée de zinc pour les additions oxydantes {\displaystyle {\ce {{ZnCl2}+2K->[{\ce {THF}}][{\ce {-2KCl}}]}}\overbrace {\ce {Zn^{0}}} ^{\ce {Zinc\ de\ Riecke}}+{\ce {R-X->[{\ce {THF}}][20-60^{\circ }{\ce {C}}]R-Zn-I}}\qquad {\begin{cases}\mathbf {R} :&{\text{allyle, aryle, akyle, benzyle}}\\\mathbf {X} :&{\text{bromure, iodure}}\end{cases}}}](https://img.franco.wiki/i/7cc0e094491b8a9724d973fa927e116432ff02e7.svg)