Pyrophoricité
La pyrophoricité ou le pyrophorisme (du grec purophoros, « qui porte le feu ») est la propriété de certaines substances dont la température d'auto-inflammation est inférieure à la température ambiante et qui peuvent par conséquent s'enflammer spontanément aux températures ambiantes. Cette température d'auto-inflammation n'est pas intrinsèque aux matériaux mais dépend du type et de la configuration des éléments étudiés[1].

Selon le glossaire de l'Agence européenne des produits chimiques, est pyrophorique un matériau solide ou liquide qui « même en petites quantités, est susceptible de s’enflammer en moins de cinq minutes lorsqu’il ou elle entre au contact de l’air ». Il peut s'agir d'une substance liquide ou d'un mélange solide[2].
La réaction pyrophorique est une sous-catégorie de la combustion spontanée, au même titre que la réaction hypergolique. La différence entre ces deux réactions provient de l'élément qui provoque la combustion : un élément oxydant pour la réaction hypergolique et l'air pour la réaction pyrophorique[3].
Liste de matériaux pyrophoriques
Solides
- Zirconium ;
- Rubidium et césium ;
- Uranium : utilisé comme pénétrateurs à base d'uranium appauvri[4] dont la poussière et les débris lors de l'impact sur la cible s'enflamment et propagent l'incendie. Sous forme finement divisée, il est aisément inflammable et les débris d'uranium des différents usinages sont susceptibles d'ignition spontanée[5] ;
- Carbonyles métalliques : (octacarbonyle de dicobalt, carbonyle de nickel) ;
- Méthanetellurlol (CH3TeH) ;
- Phosphore blanc ;
- Plutonium.
Liquides
- Hydrazine
- Composés organométalliques des principaux groupes métalliques : aluminium, gallium, indium, zinc, cadmium, etc.
- Triéthylborane
Métaux
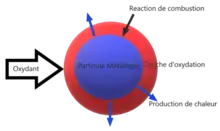
La pyrophoricité de certains métaux est généralement liée à l'inflammation de très fines particules. Cette réaction se produit lorsqu'elles entrent en contact avec l'air ou d'autres éléments oxydants, et qu'une couche d'oxyde se forme à leur surface. La chaleur engendrée par cette oxydation n'est pas dissipée assez rapidement pour réduire la température du métal, qui atteint alors sa température d'auto-inflammation. Pour atteindre cette température facilement, il faut que le rapport superficie/quantité de matière du métal (c'est-à-dire sa surface spécifique) soit élevé et que les particules de métal ne soient pas ou que très peu oxydées lorsqu'elles entrent en contact avec l'air. Cette disposition peut être trouvée lors de l'utilisation de métaux en poudre dans un environnement inerte[6].
Exemples de métaux pyrophoriques :
Détermination de la température d'auto-inflammation pyrophorique
La détermination de la température d'auto-inflammation d'un métal se fait dans le cas de vapeur métallique ou de poudre de métal avec des particules considérées comme sphériques, car le rapport surface sur volume est une condition critique[7]. Cette condition permet d'émettre l'hypothèse que le dégagement de chaleur provoqué par la formation d'une couche d'oxyde sur une sphère naissante métallique à température ambiante doit être suffisant pour augmenter la température du métal jusqu'à son point de vaporisation et fournir suffisamment de chaleur pour vaporiser le métal restant. Dans ces conditions, le bilan thermique critique pour la pyrophoricité contient trois facteurs :
- (1) : la chaleur produite/disponible ;
- (2) : la chaleur nécessaire pour évaporer le métal ;
- (3) : la chaleur nécessaire pour allumer la couche d'oxyde ;
avec :
- , le rayon de la particule métallique ;
- , l'épaisseur de la couche d'oxyde ;
- , le rayon du métal pur ;
- , la masse volumique ;
- , la chaleur d'état standard de formation massique de l'oxyde à 298 K ;
- , l'enthalpie d'état standard massique à la température T ;
- (« boiling point temperature »), indice désignant la température de vaporisation du métal ;
- , indice désignant le métal ;
- , indice désignant l'oxyde ;
- , la chaleur latente de vaporisation.
Pour qu'une combustion spontanée se produise, il faut que (1) = (2) + (3). Cela donne l'équation suivante, après simplification :
Cette formule permet de déterminer, complétée des données associées à un métal donné, le rapport . Plus ce rapport est faible, plus le métal est pyrophorique[8].
Danger pyrophorique
Le danger pyrophorique est la possibilité qu'a un matériau à devenir pyrophorique. Il dépend de plusieurs facteurs chimiques, physiques et environnementaux, tels qu'une agrégation de particules réactives possédant une grande surface spécifique et possédant un couplage physique et chimique au sein de l'agrégat qui permet une réaction essentiellement simultanée des particules, des conditions environnementales qui empêchent les transferts de chaleur depuis l'élément réactif, ou une production d'éléments réactifs à la suite d'une première oxydation qui sont capables d'être exothermiques en contact avec l'air.
De manière simplifiée, ce danger peut être représenté par la formule suivante :
- Danger Pyrophorique =
avec :
- , la masse du matériau capable de réagir avec d'autres éléments ;
- , la surface spécifique de la masse discrète qui réagit ;
- , l'énergie libéré par unité de volume de la masse qui réagit ;
- , le nombre de moles de gaz produites par unité de volume de la masse qui réagit ;
- , la surface spécifique brute de la masse qui réagit[9].
Signalement de la dangerosité des produits pyrophoriques
Le système général harmonisé de classification et d'étiquetage des produits chimiques, dit « système général harmonisé » ou SGH, classe les éléments pyrophoriques en classe 1, qui regroupe les éléments répondant au critère « La matière solide s’enflamme en moins de cinq minutes lorsqu’elle entre en contact avec l’air » et qui implique les consignes de sécurité suivantes :
- P210 : Tenir à l’écart de la chaleur/ des étincelles/des flammes nues/des surfaces chaudes ; ne pas fumer ;
- P222 : Ne pas laisser au contact de l’air ;
- P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage ;
- P335 + P334 : Enlever avec précaution les particules déposées sur la peau. Rincer à l’eau fraîche/poser une compresse humide ;
- P370 + P378 : En cas d’incendie : utiliser … pour l’extinction (« ... » correspondant à l'élément utilisé pour l'extinction, ex. : sable) ;
- P422 : Stocker le contenu sous[10].
Notes et références
- D. Tinet et J.J. Fripiat, « Étude cinétique et thermodynamique de la formation du bronze H1,6MoO3 », Journal de Chimie Physique, vol. 76, , p. 867–872 (ISSN 0021-7689, DOI 10.1051/jcp/1979760867).
- voir glossaire in Guide sur l'étiquetage et l'emballage conformément au règlement (CE) N° 1272/2008 (3 237,8k) , Agence européenne des produits chimiques, 2017, p. 224/228.
- « Primer on spontaneous heating and pyrophoricity », Office of Scientific and Technical Information (OSTI), (DOI 10.2172/10196002, lire en ligne, consulté le ).
- (en) André Gsponer, Depleted-Uranium Weapons: the Whys and Wherefores, (lire en ligne [PDF]).
- (en) « titre inconnu »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), DOE, Office of Health, Safety and Security / Nuclear Safety and Environment.
- J. P. Evans, W. Borland et P. G. Mardon, « Pyrophoricity of Fine Metal Powders », Powder Metallurgy, vol. 19, no 1, , p. 17–21 (ISSN 0032-5899 et 1743-2901, DOI 10.1179/pom.1976.19.1.17).
- (en) I. Glassman, P. Papas et K. Brezinsky, « A New Definition and Theory of Metal Pyrophoricity », Combustion Science and Technology, vol. 83, nos 1-3, , p. 161–166 (ISSN 0010-2202 et 1563-521X, DOI 10.1080/00102209208951829).
- (en) Irvin Glassman, Richard A. Yetter et Nick G. Glumac, chap. 7 « Ignition », dans Combustion, Academic Press, , 5e éd. (ISBN 978-0-12-407913-7, DOI 10.1016/b978-0-12-407913-7.00007-4), p. 363–391.
- (en) G.E. Zima, « Pyrophoricity of uranium in reactor environments », Office of Scientific and Technical Information (OSTI), (DOI 10.2172/4183911, lire en ligne, consulté le ).
- Système général harmonisé de classification et d’étiquetage des produits chimiques (SGH), , 6e éd. (ISSN 2412-1746, DOI 10.18356/dffa8889-fr), partie 2, « Dangers physiques ».
Voir aussi
Articles connexes
- Combustion spontanée
- réaction hypergolique
- Point d'auto-inflammation
Liens externes
- (en) Jim Bisker (dir.) et Tom Christman (dir.), Primer on Spontaneous Heating and Pyrophoricity (manuel), Deptartment of Energy, , 75 p. (résumé, lire en ligne [PDF]), référence DOE-HDBK-1081-2014.
- (en) List of pyrophoric materials (« Liste des matériaux pyrophoriques »), sur doctorfire.com.
![{\displaystyle {4 \over 3}\pi \,\left[r^{3}-\left(r-\delta \right)^{3}\right]\,\rho _{\text{ox}}\,\left(-\Delta _{f}H_{298,{\text{ox}}}^{\circ }\right)}](https://img.franco.wiki/i/9ae8b3bb6a3a63ae2754e424489cf5eb151af660.svg)
![{\displaystyle {4 \over 3}\pi \,\left[r-\delta \right]^{3}\,\rho _{\text{m}}\,\left[H_{\text{bpt,m}}^{\circ }-H_{298,{\text{m}}}^{\circ }+Lv\right]}](https://img.franco.wiki/i/eabd9acb6a48c24ab8a13aa84c82a6eb339ae60d.svg)
![{\displaystyle {4 \over 3}\pi \,\left[r^{3}-\left(r-\delta \right)^{3}\right]\,\rho _{\text{ox}}\,\left(H_{\text{bpt,ox}}^{\circ }-H_{298,{\text{ox}}}^{\circ }\right)}](https://img.franco.wiki/i/3a1d2f9fcf647d8f6a86e658547dbf43b4193943.svg)

















