Césium
Le césium[alpha 1] est l'élément chimique de numéro atomique 55, de symbole Cs.
Dans les conditions standard, le corps simple césium est un métal mou et ductile, blanc ou argenté à doré. Son point de fusion (28 °C) est proche de la température ambiante et du corps humain (CNTP), à laquelle il peut demeurer à l'état liquide par surfusion ; le césium partage cette propriété avec le gallium et le rubidium, le mercure étant le seul métal pur liquide et s'évaporant à température ambiante.
Le césium est le plus alcalin des métaux alcalins (base la plus forte connue ; assez pour attaquer le verre). Ses propriétés chimiques sont proches de celles du rubidium et du potassium, qui appartiennent à la même famille. Il réagit violemment avec l'eau et l'air (réaction explosive). Il est extrêmement réactif et pyrophorique, et réagit avec l'eau même à une température aussi basse que −116 °C.
On l'extrait de la pollucite (aluminosilicate Cs4Al4Si9O26·H2O) mais il est aussi présent à l’état de traces dans la lépidolite[9].
Histoire et étymologie
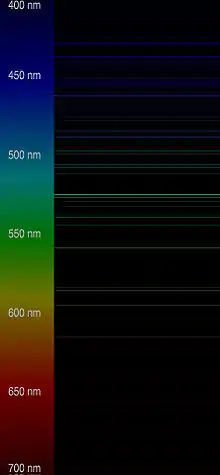
Le césium a été décelé pour la première fois en 1860 par Robert Wilhelm Bunsen et Gustav Robert Kirchhoff, lors d'une spectroscopie de l'eau minérale de Dürkheim[10], faite grâce au spectroscope qu’ils avaient inventé en 1859[9] (quelques mois après ils découvrirent le rubidium de la même façon).
Le nom a été formé sur le latin caesius (« bleu ciel »), en raison de la couleur bleu clair des deux lignes caractéristiques de son spectre d'émission.
Physicochimie

Le césium est le moins électronégatif (le plus électropositif) des métaux (à part le francium, mais ce dernier est radioactif de courte demi-vie), ce qui le rend intéressant pour l’effet photoélectrique[9].
Il présente deux degrés d’oxydation : 0 (métal) et +I (composés ioniques)[9].
Ses trois principaux types de composés sont[9] :
- les halogénures (fluorure, chlorure, bromure, iodure) ;
- le carbonate et l’hydroxyde ;
- les sels d’acides organiques (dont le formiate).
Réactivité : le césium réagit violemment avec l’air (production de superoxyde), avec l’eau même gelée (explosion, qui n'est inhibée qu'à partir de −116 °C), avec le phosphore, le soufre et le dichlore[9].
Isotopes du césium
On connaît 40[9] isotopes du césium, de nombre de masse variant entre 112 et 151, plus 17 isomères. Ce nombre d'isotopes est l'un des records pour un élément chimique[9].
Le seul isotope stable est 133Cs (78 neutrons), ce qui fait du césium un élément monoisotopique. Cet isotope étant le seul présent dans la nature, le césium est aussi un élément mononucléidique.
Les autres isotopes sont radioactifs et radiotoxiques[9]. Ils sont produits dans les supernovas, et sur Terre sont issus des retombées d'essais nucléaires atmosphériques ou d'accidents nucléaires (catastrophe de Tchernobyl, par exemple) et des déchets nucléaires, notamment le césium 137. Deux isotopes, 134Cs (demi-vie de deux ans) et 137Cs (émetteur gamma, demi-vie de 30 ans) sont des produits de fission de l'uranium[9], traceurs éventuels de fuites ou d'accidents de réacteurs nucléaires.
L'isotope radiogénique 137Cs est le plus connu. Il a en effet été très utilisé dans les études hydrologiques et écologiques mises en œuvre pour évaluer les effets de plusieurs contaminations générales de l'atmosphère induites à partir de 1945 par l'utilisation des bombes atomiques, puis par les essais nucléaires, puis (dans l'hémisphère nord principalement) par l'accident de Tchernobyl) et enfin dans une moindre mesure, à cause des rejets de centrales nucléaires ou de sites de retraitement, stockage, etc. Sa signature et son suivi ont par exemple permis de mesurer à quelle vitesse l'eau des nappes se renouvelait ou à démontrer qu'une grotte était ou non isolée du monde extérieur. Il a aussi servi à étudier la cinétique environnementale du césium (notamment dans la chaîne alimentaire). Il a une période radioactive de 30,15 ans. Il se désintègre en baryum 137m, un isomère de courte période (2,55 min) qui se désintègre lui-même en baryum 137 stable. Sa masse atomique standard est de 132,9054519(2) u.
Les déchets radioactifs, les retombées d'essais nucléaires atmosphériques ou de l'accident de Tchernobyl peuvent contenir du césium 135 à très longue période radioactive, du césium 134 (période de 2 ans), et du césium 137 (période de 30 ans). Le césium 135 a une période radioactive de 2,3 millions d’années et fait partie des déchets radioactifs à vie longue.
Toxicité
Toxicité du césium stable
Le césium stable est considéré comme chimiquement peu toxique (DL50 variant de 800 à 2 000 mg/kg selon sa forme chimique[11]).
Néanmoins, au-delà d'une certaine dose et par exemple sous forme de chlorure de césium absorbé par voie orale, il provoque une perte d'appétit, des nausées ou des vomissements, des diarrhées, voire une arythmie cardiaque[12]. En contact avec l’œil, l'hydroxyde de césium est source de sévères irritations[13] - [14].
Toxicité du césium 137
Les isotopes radioactifs sont bien plus dangereux que le césium stable. Parce qu'il est à la fois émissif de rayonnement gamma extrêmement dangereux pour tous les êtres vivants (végétaux, animaux) s'il est intégré dans l'organisme, et parce qu'il est l'homologue chimique du potassium (il tend à le remplacer dans les processus d'assimilation par les végétaux et par ingestion dans l'organisme), le césium 137 est radiotoxique, toxique et écotoxique pour toutes les espèces qui ont besoin de potassium.
De plus il se fixe sur les composants de la couche organique supérieure du sol[9]. Il n'en disparait ensuite que très lentement, notamment dans la litière forestière où il a le temps de se concentrer dans les champignons et les baies sauvages. En 1998 ces deux aliments représentaient 95 % du 137Cs total ingéré en Ukraine, et l'ingestion de radiocésium y augmentait en 1998 de 200 fois environ pour les gros consommateurs de champignons : 100 Bq/jour environ pour un consommateur normal et jusqu'à 2 000 pour les consommateurs réguliers[9], sachant que l'Ukraine a été bien moins touchée sur le Bélarus (70 % des retombées). Le gibier et le réseau trophique sont donc également contaminés[15] - [16] - [17] - [18] - [19].
Les effets des fortes doses de 137Cs ont été étudiés (et ils sont comparables à ceux d'autre sources d'irradiation grave : nausées, vomissements et diarrhées, hémorragies, coma et possiblement la mort [6] / Si l'exposition n'est que cutanée, elle peut causer un érythème, des ulcères puis des nécroses tissulaires). par contre ceux des faibles doses et des expositions chroniques ont longtemps été mal documentés. L'étude des conséquences de Tchernobyl a permis de montrer ou confirmer que :
- La charge corporelle en 137Cs est corrélée avec celle de l'alimentation[20].
- En zone contaminée, le lait maternel contient du 137Cs, et celui-ci passe dans le sang et l'organisme du nouveau-né[21] - [22]. En zone contaminée de Biélorussie, la part du 137Cs ingéré par une mère transférée au bébé allaité est d'environ 15 %[23].
- Il existe une corrélation entre charge corporelle en césium et dérèglement de l'immunité humorale et cellulaire, selon une étude portant sur des enfants vivant en zone contaminée[24]. Le césium peut contaminer le lait maternel et avoir des effets délétères chez l'enfant[25].
- Y. I. Bandazhevsky et d'autres ont plusieurs années après l'accident détecté une augmentation des pathologies cardiovasculaires[26].
- Une radiotoxicité est démontrée pour le foie[27] et le rein[28], ce qui explique probablement les troubles du métabolisme de la vitamine D associés à de faibles doses de 137Cs (également observé chez le rat exposé au 137Cs en laboratoire). Ces troubles pourraient augmenter le risque de rachitisme et de défaut de la minéralisation (problèmes osseux, dentaires..)[29]. Chez le rat, alors que les faibles doses semblent sans effet sur le squelette de l'adulte, une contamination in utero des embryons, via une exposition chronique de la mère (à de faibles doses) durant la grossesse semble perturber le métabolisme de la vitamine D, tant au niveau hormonal que moléculaire et contrairement à ce qui avait été observé chez le modèle adulte, des troubles de la calcification du squelette sont observés[30].
- Le 137Cs est aussi source d'anomalies congénitales (en particulier duplication des reins et des uretères, polydactylie, défauts du tube neural signalés en Bélarus dans les zones où les mères vivaient dans des zones exposées à plus de 555 Bq/m2[31].
- Une exposition chronique à de faibles doses est source de lésions de la vessie[32] et de troubles neurocognitifs[33].
Utilisations
- Forage : Le formiate de césium saturé dans l’eau est thermiquement stable, stable à la pression, et assez dense (2,3 g·cm−3) pour que certains sédiments y flottent. Il permet de produire une boue de forage plus dense (inventée au début des années 1990), qui peut être injectée dans le tube d’un forage profond afin de mieux contrebalancer la pression hydrostatique du fond du puits ce qui facilite l’injection et contrôle la remontée des fluides naturels. Ainsi un fluide plus dense qui remonte autour du tube entraîne plus facilement les roches broyées vers la surface. C'est ainsi qu'ont été forés les puits de ce qui était alors le plus gros projet mondial de forage pétrolier et gazier au monde, en Mer du Nord, dans le champ pétrolier et gazier d'Elgin-Franklin-Glenelg[34].
- Centrifugation : Les sels de césium donnent des solutions aqueuses denses. On les met dans le fond des éprouvettes de centrifugation, surmontées du mélange à séparer et parfois d’une solution moins dense au-dessus. Un gradient de densité se forme et lors de la centrifugation les composants du mélange se séparent selon leur niveau de densité.
- Horloge atomique : l'isotope stable 133Cs permet d'obtenir une exactitude de 2 × 10-14 (soit une seconde sur 1 600 000 ans) grâce à l'« horloge au césium ». La seconde est définie depuis 1967 comme la durée de 9 192 631 770 périodes de la radiation correspondant à la transition entre les deux niveaux hyperfins de l'état fondamental de l'atome de césium 133.
- Photomultiplicateurs et compteurs à scintillation : ces tubes à vide utilisent l'émission par une photocathode, puis la multiplication d'électrons par une succession d'électrodes (dynodes) - jusqu'à 12 ou 14. La photocathode comprend souvent des composés de césium, notamment pour produire de l'infrarouge. Par rapport aux détecteurs à semi-conducteurs, le photomultiplicateur est beaucoup plus encombrant et délicat à utiliser.
- Électrolyte pour accumulateurs[9].
- Catalyseur ou promoteur de conversion chimique (par exemple, en remplacement partiel du potassium pour mieux convertir le SO2 en SO3[35].
- Catalyseur de polymérisation (sous forme d'hydroxyde de césium, CsOH par exemple)[9].
- Propulseur de moteur ionique (devant alors être ionisé)[9].
- Sous forme de carbonate de césium (CsCO3) il forme une base intéressante pour la synthèse organique ; il est aussi sous cette forme mieux solubilisée dans les solvants organiques que les autres carbonates comme le carbonate de potassium qui lui est chimiquement proche (le potassium et le césium sont des analogues chimiques).
- sous forme d'halogénure :
- Le bromure de césium (CsBr), est présent « dans les écrans fluorescents pour rayons X, dans les prismes pour spectromètres infra-rouge et dans les fenêtres de cellules pour spectroscopie d’absorption infra-rouge »[9].
- Le chlorure de césium (CsCl) est un agent contrastant utilisé pour certaines observations en radiographie[9].
Il est aussi utilisé dans certains écrans fluorescents d’appareils aux rayons X et pour piéger des résidus de gaz dans les tubes à vide[9]. - L'iodure de césium (CsI) est intégré dans les prismes de spectromètres infrarouge, dans les compteurs à scintillation et dans certains écrans fluorescents d’appareils à rayons X[9].
- Le fluorure de césium (CsF) est une source de production d'ions fluorure en chimie des organofluorés. Il est aussi une base assez utilisée en chimie organique car les ions fluorures, peu nucléophiles, offrent de meilleurs rendements que le fluorure de potassium ou le fluorure de sodium pour la condensation de Knoevenagel. Il est aussi souvent utilisé pour la désilylation (sous forme anhydre qui forme des intermédiaires sensibles à l'eau) et « dans le THF ou le DMS, il peut attaquer une grande variété de composés organosiliciés en produisant un fluorure et un carbanion, qui peut ensuite réagir avec un électrophile »[9]. On l'utilise aussi pour éliminer des groupements protecteurs (silyls).
- L'isotope 137Cs est utilisé comme source radioactive :
- Dans les laboratoires d'étude de la physique, dont pour les Compteurs de Radioactivité Beta (C.R.A.B.) qui comptent les impulsions correspondant au nombre de désintégrations de noyaux de césium 137, lors d'expériences visant à démontrer l'aspect aléatoire de la désintégration radioactive.
- Dans les irradiateurs industriels utilisés pour la radio-stérilisation des aliments[9].
- Dans certaines jauges de convoyeurs (le cobalt 60 pouvant aussi être utilisé)[36], et dans des jauges de masse volumique (le cobalt 60 peut aussi être utilisé)[36] ou d'autres systèmes de mesure de l’épaisseur d'un matériau ou de certaines teneurs.
- Pour des systèmes d'étalonnage[37].
- En médecine, comme source radioactive de rayonnement (activité environ 109 Bq) pour traiter le cancer du col de l'utérus et le cancer de la vessie avec une source devant être directement au contact de la tumeur[9].
Des sources beaucoup plus actives (aux alentours de 1014 Bq) servent à irradier des produits sanguins pour y inhiber la division lymphocytaire et ainsi limiter les risques de maladies post-transfusionnelles chez les immunodéprimés[9].
Le chlorure de césium a été proposé comme remède en médecine alternative à la suite de la théorie faisant liant la progression des métastases cancéreuses et le pH intracellulaire. Ainsi, cet élément alcalin pénètre la cellule cancéreuse par la Na+/K+-ATPase et bloque le glucose tentant d'entrer par la membrane plasmique. La dose journalière est de 0,5 à 3 grammes de chlorure de césium en solution afin de créer un effet de saturation létal pour cellules propageant le cancer. Cela peut amener des troubles cardiaques et n’est pas efficace contre le cancer[38]. - Comme « indicateur » de retombées d'essais nucléaires, d'accidents de l'industrie nucléaire (dont de fuite des centrales nucléaires). Il a par exemple été libéré, entre autres éléments radioactifs, en quantités importantes lors des essais nucléaires atmosphériques au début des années 1960, puis lors des accidents toujours en cours de Tchernobyl et de Fukushima.
Comportement du césium dans l'environnement
La cinétique des isotopes du césium (radioéléments) dans l'environnement est étudiée car ces produits sont dangereux et souvent présent dans les retombées radioactives d'essais nucléaires et avec plus d'intérêt depuis la catastrophe de Tchernobyl.
Interactions avec les matériaux de construction
Les ions césium apportés par l'eau (pluie, lessivage, immersion, etc) peuvent être intégrés dans certains matériaux poreux (brique…) ou s'adsorber sur les mortiers, ciments, bétons.
Le césium en solution aqueuse s'adsorbe plus ou moins rapidement selon la température, le temps de contact et la teneur de la solution en césium, d'une manière relativement bien corrélée au modèle isotherme d'adsorption de Freundlich[39]. L'interaction principale entre l'ion césium et le ciment est l'adsorption (de 0,0395 à 22,34 μg.cm-2 pour une solution de 0,0069 à 8,837 mg.L-1). Plus la température est élevée, plus cette adsorption est rapide.
Décontamination, extraction sélective
Après la catastrophe de Fukushima, pour décontaminer les sols et parois de béton (ou d'asphalte) des zones les plus radioactives de la centrale et des environs proches, un robot hydrodécapeur spécial à très haute pression a été mis au point ; il arrache littéralement la peinture et la surface des ciments. L'opérateur doit ensuite récupérer et traiter les résidus aqueux, dont le césium.
Des progrès ont été expérimentalement faits dans les années 2000 concernant l'extraction sélective par solvant du 137Cs et 90Sr[40], dont par le Calix[4]arene-crown-6[41], ce qui pourrait contribuer à réduire la radioactivité de certains déchets nucléaires en la transférant vers le résidu.
Dans le sol et la strate herbacée
Dans les sols argileux et nus, le radiocésium est fortement absorbé dans les argiles pures du sol[42]. Il est alors peu mobile et ne contamine pas les eaux profondes ou superficielles (hormis en présence d'érosion).
Il est par contre beaucoup plus biodisponible dans la couche superficielle humique ou argilo-humique[43] - [44] - [45], où il peut être mobilisé (absorbé) par les racines et les rhizomes de certaines plantes, et éventuellement concentré (fougères par exemple). Les mycéliums des champignons peuvent aussi très facilement l'absorber, dont ceux de champignons à fructification souterraine (truffes, truffe du cerf en particulier) qui peuvent le concentrer ou également le véhiculer via la rhizosphère et les mycorhizes vers les plantes.
L'INRA de Montpellier a tenté de modéliser la circulation du césium via les plantes et le sol dans les années 1990, sur la base de données montrant que le taux et la vitesse d'absorption par les plantes dépendaient des espèces considérées, mais aussi de la concentration en potassium du sol, de la densité racinaire et de la distribution profonde des racines.
La présence de matière organique dans l'argile diminue la fixation du césium dans le sol et favorise son transfert vers la plante (jusqu'à 90 % en plus). Siobhan Staunton de l'INRA (ENSAM) notait néanmoins en 1996[46] qu'une grande part du césium pompé par la plante est excrétée et non transférée vers les parties supérieures. Peu après une pollution de surface, ce sont les plantes à racines superficielles qui sont contaminées, puis, 10 à 20 ans après en moyenne, ce sont les plantes se nourrissant plus profondément ou certains champignons.
On ignore encore si les arbres seront concernés après quelques décennies ou quelques siècles, et combien de temps les sangliers (volontiers nécrophages et amateurs de champignons) resteront contaminés[47]. On sait cependant que selon leur position dans le réseau trophique les animaux-gibier se contaminent différemment et présentent donc des risques différents en tant que gibier consommé[48].
C'est dans les écosystèmes forestiers que le césium 137 se montre le plus durablement présent (il y est moins lessivé), biodisponible et localement en voie de concentration (dans les régions où il a plu lors du nuage de Tchernobyl, les sols forestiers sont devenus le principal stock de césium, et notamment dans les creux et en montagne en pied de versant où il a pu s'accumuler au point d'y voir la radioactivité augmenter malgré la période radioactive du césium)[49]. Le césium est invisible, mais les analyses faites depuis 1986 montrent une gamme d'effets insidieux de contamination, avec un « degré exceptionnellement élevé de transfert de radiocésium dans les produits forestiers comme le gibier et certains produits végétaux comestibles »[49].
Dans la pyramide alimentaire
Pour les raisons décrites ci-dessus, au sein des réseaux trophiques forestiers, les animaux consommant certaines racines, rhizomes et tubercules et surtout des champignons et/ou des cadavres peuvent durablement se contaminer.
Diverses études laissent penser que le sanglier serait l'animal le plus vulnérable à la bioaccumulation, en raison de son double comportement de mycophage[47] fouisseur et de nécrophage. Par exemple, dans les zones contaminées du sud et sud/ouest de l'Allemagne, dans les 20 ans qui ont suivi les retombées de l'accident de Tchernobyl, la radioactivité moyenne de la viande de chevreuil a régulièrement diminué, mais non celle du sanglier qui est resté constante, malgré le fait que la radioactivité ambiante moyenne diminuait aussi[50]. Ainsi trouvait-on encore en Allemagne en 2008 des sangliers dont la chair dépassait plusieurs milliers de Bq/kg. Durant 10 ans (de 1998 à 2008), les analyses de 656 sangliers tués par des chasseurs dans les bois de l'Arrondissement de Ravensbourg (sud de l'Allemagne, à la frontière suisse) ont montré une très forte variabilité des teneurs en 137Cs, s'échelonnant de moins de 5 Bq/kg à 8 266 Bq/kg (soit plus de 13 fois le seuil légal pour la consommation), avec - (comme partout où ce type d'analyse a été fait) une tendance saisonnière (expliquée par les changements saisonniers de choix alimentaires, la fourniture d'agrainage en hiver, les conditions météorologiques, et peut-être un comportement particulier du césium chez le sanglier…)[50].
Les valeurs de tag (Facteur de transfert agrégé) pour les sangliers de la région de Ravensburg ont varié de 0,008 à 0,062 m2/kg pour la période 2000-2008[50].
Exposition et imprégnation de la population
Elles varient a priori selon de nombreux paramètres, environnementaux, médicaux et accidentels notamment. Hormis les situations post-accident nucléaire où le risque perdure durant des décennies, de faibles quantités de césium sont chroniquement perdues dans l'environnement via certaines activités industrielles et humaines (en trouve parfois par exemple dans les cendres volantes et refioms d'incinérateurs de déchets dangereux ou de centrales ou charbon)[11].
Exposition
L'exposition professionnelle est jugée faible[51] et surtout liée au travail dans l’industrie nucléaire[11] - [51].
Voies et degré d'exposition
Les voies d'exposition semblent d'abord être alimentaires. Les laitages et produits dérivés (fromage...) sont souvent évoqués car importants pour les enfants, mais les coquillages (filtreurs surtout), les champignons ou certaines espèces de gibier (sanglier) présentent plus de risque à poids égal[11].
En France les concentrations révélées par les campagnes d'analyse sur les laitages montrent des taux moyens aujourd'hui (années 2000-2010) très faibles, sans dépassements de normes pour les périodes récentes (2010-1018)[52] - [53], alors que dans plusieurs régions d'Europe la viande de sanglier pose encore problème.
Le moment le plus critique de la vie est celui de la Périnatalité (les 1000 premiers jours à partir de la conception)
1) car lors de la grossesse le césium et tous ses isotopes traversent la barrière placentaire et peuvent atteindre le fœtus qui a d'importants besoins de potassium pour son développement (or le Césium est son analogue chimique) ; et
2) car à l'occasion de changements métaboliques chez la mère induits par la grossesse puis l'allaitement, le césium (radioactif le cas échéant) de la mère est ensuite aussi significativement retrouvé dans le lait maternel[54]. (Des chercheurs suédois avaient montré en 1998 que 15 % de l’apport quotidien des mères en 137 Cs est directement transféré au bébé par l'allaitement[55] - [56], taux confirmé par une autre étude en l'an 2000[57]. Des analyses du césium urinaire faites lors du suivi de cohortes de femmes enceintes (cohorte Inma en Espagne[58] et Nhanes[59]) ont montré une diminution légère de l'excrétion de césium durant la grossesse (ratio de 0,9 entre les concentrations médianes au 3e trimestre et au 1er trimestre) peut être par dilution urinaire accrue[60] - [61] mais pour des raisons non comprises, les taux urinaires de césium des femmes enceintes dépassent ceux de leurs homologues non- enceintes[61].
Le métabolisme de la vitamine D peut être impliqué dans ces phénomènes[62].
Imprégnation
Peu d'études sont disponibles concernant l'imprégnation à grande échelle notamment pour les enfants (hors de zones concernées par des accidents).
Les femmes adultes ont été mieux suivies, au moins en période périnatale. Chez elles, la concentration urinaire médiane était lors d'études récentes de 4,9 μmol/mol de créatinine (soit 5,8 μg/g de créatinine) au Royaume-Uni entre Glasgow et Southampton[63], de 4,5 μg/L (4,8 μg/g de créatinine) au Canada[64] et 3,6 μg/L (5,0 μg/g de créatinine) aux États-Unis[65]. Les femmes enceintes excrètent dans leur urine plus de césium que les autres (phénomène pas encore clairement compris)[51]. L'imprégnation de la population est générale et assez comparable entre les pays, démontrant l'existence d'un « fond » général d'exposition au césium, non identifié à ce jour[63].
L'imprégnation est donc est très significative et générale ; en 2018 en France le « Volet périnatal » du programme national de biosurveillance, qui a publié une évaluation de l'imprégnation des femmes enceintes par le césium (et par 12 autres métaux ou métalloïdes et quelques polluants organiques) a montré que 100 % des femmes testées en présentaient dans leurs analyses d'urine (à presque 5μg/L pour la moyenne géométrique des résultats)[66](dans ce cas 4 145 femmes enceintes ayant accouché en France en 2011 hors Corse et TOM étaient suivies)[66]. Le dosage urinaire au sein de cette cohorte (dite « Cohorte Elfe ») de 990 femmes enceintes arrivant à la maternité a confirmé une omniprésence du Césium dans l'environnement (et nos organismes)[66] ; la moyenne géométrique était de à 4,93 μg/L, pour 6,72 μg/g de créatinine[66]. Le 95e percentile de la distribution du césium était égal à 15,0 μg/L, soit 14,6 μg/g de créatinine[66] et le césium urinaire augmentaient significativement avec l’âge de la mère[66]. Ce taux est très élevé (atteignant parfois près de 25μg/L pour 25,98 μg/g de créatinine)[66], mais il est comparable à ceux rapportés par d'autres études dans plusieurs autres pays chez les femmes enceintes. Il est cependant un peu moins élevé que ceux mesurés également à l’étranger chez les femmes non-enceintes[66] (ce qui pourrait laisser penser que l'organisme de la future mère plutôt que l'évacuer via les urines l’excrète d'une autre manière et/ou le stocke mieux et/ou le transfère vers le placenta et/ou l'embryon ou le foetus).
Faute de données consensuelles sur les sources possibles d’exposition de la population générale au césium, notamment via l'alimentation et le réseau trophique ; dans cette étude « il n’a pas été possible de rechercher les déterminants des niveaux d’imprégnation par le césium chez les femmes enceintes » ont précisé les auteurs[66].
Facteur de transfert de l'environnement à l'Homme
Peu de données existent à propos du transfert de césium stable, mais il en existe pour le radiocésium (qui est supposé se comporter de la même manière dans les organismes et donc dans la chaine alimentaire). Par exemple, en Suède :
- la teneur corporelle en radiocésium a été mesurée dans des ménages dont un membre au moins chassait. Ceci a été fait dans 5 zones caractérisées par une contamination croissante par le radiocésium (7 à 80 kBq/m2). Résultats : La teneur corporelle (corps entier) pour le 137Cs variait selon le genre : elle était de 0,3 à 1,9 kBq chez les femmes. Et était plus que doublée (0,6 à 4,7 kBq) pour les hommes. Dans ce cas le facteur de transfert du 137Cs était de 0,4 à 1,1 Bq/kg/kBq/m2 et il dépendait moins du niveau du dépôt que pour les populations précédemment étudiées ; il dépendait ici du dépôt au sol mais aussi beaucoup du sexe de la personne (les femmes se contaminant moins)[67].
- Chez les chasseurs suédois, sans surprise (et comme chez les espèces gibier telles que les sangliers qui se contaminent le plus à l'automne quand ils mangent le plus de champignons)[67], le facteur de transfert varie selon la saison[68].
- Une autre étude a répété des mesures du 137Cs (corps entier) d'adultes de familles de chasseurs suédois en 1994 puis à l'automne 1997 et au printemps 1998 sur 3 sites (By, Harbo et Gävle) proches mais présentant des contaminations différentes. Des questionnaires ont montré que les habitudes des familles différaient significativement en termes de fréquence et saisonnalité d'ingestion d'élan de chevreuil, de poissons d'eau douce, de champignons et de baies, et les analyses ont montré des variations saisonnières différentes (pas de variations dans un cas). L'étude a cependant montré que la teneur en 137Cs de l'ensemble du corps a enmoyenne diminué de 37 % en deux ans de 1994 à 1998, comme attendu de par la demi-vie écologique efficace du césium (6 ans)[69].
- Une autre étude (2017) a calculé pour ces chasseurs et leur famille la somme moyenne des doses annuelles efficaces internes et externe (pour une espérance de vie de 80 ans pour les hommes et de 84 ans pour les femmes) : Il en résulte des doses efficaces totales à vie de 8,3 mSv en moyenne dans le Västernorrland, de 4,7 mSv à Uppsala et de 4,1 mSv à Gävleborg (3 des zones les plus contaminées par les retombées de Tchernobyl ; en moyenne la dose efficace pour les hommes était d'environ 40 % plus élevée que pour les femmes. Dans chacune de ces trois zones la dose interne était d'environ 75 % de la dose efficace totale pendant toute la vie. La dose collective pour tous les chasseurs et leurs proches (44 000 individus environ, dans ces trois comtés) pourrait être estimée à environ 256 manSv[70].
- Le risque varie donc selon la contamination de l'environnement proche, mais aussi selon la saison[68] et selon le genre (différence pouvant au moins en partie être expliquée par des différences marquées de consommation de gibier et poisson sauvage selon qu'on soit un homme ou une femme d'après Burger J (2000) aux Etats-Unis[71]). Les enfants sont en outre plus à risque que les adultes.
Cinétique dans l'organisme humain
Le métabolisme et la biocinétique du césium dans l'organisme humain ne sont pas encore entièrement compris[72] - [73].
Une fois inhalé ou ingéré le Césium est très facilement absorbé par les fluides corporels et immédiatement circulant dans tout l'organisme.
Les expériences sur l'animal donnent un taux d'absorption intestinale de 98 %, ce qui est très élevé. Chez l'Homme, selon les données disponibles en 2000, 100 % du Césium est absorbé par l'intestin[74], sauf sous certaines formes physico-chimiques moins bioassimilables[75] - [76].
La contamination est réputée se faire essentiellement par ingestion et absorption gastro-intestinale mais un transfert percutané a été néanmoins été découvert et documenté chez le rat de laboratoire[11]).
Une fois dans le corps humain le césium stable et ses isotopes radioactifs semblent se comporter de la même façon[51]. Le césium est très fortement et rapidement absorbé via le tractus intestinal (car homologue du potassium qui est un élément essentiel parmi les mieux captés par le système digestif dans le bol alimentaire) ; il est ensuite transporté par le sang et tend à se fixer plus ou moins durablement à la place de son analogue chimique, le potassium ; Le Cs ingéré est distribué de façon homogène dans l'organisme humain et animal, mais on en retrouvera beaucoup dans le muscle (en tant qu'homologue du potassium) ainsi que dans l'aorte, les glandes surrénales, le foie et la rate qui sont des tissus qui le fixent sélectivement mieux que le potassium[77]. Il traverse sans difficulté le placenta et les barrières protégeant le cerveau.
Sa toxicité résulte alors principalement de ses propriétés radiologiques[51]. Selon l'IRSN (2004) les données disponibles (dont modèles expérimentaux après contamination chronique à faible dose) suggèrent que le 137 Cs peut affecter de nombreuses fonctions physiologiques et métaboliques ; il affecte notamment le système immunitaire ; il peut causer des malformations congénitales et des troubles neurologiques, surtout chez les enfants.
Dans le modèle animal (rongeur principalement) de faibles doses de radiocésium ingérées entraînent aussi des perturbations du cycle veille-sommeil, sans troubles comportementaux apparents, et affecte aussi le système cardiovasculaire.
Des systèmes physiologiques essentiels (métabolisme de la vitamine D, du cholestérol et des hormones stéroïdiennes) sont aussi affectés, bien que sans symptômes cliniques repérables.
Une étude métabolomique récente[78] s'appuyant sur des contaminations de niveaux "postaccidentels" (Tchernobyl) a montré des différences de métabolisme chez les rats contaminés chroniquement par de faibles doses de 137 Cs, dans modifications évidentes des marqueurs cliniques habituellement suivis. L'IRSN estime en 2004 que le Césium pourrait aussi et ainsi « contribuer, avec d'autres substances artificielles présentes dans l'environnement, à l'augmentation des risques d'apparition de pathologies non cancéreuses dans certaines régions du globe »
Lors du transport hors des globules rouges et à travers ou entre les cellules épithéliales, il rivalise avec le potassium en étant un peu mieux fixé que lui par l'organisme, ce qui explique peut-être son temps de séjour dans le muscle, allongé par rapport à celui du potassium[79] (notamment démontré sur des cultures cellulaires[80].
Son excrétion chez l'Homme est essentiellement urinaire[81], mais ses formes insolubles (minoritaires) sont elles majoritairement éliminées dans les fèces[11]. Après ingestion, sa demi-vie d’élimination urinaire est estimée être de 27 jours environ[12] ; Le césium urinaire ne reflète qu'une exposition récente au césium (jours et/ou semaines précédant la miction).
Traitement des intoxications au césium
Le bleu de Prusse pris par la bouche joue le rôle de chélateur : il absorbe les ions césium et thallium qui s'insèrent parfaitement dans les sites tétraédriques de la structure. Il le fait alors dans l'intestin puis est éliminé dans les selles (alors colorées en bleu très foncé). Le césium et le thallium sont alors piégés dans une forme insoluble et non disponible pour les plantes et les autres organismes vivants, ce qui réduit leurs impacts écologiques.
Mesures de la pollution de l'environnement
- L'institution japonaise l'AIST (Institut national de science industrielle avancée et de la technologie) a développé la mesure de la contamination de l'eau et des sols par l'isotope radiogénique césium après l'accident nucléaire de Fukushima au Japon le 11 mars 2011[82] - [83] - [84]. Le développement avec le bleu de Prusse a débuté en 2005[82]. Des pastilles de bleu de Prusse sont vendues sous l’appellation « Radiogardase ».
Normes, limites, législation
En France les limites annuelles d’exposition au césium radioactif sont fixées par les articles R.1333-8, R.1333-63 à 68 du Code de la santé publique : les aliments pour nourrissons doivent être au-dessous de 370 Bq/kg (600 Bq/kg pour les autres aliments).
Après les accidents nucléaires (Tchernobyl, Fukushima) des normes peuvent être adoptées plus ou moins provisoirement pour l'importation de produits venant de zones touchées par des retombées de césium, en Europe sous l'égide des règlements (UE) n° 733/2008 et n° 996/2012.
Gisements
Selon une estimation de 2004, la demande mondiale en césium pur est de moins de 25 000 kilogrammes par an ; les réserves suffisent pour des millénaires[10].
Plusieurs gisements sont connus:
- Bikita, Zimbabwe (Bikita Minerals, 2004)
- Désert de Karibib, Namibie.
- Afghanistan (Orris and Bliss, 2002, p. 10),
- Brésil (Quemeneur and Lagache, 1999),
- Inde (Chandrasekharam, 2000),
- Italie (Roskill Information Services Ltd., 1984, p. 12),
- Suède (Roskill Information Services Ltd., 1984, p. 14),
- Tibet (Mianping and others, 1995),
- États-Unis (Burt, 1993, p. 759), Maine (Sundelius, 1963, p. 94) et Dakota du Sud (Strod, 1957).
- Espagne (Solid Resources Ltd., 2004)
- Chili (Sociedad Química y Minera de Chile, 2004)
- Canada (Pakeagama pegmatite) (Cumming, 1999) et Bernic Lake[85] au Manitoba.
Les deux tiers des réserves mondiales accessibles seraient Bernic Lake dans le Manitoba, une mine de pegmatite granitique dans une amphibolite exploitée par Tanco[86] située environ 180 km à l’est-nord-est de Winnipeg, près de la frontière Manitoba–Ontario.
Images (le césium et un de ses minerais)

USGOV.jpg.webp)
Notes et références
Notes
- On trouve plus rarement la variante cæsium avec la ligature æ obligatoire[8].
Références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- SIGMA-ALDRICH
- « Césium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Entrée « Caesium » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 mars 2011 (JavaScript nécessaire)
- Article « cæsium », Dictionnaire de définitions Antidote 8, version 2, [Logiciel], Montréal, Druide informatique], 2012.
- Udppc Césium - Présentation par l'UDPPC (Union des professeurs de physique et de chimie), consulté le 07 janvier 2018
- http://pubs.usgs.gov/of/2004/1432/2004-1432.pdf
- ATSDR (2004) Toxicological profile for cesium. Atlanta: Agency for Toxic Substances and Disease Registry
- Villa A (2012) Risques associés à l'utilisation de chlorure de césium en médecine alternative anticancéreuse. Comité de coordination de toxicovigilance (voir notamment p. 17)
- CDC (2011) Cesium hydroxid Atlanta : Centers for Disease Control and Prevention; ; mis à jour le 28/09/2011|URL:https://www.cdc.gov/niosh/pel88/21351- 79.html
- CDC (2011) NIOSH Pocket Guide to Chemical Hazards cesium hydroxide | Atlanta : Centers for Disease Control and Prevention | mise à jour : 13/02/2015 | URL:https://www.cdc.gov/niosh/npg/npgd0111.html
- Nelin P & Palo T.R (1989) Factors influencing caesium-137 levels in moose (Alces Alces) and small game in northern Sweden. In The radioecology of natural and artificial radionuclides|résumé.
- Zach R & Mayoh K.R.(1982). The transfer of fallout cesium-137 from browse to moose. Part 1 (No. AECL--6832). Atomic Energy of Canada Ltd. |résumé.
- Bergman, R., Nylen, T., Appelblad, P., Bergman, I., Granstroem, M., Lidstroem, K., ... & Ramebaeck, H. (2005). Radioactivity levels in forests after the Chernobyl accident. What happens in berries, mushrooms and game ? (No. FOI-R--1587). Swedish Defence Research Agency|résumé
- Rantavaara, A., Nygren, T., Nygren, K., & Hyvönen, T. (1987). Radioactivity of game meat in Finland after the Chernobyl accident in 1986 (No. STUK-A--62). Finnish Centre for Radiation and Nuclear Safety.
- Marovic G, Lokobauer N & Bauman A (1992) Risk estimation of radioactive contamination after the Chernobyl accident using bioindicators. Health physics, 62(4), 332-337.
- Handl, J., D. Beltz, W. Botsch, S. Harb, D. Jakob, R. Michel, and L. D. Romantschuk. 2003. Evaluation of radioactive exposure from 137Cs in contaminated areas of Northern Ukraine. Health Phys 84:502-17
- Johansson, L., A. Björeland, and G. Agren. 1998. Tranfer of 137Cs to infants via human breast milk. Radiat Prot Dosimetry 79:165-67.
- Thornberg, C., and S. Mattsson. 2000. Increased 137Cs metabolism during pregnancy. Health Phys 78:502-6.
- Johansson, L., A. Björeland, and G. Agren. 1998. Tranfer of 137Cs to infants via human breast milk. Radiat Prot Dosimetry 79:165-67.
- Titov, L. P., G. D. Kharitonic, I. E. Gourmanchuk, and S. I. Ignatenko. 1995. Effects of radiation on the production of immunoglobulins in children subsequent to the Chernobyl disaster. Allergy Proc 16:185-93.
- Document de 6 pages intitulé "Effets du césium 137 sur le métabolisme de la Vitamine D3 (ou Cholécalciférol) après une contamination chronique via le lait maternel", Émilie Tissandié, 3e année de thèse (Thèse : Effets des radionucléides sur le métabolisme de la vitamine D3 chez le rat)
- Bandazhevskaya, G. S., V. B. Nesterenko, V. I. Babenko, T. V. Yerkovich, and Y. I. Bandazhevsky. 2004. Relationship between caesium (137Cs) load, cardiovascular symptoms, and source of food in 'Chernobyl' children -- preliminary observations after intake of oral apple pectin. Swiss Med Wkly 134:725-9.
- Stojadinovic, S., and M. Jovanovic. 1966. Activity of transaminases in the rat serum after internal contamination with 137Cs and 90Sr. Strahlentherapie 131:633-6.
- Nikula, K. J., B. A. Muggenburg, W. C. Griffith, W. W. Carlton, T. E. Fritz, and B. B. Boecker. 1996. Biological effects of 137CsCl injected in beagle dogs of different ages. Radiat Res 146:536-47.
- Tissandié, E., Y. Gueguen, J. M. Lobaccaro, J. Aigueperse, P. Gourmelon, F. Paquet, and M. Souidi. 2006a. Chronic contamination with 137Cesium affects Vitamin D3 metabolism in rats. Toxicology 225:75-80.
- Document déjà cité d'Emilie Tissandié, intitulé "Effets du césium 137 sur le métabolisme de la Vitamine D3 après une contamination chronique via le lait maternel", page 5-6.
- Lazjuk GI, Nikolaev DL, Novikova (1997) IV. Changes in registered congenital anomalies in the Republic of Belarus after the Chernobyl accident. Stem Cells ; 15 (Suppl. 2) : 255-60.
- Romanenko A, Morimura K, Wanibuchi H, et al. (2003) Urinary bladder lesions induced by persistent chronic low-dose ionizing radiation. Cancer Sci ; 94 : 328-33
- Gamache GL, Levinson DM, Reeves DL, Bidyuk PI, Brantley KK. (2005) Longitudinal neurocognitive assessments of Ukrainians exposed to ionizing radiation after the Chernobyl nuclear accident. Arch Clin Neuropsychol ; 20 : 81-93
- B.L. Fitzgerald, A.J. McCourt (Baroid Drilling Fluids) ; M. Brangetto (ELF Exploration UK plc), “Drilling Fluid Plays Key Role in Developing the Extreme HTHP, Elgin/Franklin Field” ; Society of Petroleum Engineers Doi:10.2118/59188-MS ; Conference Paper : IADC/SPE Drilling Conference, 23-25 February 2000, New Orleans, Louisiana ; (ISBN 978-1-55563-353-0) (résumé)
- Clément, H () Acide sulfurique|Techniques de l’Ingénieur, traité Génie des procédés| PDF, voir page 4/9
- Gerlini M & Chetaine A(2016) Non-Proliferation, Safety and Nuclear Security: Collected Essays on Technologies and International Policies |IOS Press, 29 janv. - 124 pagesvoir p 18
- M. Gerlini & A. Chetaine (2016) Non-Proliferation, Safety and Nuclear Security: Collected Essays on Technologies and International Policies |IOS Press, 29 janv. - 124 pagesvoir p 19
- http://www.pharmacorama.com/ezine/20090921153409.php
- Konstantin Volchek; Muhammed Yusuf Miah; Wenxing Kuang; Zack DeMaleki; F. Handan Tezel (2011) Adsorption of cesium on cement mortar from aqueous solutions ; Journal of Hazardous Materials (October 2011), 194, Complete, pg. 331-337 (résumé)
- Chao Xu; Jianchen Wang; Jing Chen (2012), "Solvent Extraction of Strontium and Cesium: A Review of Recent Progress" ; Solvent Extraction and Ion Exchange (October 2012), 30 (6), pg. 623-650 (résumé)
- J.-F. Dozol, V. Lamare, N. Simon, R. Ungaro, and A. Casnati (2000) Extraction of Cesium by Calix[4]arene-crown-6: From Synthesis to Process 757 (), 12-25
- Cherif, M. A. ; Martin-Garin ; Gérard, F. ; Bildstein, O. (2017) A robust and parsimonious model for caesium sorption on clay minerals and natural clay materials |Applied Geochemistry | 87 : 22-37. Article DOI:10.1016/j.apgeochem.2017.10.017
- Fielitz U (2001) Überprüfung von Ökosystemen nach Tschernobyl hinsichtlich der Strahlenbelastung der Bevölkerung |Forschungsvorhaben StSch 4206 im Auftrag des BUNR. 65 S.
- Hecht H & K.O (1997) Honikel, adiocäsium in Wald und Wild (Hsg.)|2. Veranstaltung, Bundesanstalt für Fleischforschung, Kulmbach
- Haffelder M (1995) Radiocäsium in Waldökosystemen des Hinteren Bayrischen Waldes nach dem Reaktorunfall von Tschernobyl unter besonderer Berücksichtigung der Äsungspflanzen des Schalenwildes, Diss. Uni. Ulm. S. 178
- Paris, Le sol, un patrimoine menacé ? Le point scientifique, Congrès : Forum, Paris, 24 octobre 1996
- Vilic M, Barisic D, Kraljevic P & Lulic S (2005) 137 Cs concentration in meat of wild boars (Sus scrofa) in Croatia a decade and half after the Chernobyl accident. Journal of environmental radioactivity, 81(1), 55-62.
- Pel'gunov, A. N., & Pel'gunova, L. A. (2009). The role of different species of hunt game animals in formation of irradiation dose of population in territories polluted by 137Cs. Radiatsionnaia biologiia, radioecologiia, 49(2), 234-237.
- George Shaw, Radionuclides in forest ecosystems ; Radioactivity in the Environment Volume 10, 2007, Pages 127-155 ; Radioactivity in the Terrestrial Environment doi:10.1016/S1569-4860(06)10006-6 (Résumé et 1re page. En ligne : 22 mars 2007)
- Tatiana Semizhon, Victoria Putyrskaya, Gregor Zibold, Eckehard Klemt, Time-dependency of the 137Cs contamination of wild boar from a région in Southern Germany in the years 1998 to 2008 ; Journal of Environmental Radioactivity Volume 100, Issue 11, November 2009, Pages 988-992 doi:10.1016/j.jenvrad.2009.06.023
- : métaux et métalloïde des recherches de la cohorte Elfe ; 2016 ; SANTÉ PUBLIQUE France/Imprégnation des femmes enceintes par les polluants de l'environnement en France en 2011], Décembre. Volet périnatal du programme national de biosurveillance|PDF, 224p|aussi disponible à partir de l’URL : www.santepubliquefrance.fr |Voir chapitre 3.7.1.2 Exposition de la population
- Grastilleur C. (2006) La surveillance des radionucléides dans les aliments par la Direction générale de l'alimentation (DGAl). Bulletin épidémioloique; (23):[6- 7 pp.]. URL:https://pro.anses.fr/bulletin- epidemiologique/Documents//BEP - mg -BE23.pdf
- Direction générale de la concurrence, de la consommation et de la répression des fraudes (2013) Radioactivité des denrées alimentaires Paris: Ministère de l'économie et des finances; [mis à jour 04/06/2013] | URL : http://www.economie.gouv.fr/dgccrf/radioactivite-des-denrees-alimentaires
- Giussani, A., & Risica, S. (2014). Considerations on the ICRP model predictions of the transfer of 137Cs from food to the milk and urine of lactating mothers. Journal of Radiological Protection, 34(2), N19
- Johansson L, Björeland A, Ågren G. (1998) Transfer of 137Cs to Infants via Human Breast Milk |Radiat Prot Dosimetry|79(1 -4):[165 -7 pp.]|URL: http://rpd.oxfordjournals.org/content/79/1 -4/165.full.pdf+html
- D. Harrison, J., J. Smith, T., & W. Phipps, A. (2003). Infant doses from the transfer of radionuclides in mothers' milk. Radiation protection dosimetry, 105(1-4), 251-256.|résumé
- Thornberg C & Mattsson S (2000) Increased 137Cs metabolism during pregnancy |Health Phys.|78(5):502 -6.
- suivi de 489 femmes enceintes de 2004 à 2006
- National Health and Nutrition Examination Survey, cohorte suivie aux États-Unis depuis 2003, avec analyse de césium urinaire chez 233 femmes : 5,1 μg/L en moyenne
- Fort M, Cosin-Tomas M, Grimalt JO, Querol X, Casas M, Sunyer J (2014) Assessment of exposure to trace metals in a cohort of pregnant women from an urban center by urine analysis in the first and third trimesters of pregnancy. Environ Sci PollutRe s Int. ;21(15):9234 -41
- Jain RB (2013) Effect of pregnancy on the levels of urinary metals for females aged 17-39 years old: data from National Health and Nutrition Examination Survey 2003- 2010 | J ToxicolEnviron Health A. ;76(2):86- 97.
- Tissandie, E., Gueguen, Y., Lobaccaro, J. M. A., Grandcolas, L., Grison, S., Aigueperse, J., & Souidi, M. (2009). Vitamin D metabolism impairment in the rat’s offspring following maternal exposure to 137cesium. Archives of toxicology, 83(4), 357-362|résumé.
- Morton J, Tan E, Leese E, Cocker J (2014) Determination of 61 elements in urine samples collected from a non-occupationally exposed UK adult population. Toxicol Lett.;231(2):179 -93
- Santé Canada (2013) Deuxième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada. Résultats de l'Enquête canadienne sur les mesures de la santé Cycle 2 (2009-2011). Ottawa (Ontario)
- CDC (2015) Fourth National Report on Human Exposure to Environmental Chemicals. Tables mises à jour, Fevrier. Atlanta.
- : métaux et métalloïde des recherches de la cohorte Elfe ; Décembre 2016 ; SANTÉ PUBLIQUE France / Imprégnation des femmes enceintes par les polluants de l’environnement en France en 2011]. Volet périnatal du programme national de biosurveillance|PDF, 224p|aussi disponible à partir de l’URL : www.santepubliquefrance.fr
- Johanson K.J (1994) 4.3. Radiocaesium in Game Animals in the Nordic Countries. Studies in Environmental Science, 62, 287-301.
- Agren G (2001) Seasonal and Long-Term Variations in 137Cs Among Adults from Swedish Hunter Families. Radiation protection dosimetry, 93(1), 49-53.
- Agren G (2001) Seasonal and Long-Term Variations in 137Cs Among Adults from Swedish Hunter Families. Radiation protection dosimetry, 93(1), 49-53.résumé
- Tondel, M., Rääf, C., Wålinder, R., Mamour, A., & Isaksson, M. (2017) Estimated lifetime effective dose to hunters and their families in the three most contaminated counties in Sweden after the Chernobyl nuclear power plant accident in 1986–A pilot study| Journal of environmental radioactivity | 177, 241-249
- Burger J (2000) Gender differences in meal patterns : role of self-caught fish and wild game in meat and fish diets. Environmental Research, 83(2), 140-149|résumé
- Rääf C.L, Falk R, Thornberg C, Zakaria M & Mattsson S (2004) Human metabolism of radiocaesium revisited. Radiation protection dosimetry, 112(3), 395-404.
- Souidi, M., Grison, S., Dublineau, I., Aigueperse, J., & Lestaevel, P. (2013). Le césium 137: un perturbateur de la fonction physiologique ?. Environnement, Risques & Santé, 12(2), 151-159|Doc produit dans le cadre du programme Envirhom de l'IRSN
- Després A, Métivier H. (2000) Dosimétrie des expositions aux isotopes radioactifs du césium. In : Le césium de l'environnement à l'homme . Paris : EDP Sciences
- Raaf CL, Falk R, Thornberg C, Zakaria M, Mattsson S. Human metabolism of radio-caesium revisited. Radiat Prot Dosimetry 2004 ; 112 : 395-404
- Henrichs H, Paretzke HG, Voigt G, Berg D. (1989) Measurements of Cs absorption and retention in man. Health Phys ; 57 : 571-8
- Paulin R & Siles S (1998) Césium In : Toxiques nucléaires. Paris : Masson.
- Grison S & al. (2012) The Metabolomic Approach Identifies a Biological Signature of Low-dose Chronic Exposure to Cesium 137 | Journal of Radiation Research, 53 (1) : 33 - 43|résumé
- Wright EM (1972) Mechanisms of ion transport across the choroid plexus. The Journal of physiology ;226(2):545- 71
- Cereijido M, Meza I, Martinez -Palomo A.(1981) Occluding junctions in cultured epithelial monolayers. The American journal of physiology. ;240(3):C96- 102
- CDC (2013)Biomonitoring Summary Cesium | Atlanta |Centers for Disease Control and Prevention ; mis à jour le 23/12/2016 | URL:https://www.cdc.gov/biomonitoring/Cesium_BiomonitoringSummary.html
- (ja) « プルシアンブルーを利用して多様な形態のセシウム吸着材を開発 –汚染水や土壌などさまざまな環境に適用可能– », sur AIST,
- (ja) « 土壌中のセシウムを低濃度の酸で抽出することに成功 –プルシアンブルーナノ粒子吸着材で回収し放射性廃棄物の大幅な減量化へ– », sur AIST,
- (en) Shinichi Saoshiro, « New Japan method eyed to remove radiation from soil », sur Reuters, Edwina Gibbs,
- http://rruff.info/doclib/cm/vol38/CM38_877.pdf
- http://www.cabot-corp.com/wcm/download/en-us/sp/TANCO1.pdf
Voir aussi
Bibliographie
- (fr) Colle C, Adam C, Garnier–Laplace J, Roussel-Debet S (2005) Fiche radionucléide Césium 137 et environnement. Fontenay-aux-Roses: IRSN
- (en) Fritsch & al (2008) Biotic interactions modify the transfer of cesium-137 in a soil-earthworm-plant-snail food web. Environmental Toxicology and Chemistry, 27 (8) : 1698-707 |résumé
- (en) Messiha F.S. (1984), Cesium: A bibliography update ; Pharmacology Biochemistry and Behavior (January 1984), 21, Supplement 1, pg. 113-129
Articles connexes
Liens externes
- (en) « Technical data for Cesium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- (en) Réaction d'un mélange de césium & d'eau en vidéo
- (en) Toxicological Profile for Cesium, ATSDR, U.S. Department of Health and Human Services.
- (en) Images du césium sous différentes formes
- (en) « Technical data for Cesium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||





