Fluorure de césium
Le fluorure de césium (CsF) est un composé ionique qui se présente généralement sous la forme d'un solide blanc hygroscopique. Il est plus soluble et se dissocie plus facilement que le fluorure de sodium ou le fluorure de potassium. Il peut se trouver sous sa forme anhydre, et s'il se présente sous forme hydratée il peut être séché facilement par chauffage à 100 °C durant deux heures sous vide [3]. Étant moins hygroscopique que le fluorure de tétra-n-butylammonium (TBAF) ou que le TASF (difluorotrimethylsilicate de tris(diméthylamino) sulfonium), il leur constitue une alternative utile en cas de besoin d'ions fluorures "nus" à l'état anhydre. Comme tous les fluorures solubles, c'est une base faible. Il doit donc éviter d'être mis en contact avec des acides pour éviter de former de l'acide fluorhydrique.
| Fluorure de césium | |

| |
| fluorure de césium | |
| Identification | |
|---|---|
| Nom UICPA | fluorure de césium |
| No CAS | |
| No ECHA | 100.033.156 |
| No CE | 236-487-3 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | Poudre blanche |
| Propriétés chimiques | |
| Formule | CsF |
| Masse molaire[1] | 151,903 855 1 ± 7,0E−7 g/mol Cs 87,49 %, F 12,51 %, 151.90 |
| Moment dipolaire | 7,9 D |
| Propriétés physiques | |
| T° fusion | 682 °C |
| T° ébullition | 1 251 °C |
| Solubilité | 3 670 g·l-1 (eau, 18 °C) |
| Masse volumique | 4,155 g·cm-3 (25 °C) |
| Cristallographie | |
| Système cristallin | Cubique |
| Réseau de Bravais | cF |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | Fm3m (n°225) |
| Structure type | NaCl[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés chimiques
Le fluorure de césium agit généralement comme une source d'ions fluorures F−. Il peut donc subir toutes les réactions usuelles mettant en jeu des ions fluorures en solution, comme [4]:
- 2 CsF (aq) + CaCl2 (aq) → 2 CsCl (aq) + CaF2 (s)
Étant facilement dissocié, il est relativement réactif en tant que source d'ions fluorures également en conditions anhydre, et il réagit par exemple avec les chlorures d'aryle, déficitaires en électrons, pour former des fluorures d'aryle (réaction de Finkelstein). Du fait de la force élevée de la liaison silicium-fluor, les ions fluorures sont utiles pour des réactions de désilylation (qui permettent d'éliminer des groupements Si) en chimie organique, et le fluorure de césium constitue donc une excellente source d'ions fluorures pour ces réactions en milieu anhydre.
Comme les autres fluorures solubles, CsF est une base faible (l'acide conjugué, HF, est un acide faible). La faible nucléophilie des ions fluorures en font une base utile en chimie organique [4].
Le fluorure de césium est l'un des composés possédant la liaison la plus ionique. En effet, le césium est l'élément le plus électropositif de la classification périodique (hormis le francium, un élément radioactif extrêmement rare), tandis que le fluor possède l'électronégativité la plus élevée.
Structure cristalline
Le fluorure de césium cristallise dans une structure de type NaCl, avec ceci de particulier que les ions césium sont plus gros que les ions fluorures. Les ions césium forment un réseau cubique à faces centrées, et les ions fluorures sont situés dans les sites octaédriques [4] - [5].
Fabrication
Le fluorure de césium peut être préparé par réaction de l'acide fluorhydrique et de l'hydroxyde de césium ou du carbonate de césium, suivi d'une déshydratation.
Utilisation
Le fluorure de césium est une base utile en chimie organique, du fait de la faible nucléophilie des ions fluorures. Il permet d'obtenir de meilleurs rendements que le fluorure de potassium ou le fluorure de sodium au cours d'une condensation de Knoevenagel [6].
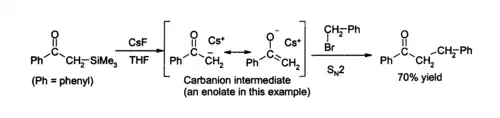
Une des applications principales du fluorure de césium en laboratoire est la désilylation, sa forme anhydre permettant la formation d'intermédiaires sensibles à l'eau. Dans le THF ou le DMS, il peut attaquer une grande variété de composés organosiliciés en produisant un fluorure et un carbanion, qui peut ensuite réagir avec un électrophile [5], comme [6]:
Il permet également d'éliminer des groupements protecteurs silyls.
CsF est également une source populaire d'ions fluorures en chimie des organofluorés. Par exemple, il réagit avec l'hexafluoroacétone pour former un sel de perfluoroalkoxide de césium stable jusqu'à 60 °C, contrairement au sel de sodium ou de potassium correspondant [7].
Sous forme monocristalline, il est transparent dans le domaine des infrarouges lointains. De ce fait, il est souvent utilisé pour les fenêtres des cellules de spectroscopie infrarouge.
Précautions
Comme les autres fluorures solubles, CsF possède une toxicité modérée [8]. Il ne doit pas être mis en contact avec des acides pour éviter la formation d'acide fluorhydrique. Les ions césium Cs+ ne sont généralement pas considérés comme toxiques [9].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Pittsburgh, PA, USA, Springer Science + Business Media, Inc., , 346 p. (ISBN 0-387-26147-8), p. 64
- (en) Friestad, G. K.; Branchaud, B. P., Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents, New York, Wiley, , 99–103 p.
- Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements, Pergamon Press, Oxford, UK, 1984.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- (en) Fiorenza, M, Mordini, A, Papaleo, S, Pastorelli, S et Ricci, A, « Fluoride ion induced reactions of organosilanes: the preparation of mono and dicarbonyl compounds from β-ketosilanes », Tetrahedron Letters, vol. 26, , p. 787 (DOI 10.1016/S0040-4039(00)89137-6)
- (en) F. W. Evans, M. H. Litt, A. M. Weidler-Kubanek, F. P. Avonda, « Reactions Catalyzed by Potassium Fluoride. 111. The Knoevenagel Reaction », Journal of Organic Chemistry, vol. 33, , p. 1837–1839 (DOI 10.1021/jo01269a028)
- MSDS Listing for cesium fluoride. www.hazard.com. MSDS Date: April 27, 1993. Retrieved on September 7, 2007.
- "MSDS Listing for cesium chloride." www.jtbaker.com. MSDS Date: January 16, 2006. Retrieved on September 7, 2007.