Hexafluoroacétone
L'hexafluoroacétone (HFA) est un composé chimique de formule CF3-CO-CF3, avec une structure similaire à celle de l'acétone avec tous ses atomes d'hydrogène remplacés par des atomes de fluor qui lui confèrent une réactivité assez différente. Il se présente sous la forme d'un gaz incolore, hygroscopique, ininflammable et très réactif, avec une odeur désagréable proche de la moutarde. Il est plus courant, dans le commerce notamment, sous forme de sesquihydrate, un diol géminal. Il est notamment utilisé dans la synthèse de composés organo-fluorés, et pour la fabrication de polyamides. Sa forme deutéro-hydratée peut servir de solvant en spectroscopie RMN.
| Hexafluoroacétone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1,1,1,3,3,3-hexafluoropropan-2-one | |
| Synonymes |
perfluoroacétone |
|
| No CAS | ||
| No ECHA | 100.010.616 | |
| No CE | 211-676-3 | |
| No RTECS | UC2450000 | |
| SMILES | ||
| InChI | ||
| Apparence | gaz incolore à l'odeur désagréable[1] | |
| Propriétés chimiques | ||
| Formule | C3F6O [Isomères] |
|
| Masse molaire[2] | 166,021 9 ± 0,002 7 g/mol C 21,7 %, F 68,66 %, O 9,64 %, |
|
| Propriétés physiques | ||
| T° fusion | −122 °C[1] | |
| T° ébullition | −27,5 °C[1] | |
| Pression de vapeur saturante | 5,9 bar à 20 °C[1] 4 525 mmHg à 21,1 °C[3] |
|
| Point critique | 81,4 °C 28,41 bar 0,567 kg·l-1[1] |
|
| Point triple | −129 °C[1] | |
| Précautions | ||
| NFPA 704 | ||
| Directive 67/548/EEC[1] | ||
 T |
||
| Transport[1] | ||
| Écotoxicologie | ||
| DL50 | 191 mg·kg-1 (rat, oral)[4] | |
| LogP | 1,46[5] | |
| Composés apparentés | ||
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Réactivité
L'hexafluoroacétone est un composé réactif en raison de son carbone central particulièrement électrophile et qui le fait réagir avec des nucléophiles, comme des alcènes ou des composés aromatiques. L'hexafluoroacétone est très réactif dans l'eau avec laquelle il forme un diol géminal, l’équilibre chimique (~106) étant fortement en faveur de la formation de ce dernier, contrairement par exemple au cas de l'acétone (10-3)[6]. De la même façon,(CF3)2CO a tendance à s'associer avec l'ammoniac pour former (CF3)2C(OH)(NH2) qui peut être déshydraté par le chlorure de phosphoryle pour donner (CF3)2CNH[7]. Les hydrates d'hexafluoroacétone sont acides et réagissent avec la plupart des métaux en produisant du dihydrogène. L'hexafluoroacétone réagit violemment en présence de bases.
L'hexafluoroacétone se décompose en monoxyde de carbone, dioxyde de carbone, fluorure d'hydrogène et difluor lorsqu'il est chauffé[1].
Synthèse
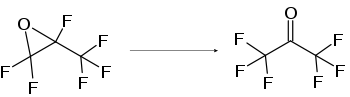
L'hexafluoroacétone peut être obtenu par isomérisation de l'hexafluoro-1,2-époxypropane, par réaction en présence de catalyseurs acides de Lewis tels que Al2O3, TiO2, WO2, AlCl3, AlBr3, SnCl4, VOCl3, TiCl4, FeCl3, CuCl2 ou ZrOCl2[8].
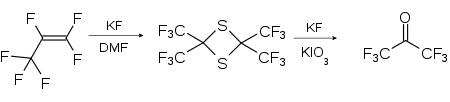
Une autre méthode utilisée en laboratoire est une réaction en deux étapes à partir du perfluoropropène. Dans un premier temps, le perfluoropropène est mis à réagir avec du soufre, réaction catalysée par le fluorure de potassium (KF) pour former un composé 1,3-dithiétane [(CF3)2CS]2. Ce dernier est ensuite oxydé par l'iodate de potassium pour former (CF3)2CO[9] :
Utilisation
L'hexafluoroacétone est principalement utilisé en synthèse organique, notamment pour des substitutions électrophiles. Il est aussi le principal intermédiaire dans la production de l'hexafluoroisopropanol, qui peut être obtenu par réduction de l'HFA, par exemple par le tétrahydruroaluminate de lithium ou le tétrahydruroborate de sodium. Il est aussi un intermédiaire dans la production de polyméthacrylate de méthyle (PMMA) ou de polyesters. L'hexafluoroacétone peut être utilisé comme solvant des polyamides et des polyglycolides.
L'hydroperoxyde de l'hexafluoroacétone est un puissant agent d'époxydation[10].
Notes et références
- Entrée « Hexafluoroacetone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 12/11/2010 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Hexafluoroacetone chez Sigma-Aldrich.
- Toxicology and Applied Pharmacology. Vol. 6, Pg. 341, 1964.
- (en) « Hexafluoroacétone », sur ChemIDplus, consulté le 12/11/2010
- Lemal DM. "Perspective on Fluorocarbon Chemistry" J Org Chem. 2004, volume 69, p 1-11. DOI 10.1021/jo0302556
- Middleton, W. J.; Carlson, H. D., Hexafluoroacetoneimine, Org. Synth., coll. « vol. 6 », , p. 664
- U.S.-Patent 3.321.515.
- Van Der Puy, M. ; Anello, L. G., Hexafluoroacetone, Org. Synth., coll. « vol. 7 », , p. 251
- W. Adam, et al, in: Chem. Rev., 2001, 101, S. 3499.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hexafluoroacetone » (voir la liste des auteurs).
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Hexafluoroaceton » (voir la liste des auteurs).