Monoxyde de carbone
Le monoxyde de carbone est le plus simple des oxydes du carbone. La molécule est composée d'un atome de carbone et d'un atome d'oxygène ; sa formule brute s'écrit CO et sa formule semi-développée C≡O ou |C≡O|. Ce corps composé est à l'état gazeux dans les conditions normales de température et de pression.
| Monoxyde de carbone | |||
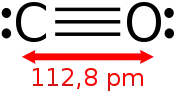
| |||
 | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.010.118 | ||
| No CE | 211-128-3 | ||
| PubChem | 281 | ||
| ChEBI | 17245 | ||
| Apparence | gaz comprimé incolore, inodore, insipide[1]. | ||
| Propriétés chimiques | |||
| Formule | CO | ||
| Masse molaire[2] | 28,010 1 ± 0,001 1 g/mol C 42,88 %, O 57,12 %, |
||
| Moment dipolaire | 0,109 80 D[3] | ||
| Propriétés physiques | |||
| T° fusion | −205 °C[1] | ||
| T° ébullition | −191 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 2,3 ml/100 ml[1] | ||
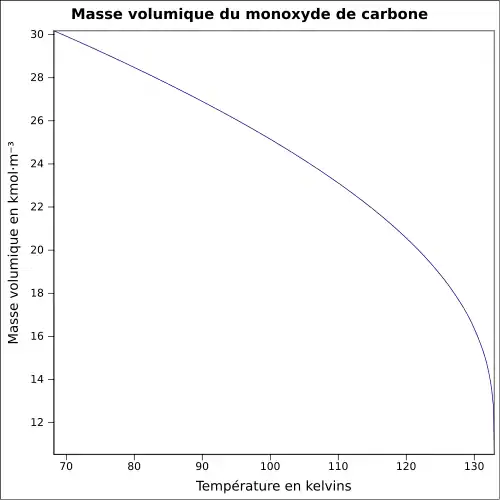
| Masse volumique | 1,145 (gaz à 298K)
|
||
| T° d'auto-inflammation | 605 °C[1] | ||
| Point d’éclair | Gaz Inflammable[1] | ||
| Limites d’explosivité dans l’air | 12,5–74,2 %vol[1] | ||
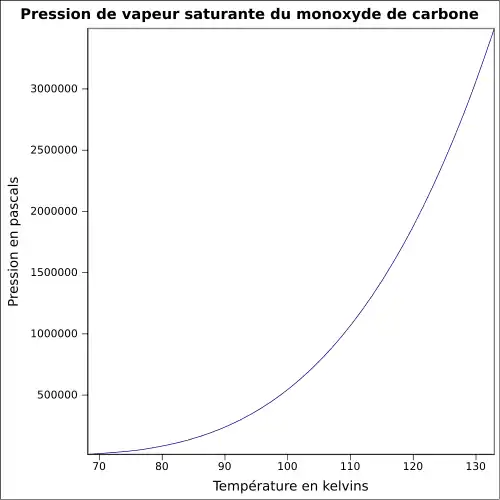
| Pression de vapeur saturante | |||
| Point critique | −140,05 °C, 3,50 MPa[5] | ||
| Vitesse du son | 338 m·s-1 (0 °C,1 atm)[6] | ||
| Thermochimie | |||
| ΔfH0gaz | −110,53 kJ·mol-1[7] | ||
| Cp | |||
| PCS | 283,0 kJ·mol-1 (25 °C, gaz)[9] | ||
| PCI | 283,4 kJ·mol-1[10] | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 14,014 ± 0,000 3 eV (gaz)[11] | ||
| Cristallographie | |||
| Symbole de Pearson | [12] | ||
| Classe cristalline ou groupe d’espace | P213, (no 198) [12] |
||
| Strukturbericht | B21[12] | ||
| Précautions | |||
| SGH[13] - [14] | |||
    Danger |
|||
| SIMDUT[15] | |||
   A, B1, D1A, D2A, |
|||
| Transport | |||
|
|||
| Inhalation | Très dangereuse, mortelle | ||
| Ingestion | Cause possible de nausée et vomissements avec risque d'intoxication | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le monoxyde de carbone est un gaz incolore, inodore, insipide et non irritant, indétectable par les mammifères bien que particulièrement toxique. Le mélange avec l’air est facile puisque les deux gaz ont une densité proche[16]. Chez l'être humain, il est la cause de nombreuses intoxications domestiques, parfois mortelles, qui peuvent être évitées par l'utilisation d'un détecteur de monoxyde de carbone[17]. Son émanation, provenant d'une combustion incomplète de composés carbonés, est accentuée par une mauvaise alimentation en air frais et/ou une mauvaise évacuation des produits de combustion (ventilation).
Structure orbitalaire
Les orbitales moléculaires qui décrivent la structure du monoxyde de carbone sont relativement semblables à celle du diazote N2. Les deux molécules ont chacune quatorze électrons et quasiment la même masse molaire. À première vue, on pourrait penser, à tort, que l'atome de carbone est divalent dans le mésomère C=O et que c'est donc un carbène. Cependant, l'isomère de résonance −C≡O+ est la forme prédominante[18], comme l'indique la distance interatomique de 112 pm, qui correspond plutôt à une triple liaison. En conséquence, la molécule CO présente un moment dipolaire inversé par rapport aux prévisions que l'on pourrait faire grâce à l'électronégativité de C et de O : une légère charge partielle négative réside sur le carbone.
Propriétés chimiques
Dans les conditions normales de température et de pression, le monoxyde de carbone est un gaz incolore et inodore, très peu soluble dans l'eau. Ses points d'ébullition et de fusion, et surtout sa densité gazeuse sont proches de ceux de l'azote moléculaire. Mais l'asymétrie d'électronégativité explique qu'il est beaucoup plus réactif que l'azote moléculaire et joue un rôle de ligand dans des complexes métalliques. Sa toxicité ((voir infra)) ou sa métastabilité en dessous de 950 °C en sont une preuve.
Le premier sens de l'équation réversible de Boudouard est une réaction de décomposition chimique exothermique (ΔH < 0).
avec une variation d'enthalpie (ΔH) de −39 kcal/mol (−163 kJ/mol).
La cinétique de cette réaction réversible est catalysée par les surfaces de métaux et d'oxydes métalliques, par exemple le fer et ses oxydes. Si la réaction a lieu avec une cinétique suffisante, elle est à moitié réalisée vers 700 °C et complète en dessous de 400 °C. Comme la réaction de Boudouard présentée dans cette direction est exothermique, elle est donc, d'après la loi de van 't Hoff, thermodynamiquement favorisée par une diminution de la température qui favorise l'évacuation de la chaleur produite par la réaction. Néanmoins la température doit être suffisante du point de vue de la cinétique réactionnelle.
Le monoxyde de carbone est absorbé par une solution saturée de chlorure cuivreux dans de l'acide chlorhydrique qui précipite. Ce précipité, composé d'addition sous forme de cristaux blancs permettait avec l'appareil Orsat de doser de manière volumétrique le monoxyde de carbone parmi d'autres gaz. L'analyse de ce gaz industriel, combustible, était pratiquée communément bien avant 1880.
Formation du monoxyde de carbone lors des combustions incomplètes
Lorsque l'oxygénation du foyer est insuffisante pour brûler complètement les gaz formés à partir de la matière, mais que la réaction est assez exothermique pour élever et maintenir la température au-delà de 950 °C, le monoxyde de carbone se forme préférentiellement au dioxyde de carbone, selon l'équilibre de Boudouard. En dessous de ce seuil, la molécule CO est métastable, a fortiori à température et pression ambiantes. Elle se décompose toutefois très lentement, et surtout au contact de surfaces pour former du dioxyde de carbone et du carbone. C'est selon cette réaction réversible que le carbone est transporté au cœur des procédés sidérurgiques ou, plus surprenant, au cœur de mécanismes biochimiques in vivo.
Combustion et vieux usages industriels
Le monoxyde de carbone réagit avec le dioxygène pour former du dioxyde de carbone suivant la réaction exothermique (ΔH < 0) :
avec une variation d'enthalpie (ΔH) de −67,5 kcal/mol (−282 kJ/mol).
C'est pourquoi il était préparé en quantité considérable dans le gazogène de type Siemens. Ce gaz (combustible en présence d'air) est le produit d'une combustion incomplète de lits de charbon, le but étant de maintenir une température importante (supérieure à 950 °C) pour favoriser la production de monoxyde de carbone face au dioxyde.
La pyrolyse de la houille ou gazéification du charbon par exemple permet d'obtenir le gaz de houille qui contient environ un dixième de masse en monoxyde de carbone (en général, les gaz manufacturés d'abord produits pour les besoins de l'éclairage contiennent principalement du dihydrogène, du méthane, des oxydes de carbone).
En termes de pyrolyse (qui était interdite par la législation française sur le gaz d'éclairage) ou sur un
Autre exemple: la projection d'eau ou de vapeur d'eau sur du charbon porté au rouge, permet d'obtenir le gaz à l'eau, encore appelé après purification gaz de synthèse.
Cette réduction de la vapeur d'eau est conduite à 500 °C, catalysée sur un lit de Fe2O3 et d'autres oxydes métalliques. Cette réaction autrefois commune en carbochimie est endothermique (ΔH > 0), avec une variation d'enthalpie libre (ΔH) de +10 kcal/mol (+41,8 kJ/mol).
Le monoxyde de carbone est le gaz réducteur des divers oxydes métalliques. Il se forme en traversant les couches de charbon de bois des bas fourneaux antiques et des hauts fourneaux, communs à partir du XIVe siècle. Les métallurgistes, et en particulier les sidérurgistes de l'Antiquité ou du Moyen Âge, soupçonnent déjà l'existence d'un corps subtil qui réduit les minerais finement triés et concassés.
Réduction du CO par le dihydrogène H2
Suivant les catalyseurs employés, les stœchiométries et les conditions des phases gazeuses, une gamme de molécules organiques ou, en présence de métaux réactifs, de carbures métalliques comme le carbure de tungstène (utilisation de poudres carbonées dans la production) a été obtenue au tournant du XXe siècle. Les chimistes allemands et français ont été les précurseurs.
Senderens et Sabatier en 1902 proposent le nickel à 240 °C sous 1 atm.
Si on augmente la pression au-delà de 100 atm et si on adapte la catalyse, la synthèse de combustibles liquides, sous forme d'hydrocarbures, ou encore d'alcènes, d'alcools, de glycols ou de cétones est réalisable.
La synthèse du méthanol, une des plus importantes matières premières industrielles de synthèse, illustre ce type de procédé :
À une pression d'environ 300 atm, et une température de 370 °C, l'emploi de catalyseurs à base de ZnO, Cr2O3 permet d'obtenir un méthanol très pur.
Une autre possibilité de catalyse à 50 atm, à une température de 250 °C avec CuO, ZnO, Al2O3 est encore commune pour obtenir du méthanol.
On peut produire de l'acide acétique en faisant réagir du monoxyde de carbone et du méthanol avec une catalyse homogène de rhodium (procédé Monsanto).
Cependant, ces réactions ne sont pas utilisées dans tous les cas, d'autres réactions catalysées par l'activité microbienne sont plus efficaces, plus faciles à mettre en œuvre ou moins coûteuses, ainsi l'acide acétique (acide éthanoïque) peut être produit à partir d'éthanol lors de la fermentation acétique par des bactéries, l'éthanol étant lui-même produit à partir de sucres lors de la fermentation alcoolique par des levures ou des bactéries.
Réaction d'addition
L'addition de CO en présence de dihydrogène avec les alcènes, appelée hydroformylation, permet la synthèse industrielle des aldéhydes.
- alcène monosubstitué + CO2 + H2 → mélange d'aldéhydes, puis après réduction, d'alcools primaires.
L'action catalytique de Co(CO)4, à P # 120 bars, T = 80 °C, permet de fixer CO sur la chaîne carbonée. Les proportions de racémiques sont fonction de la facilité d'accès au site électrophile. De façon prépondérante, la chaîne est allongée plutôt que ramifiée.
Une réaction conduite en présence d'eau donne des acides carboxyliques. S'ils sont produits en même temps que des cétones, réduites en alcools, des équilibres d'estérification favorisent un mélange complexe avec des esters.
Le procédé Aldox permet à partir d'alcènes terminaux (voir alpha-olefin), propène, et de gaz de synthèse, une première réaction OXO. Après aldolisation avec la soude NaOH, puis une crotonisation à l'aide d'un acide, et enfin une hydrogénation sur Ni, des alcools primaires en C6-C9 peuvent servir de plastifiants sous forme d'ester.
Outre les alcènes, CO s'additionne aussi au dioxygène (combustion), aux dihalogènes ou au cyanogène, au soufre ou à la soude.
Composés d'addition avec des métaux de transition : les carbonyles de métaux
Avec le nickel et le fer, comme avec les autres métaux de transition du groupe VI, du groupe VII et du groupe VIII, le monoxyde de carbone forme des composés d'addition. La structure de ces complexes a été élucidée par les travaux pionniers d'Alfred Werner.
Le tétracarbonyle de nickel Ni(CO)4 est un composé volatil découvert en 1888 par Mond, Langer et Quincke qui a permis de purifier le nickel du cobalt. Ce composé, cancérogène, se décompose immédiatement en monoxyde de carbone et nickel, ce qui permet la purification du nickel. L'emploi de monoxyde de carbone sous forte pression a permis de découvrir une multitude d'autres carbonyles de métaux entre 1890 et 1910, parmi lesquels Co(CO)4 utilisé ci-dessous comme catalyseur de la synthèse OXO. Ces transporteurs d'oxyde de carbone sur les molécules organiques, communément usités dès 1940 et appelés carbonyles métalliques, donneront cours à une intense littérature de brevets dans les années 1950. Fernand Gallais a apporté une meilleure compréhension physicochimique de ce domaine désormais établi de la chimie de coordination.
Le monoxyde de carbone dans la nature
Une petite partie est d'origine géologique, une partie substantielle vient de la combustion de ressources énergétiques fossiles, mais l'essentiel provient des feux de biomasse. Ces feux sont en partie d'origine naturelle, mais le plus souvent d'origine anthropique (feux de forêt, de brousse, etc.).
Pour les panaches les plus concentrés en CO, hormis au Japon et en Inde où la source anthropique domine, les feux de biomasse en sont l'origine première. Les feux contribuent « en moyenne à 45 % aux 1 % plus forts panaches observés en Allemagne, ce chiffre atteignant 70 % pour le nord-est des États-Unis et le sud-est de la Chine, et 90 % pour la Namibie »[19]. Ceci explique aussi la saisonnalité des pics de concentration en CO dans l'atmosphère, saisonnalité qui varie selon la proximité du pôle ou de l'équateur. Ces panaches touchent la couche limite des régions touchées (de 0 à 2 km au-dessus de la surface terrestre) et en partie transportés plus haut jusque dans la troposphère libre (au-dessus de la couche limite) où des vents plus forts les dispersent plus largement, et où ils peuvent persister un certain temps[19]. En aérologie, CO est un traceur parfois utilisé pour cartographier le déplacement de panaches de pollutions créées par de grands feux.
Intoxication au monoxyde de carbone
L’intoxication par le monoxyde de carbone représente en France 6 000 à 8 000 cas par an dont 90 (en 2006[20]) à 300 décès[21]. C'est la première cause de décès par intoxication en France. En revanche la mortalité hospitalière est inférieure à 1 %.
Ces causes sont le plus souvent accidentelles, par mauvais fonctionnement ou mauvaise utilisation de moyens de chauffage (bois, fuel, etc.) ou de moteurs thermiques (par exemple : fonctionnement d'un groupe électrogène dans un garage mal ventilé).
En France, entre et , 1 008 incidents d’intoxication domestique au CO et impliquant 3 490 personnes ont été signalés à l’Institut de veille sanitaire (InVS), malgré les conditions météorologiques clémentes pendant l'hiver. De à mi-, 53 épisodes d’intoxication au monoxyde de carbone ont concerné 170 personnes[17].
Signes cliniques
Les signes cliniques les plus fréquents sont des céphalées (environ 80 % des cas), des vertiges (75 % des cas), des nausées (51 % des cas). Le malaise est aussi fréquent. L’asthénie, l’impotence musculaire surtout des membres inférieurs sont aussi classiques.
Une exposition plus importante provoque des signes neurologiques et sensoriels : excitation, agitation, ataxie (trouble neurologique), confusion, et plus graves, perte de conscience (16 % des cas) et coma (3 à 13 % des cas).
Utilisation pour des meurtres de masse
Au cours de la Seconde Guerre mondiale le monoxyde de carbone fut utilisé par le régime nazi en concurrence avec le Zyklon B pour mettre à mort les handicapés, les juifs et d’autres victimes. Plusieurs moyens furent utilisés pour asphyxier les victimes avec ce gaz.
Lors de l’Aktion T4 visant à éliminer les handicapés, le gaz était fourni sous forme de bonbonnes dont le contenu était diffusé par des canalisations dans les chambres à gaz aménagées dans les « instituts d'euthanasie ».
Pour la solution finale, deux techniques furent mises en œuvre. Soit les victimes montaient à bord de camions spécialement aménagés. Les gaz d’échappement pouvaient être dérivés vers la caisse hermétique du véhicule où étaient enfermées les victimes. Ce procédé fut utilisé au camp d’extermination de Chelmno et en d’autres endroits. Dans les trois camps d’extermination de l’Aktion Reinhard, les gaz d’échappement de moteurs à explosion étaient canalisés à l’intérieur des chambres à gaz où se trouvaient les victimes[22].
Valeurs seuils ou guide
En France, l'AFSSET a publié en 2007 des Valeurs guides de qualité d’air intérieur (VGAI)[23] :
- 10 mg·m-3, pour une exposition de 8 h
- 30 mg·m-3, pour une exposition d’1 h
- 60 mg·m-3, pour une exposition de 30 min
- 100 mg·m-3, pour une exposition de 15 min
- 1,28 % de CO dans l'air entraîne la perte de connaissance après quelques respirations et la mort survient en moins de 3 minutes.
- 30 minutes d'exposition à 0,32 % de CO dans l'air provoque également un décès.
Monoxyde de carbone et pollution atmosphérique

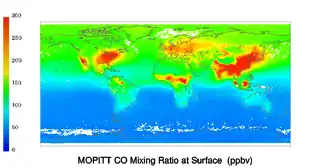
Le monoxyde de carbone est plus connu comme polluant de l'air intérieur, mais il est aussi impliqué de façon majeure dans les effets délétères de la pollution atmosphérique.
Diverses mesures (y compris satellitaires[24] - [25]) montrent qu'il est émis en grande quantité par les feux de forêts, et de manière plus diffuse par les chaudières et moteurs thermiques, y compris dans la haute atmosphère par les tuyères d'avion où le monoxyde de carbone pourrait contribuer à perturber les équilibres physico-chimiques aux altitudes de vol des avions à réaction, altitudes où des phénomènes photochimiques complexes sont en jeu, avec de probables interactions avec l'ozone et la vapeur d'eau.
Dans la troposphère, le monoxyde de carbone est un gaz toxique reconnu à des concentrations assez basses.
Plusieurs études épidémiologiques ont mis en évidence une corrélation entre la pollution au monoxyde de carbone et la mortalité due à des causes cardiovasculaires[26], sans qu'il soit possible d'affirmer si la relation de cause à effet n'est pas plutôt due à d'autres polluants présents. Toutefois certaines études expérimentales ont confirmé la possibilité d'un lien direct. En effet, une étude[27] a permis de mettre en évidence le développement d'un phénotype cardiomyocytaire pathologique chez une population de rats exposés à ce polluant. De plus, une étude[28] a permis d'observer une augmentation de la sensibilité du myocarde à l'ischémie-reperfusion (simulation d'un infarctus du myocarde). Cependant cette même équipe a également rapporté que les effets délétères du monoxyde de carbone sur la sensibilité à l'ischémie-reperfusion pourraient être contrecarrés par une activité physique régulière et modérée, susceptible de prévenir le développement du phénotype pathologique[29].
Le tabagisme est aussi une source d'exposition chronique à de petites quantités de CO[30].
Notes et références
- MONOXYDE DE CARBONE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) M.Dubite, Handbook of chemistry and physics, Vienne, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 142006679X), p. 9-50
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9 et 0-07-049841-5, LCCN 96051648), p. 2-50
- (en) Irving M. Klotz et Robert M. Rosenberg, Chemical Thermodynamics, Basic Concepts and Methods, Hoboken, Wiley-VCH Verlag GmbH & Co. KGaA, , 7e éd., 564 p. (ISBN 978-0-471-78015-1 et 0-471-78015-4, LCCN 2008275257), p. 98.
- (en) W. M Haynes, Handbook of chemistry and physics, Boca Raton, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 14-40
- (en) Irvin Glassman et Richard A. Yetter, Combustion, Londres, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2, LCCN 2008274100), p. 6
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, 2 et 3, Houston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- Magalie ROY-AUBERGER, Pierre MARION et Nicolas BOUDET, « Gazéification du charbon », Techniques de l'Ingénieur, , p. 4 (lire en ligne
 , consulté le ), J5200.
, consulté le ), J5200. - (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « The CO (B21) Structure », sur http://cst-www.nrl.navy.mil/ (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Monoxyde de carbone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- L’air a une masse molaire moyenne de 29 g/mol, le CO a une masse molaire de 28 g/mol. Le CO2 (44 g/mol), est par ailleurs moins toxique et non combustible, et a tendance à s’accumuler au niveau du sol dans les lieux calmes.
- « Responsables d’une centaine de décès en France chaque année. Comment éviter les intoxications au monoxyde de carbone ? », sur Ministères des solidarités et de la santé, (consulté le ).
- (de) Werner Kutzelnigg, Einführung in die Theoretische Chemie, Weinheim, Wiley-VCH, , 896 p. (ISBN 3527306099).
- Rôle des feux de biomasse dans les profils troposphériques de monoxyde de carbone et résumé en français (Données brutes accessibles dans la base de données IAGOS ; (http://www.iagos.org).
- Intoxication à Saliès dans le Tarn, sur le site de la Dépêche du Midi
- [PDF] méthodologie du Baromètre français Santé-Environnement
- Eugen Kogon, Hermann Langbein et Adalbert Ruckerl, Les Chambres à gaz, secret d'État, Paris, Éditions de Minuit, coll. « Points », , 300 p. (ISBN 2-02-040960-7, lire en ligne).

- « Anses - Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail », sur www.anses.fr (consulté le )
- (en) Tobias Borsdorff, Joost aan de Brugh, Haili Hu, Otto Hasekamp, Ralf Sussmann, Markus Rettinger, Frank Hase, Jochen Gross, Matthias Schneider, Omaira Garcia, Wolfgang Stremme, Michel Grutter, Dietrich G. Feist, Sabrina G. Arnold, Martine de Mazière, Mahesh Kumar Sha, David F. Pollard, Matthäus Kiel, Coleen Roehl, Paul O. Wennberg, Geoffrey C. Toon et Jochen Landgraf, « Mapping carbon monoxide pollution from space down to city scales with daily global coverage », Atmos. Meas. Tech., vol. 11, no 10, , p. 5507-5518 (ISSN 1867-1381, DOI 10.5194/amt-11-5507-2018, lire en ligne).
- (en) M. Buchwitz, R. de Beek, S. Noël, J. P. Burrows, H. Bovensmann, H. Bremer, P. Bergamaschi, S. Körner et M. Heimann, « Carbon monoxide, methane and carbon diox- ide columns retrieved from SCIAMACHY by WFM-DOAS: year 2003 initial data set », Atmospheric Chemistry and Physics Discussions, vol. 5, no 12, , p. 3313–3329 (DOI 10.5194/acp-5-3313-2005, lire en ligne [PDF]).
- (en) Robert D. Brook, Barry Franklin, Wayne Cascio et Yuling Hong, « Air Pollution and Cardiovascular Disease », Circulation, vol. 109, no 21, , p. 2655–2671 (ISSN 0009-7322 et 1524-4539, DOI 10.1161/01.cir.0000128587.30041.c8, lire en ligne, consulté le ).
- (en) Lucas Andre, Julien Boissière, Cyril Reboul, Romain Perrier, Santiago Zalvidea, Gregory Meyer, Jérôme Thireau, Stéphane Tanguy, Patrice Bideaux, Maurice Hayot, François Boucher, Philippe Obert, Olivier Cazorla et Sylvain Richard, « Carbon Monoxide Pollution Promotes Cardiac Remodeling and Ventricular Arrhythmia in Healthy Rats », American Journal of Respiratory and Critical Care Medicine, vol. 181, no 6, , p. 587–595 (ISSN 1073-449X et 1535-4970, DOI 10.1164/rccm.200905-0794oc, lire en ligne, consulté le ).
- (en) Gregory Meyer, Lucas André, Stéphane Tanguy, Julien Boissière, C. Farah, F. Lopez-Lauri, S. Gayrard, Sylvain Richard, François Boucher, O. Cazorla, Philippe Obert et Cyril Reboul, « Simulated urban carbon monoxide air pollution exacerbates rat heart ischemia-reperfusion injury », American Journal of Physiology-Heart and Circulatory Physiology, vol. 298, no 5, , H1445–H1453 (ISSN 0363-6135 et 1522-1539, DOI 10.1152/ajpheart.01194.2009, lire en ligne, consulté le ).
- (en) C. Farah, Gregory Meyer, Luncas André, Julien Boissière, S. Gayrard, Olivier F. Cazorla, Sylvain Richard S, François Boucher, Stéphane Tanguy, Philippe Obert et Cyril Reboul, « Moderate exercise prevents impaired Ca2+ handling in heart of CO-exposed rat: implication for sensitivity to ischemia-reperfusion », American Journal of Physiology-Heart and Circulatory Physiology, vol. 299, no 6, , H2076–H2081 (ISSN 0363-6135 et 1522-1539, DOI 10.1152/ajpheart.00835.2010, lire en ligne, consulté le ).
- (en) Seymour I. Cohen, Norman M. Perkins, Hans K. Ury et John R. Goldsmith, « Carbon Monoxide Uptake in Cigarette Smoking », Archives of Environmental Health: An International Journal, vol. 22, no 1, , p. 55–60 (ISSN 0003-9896, PMID 5539982, DOI 10.1080/00039896.1971.10665815, résumé).
Voir aussi
Articles connexes
Bibliographie
Liens externes
- « Intoxications au monoxyde de carbone », sur Ministères des solidarités et de la santé (consulté le )
- « L'intoxication au monoxyde de carbone — Un diagnostic pas toujours facile à poser! »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur Direction de la Santé publique de Montréal
- (en) Lucas Andre, Julien Boissière, Cyril Reboul, Romain Perrier, Santiago Zalvidea, Gregory Meyer, Jérôme Thireau, Stéphane Tanguy, Patrice Bideaux, Maurice Hayot, François Boucher, Philippe Obert, Olivier Cazorla et Sylvain Richard, « Carbon Monoxide Pollution Promotes Cardiac Remodeling and Ventricular Arrhythmia in Healthy Rats », American Journal of Respiratory and Critical Care Medicine, vol. 181, no 6, , p. 587–595 (ISSN 1073-449X et 1535-4970, DOI 10.1164/rccm.200905-0794oc, lire en ligne, consulté le )
- (en) Gregory Meyer, Lucas André, Stéphane Tanguy, Julien Boissière, C. Farah, F. Lopez-Lauri, S. Gayrard, Sylvain Richard, François Boucher, O. Cazorla, Philippe Obert et Cyril Reboul, « Simulated urban carbon monoxide air pollution exacerbates rat heart ischemia-reperfusion injury », American Journal of Physiology-Heart and Circulatory Physiology, vol. 298, no 5, , H1445–H1453 (ISSN 0363-6135 et 1522-1539, DOI 10.1152/ajpheart.01194.2009, lire en ligne, consulté le ).
- (en) C. Farah, Gregory Meyer, Luncas André, Julien Boissière, S. Gayrard, Olivier F. Cazorla, Sylvain Richard S, François Boucher, Stéphane Tanguy, Philippe Obert et Cyril Reboul, « Moderate exercise prevents impaired Ca2+ handling in heart of CO-exposed rat: implication for sensitivity to ischemia-reperfusion », American Journal of Physiology-Heart and Circulatory Physiology, vol. 299, no 6, , H2076–H2081 (ISSN 0363-6135 et 1522-1539, DOI 10.1152/ajpheart.00835.2010, lire en ligne, consulté le )