Glucide
Les glucides sont définis par l'Union internationale de chimie pure et appliquée (UICPA) comme une classe de composés organiques contenant un groupe carbonyle (aldéhyde ou cétone) et au moins deux groupes hydroxyle (-OH). On inclut dans cette classe les substances issues des monosaccharides par réduction du groupe carbonyle, par oxydation d'au moins un groupe à l'extrémité de la chaîne en acide carboxylique ou par remplacement d'un ou plusieurs groupes hydroxyle par un atome d'hydrogène, un groupe amino, un groupe thiol ou par tout atome similaire.

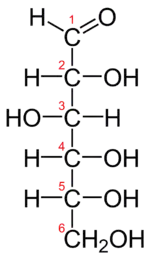
Les glucides ont été initialement (et fautivement) nommés hydrates de carbone (ou carbohydrates), car on avait observé que leur composition élémentaire pourrait correspondre à un modèle Cn(H2O)p. Toutefois, la chimie a rapidement découvert que ces composés ne sont pas des hydrates [parce que H2O ne s'y retrouve pas sous cette forme, avec un O et deux H qui lui sont liés, comme dans la molécule de glucose (ci-contre)], d'où un nécessaire changement de nom que n'ont pas encore complètement fait les anglophones, qui utilisent encore le terme « carbohydrates », ou les germanophones, qui parlent de « Kohlenhydrate ».
Ils se présentent généralement sous la forme de cristaux blancs, car ils n'absorbent pas les rayonnements du spectre UV, ni ceux du spectre visible.
Les glucides font partie, avec les protéines et les lipides, des constituants essentiels des êtres vivants et de leur nutrition, car ils sont un des principaux intermédiaires biologiques de stockage et de consommation d'énergie. Chez les organismes autotrophes, comme les plantes, les sucres sont convertis en amidon pour le stockage. Chez les organismes hétérotrophes, comme les animaux, ils sont stockés sous forme de glycogène puis utilisés comme source d'énergie dans les réactions métaboliques, leur oxydation lors de la digestion des glucides apportant environ 17 kJ/g selon l'étude dans la bombe calorimétrique.
Typologie
Les glucides sont habituellement répartis entre oses (monosaccharides tels le glucose, le galactose ou le fructose) et osides, qui sont des polymères d'oses (oligosaccharides et polysaccharides). Les disaccharides (diholosides), tels le saccharose, le lactose ou le maltose font partie de cette dernière catégorie. Mais seuls les monosaccharides et les disaccharides ont un pouvoir sucrant. Les polysaccharides, comme l'amidon, sont insipides.
- Les oses (sucres simples) sont des molécules simples, non hydrolysables, formant des cristaux incolores.
- Les osides (sucres complexes), hydrolysables sont des polymères d'oses liés par une liaison osidique :
- les holosides sont des polymères exclusivement d'oses ;
- les oligoholosides ont un degré de polymérisation inférieur à 10,
- les polyholosides ont un degré de polymérisation supérieur à 10 (ex. : amylose, amylopectine, cellulose, glycogène),
- les homopolyosides sont les glucides dont l'hydrolyse donne un seul type d'oses,
- les hétéropolyosides sont les glucides dont l'hydrolyse ne donne pas qu'un seul type d'oses ;
- les hétérosides sont des polymères d'oses et de molécule(s) non glucidique(s) (aglycone) :
- les holosides sont des polymères exclusivement d'oses ;
Structure, classification et nomenclature
Oses simples
Les oses possèdent tous un groupe carbonyle mais celui-ci peut apparaître sous une forme « équivalente » ayant le même degré d'oxydation comme un acétal ou un hémiacétal, spécialement dans les formes cycliques. Les oses possédant un groupe aldéhyde, masqué ou non, sont nommés « aldoses ». Pour un groupe cétone, ils sont appelés « cétoses ».
Ils sont caractérisés par leur nombre d'atomes de carbone, toujours supérieur à trois :
- les trioses possèdent 3 carbones : dihydroxyacétone, glycéraldéhyde ;
- les tétroses possèdent 4 carbones : érythrose, thréose, érythrulose ;
- les pentoses possèdent 5 carbones : ribose, arabinose, xylose, lyxose, ribulose, xylulose ;
- les hexoses possèdent 6 carbones : allose, altrose, glucose, mannose, gulose, idose, galactose, talose, psicose, fructose, sorbose, tagatose ;
- les heptoses possèdent 7 carbones : sédoheptulose ;
- les octoses possèdent 8 carbones : heptahydroxyoctanal.
Représentation
Les oses sont présents sous forme acyclique et cyclique (cycle de cinq ou six atomes), lesquelles sont détaillées ci-dessous.
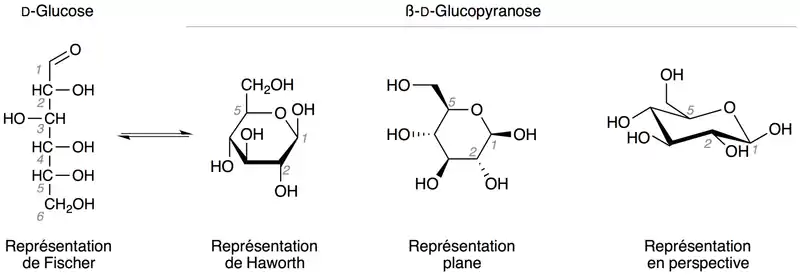
Représentation linéaire : modèle de Fischer

Tous les oses possèdent un pouvoir rotatoire du fait de la présence d'un carbone asymétrique, les oses sont dits chiraux sauf la dihydroxyacétone.
Deux énantiomères (antipodes optiques) ont les mêmes propriétés à l'exception d'une seule : leur pouvoir rotatoire opposé. La figure 1 représente les deux énantiomères du glucose, la forme D-glucose est la forme naturelle. Il est à noter que dans la représentation de Fischer, par convention, le carbone le plus oxydé est placé en haut, ce qui permet de définir sans ambiguïté le sens gauche/droite des substituants de la chaîne carbonée.
- Dans la forme D, le groupe alcool (-OH) porté par le carbone n-1 est à droite (en représentation de Fischer).
- Dans la forme L, le groupe alcool porté par le carbone n-1 est à gauche (en représentation de Fischer).
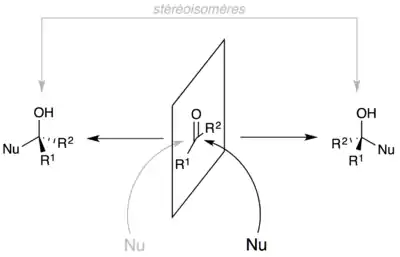
Il existe aussi des stéréoisomères qui sont des isomères optiques. Tous les énantiomères sont des stéréoisomères.
Cyclisation
Pour les sucres, selon qu'un groupe hydroxyle attaque le carbonyle d'un côté ou de l'autre (voir figure), on forme un carbone (généralement) asymétrique appelé « centre anomère ». Le cycle est constitué par cinq (furanose) ou six (pyranose) atomes. Dans une représentation plane avec le groupe -CH2OH au-dessus du plan formé par le cycle, l'anomère est dit « α » si le groupe hydroxyle se trouve derrière le plan, ou « β » s'il se trouve au-dessus du plan. Si la configuration n'est pas connue, on utilise la lettre grecque ξ (xi).
Représentation cyclique : modèle de Haworth
Quand on laisse du glucose préalablement cristallisé en solution dans de l'eau, le pouvoir rotatoire passe de +112° à +52,5°. Quand on laisse en solution dans l'eau du glucose préalablement cristallisé dans de l'acide acétique, le pouvoir rotatoire passe de +19° à +52,5°.
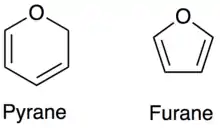
Ceci s'explique par le fait que le glucose (linéaire) en solution aqueuse s'équilibre entre deux formes cycliques. Ceci est dû au fait que le groupe aldéhyde du glucose va réagir avec un des groupes alcool (celui du carbone 5). Le glucose devient cyclique, et il dérive du pyrane (ci-contre) d'où il tire le nom « glucopyranose ». Dans cette cyclisation, telle que décrite dans le paragraphe ci-dessus, le groupe alcool peut s'additionner sur le groupe aldéhyde d'un côté ou de l'autre, ce qui provoque l'apparition de deux composés : les anomères α et β.
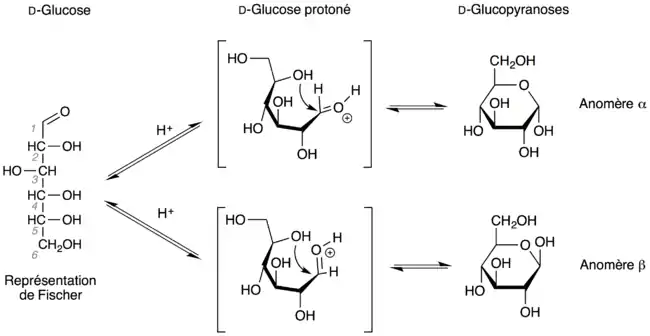
Dans le modèle de Haworth, on considère que le cycle est plan avec l'oxygène endocyclique vers le haut et le carbone anomère à sa droite : si le groupe hydroxyle sur le carbone anomère est en dessous du plan du cycle, il est dit α, sinon il est dit β.
En solution aqueuse, le glucose est en équilibre tautomère : 65 % sous forme β-D-glucopyranose, 0,1 % sous forme D-glucose (linéaire) et 35 % d'α-D-glucopyranose. La cyclisation des sucres permet d'avoir deux fois plus d'isomères.
Certains sucres ont cependant tendance à cycliser non pas sous la forme « pyranique » (cycle à six atomes) mais plutôt sous la forme « furanique » (cycle à cinq atomes). Parmi ces sucres, un des plus importants est le ribose qui, dans sa forme D-β, fait partie intégrante des acides nucléiques comme l'acide désoxyribonucléique (ADN) et l'acide ribonucléique (ARN).
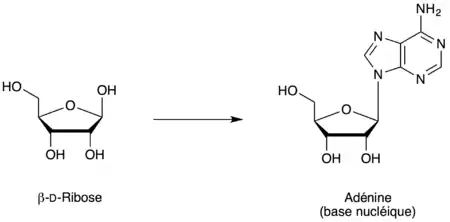
Les oses se cyclisant sous forme furanique (furanose) sont :
- le ribose donnant du ribofuranose ;
- le 2-désoxyribose donnant du 2-désoxyribofuranose ;
- le fructose donnant du fructofuranose ;
- de manière générale, ce sont les cétohexoses et les aldopentoses.
Les oses se cyclisant sous forme pyranique (pyranose) sont :
Osides
Les osides sont des polymères d'oses liés par une liaison osidique. Ils sont hydrolysables, et aussi appelés « glucides complexes ».
Terminologie et classification des osides
Deux formes d'osides sont nommables. D'un côté, dans les oligosaccharides, on retrouve un nombre déterminé de monosaccharides (oses). Pour les nommer, on peut alors employer les termes : « disaccharides » (ex. : saccharose), « trisaccharides » (ex. : raffinose), etc. D'un autre côté, les polysaccharides sont composés d'un nombre indéterminé de monosaccharides. Pour les nommer, on emploie le terme « polysaccharides » (ex. : cellulose).
Formation de la liaison osidique
Une liaison osidique est une liaison covalente, produit de la réaction entre le groupe alcool hémiacétalique (-OH formé par le carbone anomère) et une autre molécule (glucidique ou non).
Diholosides
Les diholosides ou dissacharides ou encore diosides sont des sucres composés de deux molécules d'ose (dimère).
Non-réducteurs
On dit qu'un diholoside est « non réducteur » si le carbone portant le OH hémiacétalique est engagé dans une liaison (le groupe hémiacétalique n'est pas libre). Autrement dit, la liaison finale est du type « oside ».
- Saccharose, aussi appelé « sucrose ».
C'est un diholoside non réducteur, son nom systématique est l'« α-D-glucopyranosyl(1→2)β-D-fructofuranoside ».
Il est scindé en deux molécules : le D-glucopyranose et le D-fructofuranose par l'invertase qui est une α-glycosidase, c'est-à-dire une enzyme spécifique de cette liaison glycosidique.
On le trouve dans les champignons, les bactéries ou encore dans l'hémolymphe des insectes. De nombreux organismes l'accumulent en réponse à un choc thermique. Son nom systématique est l'« α-D-glucopyranosyl(1→1)α-D-glucopyranoside ».
Il est scindé en deux molécules : deux molécules de D glucopyranose par l'invertine.
Réducteurs
C'est un diholoside réducteur car son groupe hémiacétalique est libre, c'est le glucide du lait, son nom systématique est le « β-D-galactopyranosyl(1→4)-D-glucopyranose ».
Il est hydrolysé en deux molécules : le D glucose et le D galactose par une β-galactosidase.
C'est un diholoside homogène réducteur, son nom systématique est l'« α-D-glucopyranosyl(1→4)D-glucopyranose ».
Il provient de l'hydrolyse partielle de l'amidon. Il peut être à son tour hydrolysé par une α-glucosidase en deux molécules de D-glucose.
C'est un diholoside homogène réducteur, son nom systématique est le « β-D-glucopyranosyl(1→4)D-glucopyranose ».
Il provient de l'hydrolyse partielle de la cellulose et est hydrolysé lui-même par une β-glucosidase.
C'est un produit de dégradation de l'amidon et du glycogène. Son nom systématique est l'« α-D-glucopyranosyl(1→6)D-glucopyranose ».
Structure
Un diholoside est constitué de deux oses liés par liaison osidique et peut être réducteur ou non. Exemples : maltose, saccharose, lactose, cellobiose.
Raffinose
Présent dans la betterave, le raffinose est éliminé lors du raffinage du sucre. C'est un triholoside non réducteur, son nom systématique est l'« α-D-galactopyranosyl(1→6)α-D-glucopyranosyl(1→2)β-D-fructofuranoside ».
Gentianose
Le gentianose est présent dans la gentiane.
Polyholosides
Un polyholoside est l'association d'un très grand nombre de molécules liées par des liaisons O-glycosidiques. Ses chaînes sont linéaires ou ramifiées.
C'est un polyholoside homogène non réducteur constitué de deux composés :
- l'amylose (hydrosoluble), polymère de glucose lié par une liaison α(1→4) (20 à 30 %) ;
- l'amylopectine (insoluble), amylose ramifié par une liaison α(1→6) (70 à 80 %).
L'amidon est un polymère de glucose ; il peut être hydrolysé par une α-glucosidase. C'est la substance de réserve glucidique des végétaux. Les féculents sont une source majeure d'amidon dans l'alimentation humaine.
Il se colore, en présence du lugol (eau iodée), en bleu-violet caractéristique.
Au niveau de sa structure, il est pratiquement identique à l'amidon : il possède plus de ramifications que l'amidon (une ramification tous les dix résidus glucose), tout le reste de la structure est identique à l'amidon. Sa masse molaire est plus élevée (de l'ordre de 106 g/mol). C'est la substance de réserve glucidique des animaux. Contrairement à l'amidon, il est soluble dans l'eau froide.
Le glycogène a été extrait par Claude Bernard en 1856 dans le foie. C'est la forme de stockage du glucose excédentaire chez les animaux et les champignons. Il s'agit aussi d'un polymère de glucose ramifié (un branchement tous les six à huit unités glucose). Le glycogène est formé par la glycogénogenèse et décomposé par la glycogénolyse.
On le trouve en surplus dans le cas de la glycogénose de type II ; maladie dans laquelle l'absence de maltase acide des lysosomes, empêche sa dégradation.
Le glycogène est mis en évidence par le lugol (eau iodée) qui conduit à une coloration brun acajou.
C'est un polyholoside homogène de glucose liés par une liaison β(1→4).
La principale molécule structurelle des plantes est la cellulose. Le bois est en partie composé de cellulose, tandis que le papier et le coton sont de la cellulose presque pure. La cellulose est un polymère de glucose. C'est une molécule très longue et rigide, dont la structure lui confère ses propriétés mécaniques telles qu'observées chez les plantes.
Elle ne peut être assimilée par l'être humain mais sa présence dans l'alimentation favorise le transit intestinal et protège l'organisme contre le cancer du côlon.
L'agar-agar est un polyholoside mixte constitué de D- et L-galactose estérifié par de l'acide sulfurique. Extrait d'algues, il est utilisé en bactériologie et dans l'industrie alimentaire comme gélifiant.
Les dextranes sont produits par certaines bactéries, telles la Leuconostoc mesenteroides, en présence de sucre. De poids moléculaire élevé, ils sont composés d’unités D-glucose reliées par une liaison osidique α(1→6).
L'acide hyaluronique est un mucopolysaccharide constitué d'acide-β-glucuronique et de N-acétylglucosamine reliés par une liaison β(1→3). C'est un des principaux constituants de la substance fondamentale du tissu conjonctif à laquelle il confère sa viscosité.
Hétérosides
Les hétérosides sont des molécules complexes dont l'hydrolyse fournit au moins une molécule d'ose.
Nucléotides
Les nucléotides sont constitués d'une base nucléique, d'un ose (ribose, 2-désoxyribose) et d'un groupe phosphate. Ce sont des N-hétérosides.
Citons l'adénosine monophosphate, et ses dérivés utilisés dans le transport de l'énergie intracellulaire, l'acide ribonucléique (ARN) chargé de guider la synthèse cellulaire des protéines, l'acide désoxyribonucléique (ADN) porteur de l'hérédité.
ONPG
L'ortho-nitrophényl-β-galactoside (ONPG) est utilisé en bactériologie systématique, l'orthonitrophényl-β-D-galactopyranoside est hydrolysé par une β-galactosidase.
C'est un O-hétéroside.
Propriétés physico-chimiques
Propriétés physiques
Les oses n'absorbent ni dans l'UV, ni dans le visible. Ils sont thermolabiles et caramélisent à haute température.
Interconversion
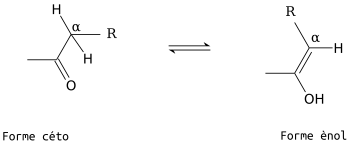
Les sucres présentent un équilibre céto-énolique, causée par l'acidité du proton α. Cette tautomérie est commune aux aldoses et aux cétoses, la forme cétone est nettement majoritaire.
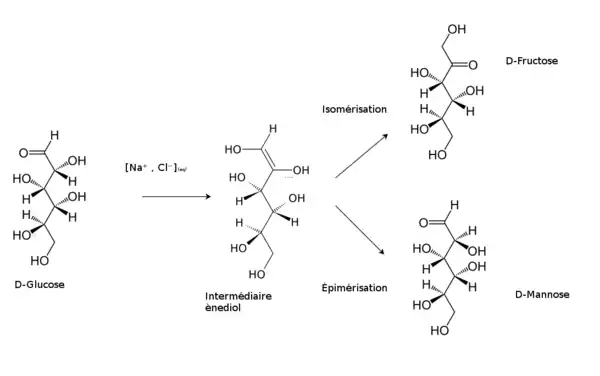
Cette tautomérie génère l'interconversion des oses. Par exemple, en milieu fortement basique (une solution d'hydroxyde de sodium), le D-glucose s'isomérise en D-fructose ou s'épimérise en D-mannose, moyennant une forme transitoire cis-ènediol.
Propriétés réductrices
Les oses simples et les diholosides ayant un carbone hémiacétalique libre sont réducteurs de par leur groupe aldéhyde. Le groupe aldéhyde est oxydé en groupe acide carboxylique. L'un des groupes alcool primaire peut être oxydé en groupe acide carboxylique.
Les diholosides non réducteurs sont ceux dont aucun carbone hémiacétalique n'est libre, il est mis en jeu dans la liaison osidique.
- Réduction des ions métalliques
Réduction de l'ion cuivre(II) (Cu2+) en oxyde de cuivre(I) (Cu2O) (liqueur de Fehling). Cette propriété est utilisée dans la méthode de Bertrand pour le dosage des glucides.
- Réduction de composés organiques
Par exemple, le 3,5-dinitrosalicylate (DNS) est réduit en 3-amino-5-nitrosalicylate, composé rouge brun permettant de doser les oses réducteurs par colorimétrie.
- Oxydation par voie enzymatique
En présence de dioxygène, la glucose oxydase oxyde le glucose en gluconolactone (puis acide gluconique) avec libération d'eau oxygénée. L'oxydation du carbone 1 (portant le groupe pseudo-aldéhydique) conduit au gluconolactone (non réducteur), celle en C6 conduit à l'acide glucuronique (réducteur). Une double oxydation en C1 et C6 conduit à l'acide glucosaccharidique (non réducteur). La glucose oxydase est utilisée pour mesurer la glycémie.
Hydrolyse chimique
L'hydrolyse chimique n'est pas spécifique, elle conduit à la plus petite sous-unité des glucides : les oses. Elle est réalisée en présence d'acide chlorhydrique.
Hydrolyse enzymatique
L'hydrolyse enzymatique, contrairement à l'hydrolyse chimique, est spécifique. Ces enzymes sont des hydrolases.
- La β-glucosidase hydrolyse les liaisons osidiques mettant en jeu un glucose dont l'-OH hémiacétalique est en position β.
- L'α-amylase rompt les liaisons osidiques à l'intérieur de la chaîne d'amylose.
- La β-amylase hydrolyse les liaisons osidiques à partir des extrémités.
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- FMA
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Cours sur les glucides [PDF]
- (en) Nomenclature des sucres