Projection de Fischer
La projection de Fischer est une représentation plane d'une molécule organique tridimensionnelle, particulièrement utilisée en chimie organique et en biochimie, notamment pour l'étude des sucres. Son nom provient de celui d'Hermann Emil Fischer qui utilisa ce type de représentation dans ses études pionnières en chimie des sucres.


Principe
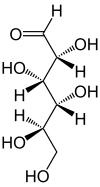
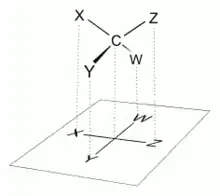
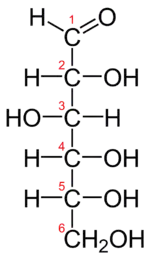
Toutes les liaisons chimiques non terminales sont représentées comme des lignes horizontales ou verticales. La chaîne carbonée principale se situe sur la ligne verticale. L'orientation de la chaîne carbonée est telle que le carbone le plus oxydé est placé dans la moitié supérieure. Les lignes horizontales représentent des liaisons situées au-dessus du plan de projection ou, autrement dit, sont orientées vers le spectateur[1]. (voir figures ci-contre à gauche).

Les molécules à géométrie tétraédrique simple peuvent être facilement tournées dans l'espace, de sorte que cette condition soit remplie. Par exemple, un monosaccharide à trois atomes de carbone (triose), tel que le D-Glycéraldéhyde (figure ci-contre à droite), a une géométrie tétraédrique, avec C2 en son centre, et peut être tourné dans l'espace de sorte que la chaîne de carbone soit verticale avec C1 en haut, et que les liaisons horizontales reliant C2 à -H et -OH soient toutes deux orientées vers le spectateur.
Cependant, lors de la création d'une projection de Fischer pour un monosaccharide de plus de trois carbones, il n'y a aucun moyen d'orienter la molécule dans l'espace de sorte que toutes les liaisons horizontales soient orientées vers le spectateur. En effet, si la molécule est tournée de manière que les deux liaisons horizontales avec C2 soient orientées vers le spectateur, les liaisons horizontales avec C3 seront généralement orientées vers l'extérieur. L'astuce consiste alors, avant de dessiner les liaisons avec C3, à faire tourner dans l'espace le bas de la molécule autour de son axe vertical d'un angle tel que les dites liaisons soient bien orientées vers le spectateur. D'autres rotations similaires peuvent être nécessaires pour compléter le dessin (voir les figures ci-après).

Pour passer de la représentation de Fischer à celle de Cram (ou Natta), il faut considérer chaque atome de carbone indépendamment des autres, car la représentation de Fischer n'est pas une simple projection de la molécule sur un plan en deux dimensions.
Utilisations


Les projections de Fischer sont le plus souvent utilisées en biochimie pour représenter les monosaccharides, mais elles peuvent aussi être utilisées pour les acides aminés ou pour d'autres molécules organiques. Puisqu'elles permettent de dépeindre la stéréochimie (les structures tridimensionnelles) d'une molécule, elles sont très utiles pour différencier les énantiomères de molécules chirales. En respectant toutes les conventions propres à la projection de Fischer, on peut définir l'appartenance d'une espèce chirale à la série D (dexter, droite) ou L (laevus, gauche). Pour ce faire, on considère les substituants figurant en horizontal par rapport au carbone asymétrique représenté le plus en bas dans la projection de Fischer. Si, parmi ces deux substituants, le substituant de plus forte priorité se trouve vers la droite, alors la molécule appartient à la série D, s'il est vers la gauche elle appartient à la série L. Il est à noter que l'appartenance d'une espèce à la série D ou L ne préjuge pas de son caractère lévogyre ou dextrogyre ni de la configuration absolue (R/S) des carbones asymétriques que comporte cette espèce (dans l'exemple des acides aminés, on ne pourra établir la configuration absolue de leur carbone α asymétrique qu'en connaissance du radical et de sa priorité CIP).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Fischer projection » (voir la liste des auteurs).
- (en) « Fischer projection », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)