Aldéhyde
Un aldéhyde est un composé organique, faisant partie de la famille des composés carbonylés, dont l'un des atomes de carbone primaire (relié au plus à 1 atome de carbone) de la chaîne carbonée porte un groupement carbonyle. Un aldéhyde contient donc la séquence :
 (R représente une chaîne carbonée.)
(R représente une chaîne carbonée.)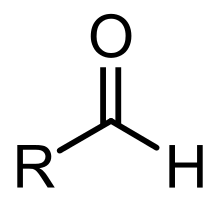
L'aldéhyde le plus simple (R réduit au seul atome H) est le formaldéhyde (ou méthanal), aussi appelé formol lorsqu'il est en solution aqueuse : 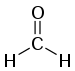
Un aldéhyde dérive formellement d'un alcool primaire (oxydation) dont le groupement hydroxyde -OH est en bout de chaîne et se forme à la suite de l'enlèvement de deux atomes H d'où le nom « alcool déshydrogéné » ou aldéhyde.
Nomenclature
L'aldéhyde aura le nom de l'alcane correspondant, auquel on ajoute le suffixe « -al ». Pour le reste, les règles sont les mêmes que celles énoncées pour les alcènes. Quand l'aldéhyde constitue le groupe fonctionnel prioritaire de la molécule, il n'est pas nécessaire de lui attribuer un indice de position, car il est toujours en position terminale (1).
CH3 - CHO : éthanal
CH3 - CH(CH3) - CH2 - CHO : 3-méthylbutanal
Quand l'aldéhyde est un substituant sur un composé cyclique comme le benzène, il porte alors le nom de carbaldéhyde ou carboxaldéhyde qui sont deux termes équivalents. Par exemple, le composé suivant peut se nommer benzènecarbaldéhyde ou benzènecarboxaldéhyde (le nom courant benzaldéhyde est également accepté) :
C6H5 - CHO
Quand le groupe aldéhyde n'est pas prioritaire, on lui attribue un préfixe de la forme alcanoyle. Par exemple, le composé suivant se nomme acide éthanoylbenzènesulfonique :
OHC - CH2 - C6H5 - SO3H
Propriétés, réactivité
Elles sont généralement communes aux aldéhydes et aux cétones (voir les caractéristiques du composé carbonylé).
Production et synthèse
Par hydroformylation
Appelée aussi procédé oxo, cette réaction est utilisée pour obtenir des aldéhydes en C3-C19 à partir d'alcènes, c'est le principal procédé de production du butanal. On emploie du monoxyde de carbone et du dihydrogène à une pression de 10 à 100 atmosphères et une température de 40 à 200 °C, en présence d'un catalyseur (un métal de transition tel que le rhodium).
Par oxydation des alcools
On obtient les aldéhydes par oxydation d'alcools primaires et des cétones par oxydation d'alcools secondaires (l'alcool tertiaire ne peut s'oxyder que dans des conditions extrêmes, on le considère souvent comme ne pouvant pas être oxydé).

Cette oxydation met donc en jeu le couple rédox:
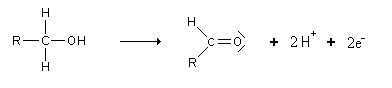
Cependant, les aldéhydes sont encore de bons réducteurs. Ils s'oxydent donc très facilement en acides carboxyliques:

Il y a même un cas pour lequel la réaction continue : le méthanol. Il s'oxyde d'abord en méthanal, puis en acide méthanoïque, et enfin en dioxyde de carbone.

Oxydation industrielle
- oxydation par O2 de l'air

On peut utiliser comme catalyseur Fe2O3 ou MnO3 à 400 °C, ou un catalyseur à base d'argent vers 600 °C.
- Déshydrogénation catalytique des alcools primaires
L'alcool est gazeux. On utilise comme catalyseur CuO vers 400 à 500 °C, Ag, Cu vers 300 °C, ZnO ou encore ZrO vers 300 à 400 °C.

- Procédé de Hoechst-Wacker
Oxydation de l'éthylène en acétaldéhyde
Oxydation chimique
Il faut utiliser un oxydant « doux », sous des conditions opératoires strictes, afin d'éviter la seconde oxydation. On utilise en général un dérivé du chrome VI dans des proportions stœchiométriques. Il y a 2 méthodes historiques :
- Pour les aldéhydes ayant une chaîne carbonée courte, et qui sont donc plus volatils, on utilise le dichromate de potassium K2Cr2O7, en milieu acide, à température supérieure à la température d'ébullition de l'aldéhyde, ce qui permet son extraction après formation.
- Pour les autres aldéhydes, on utilise le réactif de Sarett, composé de trioxyde de Chrome VI CrO3 dans la pyridine, à basse température (0 °C).
Cependant la pyridine et les composés à base de chrome sont très toxiques, et ne peuvent plus être utilisés. D'autres méthodes ont été développées :
- Le PCC et PDC, toujours à base de chrome, mais dans des quantités moins importantes;
- Les méthodes au DMSO activé (dont l'oxydation de Swern);
- Periodates (réactifs de Dess-Martin, IBX).
Par ozonolyse des alcènes
Des aldéhydes peuvent être obtenus par ozonolyse d'alcènes. Il est important d'utiliser un additif réducteur au cours de la réaction, comme un sulfure (classiquement le diméthylsulfure) ou une phosphine (la triphénylphosphine, moins odorante que les composés soufrés), afin de piéger les sous produits oxydants (eau oxygénée). Dans le cas contraire, une suroxydation de l'aldéhyde en acide carboxylique est observée.
Utilisation
Les aldéhydes sont des produits de synthèse très puissants qui apportent, indépendamment de leur propre odeur, un prodigieux pouvoir de diffusion aux compositions. En parfumerie, ceci concerne surtout les aldéhydes aliphatiques. La découverte des aldéhydes a donné aux créateurs une palette nouvelle. Leur utilisation marquée est à l'origine des parfums de type dit « Aldéhydé ».
Les aldéhydes sont utilisés comme moyen de désinfection et à la fabrication de préparation organique. Des aldéhydes et des cétones sont utilisés à la fabrication de matière plastique, solvant, colorant parfum et médicament. Par exemple, l'aldéhyde C 17 a une odeur de cerise.
Acétalisation
L'acétalisation est une réaction réversible permettant de transformer un composé carbonylé et deux alcools (ou un diol) en acétal. Cette réaction permet en fait de protéger le groupe carbonyle, ou l'alcool.
Réaction

Conditions
- Chauffage
- Catalyse acide (en général APTS)
Caractéristiques et remarques
- Quand on utilise un aldéhyde, on nomme le produit obtenu « acétal ». Quand on utilise une cétone, on nomme le produit obtenu « cétal ». Cependant, de plus en plus on utilise le terme acétal comme terme générique pour désigner les 2 produits. On appelle par contre toujours la réaction (aussi bien pour les aldéhydes et pour les cétones) « acétalisation ».
- Cette réaction est en général en faveur de l'acétal (contrairement aux cétals).
Si on veut la favoriser dans ce sens, on utilise un excès d'alcool (qui sert par la même occasion de solvant), on peut aussi distiller l'eau (distillation hétéroazéotropique) à l'aide de l'appareil de Dean et Stark. Pour favoriser la réaction inverse, c'est le contraire : on met un excès d'eau pour hydrolyser l'acétal.
- Quand on veut protéger la fonction carbonyle, on utilise le plus souvent un diol, comme l'éthane-1,2-diol :

- Cette réaction peut aussi très bien servir à protéger une fonction alcool, en particulier les diols vicinaux.
- Dans certains cas, la réaction peut s'arrêter à l'hémiacétal (cas des hémiacétals cycliques).
Action d'un réactif de Grignard
Un réactif de Grignard réagit sur un aldéhyde pour former un alcool secondaire (→réaction).
Réaction de Wittig
La réaction de Wittig transforme une aldéhyde en dérivé éthylènique. Il transforme en fait la liaison C=O en liaison C=C.
Industriellement
On utilise le dihydrogène H2 dans un solvant inerte, en présence d'un catalyseur (catalyse hétérogène). Il s'agit bien souvent de métaux, comme le platine (Pt), le palladium (Pd), le nickel (Ni) ou le rhodium (Rh).
Si jamais l'aldéhyde possède aussi une liaison C=C, celle-ci aussi est hydrogénée (la réaction est plus facile sur C=C que sur C=O).
La réaction est exothermique.
Par les hydrures
On peut utiliser le DIBAL pour la réduction des aldéhydes en alcool.
Tests de reconnaissance
Pour mettre en évidence la présence d'aldéhyde, on peut faire un test de reconnaissance :
- Addition de composés de type Z-NH2 (amine): formation d'un précipité.
- Le test à la liqueur de Fehling, qui prend une couleur rouge brique à chaud en présence d'aldéhyde.
- Le test dit du « miroir d'argent », utilisant le réactif de Tollens, aboutissant à la création d'un dépôt d'argent solide.
- Le test au réactif de Schiff, qui à froid, colore la solution en rose.
Mais ces méthodes utilisant des réactions chimiques avec l'aldéhyde le détruisent.
On utilise maintenant plus volontiers les méthodes de spectrométrie (RMN et infrarouge) permettant de détecter cette fonction sans destruction de l'échantillon.
Notes et références
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (no + nn + nb) Store medisinske leksikon
- Notices dans des dictionnaires ou encyclopédies généralistes :