Periodinane de Dess-Martin
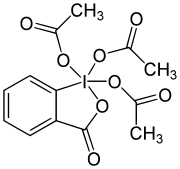
Le periodinane de Dess-Martin ou DMP (de l'anglais Dess-Martin periodinane) est un réactif employé en chimie organique pour oxyder les alcools primaires en aldéhydes et les alcools secondaires en cétones. Par rapport aux oxydants à base de chrome (VI) ou de DMSO, ce periodinane (composé hypervalent de l'iode) présente de nombreux avantages : conditions opératoires plus douces (pH neutre et température ambiante), réactions plus rapides, meilleurs rendements, modes opératoires simplifiés, grande chimiosélectivité permettant de préserver des groupes fonctionnels sensibles, et longue durée de conservation. Cependant son usage industriel est limité par son coût et par son caractère potentiellement explosif[3].
| Periodinane de Dess-Martin | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1,1,1-tris(acétyloxy)-1λ5,2-benziodoxol-3(1H)-one acétate de 1,1-diacétyloxy-3-oxo-1λ5,2-benziodoxol-1-yle |
|
| Synonymes |
1,1,1-triacétoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one |
|
| No CAS | ||
| No ECHA | 100.197.885 | |
| PubChem | 159087 | |
| ChEBI | 295745 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C13H13IO8 [Isomères] |
|
| Masse molaire[1] | 424,142 ± 0,013 7 g/mol C 36,81 %, H 3,09 %, I 29,92 %, O 30,18 %, |
|
| Propriétés physiques | ||
| T° fusion | 130 à 133 °C[2] | |
| Masse volumique | 1,362 g·cm-3 | |
| Précautions | ||
| Directive 67/548/EEC[2] | ||
 Xn |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
Le DMP doit son nom aux chimistes américains Daniel Benjamin Dess et James Cullen Martin qui l'ont développé en 1983[4]. Bien que dérivé de l'acide 2-iodoxybenzoïque (IBX) qui oxyde également les alcools, le DMP est beaucoup plus réactif et beaucoup plus soluble dans les solvants organiques grâce à ses trois groupements acétate liés à l'iode[5].
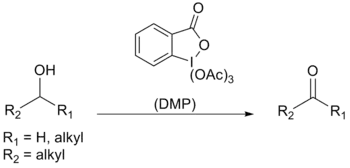
Synthèse
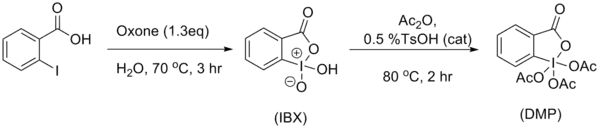
La synthèse classique[6] du DMP consistait à chauffer une solution de bromate de potassium, d'acide sulfurique et d'acide 2-iodobenzoïque pour obtenir l'IBX qui était ensuite acétylé par un mélange d'acide acétique et d'anhydride acétique :
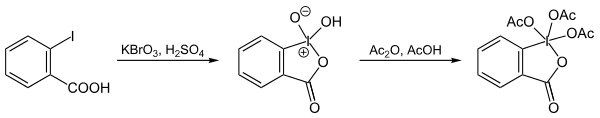
Une synthèse plus récente[7] de l'IBX permet de s'affranchir des dangers liés à la manipulation de KBrO3 et du dibrome issu de sa réduction en traitant l'acide 2-iodobenzoïque par l'hydrogénopersulfate de potassium KHSO5 (ou "Oxone") en solution aqueuse à chaud pendant 3h. L'acétylation de l'IBX est ensuite réalisée selon la procédure modifiée d'Ireland et Liu[8] c'est-à-dire en présence d'une quantité catalytique d'APTS qui accélère la réaction (2h vs. 24h dans la synthèse classique), augmente le rendement qui dépasse les 90% et simplifie l'isolement du DMP obtenu sous forme solide après filtration et rinçage à l'éther :
Mécanisme de l'oxydation
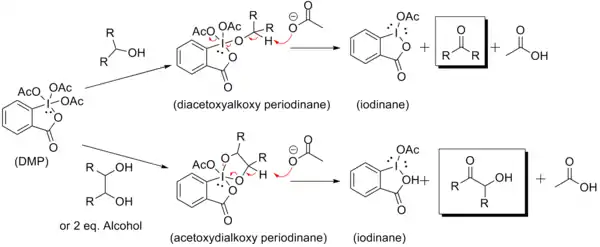
Le réactif de Dess-Martin sert surtout à oxyder des alcools complexes, fragiles et multifonctionnels. L'une des raisons de son efficacité réside dans son aptitude à complexer très sélectivement le groupe hydroxyle ce qui permet à l'alcool de réaliser un rapide échange de ligands. Le remplacement d'un des groupes acétate du DMP par l'alcool est la première étape de la réaction d'oxydation.
Les données de RMN 1H indiquent que l'utilisation d'un équivalent d'alcool conduit à la formation d'un intermédiaire diacétoxyalkoxyperiodinane. L'ion acétate libéré joue le rôle de base en déprotonant la position α (c'est-à-dire l'atome d'hydrogène porté par le carbone fonctionnel de l'alcool) ce qui libère le composé carbonylé, l'iodinane et une molécule d'acide acétique.
Dess & Martin avaient déjà remarqué que l'oxydation de l'éthanol était favorisée par la présence d'un excès d'alcool. Avec un deuxième équivalent d'alcool ou lorsqu'un diol est utilisé, l'intermédiaire est un acétoxydialkoxyperiodinane dont le caractère labile accélère la réaction d'oxydation [9] :
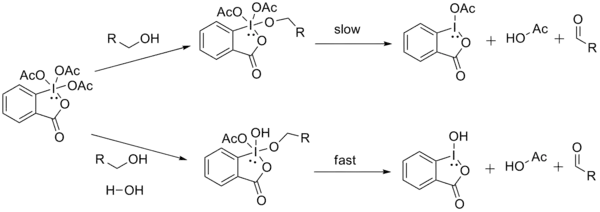
Schreiber et al. ont montré que la présence d'eau accélérait la réaction d'oxydation par le DMP[10]. En rapprochant cette observation de celle de Dess et Martin concernant l'accélération de la réaction par un excès d'alcool, il a été suggéré que le remplacement d'un acétate par un groupement moins électro-attracteur (hydroxyle dans le cas de l'eau, alkoxy dans le cas de l'alcool en excès) pourrait majorer la labilité de l'intermédiaire en fragilisant la liaison entre l'atome d'iode et le groupement acétate restant. La décomposition plus rapide de cet intermédiaire expliquerait alors le gain de vitesse :
Chimiosélectivité
Les conditions standard d'utilisation du DMP permettent une oxydation sélective des alcools en aldéhydes ou cétones sans affecter les cycles furaniques, les éthers d'énols ni les amides secondaires[9].
Le DMP oxyde facilement les alcools allyliques et benzyliques[11] pourtant réfractaires à certains oxydants classiques des alcools. Myers et al. ont montré[12] que contrairement à d'autres oxydants (y compris l'oxydation de Swern) le DMP pouvait oxyder sans épimérisation les aminoalcools N-protégés.
L'oxydation par le DMP des alcools allyliques et benzyliques est plus rapide que celle des alcools saturés[9], mais les aldoximes et cétoximes sont oxydés encore plus rapidement en aldéhydes et cétones (respectivement) que les alcools primaires, secondaires ou benzyliques[13].
L'exemple suivant illustre la chimiosélectivité de l'oxydation de Dess-Martin. Le substrat est un alcool primaire α,β-insaturé que le DMP convertit en aldéhyde. Le produit d'intérêt est un motif identifié dans la structure de plusieurs composés naturels et pourrait être valorisé en tant que synthon. Pour réaliser cette oxydation, Thongsornkleeb and Danheiser[14] ont employé le réactif de Dess-Martin dans des conditions opératoires adaptées (dilution dans un mélange d'isomères de pentane, lavage à la poly(4-vinylpyridine) pour éliminer l'acide acétique formé pendant la réaction, filtration et concentration par distillation) :

Le tert-butyl DMP
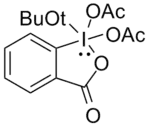
L'oxydation des alcools mono- et di-fluorés est plus difficile. L'oxydation de Swern a pu être employée mais elle nécessite dans ce cas un large excès d'oxydant et ses résultats ne sont pas toujours reproductibles. Linderman et Graves[15] ont montré que le DMP s'avérait efficace dans la plupart des cas à condition que l'alcool ne comporte pas de fonction nucléophile car celles-ci réagissent sur le DMP en se substituant aux groupes acétate.
Si le DMP est modifié en remplaçant un acétate par un groupement tert-butoxy il existe à ce niveau un encombrement stérique suffisant pour limiter de telles réactions indésirables. Ce tert-butyl DMP oxyde efficacement les alcools fluorés en composés carbonylés.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dess-Martin periodinane » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Dess-Martin periodinane, consultée le 18 juin 2014.
- Plumb, J.B. et Harper, D.J., « Chemical Safety: 2-Iodoxybenzoic acid », Chem. Eng. News, vol. 68, , p. 3 (DOI 10.1021/cen-v068n029.p002)
- Dess, D. B. et Martin, J. C., « Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones », J. Org. Chem., vol. 48, , p. 4155 (DOI 10.1021/jo00170a070)
- (en) Dess, D.B. ; Martin, J.C., « A useful 12-I-5 triacetoxyperiodinane (the Dess-Martin periodinane) for the selective oxidation of primary or secondary alcohols and a variety of related 12-I-5 species », J. Am. Chem. Soc., vol. 113, , p. 7277 (DOI 10.1021/ja00019a027)
- Boeckman Jr., R. K.; Shao, P.; Mullins, J. J., The Dess-Martin Periodinane, Org. Synth., coll. « vol. 10 », , p. 696
- Frigerio, M., Santagostino, M. et Sputore, S., « A User-Friendly Entry to 2-Iodoxybenzoic Acid (IBX) », J. Org. Chem., vol. 64, , p. 4537 (DOI 10.1021/jo9824596)
- Ireland, R. E. et Liu, L., « An improved procedure for the preparation of the Dess-Martin periodinane », J. Org. Chem., vol. 58, , p. 2899 (DOI 10.1021/jo00062a040)
- Dess, D. B. et Martin, J. C., « A useful 12-I-5 triacetoxyperiodinane (the Dess-Martin periodinane) for the selective oxidation of primary or secondary alcohols and a variety of related 12-I-5 species », J. Am. Chem. Soc., vol. 113, , p. 7277 (DOI 10.1021/ja00019a027)
- Meyer, S. D. et Schreiber, S. L., « Acceleration of the Dess-Martin Oxidation by Water », J. Org. Chem., vol. 59, , p. 7549 (DOI 10.1021/jo00103a067)
- Lawrence, N.J., Crump, J.P., McGown, A.T. et Hadfield, J.A., « Reaction of Baylis-Hillman products with Swern and Dess-Martin oxidants. », Tetrahedron Lett., vol. 42, , p. 3939 (DOI 10.1016/S0040-4039(01)00587-1)
- Myers, A.G. et al., « Synthesis of highly epimerizable N-protected _-amino aldehydes of high enantiomeric excess. », Tetrahedron Lett., vol. 41, , p. 1359 (DOI 10.1016/S0040-4039(99)02293-5)
- Chaudhari, S.S. et Akamanchi, K.G., « A mild, chemoselective, oxidative method for deoximation using Dess-Martin periodinane. », Synthesis, vol. 1999, , p. 760 (DOI 10.1055/s-1999-3476)
- Thongsornkleeb, C. et Danheiser, R.L., « A Practical Method for the Synthesis of 2-Alkynylpropenals », J. Org. Chem., vol. 70, , p. 2364 (PMCID 2897060, DOI 10.1021/jo047869a)
- Linderman, R.J. et Graves, D.M., « Oxidation of Fluoroalkyl-Substituted Carbinols by the Dess-Martin reagent », J. Org. Chem., vol. 54, , p. 661 (DOI 10.1021/jo00264a029)