Iode
L'iode est l'élément chimique de numéro atomique 53, de symbole I. C'est un membre de la famille des halogènes.
Il s'agit d'un élément relativement rare dans le milieu naturel, arrivant 47e dans l'écorce terrestre. Comme les autres halogènes, on le trouve essentiellement sous forme diatomique I2, correspondant au diiode, solide gris métallique aux vapeurs violettes appelé communément « iode » par abus de langage. Son nom vient du grec ἰώδης signifiant « couleur de la violette ». Il a été nommé ainsi par Gay-Lussac à la suite de la découverte en 1811 par le chimiste Bernard Courtois d'une substance alors inconnue issue d'algues destinées à la production de salpêtre lors des guerres napoléoniennes.
C'est l'oligo-élément le plus lourd présent dans la plupart des formes de vie — seul le tungstène, utilisé comme cofacteur par quelques bactéries, a une masse atomique supérieure. Sa faible toxicité et la facilité avec laquelle il se lie aux composés organiques alliées à sa masse atomique élevée en ont fait un agent de contraste très utilisé en radiographie.
Chez l'animal et l'homme, l'excès[8] comme la carence en iode sont associés à des pathologies sévères[9]. Le manque d'iode inhibe la croissance et peut être à l'origine de l'apparition de « nodules » de la thyroïde. La carence grave peut causer divers troubles mentaux (crétinisme, surtout autrefois observé chez les populations éloignées des régions maritimes, notamment en montagne).
L'iode est un composant des hormones thyroïdiennes, synthétisées par la glande thyroïde. Les radioisotopes de l'iode sont par conséquent susceptibles de provoquer un cancer de la thyroïde lorsqu'ils sont absorbés par l'organisme. L'iode 131, en raison de sa radioactivité β, est à ce titre l'un des produits de fission nucléaire les plus cancérogènes qui soient.
Les « comprimés d'iode » utilisés pour saturer la thyroïde en cas de contamination à l'iode 131 lors d'un accident nucléaire contiennent typiquement 65 ou 130 mg d'iodure de potassium ; ils doivent être pris rapidement après l'accident. Certaines molécules (toxiques) freinent ou bloquent l'entrée de l'iode dans la thyroïde, dont les nitrates, perchlorates et thiocyanates qu'on dit « goitrogènes » (avec effets cumulatifs possibles[10]).
 Diiode solide.  Diiode gazeux. |
Histoire
L'iode a été découvert en 1811 par le chimiste et fabricant de salpêtre Bernard Courtois dans des cendres d'algues marines. Courtois suspecte la nature élémentaire de la substance qu'il découvre, mais il faudra attendre les conclusions de Gay-Lussac et Davy qui, quasi simultanément, confirment qu'il s'agit d'un nouvel élément. Il a été nommé ainsi par Gay-Lussac, dans une publication du [11], à partir du grec ἰοειδής / ioeidḗs (« violet ») en raison de la couleur de sa vapeur quand il est chauffé.
Propriétés physiques et chimiques
L'iode est peu soluble dans l'eau, mais ses sels (iodures, iodates) le sont bien davantage, et la concentration d'iode est plus élevée dans l'eau de mer que dans les roches, environ 50 contre 40 ppb[12].
L'iode adopte une grande variété d'états d'oxydation : −1, +1, +3, +5 et +7 essentiellement. En pratique, c'est l'état d'oxydation −1 qui est le plus significatif : c'est celui de l'ion iodure I−, présent dans les sels d'iode et dans les composés organo-iodés.
Parmi les minéraux contenant de l'iode, on trouve le nitronatrite, présent dans certaines roches sédimentaires comme le caliche du Chili. Certaines grandes algues (kelp) sont également riches en iode (majoritairement sous forme minérale, les ions iodures), avec des teneurs entre 0,03 et 5 % de poids sec (soit 1 000 à 150 000 fois la concentration de l'iode dans l'eau de mer)[12]. Elles ont en effet un équipement enzymatique (de type haloperoxydase (en)[13]) assurant d'une part la capture des iodures de l'eau de mer qui s'accumulent préférentiellement dans la paroi cellulaire exposée aux stress biotiques (épiphyte, défense contre les pathogènes) et abiotiques (exposition aux UVs, dessiccation lors des marées, stress oxydant, thermique et osmotique), d'autre part la biosynthèse de composés volatils iodés (phénomène de iodovolatilisation à l'origine de la condensation de l'eau des nuages et du fameux « air iodé »)[14] constituant, fort probablement, une stratégie développée par les algues pour se défendre contre ces stress[15]. Les bactéries du sol participent aussi au cycle biogéochimique[16] de l'iode[17], y compris en forêt[18].
Diiode
Le diiode est, aux conditions normales de température et de pression, un solide gris-noir aux éclats métalliques violets composé de molécules homonucléaires I2. Il se sublime lentement dès la température ambiante, fond à 113,7 °C et bout à 184,3 °C en formant un gaz violet très irritant.
Le diiode disponible dans le commerce contient généralement beaucoup d'impuretés, qui peuvent être éliminées par sublimation. Il peut également être préparé sous forme ultra-pure en faisant réagir de l'iodure de potassium KI avec du sulfate de cuivre CuSO4, qui commence par donner de l'iodure de cuivre(II) CuI2, lequel se décompose spontanément en Iodure de cuivre(I) CuI et diiode I2
- Cu2+ + 2 I− → CuI2 ;
- 2 CuI2 → 2 CuI + I2.
Il existe d'autres méthodes pour isoler l'iode en laboratoire, par exemple l'oxydation de l'ion iodure I− en iodure d'hydrogène HI par le dioxyde de manganèse MnO2.
Iodure et polyiodures
L'ion iodure I− réagit réversiblement avec le diiode I2 pour former l'ion triiodure I3−.
D'une manière générale, il existe des ions polyiodure de formule générique Inm−, tels que les ions I5− ou I82−.
Oxydoréduction
Les iodures s'oxydent lentement sous l'effet de l'oxygène de l'atmosphère en libérant du diiode. C'est ce qui donne progressivement une teinte jaune au cours du vieillissement des sels d'iodure et des composés organoiodés[19]. C'est également ce qui provoque l'appauvrissement en iode des sels iodés lorsqu'ils sont exposés à l'air libre[20] ; certains sels sont enrichis en iode avec des ions iodate IO3− plutôt que des ions iodure I− pour éviter cette déperdition d'iode avec le temps.
L'iode s'oxyde et se réduit facilement. La réaction d'oxydo-réduction la plus courante est l'interconversion des espèces I− et I2, par exemple avec le chlore Cl2 et le dioxyde de manganèse MnO2[21] :
Le diiode est réduit en iodure d'hydrogène HI par le sulfure d'hydrogène H2S et l'hydrazine N2H4[22] :
L'iode forme une solution d'un bleu intense lorsqu'il est dissous dans l'acide sulfurique fumant (oléum à 65 %). Cette couleur bleue est due au cation I2+ résultant de l'oxydation par le trioxyde de soufre SO3[23] :
Le cation I2+ est également formé lors de l'oxydation du diiode par le pentafluorure d'antimoine SbF5 ou par le pentafluorure de tantale (en) TaF5 en formant des cristaux d'un bleu profond de I2+Sb2F11− ou de I2+Ta2F11− respectivement. Les solutions de ces sels deviennent rouges en dessous de −60 °C en raison de la formation du cation I42+ :
- 2 I2+ I42+.
En milieu plus basique, I42+ se dismute en I3+ et un composé d'iode(III). Un excès d'iode réagit alors avec I3+ pour former le cation I5+ (vert) puis I153+ (noir).
Oxydes et oxoacides
Les oxydes d'iode les plus connus sont les anions IO3− et IO4−, mais on connaît encore d'autres oxydes, tel que le pentoxyde de diiode I2O5, un oxydant fort qui est également l'anhydride de l'acide iodique HIO3.
Contrairement au chlore, la formation de l'ion hypoiodeux IO− en solution aqueuse neutre d'iode est négligeable :
En solution basique, par exemple avec de l'hydroxyde de sodium NaOH, le diiode I2 donne en deux étapes de l'iodure I− et de l'iodate IO3− :
En chimie inorganique, on emploie des dérivés organiques d'ion hypoiodeux (acide 2-iodoxybenzoïque et periodinane de Dess-Martin).
L'acide iodique HIO3, l'acide periodique HIO4 et leurs sels sont des oxydants forts et sont utilisés en synthèse organique. Le diiode I2 est oxydé en iodate IO3− par l'acide nitrique HNO3 ainsi que par les chlorates ClO3−[24] :
Composés inorganiques
L'iode forme des composés avec tous éléments hormis les gaz rares. L'acide iodhydrique, solution aqueuse d'iodure d'hydrogène HI, est un réactif industriel important, utilisé notamment comme co-catalyseur dans le procédé Cativa de production de l'acide acétique CH3COOH.
Bien que moins électronégatif que les autres halogènes, l'iode réagit violemment avec certains métaux, tels que l'aluminium :
Cette réaction libère 314 kJ par mole d'aluminium, valeur proche de celle de la thermite (de l'ordre de 425 kJ·mol-1). Cette réaction démarre spontanément et n'est pas confinée en volume en raison du nuage d'iode provoqué par les températures élevées.
On emploie également du tétraiodure de titane TiI4 et de l'iodure d'aluminium (en) AlI3 pour produire du butadiène H2C=CH2–CH2=CH2, qui sert à fabriquer de nombreux matériaux tels que des élastomères (caoutchoucs synthétiques)[25].
Les sels métalliques alcalins sont des solides incolores très solubles dans l'eau, et l'iodure de potassium KI est une source commode d'ions iodure I−, moins hygroscopique que l'iodure de sodium NaI et donc plus facile à manipuler. Ces deux sels sont principalement utilisés pour produire du sel iodé destiné à prévenir la carence en iode auprès des populations distantes des régions côtières. L'iodure de sodium est particulièrement utilisé pour réaliser la réaction de Finkelstein car il est plus soluble dans l'acétone que l'iodure de potassium ; dans cette réaction, un chlorure d'alkyle est converti en iodure d'alkyle, réaction soutenue par le fait que le chlorure de sodium produit au cours de la réaction est insoluble dans l'acétone :
- R–Cl(acétone) + NaI(acétone) → R–I(acétone) + NaCl(s) ↓.
Composés interhalogènes
Plusieurs composés interhalogènes font intervenir de l'iode, notamment le monochlorure d'iode ICl, le trichlorure d'iode ICl3, le pentafluorure d'iode IF5 et l'heptafluorure d'iode IF7, qui sont des exemples classiques de molécules hypervalentes à liaisons 3c-4e dès qu'elles contiennent plus de deux atomes.
Composés organiques
Les organismes marins, les micro-organismes des rizières et la combustion de matière organique libèrent dans l'atmosphère terrestre environ 214 000 t/an[26] d'iodométhane CH3I (appelé communément iodure de méthyle), rapidement oxydé dans le cadre d'un « cycle de l'iode » global.
L'iodométhane et un petit nombre d'autres composés organoiodés — tels que le diiodométhane CH2I2 (iodure de méthylène), le triiodométhane CHI3 (iodoforme) et le tétraiodométhane CI4 (tétraiodure de carbone) — jouent un rôle dans des réactions de synthèse industrielles en raison de la facilité avec laquelle la liaison C–I se forme et se défait : c'est la plus faible des liaisons carbone–halogène, l'intensité de ces dernières étant rangée dans l'ordre de l'électronégativité des halogènes, c'est-à-dire fluor > chlore > brome > iode, et dans l'ordre inverse de leur rayon atomique et de la longueur de la liaison C–X (où X représente un halogène quelconque) ; la faiblesse de cette liaison donne souvent une teinte jaune aux composés organoiodés en raison d'impuretés de diiode I2.
Ces composés sont très denses, en raison de l'atome d'iode : la masse volumique de l'iodométhane à 20 °C est de 2,28 g/cm3, celle du diiodométhane est de 3,325 g/cm3.

Presque tous les composés organoiodés présentent un ion iodure lié à un atome de carbone et sont généralement rangés parmi les iodures. De rares organoiodés présentent néanmoins de l'iode dans un état d'oxydation plus élevé (III ou V)[27]. Ils sont appelés periodane ou plus souvent, en raison du terme anglais, periodinane et sont généralement des oxydants doux comme l'acide 2-iodoxybenzoïque (IBX).
Des composés organopolyiodés peuvent être utilisés comme agents de contraste en fluoroscopie, une technique d'imagerie médicale, en tirant parti de l'absorption des rayons X par le noyau des atomes d'iode en raison de leur masse atomique élevée. La plupart de ces agents sont des dérivés du 1,3,5-triiodobenzène et contiennent près de 50 % d'iode en masse ; l'ioversol est un exemple de tels agents de contraste.
Composés biologiques
D'un point de vue médical, les composés biologiques de l'iode les plus importants dans la physiologie humaine sont les hormones thyroïdiennes : la thyroxine (T4) et la triiodothyronine (T3), qui agissent sur à peu près toutes les cellules du corps en augmentant le métabolisme de base, la biosynthèse des protéines, la croissance des os longs (de concert avec l'hormone de croissance), le développement neuronal et la sensibilité aux catécholamines, telles que l'adrénaline.
-Thyroxine_Structural_Formulae_V2.svg.png.webp) |
-Triiodthyronine_Structural_Formulae_V2.svg.png.webp) | |
Thyroxine (hormone T4). |
Triiodothyronine (hormone T3). |
Isotopes
L'iode possède 37 isotopes connus, de nombre de masse variant entre 108 et 144, et 16 isomères nucléaires. Parmi ces isotopes, seul 127I est stable, et représente la totalité de l'iode naturel, faisant de l'iode un élément monoisotopique et un élément mononucléidique. Sa masse atomique standard est donc la masse isotopique de 127I, soit 126,904 47(3) u.
Protection de la thyroïde contre l'iode radioactif
L'iodure de potassium naturel, à base d'iode 127 stable, peut être utilisé sous diverses formes (en comprimés pour effet progressif, en solution saturée dite « SSKI » en cas d'urgence) pour saturer temporairement la capacité d'absorption d'iode de la thyroïde afin de bloquer pendant quelques heures la fixation éventuelle d'iode 131 dans cette glande ; c'est notamment le cas pour se prémunir des conséquences des retombées d'iode radioactif d'une bombe A ou d'un accident nucléaire.
Les doses d'iodure de potassium recommandées par l'OMS en cas d'émission d'iode radioactif ne dépassent pas 130 mg/jour au-dessus de l'âge de 12 ans et 65 mg/jour au-dessus de 3 ans[28] ; passé l'âge de 40 ans en revanche, l'utilisation préventive de comprimés d'iodure de potassium n'est pas recommandée — elle ne l'est qu'en cas de contamination effective justifiant la protection de la thyroïde — car les effets indésirables de l'iodure de potassium augmentent avec l'âge et peuvent dépasser les effets protecteurs de ce composé[28].
La protection offerte par les comprimés d'iodure de potassium est maximum environ deux heures après la prise et cesse après une journée.
- En Belgique, le Conseil supérieur de la santé tire les premières leçons de l'accident de Fukushima concernant les plans d'urgence nucléaire belges dans son avis de 2015 : « Accidents nucléaires, environnement et santé à l'ère post-Fukushima. Partim : Protection de la thyroïde ». En cas d'accident nucléaire, le Conseil recommande l'administration d'iode stable (sous forme d'iodure de potassium) dans les groupes à risque (enfants, femmes enceintes et femmes allaitantes) dans un rayon allant jusqu'à 100 km des installations nucléaires ; dans un rayon de 20 km, la recommandation d'administrer de l'iode à toutes les personnes, sauf contre-indication, reste d'application. Les réactions allergiques à l'iode sont rares et les antécédents de réactions allergiques à des produits de contraste iodés ou après application locale de povidone iodée ne constituent pas des contre-indications. Chez les patients de plus de 40 ans, il convient d'être attentif à l'existence éventuelle de pathologies thyroïdiennes pouvant contre-indiquer l'administration d'une dose élevée d'iode[29]. Le Centre belge d'information pharmacothérapeutique (CBIP) complète cet avis avec des recommandations pratiques pour la prise d'iode et confirme l'importance d'un avis médical pour les personnes de plus de 40 ans avec des problèmes de thyroïde. La Belgique recommande l'utilisation des comprimés de 65 mg d'iodure de potassium (équivalent à 50 mg d'iode. La posologie recommandée est la suivante : jusqu'à 1 mois : ¼ comprimé ; de 1 à 36 mois : ½ comprimé ; de 3 à 12 ans : 1 comprimé ; de 13 à 40 ans : 2 comprimés en 1 prise ; chez les femmes enceintes ou allaitantes (même chez les femmes âgées de plus de 40 ans) : 2 comprimés en 1 prise[30].
Gisements miniers et production
Seuls deux types de sources naturelles d'iode sont exploités commercialement : le caliche au Chili, et les saumures riches en iode des champs pétrolifères et gaziers essentiellement au Japon et aux États-Unis. Les réserves mondiales d'iode étaient estimées à 15 millions de tonnes fin 2010[31], dont 9 millions au Chili, 5 millions au Japon et 250 000 aux États-Unis.
- Le caliche est une roche sédimentaire riche en nitrate de sodium NaNO3, qui fait l'objet de l'exploitation minière de cette roche, et de faibles quantités d'iodate de sodium NaIO3 et d'iodure de sodium NaI. Ces trois composés sont extraits en même temps[32].
Grâce à cette ressource, le Chili était le principal producteur d'iode en 2010 — environ 18 000 t, soit 62 % de la production mondiale publiée[31].
- Les saumures constituent l'autre source primaire d'iode exploitée commercialement. Les champs de gaz naturel de Minami à l'est de Tokyo au Japon et du bassin d'Anadarko dans l'Oklahoma aux États-Unis en sont les deux principales sources. Ces saumures ont une température de plus de 60 °C en raison de la profondeur de ces sources. Elles sont d'abord purifiées et traitées à l'acide sulfurique H2SO4, et l'iodure d'hydrogène HI résultant est alors oxydé en diiode I2 par action de chlore Cl2, avant d'être récupéré à travers une tour d'absorption contenant du dioxyde de soufre SO2 :
La production d'iode américaine est tenue confidentielle par l'USGS, tandis que celle du Japon était d'environ 9 800 t en 2010, soit près de 34 % de la production mondiale publiée[31]. Le prix de l'iode industriel a très fortement augmenté en 2011 d'environ 40 %.
- La concentration d'iode dans l'eau de mer n'est pas suffisante pour que l'extraction de cet élément à partir de cette source soit rentable. Les grandes algues marines (kelp) ont été exploitées au XVIIIe siècle et au XIXe siècle — c'est d'ailleurs à partir de telles algues que l'iode a été isolé pour la première fois — mais n'est plus viable économiquement[33].
Utilisations
Histoire
La médecine chinoise traditionnelle avait déjà constaté que la poudre issue d'éponge marine brûlée (riche en iode) permet de lutter contre les goitres, bien avant que l'on ait montré en Europe (en 1830) que l'iode avait cet effet. Cette dernière découverte fut d'ailleurs suivie d'une série d'intoxications dues à un usage trop fréquent et/ou trop enthousiaste de l'iode (au milieu du XIXe siècle F Rilliet comprenait que ces intoxications étaient induites par l'iode « administré à petites doses longtemps continuées »[34] mais ces intoxications avaient été assez graves pour discréditer puis faire abandonner la prophylaxie à l'iodure durant plusieurs décennies… Jusqu'à ce qu'Eugen Baumann montre (en 1896) que la thyroïde contient normalement un composé organique de l'iode. Cette découverte relance le traitement et la prévention du goitre par l'iode, après qu'on ait compris qu'il s'agit d'un oligoélément qui ne doit être absorbé qu'en petites quantités. Le médecin suisse Otto Bayard est le premier à mélanger de l'iode avec du sel de cuisine pour lutter contre les carences chez les populations montagnardes ; son action est reprise par la Suisse puis par d'autres pays, démarrant la prophylaxie par l'iode. Durant la Première Guerre mondiale, en 1917, le sel iodé distribué au goitreux et dans des régions goitreuses s'est révélé efficace pour prévenir le goitre endémique et le risque de crétinisme[35].
Production d'acide acétique
L'iode est principalement utilisé pour catalyser la production d'acide acétique CH3COOH par le procédé Monsanto et par le procédé Cativa. Dans ces procédés, qui permettent de répondre à la demande mondiale en acide acétique, l'acide iodhydrique HI convertit le méthanol CH3OH en iodure de méthyle CH3I, qui est ensuite carbonylé en iodure d'acétyle CH3COI, lequel est enfin hydrolysé en acide acétique et en acide iodhydrique, qui s'en trouve régénéré.
Complément alimentaire en iode pour le bétail
Une fraction importante de l'iode produit dans le monde est utilisée sous forme d'EDDI (diiodure d'éthylènediammonium) I−H3N+–CH2–CH2–NH3+I− comme complément alimentaire destiné au bétail et aux animaux domestiques en vue de prévenir toute carence en iode chez ces animaux.
Lampe halogène
Lampe à incandescence qui contient un gaz inerte et de l'iode ou de l'iodure de méthyle. À cause de sa température très élevée, une partie du filament en tungstène s'évapore et un dépôt métallique se forme sur la paroi de l'ampoule. Celui-ci réagit alors avec l'iode, pour former des iodures métalliques volatils. Ces composés sont détruits au contact du filament, permettant ainsi le retour du métal à sa source. Ce qui permet d'augmenter la durée de vie et d'augmenter la température de fonctionnement.
Un filament à température plus élevée donne une lumière plus blanche (avantage) mais émet une proportion importante d'ultraviolet (inconvénient). Afin de résister aux hautes températures, l'ampoule est en verre de silice souvent du quartz fondu, transparent aux UV. Un écran en verre ordinaire (qui filtre les UV) est indispensable autour de l'ampoule « halogène » pour éviter que le sodium de la sueur des doigts catalyse une recristallisation de la silice ce qui détruirait l'ampoule.
On utilise également du bromure de méthyle CH3Br ou le dibromure de méthyle CH2Br2.
Lampes à halogénures métalliques
Lampes contenant des halogénures (en particulier des iodures) de terres rares (yttrium, dysprosium, scandium, thallium), ainsi que d'autres métaux (indium, lithium) et du mercure sous pression. L'arc électrique produit excite la combinaison d'atomes métalliques permettant de recréer la « lumière du jour ».
Autres utilisations
- Examen aux rayons X : L'iode possède une forte opacité aux rayons X. Il est utilisé en tant qu'agent de contraste (sous une forme injectable). Des molécules organoiodées sont utilisées en imagerie médicale pour opacifier des organes (rein, artères, veines, vésicule biliaire, cerveau, etc.).
Les principales sociétés pharmaceutiques produisant des agents de contraste sont Guerbet (France), Schering (Allemagne), Squibb (USA), Bracco (Italie).
- Scintigraphie et Imagerie médicale : des isotopes radioactifs (123I par exemple) de l'iode sont utilisés comme radiotraceurs dans le corps humain pour des examens médicaux (scintigraphie de la thyroïde).
- Traitement anticancéreux ; contre le cancer de la thyroïde par radiothérapie : l'iode 131 radioactif se fixe préférentiellement sur la thyroïde malade et les cellules métastatiques en les détruisant, mais il expose les autres cellules à un rayonnement interne et il a récemment été remis en cause pour le traitement des cancers de petite taille, car il augmente le risque de développer un second cancer à la suite du traitement[36].
- Pluie : l'iode peut aider, sous forme d'iodure d'argent AgI à déclencher une pluie artificielle, plus exactement à l'ensemencement des nuages.
- Microscopie et indicateur coloré : Les amidonniers ont appris depuis longtemps à utiliser la réaction spécifique de l'iode avec l'amidon pour colorer les grains de celui-ci. Dans le test à l'iode-amidon (en), la coloration obtenue varie selon le ratio d'amylose et d'amylopectine contenues dans le grain.
Chez l'être humain
Comme oligo-élément
L'essentiel de l'iode est d'origine marine. Du fait des précipitations, il se retrouve de manière inégale dans les terres, et donc, dans les différentes plantes consommées[38]. La source de l'iode alimentaire dans les pays européens et aux États-Unis se trouve principalement dans les poissons, les fruits de mer et les algues[38].
L'iode est absorbé sous forme d'ions au niveau de l'estomac et du duodénum. Il est stocké principalement dans la thyroïde et excrété dans les urines. On a aussi montré qu'« il existe une interrelation très étroite entre le métabolisme du sélénium et celui de l'iode »[39]
L'iode est un oligo-élément essentiel à la vie humaine. Les besoins journaliers chez l'adulte sont d'environ 150 µg, davantage chez la femme enceinte (de 200 à 290 μg). Il sert exclusivement à fabriquer les hormones thyroïdiennes, dont la thyroxine. Il est souvent ajouté au sel de cuisine (sel iodé), parfois au lait (au Royaume-Uni notamment) pour éviter toute carence (voir aussi le tableau des aliments riches en iode). L'absorption quotidienne se situe entre 0,05 et 0,1 mg[40]. Pour toute une vie les besoins en iode sont d'environ 2 à 4 grammes[41], à peine l'équivalent d'une cuillère à café. C'est assez faible mais cela reste redoutable car notre organisme ne sait pas stocker cet oligo-élément de manière prolongée[42].
Son absence provoque une turgescence de la glande thyroïdienne, qui se manifeste par un goitre. La carence en iode entraine un retard de croissance et divers troubles mentaux.
Des régions montagnardes peuvent être pauvres en iode en raison du lessivage des sols par les anciens glaciers[43]. Les cas de difformité et de nanisme étaient donc fréquents parmi les populations paysannes alpines. Dans les Alpes, la population isolée des vallées était beaucoup plus souvent atteinte de troubles liés à la carence en iode. La première définition du « crétin goitreux » est donnée dans l'encyclopédie raisonnée des sciences, des arts et des métiers (1754) de Diderot. L'expression « crétin des Alpes » est usuelle. Le crétinisme est une forme de débilité mentale et de dégénérescence physique en rapport avec une insuffisance thyroïdienne.
L'iode est indispensable pour la maturation du système nerveux du fœtus. La carence peut avoir un retentissement sur le développement cérébral.
En 2007, près de deux milliards de personnes, dont un tiers d'âge scolaire, ont un déficit en iode[44], ce qui en fait un des problèmes majeurs de santé publique. L'une des façons de lutter contre cela est l'ajout d'iode dans le sel de consommation.
- En Belgique, le Conseil Supérieur de la Santé a publié en 2014 un avis « Stratégies visant à augmenter l'apport iodé en Belgique, évaluation et recommandations » dans lequel on apprend que le statut iodé de la population belge est sous contrôle. Seules les femmes qui désirent un enfant ou qui sont enceintes devraient prendre un complément alimentaire iodé et/ou utiliser un sel de cuisine iodé à teneur modérée en iode (10 à 15 mg/kg)[45]
La perte en iode durant la cuisson varie suivant le type de cuisson et le temps de cuisson[46].
| perte en iode en % | |
|---|---|
| ébullition | 37 à 40 % |
| torréfaction | 10 % |
| friture | 10 % à 27 % |
| cuisson au micro-ondes | 27 % |
| cuisson sous pression | 22 % |
| vapeur | 20 % |
Ainsi concernant le sel de table enrichi en iode, il est recommandé de l'ajouter après la cuisson et non pendant la cuisson[46].
Une étude a mis en évidence qu'une fois que la boite de sel a été ouverte, au bout de 20 à 40 jours, la moitié de l'iode contenue dans le sel a disparu par sublimation[48] - [49] - [50].
Une étude a montré que la pasteurisation (HTST ou pasteurisation éclair) réduit la teneur en iode dans le lait de 52%[51] - [52]. La stérilisation du lait par contre n'a pas réduit la quantité d'iode dans le lait[51].
En tant qu'antiseptique
Le diiode I2 dissous dans l'éthanol (« teinture d'iode ») ou dans une solution aqueuse d'iodure de potassium KI (solution de lugol) est également utilisé en pharmacie et en milieu hospitalier comme antiseptique puissant. Il laisse des traces jaunes sombres caractéristiques sur la peau. Il existe également des composés organiques où l'iode est lié, tels que la povidone iodée (Bétadine ou Iso-bétadine). L'alcool iodé à 1 % est inscrit au Formulaire National Français, complément de la Pharmacopée[53].
Prévention de contamination radioactive
L'iode radioactif 131I peut être rejeté accidentellement par un réacteur nucléaire. Il est assimilé avec la nourriture ou l'eau contaminée, et se fixe dans la glande thyroïde. L'ingestion de comprimés d'iodure de potassium (130 mg par jour pour un adulte, 65 mg pour un enfant de moins de 12 ans) sature la thyroïde et évite la fixation d'iode dans l'organisme pendant l'exposition à l'iode radioactif : cette consigne de sécurité est surtout valable pour les enfants et les femmes enceintes ou allaitant, les risques de cancers thyroïdiens étant majeurs ; au-delà de 40 ans, la prise d'iodure de potassium devient discutable, la balance bénéfices/risques n'étant plus aussi favorable[28].
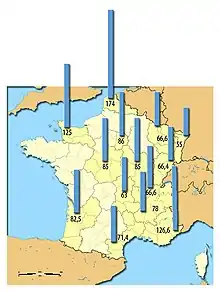
En France, lors de la dernière campagne de distribution préventive, environ 52 % des particuliers situés dans un rayon de 10 km autour des centrales nucléaires se sont déplacés en pharmacie pour retirer leurs comprimés d'iodure de potassium[54].
Toxicité et risques en cas d'excès
De nombreux composés chimiques contenant de l'iode sont utilisés en médecine et/ou en milieu professionnel (industrie, chimie, médecine)[55]. La pénétration au sein de l'organisme peut se faire par les voies respiratoire, cutanée ou digestive[55]. L'iode (sauf à faible dose) est nocif par inhalation, par ingestion et à haute dose par contact avec la peau[56].
La surcharge iodée iatrogène (c'est-à-dire induite par de l'iode médicamenteux) est le plus souvent due à un accident médical lié[57] à un usage médicamenteux inadapté.
Un abus de compléments alimentaires iodés peut aussi être en cause[58].
Certains environnements professionnels sont aussi source de contamination interne (Ex : fabrication d'écrans de gamma-caméras à partir de cristaux d'iodures de sodium et de césium, notamment au stade de l'usinage et du polissage en salle sèche[55].
La surcharge en iode peut alors occasionner (ou simplement révéler) des altérations du fonctionnement thyroïdien (hypo- ou hyperthyroïdie)[59] mais peut aussi avoir des effets toxiques chez certains patients, pouvant par exemple résulter de l'usage de désinfectant riche en iode (bétadine par exemple) chez les grands brûlés, l'iode passant en trop grande quantité dans le sang et la lymphe du patient, en pouvant induire une acidose métabolique grave[60] ou plus rarement une insuffisance rénale aiguë (avec nécrose tubulaire aiguë) chez des patients abondamment traités par un produit iodé au niveau des muqueuses[61]. La littérature cite aussi des cas d'intoxications massives induites par des irrigations profondes et prolongées de plaies par de la bétadine[62].
Pour savoir à partir de quand il y a excès ou anomalie, il faut connaitre la teneur « normale » en iode des cheveux, ongles, de l'urine (iodémie), du sang…. Ces paramètres commencent à être mieux connus et s'inscrivent notamment dans le concept de « profil métallique » (moyen ou individuel)[63]
Précautions à prendre
L'iode étant un oligoélément thyroïdien actif à très faible dose, un risque d'intoxication par l'iode (et d'hypothyroïdie secondaire) justifie de proscrire formellement l'utilisation de désinfectants iodés chez les personnes les plus vulnérables aux surdoses que sont les nouveau-nés[64] et a fortiori les prématurés, ainsi que chez la femme enceinte et allaitante[65].
Allergie à l'iode
Certaines personnes peuvent être allergiques à des produits contenant de l'iode, comme au produit contrastant injecté pour des examens de radiologie ou encore certains fruits de mer. Il s'est donc répandu l'idée que l'on pouvait être allergique à l'iode. Ceci est en réalité impossible : c'est à des composés de l'iode que l'on peut être allergique[66], mais jamais à l'élément, qui entre notamment dans la composition de certaines hormones thyroïdiennes.
Les produits susceptibles d'induire une allergie à l'iode contiennent tous de l'iode, mais ce sont des substances différentes qui interviennent dans le cas de l'allergie. Pour la bétadine, c'est la povidone iodée (le véhicule de l'iode) qui est responsable. Pour les produits de contraste iodés, l'osmolalité est mise en cause, et pour les produits de la mer (poissons et crustacés), ce sont des protéines musculaires. Il n'existe donc aucune réaction croisée ni de facteurs de risques. De plus, il n'y a aucune allergie rapportée dans le cas d'utilisation de solution alcoolique ou aqueuse d'iode, telles la solution de Lugol, la teinture d'iode, etc.
Ecotoxicologie
L'iode comme d'autres halogènes (le fluor, le chlore[67] - [68], mais surtout le brome[69] - [70]) semble en cause[71] dans le phénomène de pluies de mercure, qui a notamment massivement contaminé le pergélisol arctique en mercure.
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- Paul Arnaud, Brigitte Jamart, Jacques Bodiguel, Nicolas Brosse, Chimie Organique 1er cycle/Licence, PCEM, Pharmacie, Cours, QCM et applications, Dunod, , 710 p., Broché (ISBN 2100070355)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- (en) T.A. Czuppon et al., Kirk-Othmer encyclopedia of chemical technology 4th ed. : Ammonia, vol. 2, John Wiley & Sons.
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Entrée « Iodine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 21 août 2018 (JavaScript nécessaire)
- Chez l'homme adulte, on parle d'excès à partir d'une excrétion d'iode d'environ 800 mg/24 heures.
- P. Laurberg, I. Bülow Pedersen, N. Knudsen, L. Ovesen, and S. Andersen, « Environmental Iodine Intake Affects the Type of Nonmalignant Thyroid Disease », Thyroid, 2001, p. 457-469. DOI : 10.1089/105072501300176417 (résumé).
- M. Tonacchera, A. Pinchera, A. Dimida, E. Ferrarini, P. Agretti, P. Vitti, F. Santini, K. Crump & J. Gibbs. « Relative potencies and additivity of perchlorate, thiocyanate, nitrate and iodide on the inhibition of radioactive iodide uptake by the human sodium iodide symporter ». Thyroid, 2004, p. 1012–1019 (résumé).
- Joseph Louis Gay-Lussac, Mémoire sur l'iode, Annales de Chimie, 1814, tome 91, p. 5-160.
- (en) E. F. Verhaeghe, A. Fraysse, J.-L. Guerquin-Kern, T.-D. Wu, G. Devès, C. Mioskowski, C. Leblanc, R. Ortega, Y. Ambroise et P. Potin, « Microchemical imaging of iodine distribution in the brown alga Laminaria digitata suggests a new mechanism for its accumulation », Journal of Biological Inorganic Chemistry, vol. 13, , p. 257–269.
- (en) FC. Küpper, N. Schweigert, E. Ar Gall, J. M. Legendre, H. Vilter et B. Kloareg, « Iodine uptake in Laminariales involves extracellular, haloperoxidase-mediated oxidation of iodide », Planta, vol. 207, , p. 221-232.
- Dans l'atmosphère, les composés volatils iodés sont progressivement transformés par photolyse en radicaux iodés qui réagissent avec l'ozone pour former des particules iodées. En réalité, cet « air iodé » ne vient pas de ces particules iodées micronisées dans les gouttelettes car elles n'ont pas d'odeur. Le parfum de l'air iodé provient certainement des composés organiques volatils (dont les composés volatils iodés) émis par les algues et dispersés par le vent et les embruns. Cf. Catherine Leblanc et Philippe Potin, « L'air iodé du bord de mer : de la défense des algues à la formation des nuages », Biofutur, vol. 29, no 308, , p. 51.
- (en) G. Malin, F. C. Küpper, L. J. Carpenter, A. Baker, W. Broadgate, B. Kloareg et P. S. Liss, « Trace gas production by seaweeds: defense, oxidative stress, signalling and atmospheric significance », Journal of Phycology, vol. 37, no 2, , p. 32-33 (DOI 10.1111/j.1529-8817.2001.jpy37303-82.x).
- Global Iodine Biogeochemical Cycle, tiré de Chris M. Yeager, « Microbial Transformation of Iodine: From Radioisotopes to Iodine Deficiency », Advances in Applied Microbiology, vol. 101, 2017, p. 83-136.
- (en) Muramatsu Y, Yoshida S, Fehn U, Amachi S, Ohmomo Y, « Studies with natural and anthropogenic iodine isotopes: iodine distribution and cycling in the global environment », J Environ Radioact, vol. 74, nos 1-3, , p. 221-232 (DOI 10.1016/j.jenvrad.2004.01.011).
- Marine Roulier, Cycle biogéochimique de l'iode en écosystèmes forestiers (thèse de doctorat en chimie analytique et environnement), , 254 p. (OCLC 1085365876, SUDOC 233946225, présentation en ligne, lire en ligne).
- (en) Phyllis A. Lyday et Tatsuo Kaiho, « Iodine and Iodine Compounds », dans Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, (ISBN 978-3-527-30673-2, DOI 10.1002/14356007.a14_381.pub2, lire en ligne), p. 1–13.
- (en) Katarzyna Waszkowiak et Krystyna Szymandera-Buszka, « Effect of storage conditions on potassium iodide stability in iodised table salt and collagen preparations », International Journal of Food Science & Technology, vol. 43, no 5, , p. 895–899 (ISSN 0950-5423 et 1365-2621, DOI 10.1111/j.1365-2621.2007.01538.x, lire en ligne, consulté le ).
- Frank Albert Cotton et Geoffrey Wilkinson, Advanced inorganic chemistry: a comprehensive text, J. Wiley & sons, (ISBN 978-0-471-84997-1).
- (en) N.L. Glinka, « General Chemistry ».vol. 2, éditions Mir, 1981.
- (en) Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman, « Inorganic chemistry ». Academic Press, 2001, p. 419–420. (ISBN 0123526515).
- (en) Linus Pauling, « General Chemistry ». Dover Publications, 1988. (ISBN 0486656225).
- (en) Phyllis A. Lyday, « Iodine and Iodine Compounds ».dans Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI 10.1002/14356007.a14_381.
- (en) N. Bell, L. Hsu, D. J. Jacob, M. G. Schultz, D. R. Blake, J. H. Butler, D. B. King, J. M. Lobert et E. Maier-Reimer, « Methyl iodide: Atmospheric budget and use as a tracer of marine convection in global models », Journal of Geophysical Research, vol. 107, no D17, , p. 4340 (DOI 10.1029/2001JD001151)
- (en) Alex G. Fallis, Pierre E. Tessier, « 2-Iodoxybenzoic acid (IBX)1 ». dans Encyclopedia of Reagents for Organic Synthesis, John Wiley, 2003. DOI 10.1002/047084289X.rn00221.
- (en) World Health Organization – 1999 « Guidelines for Iodine Prophylaxis following Nuclear Accidents ».
- « Accidents nucléaires, environnement et santé à l’ère post-Fukushima. Partim : Protection de la thyroïde » [PDF], AVIS DU CONSEIL SUPERIEUR DE LA SANTE no 9275, Conseil Supérieur de la Santé, (consulté le )
- « AVIS DU CONSEIL SUPERIEUR DE LA SANTE CONCERNANT LA PROPHYLAXIE IODEE EN CAS D'ACCIDENT NUCLEAIRE » [html], Bon à savoir, Centre Belge d'Information Pharmacothérapeutique, (consulté le )
- (en) USGS Minerals Information – 2011 « Iodine – Statistics and Information ».
- (en) Jessica Elzea Kogel, Nikhil C. Trivedi, James M. Barker, Stanley T. Krukowski (2006). « Industrial Minerals & Rocks: Commodities, Markets, and Uses », p. 541–552, 2006. (ISBN 9780873352338).
- (en) Edward C. C. Stanford, On the Economic Applications of Seaweed », dans Journal of the Society of Arts p. 185–189, 1862.
- Rilliet F (1858). Quelques mots sur l'intoxication produite par l'iode administré à petites doses longtemps continuées, par le Dr F. Rilliet... L. Martinet.
- Kimball, O. P. (1953). History of the prevention of endemic goitre. Bulletin of the World Health Organization, 9(2), 241.
- voir l'article : Cancer de la thyroïde.
- Mornex,1987 et LeGuenelal., 2000, cités par Le Guen, B., Hémidy, P. Y., Gonin, M., Bailloeuil, C., Van Boxsom, D., Renier, S., & Garcier, Y. (2001). Arguments et retour d'expérience sur la distribution d'iode stable autour des centrales nucléaires françaises. Radioprotection, 36(4), 417-430. URL:https://www.researchgate.net/profile/Bernard_Le_Guen/publication/245276139_Arguments_et_retour_d%27experiencesur_la_distribution_d%27iode_stable_autourdes_centrales_nucleaires_francaises/links/57cfff4b08ae057987ae67cc/Arguments-et-retour-dexperiencesur-la-distribution-diode-stable-autourdes-centrales-nucleaires-francaises.pdf
- Zimmermann MB, Jooste PL, Pandav CS, Iodine-deficiency disorders, Lancet, 2008;372:1251-1262
- Ducros V & Favier A (2004). Métabolisme du sélénium. EMC-endocrinologie, 1(1), 19-28| résumé.
- J.O Peyrin, J.C Vandroux, Atlas des glandes endocrines, Université Jean Monnet, Saint Étienne, (page consultée le 13 juin 2008).
- Le Républicain Niger : Lutte contre les troubles dus à la carence en iode
- Conseil international des infirmières : Les infirmières, les pharmaciens et les médecins du monde demandent à l’Inde de n’utiliser que du sel iodé
- (en) B.S Hetzel, Iodine and Iodine-Deficiency Disorders, Cambridge University Press, (ISBN 0-521-40214-X), p. 797.dans The Cambridge World History of Food, vol. 1, K.F Kiple et K..C Ornelas (dir.).
- Iodine deficiency—way to go yet, Lancet, 2008; 372:88
- « Stratégies visant à augmenter l’apport iodé en Belgique, évaluation et recommandations » [PDF], AVIS DU CONSEIL SUPERIEUR DE LA SANTE no 8913, Conseil Supérieur de la Santé, (consulté le ).
- Ritu Rana et Rita Singh Raghuvanshi, « Effect of different cooking methods on iodine losses », Journal of Food Science and Technology, vol. 50, no 6, , p. 1212–1216 (ISSN 0022-1155, PMID 24426037, PMCID PMC3791240, DOI 10.1007/s13197-011-0436-7, lire en ligne, consulté le )
- G. Goindi, M. G. Karmarkar, U. Kapil et J. Jagannathan, « Estimation of losses of iodine during different cooking procedures », Asia Pacific Journal of Clinical Nutrition, vol. 4, no 2, , p. 225–227 (ISSN 0964-7058, PMID 24394330, lire en ligne, consulté le )
- (en) Lynne Farrow, The Iodine Crisis : What You Don't Know about Iodine Can Wreck Your Life, Devon Press, , 257 p. (ISBN 978-0-9860320-0-4, lire en ligne)
« page 192 - Dasgupta et al. report it takes between 20 and 40 days for an opened container of iodized salt to lose half of its iodine. »
- « Iodine Nutrition: Iodine Content of Iodized Salt in the United States » : « FIGURE 1. Loss of iodine over time with exposure to air with specified humidity levels, no light »
- « FIGURE 1. Loss of iodine over time with exposure to air with specified humidity levels, no light, 22 (1 °C »
- Pantea Nazeri, Mohammad Ali Norouzian, Parvin Mirmiran et Mehdi Hedayati, « Heating Process in Pasteurization and not in Sterilization Decreases the Iodine Concentration of Milk », International Journal of Endocrinology and Metabolism, vol. 13, no 4, (ISSN 1726-913X, PMID 26587031, PMCID PMC4648127, DOI 10.5812/ijem.27995, lire en ligne, consulté le ) :
« The present study is the first to investigate this effect; and contrary to our predictions, heating during sterilization did not decrease the iodine concentration in the milk. »
- Pantea Nazeri, Mohammad Ali Norouzian, Parvin Mirmiran et Mehdi Hedayati, « Heating Process in Pasteurization and not in Sterilization Decreases the Iodine Concentration of Milk », International Journal of Endocrinology and Metabolism, vol. 13, no 4, (ISSN 1726-913X, PMID 26587031, PMCID PMC4648127, DOI 10.5812/ijem.27995, lire en ligne, consulté le )
- « Formulaire national : Liste des monographies en vigueur au Formulaire national », sur ANSM (consulté le ).
- (fr) 2e phase de distribution de comprimés d’iode pour les entreprises et collectivités – Mobilisez-vous !
- Guével E, Madani R, Conso F, Causse E & Choudat D (2004) « Dysfonctionnement thyroïdien et surcharge iodée professionnelle ». Archives des Maladies Professionnelles et de l'Environnement, 65(5), 438-441.
- L'iode au travail
- Hassani H (2012) Accidents médicaux liés à l’utilisation des produits de contraste iodés en radiodiagnostic: éléments pour la détermination de la responsabilité médicale du radiologue. La Revue de Médecine Légale, 3(3), 103-114.
- Testud, F., & Du Boullay, H. (2006). Compléments alimentaires à base d'algues marines et dysthyroïdie: une possible relation?. La Revue de médecine interne, 27(5), 429-430
- Wemeau J.L (2002) Hypothyroïdies liées aux surcharges iodées : Les surcharges iodées. La Presse médicale, 31(35), 1670-1675
- Pietsch J & Meakins J.(1976). Complications of povidone-iodine absorption in topically treated burn patients. The Lancet, 307(7954), 280-282 | résumé
- Béji S, Kaaroud H, Moussa F.B, Abderrahim E, Zghidi S, Hamida F.B,... & Kheder A (2006) Insuffisance rénale aiguë secondaire à la povidone iodée. La Presse Médicale, 35(1), 61-63 | résumé.
- Lemaire-Hurtel A.S, Bodeau S, Bennis Y, Andrejak M, Lobjoie E, Chatelain D & Gaulier J.M (2014) Intoxication aiguë à la bétadine alcoolique : à propos d'un cas. Toxicologie Analytique et Clinique, 26(2), S27-S28.
- Goullé J.P, Saussereau E, Mahieu L, Bouige D, Guerbet M & Lacroix C (2010) Le profil métallique: un nouveau concept médical. La Revue de médecine interne, 31(2), 128-134.
- Lahmiti, S., El Fakiri, K., & Aboussad, A. (2010). Les antiseptiques en néonatologie: l’héritage des anciens à la lumière du jour. Archives de pédiatrie, 17(1), 91-96 | résumé
- Beaufrere, B., Bresson, J. L., Briend, A., Ghisolfi, J., Goulet, O., Navarro, J.,... & Vidailhet, M. (2000). La nutrition iodée chez l'enfant. Archives de pédiatrie, 7(1), 66-74.
- http://www.urgencenucleaire.qc.ca/documentation/iodemdque.pdf
- Lin, C.-J. and Pehkonen, S. O., Oxidation of elemental mercury by aqueous chlorine (HOCl/OCl-): Implications for tropospheric mercury chemistry, J. Geophys. Res., 103D, 28093–28102, 1998.
- Lin, C.-J. and Pehkonen, S. O., Aqueous phase reactions of mercury with free radicals and chlorine: Implications for atmospheric mercury chemistry ; Chemosphere, 38, 1253–1263, 1999.
- Goodsite, M., Plane, J. M. C., and Skov, H., A theoretical study of the oxidation of Hg to HgBr2 in the troposphere, Environ. Sci. Technol., 38, 1772–1776, 2004
- Evans M.J, Jacob D.J, Atlas E, Cantrell C.A, Eisele F, Flocke F, Fried A, Mauldin R.L, Ridley B.A, Wert B, Talbot R, Blake D, Heikes B, Snow J, Welega J, Weinheimer A-J et Dibb J (2003) Coupled evolution of BrOX-ClOXHOX-NOX chemistry during bromine-catalyzed ozone depletion events in the Arctic boundary layer, J. Geophys. Res., 108(D4), 8368, doi:10.1029/2002JD002732.
- Zingler J & Platt U (2005) Iodine oxide in the Dead Sea Valley: Evidence for inorganic sources of boundary layer IO, J. Geophys. Res., 110, D07307, doi:10.1029/2004JD004993
Voir aussi
Bibliographie
- (en) WHO, ICCIDD. Assessment of the iodine deficiency disorders and monitoring their elimination. Geneva, 2001.
Articles connexes
Liens externes
- Ressources relatives à la santé :
- DrugBank
- (en) Medical Subject Headings
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) « Technical data for Iodine » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||






