Cyclooctasoufre
Le cyclooctasoufre est un corps simple de formule chimique S8, constitué de huit atomes de soufre. Il s'agit d'un solide le plus souvent cristallin de couleur jaune ou orange pâle à température ambiante. C'est un allotrope naturel du soufre. Lorsque l'on parle de soufre, on parle en fait généralement de cyclooctasoufre qui est la forme allotropique prédominante du soufre à température ambiante.
| Cyclooctasoufre | |
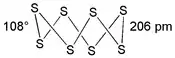
| |
| Structure du cyclooctasoufre | |
| Identification | |
|---|---|
| Nom UICPA | octathiocane |
| Synonymes |
octasoufre, |
| No CAS | |
| PubChem | 66348 |
| ChEBI | 29385 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | S8 [Isomères] |
| Masse molaire[1] | 256,52 ± 0,04 g/mol S 100 %, |
| Propriétés physiques | |
| T° fusion | 112,8 °C (soufre α)[alpha 1] - [2] 119,6 °C (soufre β)[alpha 1] - [2] 106,8 °C (soufre γ)[2] |
| T° ébullition | 444,6 °C |
| Masse volumique | 2,07 g·cm-3 (soufre α)[2] 1,94-2,01 g·cm-3 (soufre β)[2] 2,19 g·cm-3 (soufre γ)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Différentes formes
Il existe plusieurs polymorphes d'octasoufre : Sα, Sβ, Sγ, Sλ et Sμ. La stabilité de ces polymorphes dépend principalement de la température et de l'état de celui-ci.
Soufre α
Ce système cristallin octaèdre orthorhombique noté Sα constitue la forme standard du cyclooctasoufre à l'état solide. C'est la forme allotropique la plus stable du soufre et donc du cyclooctasoufre jusqu'à 95,6 °C environ.
Soufre β
Noté Sβ, c'est la structure cristalline de l'octasoufre qui prédomine entre 95,6 °C et 119,6 °C à 100 kPa. Sβ est dans l'état solide sous forme de prismes monocliniques. Il peut néanmoins demeurer métastable à température ambiante pendant plusieurs semaines s'il a été obtenu par trempe à partir d'une phase à plus de 100 °C. Sβ fond à 119,6 °C pour donner du soufre λ noté Sλ.
Soufre γ
Noté Sγ, il est une forme rare de soufre de structure monoclinique. Il est peu abondant bien que stable dans la même gamme de température que Sβ. Il est obtenu par refroidissement lent de soufre fondu au-dessus de 160 °C. La rosickyite (en) est un exemple de soufre gamma, natif.
Soufre λ
Noté Sλ, il représente un ensemble de variétés allotropiques octasoufre à l'état liquide et entre 119,6 à 159 °C.
Évolution avec la température
De la forme prédominante
Le cyclooctasoufre se trouve majoritairement dans l'état solide sous la forme cristalline Sα jusqu'à 95,6 °C puis sous la forme de Sβ jusqu'à 119,6 °C. À cette température, il passe à l'état liquide et on le trouve alors majoritairement sous forme de Sλ jusqu'à 159 °C. Cette température marque le début de la polymérisation. Les cycles à huit atomes de soufre s'ouvrent pour devenir des espèces radicalaires qui polymérisent et forment de longues chaînes de soufre, notées Sµ, contenant jusqu'à un million d'atomes. Alors que jusque-là l'octasoufre était la forme allotropique majoritaire du soufre, à cette température d'autres formes cycliques du soufre, telles que S6, S7 et S12, sont en équilibre avec S8. La trempe de cette phase, extraite à l'aide de disulfure de carbone CS2, donne un solide amorphe constitué de segments de chaînes Sn où 103 ≤ n ≤ 106.
Propriétés
Lorsque l'octasoufre est liquide (119,6 °C) sa viscosité commence par diminuer avec l'augmentation de la température. Néanmoins la rupture des cyclooctasoufres, le début de la polymérisation et donc la modification de structure vers 159 °C entraînent une augmentation soudaine. Elle passe ensuite par un maximum à 187 °C, correspondant à du soufre ω à longues chaînes. La viscosité décroît alors lorsque la température continue de croître jusqu'à ébullition à 444,6 °C, les chaînes étant brisées par la chaleur en segments de plus en plus petits.
La trempe de cette phase, extraite à l'aide de disulfure de carbone CS2, donne un solide amorphe dit soufre μ, constitué de segments de chaînes Sn où 103 ≤ n ≤ 106.
Notes et références
Notes
- Les températures de fusion du soufre α et du soufre β peuvent légèrement varier, le cycle S8 se décomposant progressivement au-dessus d'environ 119 °C en donnant des espèces abaissant le point de fusion du solide[2].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) N. N. Greenwood, Chemistry of the elements, Oxford Boston, Butterworth-Heinemann, , 1341 p. (ISBN 0-7506-3365-4, OCLC 37499934), p. 654-655.
Sources
- Chemical Reviews, 1976, vol. 76, n° 3