Disulfure de carbone
Le disulfure de carbone (anciennement sulfure de carbone) est le composé chimique de formule CS2. Liquide jusqu'à 46 °C, le disulfure de carbone est extrêmement volatil. Pur, il est incolore et possède une faible odeur éthérée, mais les impuretés soufrées qu'il contient souvent le rendent jaunâtre et lui confèrent une odeur forte et désagréable.
| Disulfure de carbone | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Disulfure de carbone | |
| Synonymes |
Anhydride sulfocarbonique |
|
| No CAS | ||
| No ECHA | 100.000.767 | |
| No CE | 200-843-6 | |
| Apparence | liquide incolore, d'odeur caractéristique[1]. | |
| Propriétés chimiques | ||
| Formule | CS2 [Isomères] |
|
| Masse molaire[2] | 76,141 ± 0,011 g/mol C 15,77 %, S 84,23 %, |
|
| Moment dipolaire | 0,06 D[3] | |
| Diamètre moléculaire | 0,453 nm[3] | |
| Propriétés physiques | ||
| T° fusion | −111 °C[1] | |
| T° ébullition | 46 °C[1] | |
| Solubilité | dans l'eau à 20 °C : 2 g l−1[1] | |
| Paramètre de solubilité δ | 20,5 MPa1/2 (25 °C)[4] | |
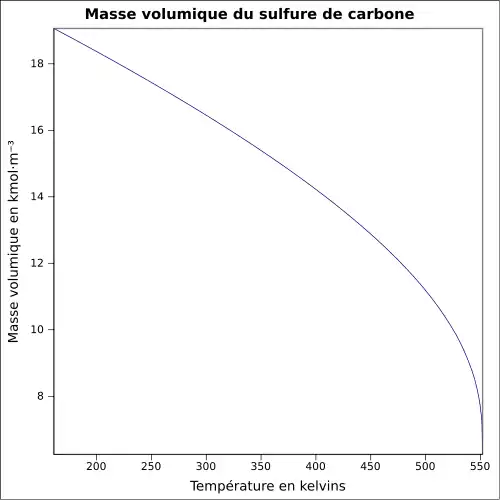
| Masse volumique | 1,26 g cm−3[1]
|
|
| T° d'auto-inflammation | 90 °C[1] | |
| Point d’éclair | −30 °C (coupelle fermée)[1] | |
| Limites d’explosivité dans l’air | 1–50 % vol[1] | |
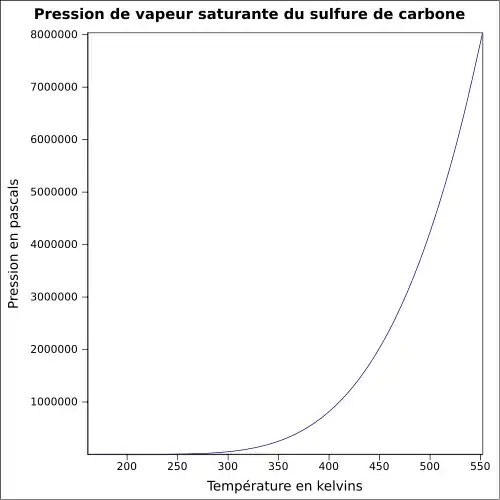
| Pression de vapeur saturante | à 25 °C : 48 kPa[1]
|
|
| Viscosité dynamique | 0,36 mPa s à 25 °C | |
| Point critique | 79,0 bar, 278,85 °C[6] | |
| Conductivité thermique | 0,162 W m−1 K−1 à 20 °C | |
| Conductivité électrique | 78 × 10−19 Ω−1 cm−1 à 18 °C | |
| Vitesse du son | 1 140 m s−1 à 25 °C[7] | |
| Thermochimie | ||
| S0gaz, 1 bar | 237,83 J mol−1 K−1 | |
| S0liquide, 1 bar | 151,0 J mol−1 K−1[8] | |
| ΔfH0liquide | 89,41 kJ mol−1[9] | |
| ΔvapH° | 27,50 kJ mol−1[8] | |
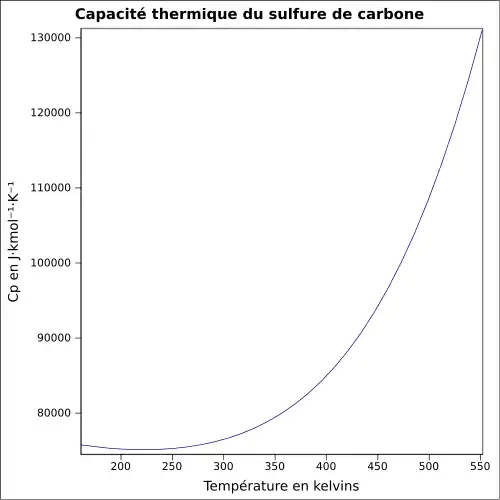
| Cp | 76,45 J mol−1 K−1 à 25 °C (liquide) |
|
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 10,068 5 ± 0,002 0 eV (gaz)[11] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,624[3] | |
| Précautions | ||
| SGH[12] | ||
   Danger |
||
| SIMDUT[13] | ||
  B2, D1B, D2A, D2B, |
||
| NFPA 704 | ||
| Transport | ||
| Écotoxicologie | ||
| LogP | 1,84[1] | |
| Seuil de l’odorat | bas : 0,01 ppm haut : 0,42 ppm[14] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Le disulfure de carbone est un solvant très toxique, utilisé en chimie pour dissoudre de nombreux composants organiques (notamment les résines, les cires et le caoutchouc) ainsi que le soufre, le phosphore blanc, le sélénium et l'iode.
Le disulfure de carbone est également utilisé comme intermédiaire de synthèse dans la fabrication de nombreux composés organiques soufrés : agents de vulcanisation du caoutchouc, produits pharmaceutiques, produits phytosanitaires (fongicides, insecticides). Au XIXe siècle, il fut utilisé pour lutter contre le phylloxéra de la vigne.
Propriétés physiques
Le disulfure de carbone est un liquide dense et volatil, avec un haut degré d'inflammabilité dans l'air, une température d'auto-inflammation remarquablement basse ainsi qu'une sensibilité exacerbée à l'électricité statique.
Occurrence et synthèse
De petites quantités de disulfure de carbone sont synthétisées lors des éruptions volcaniques et dans les marais.
CS2 a été produit industriellement à partir de la fin du XIXe siècle, à partir de charbon (ou de coke) et de soufre vaporisé à haute température (800 à 1 000 °C). Cette méthode était cependant peu efficace sur le plan énergétique et elle a été remplacée à partir des années 1950 par la synthèse à base de gaz.
La filière gaz naturel utilise une température de réaction plus basse, de l'ordre de 600 °C ; la réaction est catalysée par du gel de silice ou de l'alumine[15].
- CH4 + 12 S8 → CS2 + 2 H2S
Cette réaction est analogue à la combustion du méthane. Bien que structurellement similaire au dioxyde de carbone, CS2 est extrêmement inflammable :
- CS2 + 3 O2 → CO2 + 2 SO2.
Réactions
Comparé au dioxyde de carbone, CS2 est plus réactif vis-à-vis des nucléophiles et est plus facile à réduire. Cette différence de réactivité s'explique par le caractère p-donneur faible du soufre qui rend le carbone plus électrophile. Cette réactivité est très utilisée pour la synthèse de composés organosulfurés.
Additions nucléophiles
Les nucléophiles comme les amines réagissent pour donner des dithiocarbamates :
- 2 R2NH + CS2 → [R2NH2+][R2NCS2−].
Les xanthates se forment de façon similaire à partir d'alcoolates :
- RONa + CS2 → [Na+][ROCS2−].
Cette réaction est le point de départ de la fabrication de cellulose réarrangée, principal composant de la rayonne (viscose) et de la cellophane. Les xanthates et leurs équivalents soufrés les thioxanthates (dérivé d'un traitement de CS2 par des thiolates de sodium) sont utilisés comme agents de flottation dans le traitement de certains minerais. La réaction avec le sulfure de sodium donne l'ion trithiocarbonate :
- Na2S + CS2 → [Na+]2[CS32−].
Réduction
Le sodium réduit CS2 et donne l'hétérocycle « dmit2− »[16] :
- 3 CS2 + 4 Na → Na2C3S5 + Na2S.
Une réduction électrochimique directe donne l'anion tétrathiooxalate[17] :
- 2 CS2 + 2 e− → C2S42−.
Chloration
La production de tétrachlorure de carbone à partir de CS2 est la voie de synthèse majoritairement employée[15] :
Cette conversion passe par l'intermédiaire thiophosgène, CSCl2.
Chimie de coordination
CS2 est un ligand impliqué dans de nombreux complexes, formant des recouvrements de type Pi. Par exemple CpCo(η2-CS2)(PMe3)[18].
Utilisations
La principale utilisation du CS2 est la fabrication des fibres de viscose[19]. Il est aussi utilisé pour la synthèse de tétrachlorure de carbone et les feuilles de cellophane[20].
La production mondiale était de l'ordre de 750 000 t en 1990. Elle diminue depuis à cause des contraintes sur l'utilisation de CCl4 et du remplacement des films de cellophane par d'autre matériaux[20].
Dangerosité
À des niveaux élevés, le disulfure de carbone peut être mortel, car il touche le système nerveux. Ce point est critique dans l'industrie de la rayonne viscose où il est présent en plus du sulfure d'hydrogène lui aussi toxique.
Le disulfure de carbone est particulièrement irritant pour les yeux et la peau. Il est considéré comme un des plus irritants pour cette dernière. Une ingestion par inhalation, lors d’une exposition courte, cause, à haute concentration, des tremblements, vertiges, hallucinations, troubles comportementaux, troubles de la marche ainsi que des mouvements désordonnés. Après une ingestion grave, survient un coma souvent convulsif, une défaillance respiratoire (paralysie) voire le décès de l’individu. Les survivants présentent par la suite des séquelles neurologiques[21].
En cas d’exposition chronique, on remarque chez ces individus différents troubles neurocomportementaux : fatigue, irritabilité, céphalées, problème de concentration, vertiges, perte de poids, diminution de la force musculaire, troubles de la mémoire, du sommeil et de la libido et tendance dépressive.
En , un wagon-citerne contenant 70 tonnes de disulfure de carbone a été accidenté lors d'une collision de trains à Godinne en Belgique. Par mesure de précaution en raison de la toxicité et du risque d'explosion durant le transvasement du produit, un périmètre de sécurité de 500 mètres a été délimité et tout un quartier a été évacué plusieurs jours[22].
Le 18 mai 2022, un camion-citerne contenant du disulfure de carbone s'est renversé à la suite d'une collision sur l'autoroute A7, aux abords de Chasse-sur-Rhône en France. La sécurisation et le dépannage ont mobilisé 110 sapeurs pompiers, 26 engins, des gendarmes et des policiers. Un périmètre de sécurité de 1,5 km a été mis en place. La zone commerciale et l'autoroute ont été évacuées, et les habitants ont été invités à rester confinés à leur domicile[23] - [24].
Notes et références
- DISULFURE DE CARBONE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40.
- WebBook de Chimie NIST, SRD 69, « Carbon disulfide » (consulté le ).
- (en) W.D. Good, J.L. Lacina et J.P. McCullough, « Methanethiol and carbon disulfide: Heats of combustion and formation by rotating-bomb calorimetry », Journal of Physical Chemistry, vol. 65, , p. 2229-2231.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008).
- « Disulfure de carbone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- « Carbon disulfide », sur hazmap.nlm.nih.gov (consulté le ).
- Holleman, A. F. et Wiberg, E., Inorganic Chemistry, Academic Press, San Diego, 2001 (ISBN 0-12-352651-5).
- (en) Girolami, G. S., Rauchfuss, T. B. et Angelici, R. J., Synthesis and Technique in Inorganic Chemistry, University Science Books, Mill Valley, CA, 1999 (ISBN 0-935702-48-2).
- (en) Jeroschewski, P., « Electrochemical Preparation of Tetraalkylammonium Salts of Tetrathiooxalic Acid », Zeitschrift für Chemie (1981), vol. 21, 412.
- (en) Werner, H., « Novel Coordination Compounds formed from CS2 and Heteroallenes », Coordination Chemistry Reviews, 1982, vol. 43, p. 165-185, {DOI|10.1016/S0010-8545(00)82095-0}.
- (en) M. D. S. Lay, M. W. Sauerhoff et D.R. Saunders, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH (DOI 10.1002/14356007.a05_185), « Carbon Disulfide ».
- M. Hégo, « Disulfure de carbone », Techniques de l'ingénieur, no J 6290, , p. 8.
- N. Bonnard, T. Clavel, M. Falcy et al. (2013), « Disulfure de carbone - Fiche toxicologique no 12 », INRS.
- Emmanuel Wilputte, « Godinne : extrême prudence avec le disulfure de carbone », sur l'avenir.net, (consulté le ).
- Anthony Soudani, « Près de Lyon. L'autoroute A7 coupée après un grave accident : ce que l'on sait », sur Actu Lyon, (consulté le ).
- V.W., « Un camion-citerne transportant des matières dangereuses se renverse sur l’A7 : des centaines de camions bloqués », sur Le Dauphiné Libéré, (consulté le ).
Voir aussi
Articles connexes
Liens externes
- (en) National Pollutant Inventory: Carbon disulfide, sur npi.gov.au
- N. Bonnard, T. Clavel, M. Falcy et al., « Disulfure de carbone - Fiche toxicologique no 12 », INRS, 2013
- Fiche toxicologique internationale, sur cdc.gov