Olfaction
L'olfaction ou l'odorat est le sens qui permet d'analyser les substances chimiques volatiles (odeurs) présentes dans l’air.

L'olfaction est un sens vital pour de nombreuses espèces[1] ; il est par exemple utile ou nécessaire pour les activités de recherche alimentaire (chasse, recherche de végétaux appétents, etc.), l’évitement des prédateurs, la localisation du lieu de nidification, ponte, reproduction, mise bas, etc., pour la reconnaissance et le marquage du territoire, pour la communication entre individus par messages olfactifs, pour la recherche de partenaires sexuels, et pour la pollinisation des fleurs, etc.
Ce sens est moins utilisé chez l’être humain que chez de nombreux mammifères pour lesquels il est prépondérant, néanmoins, l'odeur personnelle semble encore jouer un ou plusieurs rôles chez l'humain en termes de communication non verbale[2], à plusieurs âges de la vie, avec des nuances notamment selon le sexe (Homme/Femme)[3], selon l'âge ou selon les contextes socio-culturels[4] - [5].
L'olfactique est la science du langage des odeurs et de leur rôle dans cette communication non verbale[6].
Chez les animaux (non humains)
Arthropodes
Les arthropodes se dirigent surtout par le toucher et par l'odorat, qui ont leur siège dans des poils sensoriels. Ceux-ci sont creux et contiennent le prolongement d'un neurone sensitif.
Poissons
L'odorat du requin est le plus développé des animaux.
Oiseaux
La réalité de l'odorat des oiseaux a fait l'objet de nombreuses controverses. Aristote et Pline l'Ancien la reconnaissaient, mais à l'époque moderne le consensus était que cet odorat était extrêmement peu développé, malgré des arguments contraires développés par Charles Waterton et Richard Owen à la fin du XIXe siècle et les exemples éclairants de l'Urubu à tête rouge et du Kiwi, en raisons d'expériences dont Kenneth Stager (en) ne montra les biais méthodologiques qu'en 1964. Les neurobiologistes soutenaient par ailleurs que les oiseaux, ayant un cortex à peine ébauché, ne pouvaient pas comme les mammifères posséder de grandes zones corticales dévolues au traitement des informations olfactives. En réalité, de nombreuses espèces possèdent des cavités nasales volumineuses tapissées d'une muqueuse olfactive reliée à un bulbe olfactif de très grande taille. Depuis la fin du XXe siècle, de grandes capacités olfactives ont été démontrées, notamment chez les pétrels, les albatros, les puffins, les pigeons voyageurs et même les poules domestiques[7].
L'appareil olfactif est plus ou moins développé selon les familles d'oiseaux. Les bulbes olfactifs du Pétrel des neiges notamment, de la famille des Procellariidae, occupent un tiers de la masse cérébrale. Par l'enregistrement direct de la réponse neuronale des bulbes comme par l'observation des réponses physiologiques des individus, on sait que les vautours, les canards, les pigeons et les étourneaux perçoivent différentes odeurs et les distinguent[8].
Les oiseaux peuvent utiliser les odeurs[8] pour :
- rechercher leur nourriture. Les urubus repèrent ainsi les charognes, et les pétrels les zones riches en plancton ;
- mémoriser et retrouver leur chemin, vers leur nid (vers le pigeonnier pour les pigeons voyageurs) ou tout autre endroit ;
- attirer de potentiels partenaires sexuels. Les étourneaux mâles et les mésanges bleues femelles, par exemple, incorporent à leurs nids des végétaux odorants.
Chez certaines espèces, les sécrétions de la glande uropygienne ont une odeur reconnaissable et différente d'un individu à l'autre, ce qui permet la reconnaissance individuelle et intervient peut-être dans l'attraction de partenaires potentiels. C'est notamment le cas de certains canards, de nombreux pétrels, des macareux et des huppes[8].
Mammifères non humains
L'odorat du chat est celui le plus développé des mammifères jusqu'à ce jour.
Applications
Des chiens ont été dressés avec succès pour repérer à l'odorat des gouttes de mercure par exemple piégées dans la moquette ou dans les fentes d'un plancher, des instruments contaminés, des puits, des égouts... Deux labradors ont ainsi en Suède pu aider à repérer 1,3 t de mercure collectées, dans les 1 000 écoles ayant participé au projet « Mercurius 98 »[9]. Aux États-Unis, un chien dressé a permis de récupérer 2 t de mercure dans les écoles du Minnesota[10].
Olfaction humaine
Importance
Chez l'être humain, l'individu est généralement naturellement capable de distinguer sa propre odeur, celle de son partenaire de couple et de certains de ses proches, et celles d'autres personnes[2], mais cette capacité peut être fortement dégradée par l'usage de désodorisant de parfums ou de certaines pratiques d'hygiène corporelle[2]. Le cerveau et d'autres organes (cœur) continuent à réagir à certains stimuli olfactifs durant le sommeil[11]. Au troisième jour, le nouveau-né se montre capable de réagir à l'odeur de sa mère, à celle du lait maternel (ou du lait artificiel s'il a commencé à être nourri avec ce lait précocement) ou de répondre par des mimiques différentes à une odeur agréable (vaniline) ou désagréable (acide butyrique)[12]. La plupart des études ayant comparé les capacités olfactives des hommes et des femmes ont conclu que les femmes sont plus douées que les hommes pour détecter les odeurs, les identifier, les discriminer et les mémoriser[3]. L'imagerie fonctionnelle et les études électrophysiologiques vont dans le même sens (quand des différences de sexe existent)[3]. Le cycle menstruel, la grossesse, la gonadectomie, et l'hormonothérapie substitutive influencent l'olfaction féminine. Bien que l'importance des phéromones soit discutée chez l'être humain, il semble exister une relation complexe entre hormones de la reproduction humaine et la fonction olfactive[3].
Certaines odeurs peuvent aussi aider à se concentrer sur une tâche difficile ; on a ainsi expérimentalement montré que la diffusion épisodique d'une odeur telle que celle de la menthe poivrée pouvait améliorer les résultats d'un exercice difficile impliquant une double tâche (Dual-task) complexe, mais n'améliorait pas les résultats à un test facile[13]. Chez de nombreux animaux, l'odorat est bien plus important que pour l'être humain[1]. Ainsi, les corridors biologiques (y compris aquatiques) sont-ils pour de nombreuses espèces des corridors de parfums et d'odeurs. Ils sont d'ailleurs surtout utilisés de nuit ou dans la pénombre le matin et le soir. Le goût, qui permet de détecter les substances chimiques en solution, est un sens proche de celui de l'odorat. Il n'existe d'ailleurs pas de distinction entre goût et odorat en milieu aquatique[14].
L'olfaction est plus active ou améliorée dans un air humide, chaud (ou « lourd »), car l'hygrométrie élevée permet aux molécules d'aérosols odorants de se conserver plus longtemps (ex. : parfums)[15].
Mécanisme

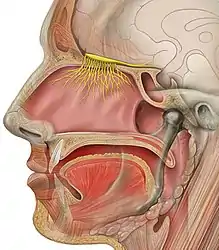
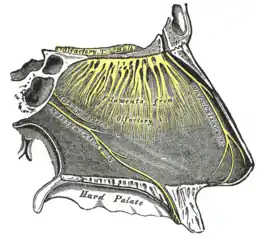
L’olfaction est la fonction sensorielle qui correspond à la perception des substances odorantes. Il s'agit généralement de la perception consciente, qui peut être sollicitée par voie directe (flairage) ou par voie rétro-nasale. Cette fonction est assurée par la muqueuse olfactive qui couvre environ 10 % soit 2 cm2 de la surface totale de la cavité nasale[14]. Des cellules glandulaires, présentes dans la muqueuse et dans la sous-muqueuse, sécrètent un mucus tapissant l'épithélium olfactif, ce qui assure un lavage permanent de la muqueuse.
Cette muqueuse olfactive est composée de neurones olfactifs primaires, bien plus sensibles que les gustatifs[14]. Ces neurones sont des neurones spécialisés bipolaires : ils présentent des cils à l'extrémité des dendrites qui baignent dans la couche de mucus tapissant la cavité nasale et qui aboutissent dans l'épithélium olfactif, un corps cellulaire situé dans le premier tiers de la muqueuse, et un axone communiquant avec le bulbe olfactif. Les neurones olfactifs, comme les neurones gustatifs, et contrairement aux autres neurones, se renouvèlent constamment tous les un ou deux mois[14]. Contrairement à ce qui se passe chez les rongeurs, les cellules nerveuses du bulbe olfactif humain ne se renouvellent pas ou très peu (moins de 1 % en 100 ans) (neurogenèse adulte)[16] - [17].
Les molécules odorantes arrivent soit directement par diffusion dans le mucus, soit sont prises en charge par des protéines de transport (odor binding protein ou OBP) qui permettent aux molécules hydrophobes — majoritaires — de pénétrer dans le mucus recouvrant l'épithélium, et ainsi d'atteindre les récepteurs membranaires présents sur les cils des neurones olfactifs. On pense que ces protéines de transports concentreraient les molécules odorantes sur les récepteurs membranaires. En tant que ligands, les molécules odorantes se fixent sur des récepteurs membranaires des cils ce qui déclenche une voie de transduction d'un stimulus faisant intervenir des protéines Golf (premier messager), l'enzyme adénylate cyclase, et l'AMPc (second messager). Le second messager provoque l'ouverture de canaux ioniques Ca2+/Na+ présents sur la membrane plasmique du récepteur olfactif, ces deux ions entrent alors dans la cellule. Le Ca2+ provoque l'ouverture d'un canal Cl−, la sortie de cet ion entraîne une dépolarisation de la membrane de sorte que le récepteur olfactif produit des potentiels d'action. Ces influx vont aller directement vers le bulbe olfactif, dans la région préfrontale du cerveau, où ces informations (et celles du goût) sont traitées par l'organisme.
Chaque type de récepteur olfactif (400 différents types de protéines de récepteurs olfactif sont répertoriées[18]) semble posséder une sensibilité particulière, qui recouvre partiellement, mais non totalement, celles des autres cellules. Cela signifie qu'une molécule définie active un ensemble unique de récepteurs (chacun de ces récepteurs répondant avec une intensité qui lui est propre). Les axones des neurones olfactifs portant le même récepteur convergent vers une même structure synaptique (glomérule) localisé au sein du bulbe olfactif. Cette activation « géographique » se traduit ensuite par un motif spatiotemporel nerveux particulier au sein du bulbe olfactif et interprétée comme une odeur par le cerveau.
Les millions d'odeurs détectables par l'humain sont chacune créées par une substance odorante structuralement distincte des autres. Pour être odorante, la substance doit avoir un poids moléculaire compris entre certaines valeurs et être volatile. Le mécanisme est encore assez mal connu, mais des progrès considérables ont été accomplis ces dernières années dans sa compréhension[19] à la suite de la découverte des gènes (plus de 1 000, soit 3 % des gènes humains[14]) qui codent les protéines réceptrices des odorants. Chaque neurone olfactif n'exprimant qu'un ou quelques-uns de ces gènes, de nombreux récepteurs olfactifs sont donc nécessaires. L'être humain est ainsi capable de percevoir des milliers voire des milliards de composés odorants grâce à un système de codage combinatoire reposant sur la sélectivité limitée des neurones récepteurs olfactifs (en). Ces neurones exprimant un même gène de récepteur olfactif transmettent tous leurs potentiels d'action à une même petite zone du bulbe olfactif[14]. Depuis qu'Homo sapiens existe, 60 % de ses gènes olfactifs ont été perdus par inactivation génique mais il lui en reste encore aujourd'hui 350 à 400 actifs[20].
L'odorat humain était considéré comme l'un des sens les moins développés[21]. Au XIXe siècle et jusque dans les années 1970, les neuroanatomistes qualifiaient l'homme de microsmate (faible développement des aires cérébrales associées à l'olfaction) du fait de son utilité moindre pour la survie (système olfactif vestigial, la bipédie ayant éloigné le nez du substrat terrestre), et l'opposaient aux espèces macrosmates (rongeurs, canidés)[22]. La littérature scientifique considérait qu'il pouvait détecter 10 000 odeurs différentes mais les études menées par des éthologues comme Karl von Frisch depuis les années 1970 ont montré que l'homme possède une discrimination qualitative des odeurs fine et multiple, s'effectuant sur des quantités infinitésimales[22]. Une étude en 2014 suggère qu'il peut percevoir plus d'un billion (1 000 milliards) d'odeurs[23]. Ainsi, l'olfaction reste d'une grande importance dans la détermination consciente ou inconsciente de nos comportements. Il existe, en pratique, deux seuils perceptifs. Le plus faible correspond à la détection d'une odeur, mais que le sujet ne peut identifier. Le second seuil correspond à l'identification de l'odeur en question. Certaines molécules, comme les thiols, se détectent à des taux beaucoup plus faibles que d'autres. Certains animaux sont capables de détecter des molécules un milliard de fois plus diluées que le seuil de notre odorat. Enfin, il existe une présomption que certaines molécules (hormones, phéromones) soient détectées par le système olfactif, même si leur perception ne se traduit pas en termes d'odeur « consciente ».
La perception d'une odeur résulte d'un stimulus très rapide, presque instantané, qui comporte plusieurs informations, parmi lesquelles l'intensité et la qualité de l'odeur[24]. Au niveau de l'intensité, notre odorat se comporte comme pour la notion de chaud et de froid. L'intensité du signal est importante au début de la perception puis baisse progressivement avec l'adaptation. Sur le plan qualitatif, notre odorat fonctionne comme pour la notion de goût. Nous pouvons reconnaître, apprécier et classer la qualité d'une odeur, en nous basant sur des réponses instinctives et culturelles. Et pour échanger des descriptions d'odeurs, il est possible d'apprendre le champ des Odeurs comme langage commun.
Bien qu'empruntant des voies nerveuses distinctes, l'odorat et le goût sont étroitement liés et une grande partie de ce qu'on attribue au goût dépend en fait de l'odorat. Ainsi, si l'organe olfactif est congestionné à cause d'un rhume, les sensations de goût s'en trouvent considérablement réduites.
Aspects quantiques du mécanisme de l'odorat
Certains mécanismes de type clé (molécule odorante) - serrure (récepteur) sont connus et admis[25] mais, ils sont incomplètement compris, tout comme pour d'autres domaines impliquant des phénomènes de reconnaissance ligands-protéines ; ils ne suffisent pas à expliquer la performance et la rapidité de la réponse olfactive[26] (par exemple le mécanisme de l'olfaction ne semble pas altérer la composition chimique de la molécule odorante et la physique et la chimie classiques expliquent mal ce qui au sein d'un composant odorant active réellement le récepteur)[27].
Des effets quantiques semblent pouvoir expliquer (au moins en partie) l'efficience et la rapidité de l'olfaction (comme ils semblent aussi jouer un rôle clé dans les processus enzymatiques et de magnétodétection)[27]. Malcolm Dyson en 1938[28] puis Wright en 1977[29] ont d’abord posé l'hypothèse que les vibrations moléculaires de la molécule odorante sont ce qui est détecté par le récepteur (lequel pourrait ensuite par exemple transformer d’une certaine manière les variations thermiques d'un produit odorant en signal compris par le cerveau), mais cette hypothèse posait la question de savoir comment le récepteur pourrait distinguer une fluctuation particulière alors que dans les cellules et tout organisme vivant tout fluctue thermiquement en permanence.
En 1996, Luca Turin suggère que le récepteur détecte non pas les fluctuations thermiques, mais les vibrations mécaniques quantiques de la substance odorante[30], un processus de ce type avait déjà été observé en 1968 comme moyen de transduction d'une signalisation par Lambe et Jaklevik[31] qui avaient mis en évidence un « tunnellisation inélastique d'électrons » (IET) capable d'encoder des informations sur l'énergie moléculaire (vibrations quantifiées ou phonons) dans le courant résultant (une tunnelisation inélastique correspond à une transition se faisant sans perte d'énergie pour l'électron qui traverse une barrière isolante (via l'effet tunnel), alors qu'il perd de l'énergie dans le cas de la transition élastique, cas de figure largement dominant)[27]. Un effet biologique de ce type est possible dans les récepteurs du nez ; la règle d'or de Fermi vaut pour un transfert d'électrons, l'odorant n'ayant alors qu'une présence faiblement perturbatrice ; la cellule réceptrice ne sentirait pas cet odorant, mais en quelque sorte l'entendrait (via des phonons, non pas par un système de type tympanique, mais par un système d'interactions se déroulant à l'échelle atomique, relevant de la physique quantique et/ou de la chimie quantique[32]. Il suffirait que l'agent odorant frôle le site de liaison du GPCR (barrière isolante), qu'il s'y fixe brièvement via un système donneur/accepteur d'électrons, permettant un transfert d'un électron (causé par l'effet perturbateur de la simple présence de l'odorant). Si le transfert d'électron est inélastique, il est discriminatoire et la molécule odorante peut être identifiée par son excitation phonon[27]. Ce modèle est compatible avec la reconnaissance de molécules chirales par l'olfaction[33] - [34].
Tester cette hypothèse est théoriquement assez facile, grâce au fait qu'une vibration moléculaire change en cas de substitutions isotopiques. En effet l'isotope a une taille/masse qui varie légèrement, ce qui implique un changement vibratoire (sans modifier aucune autre propriété physique si l'isotope n'est pas également aussi radio-actif). La substitution d'un seul atome de l'odorant par l'un de ses isotopes (atome d'oxygène ou d'hydrogène par exemple, remplacé par l'un de leurs isotopes) doit alors changer l'odeur perçue par le sujet qui inhale l'odorant... différence qui pourrait difficilement être expliquée par les hypothèses non-quantiques).
La perception humaine des odeurs est cependant modulée par des facteurs subjectifs et culturels pouvant compliquer l'expérimentation. De plus les premières expérimentations ont donné des résultats penchant tantôt dans un sens, tantôt dans l'autre :
- en 1996, Haffenden et al. ont montré que notre odorat discrimine le benzaldéhyde du benzaldéhyde-d6[35] ;
- en 2004, Keller & Voshall concluent par contre que notre nez ne discrimine pas l'acétophénone et l'acétophénone d-8[36] ;
- en 2013, cette dernière étude est contestée : ces isotopes sont en réalité bien différenciés par le nez humain quand la pureté des odorants a préalablement été vérifiée par chromatographie en phase gazeuse[37] ;
- puis des études comportementales sur modèle animal : mouche à fruits (Drosophila melanogaster[38] et abeille domestique (Apis mellifera)[39] ont clairement montré que ces insectes sont bien capables de distinguer les odorants isotopiquement substitués, mais il s'agit de modèles éloignés de l'Homme, et le mécanisme moléculaire de cette différentiation n'a pas été expliqué ;
- en 2015 des doutes ont été à nouveau soulevés par Zhuang et al. qui ont testé l'un des quelque 390 types connus de récepteurs olfactifs humains : «OR5AN1», connu comme « reconnaissant le musc ». Ils l'ont testé par les moyens de la biologie moléculaire in vitro en l'exposant à de la muscone (deutérée et non-deutérée). Pour éliminer tout processus subjectif, et tout risque de périréception et de post-reception, ils ont directement sondé le processus d'activation de ce récepteur. Les auteurs ont conclu que pour plusieurs odorants musqués les courbes dose-réponse ne montraient aucune différenciation entre les formes isotopiques des substances odorantes ayant une signification statistique[40] ;
- en 2017, Jennifer C. Brookes note dans un article de type Review que l'étude de Zhuang & al. (évoquée ci-dessus) n'a testé qu'un seul récepteur (sensible au musc) et en postulant que seules les vibrations C−H sont des signatures des spectres olfactifs. Or, selon Brookes (2017) au vu du corpus théorique disponible en 2007[32], il semblerait préférable de tester les modes vibrationnels tels que C=O en remplaçant l'Oxygène par un oxygène isotopique, ce qui impliquerait a priori des changements de forces plus significatifs, plus susceptibles de favoriser des effets tunnel pour les électrons. Il est possible, et même probable, toujours selon Brookes (2017) que les tests ciblant la deutération du couple C–H ont porté sur un mode de vibration qui n'est pas celui utilisé par les récepteurs odorants (la deutération avait été explorée par Lin & Besohn en 1968)[41].
Modulation
Comme les autres sens, l'odorat peut être exacerbé par l'attention. Son intensité dépend aussi du rythme circadien[42]. Il a ainsi été montré chez le rat de laboratoire que la performance de la réponse neuronale à une odeur varie selon l'heure[43] - [42]. Ainsi, chez le rat, une odeur réputée biologiquement neutre (huile de bois de cèdre, ou huile minérale) est un stimulus odorant mieux perçu en période de nuit subjective par l'odorat du rat que de jour subjectif, de même pour une odeur biologiquement pertinente (alarme) telle que celle de l'urine du renard roux, l'un des principaux prédateurs potentiels du rat[42].
Développement
Dans les années 1960, des recherches menées par le professeur Lipsitt ont permis de démontrer qu'il existe des capacités de détection et d'apprentissage des odeurs chez le nouveau-né. Même in utero, le système olfactif du fœtus est un des premiers sens à se mettre en place entre 11 et 15 semaines[44].
L'exposition du fœtus aux substances odorantes transportées par le liquide amniotique lui donne une première expérience olfactive qui est susceptible d'influencer ses préférences après la naissance[45].
Éléments anatomiques
Au niveau anatomique, le système olfactif est composé de deux structures, le système olfactif principal dont la stimulation induit les sensations d'odeur et le système trigéminal qui induit des sensations somatosensorielles (tactile, thermique, douleur, humidité)[46]. Il existe une troisième partie appelée « organe voméronasal », qui est situé en retrait dans l'orifice des narines. Chez l'homme, l'organe voméronasal reste dans un état rudimentaire car ses afférences nerveuses disparaissent dès la 18e semaine de la vie embryonnaire. Il ne semble pas fonctionnel, mais son implication dans la détection de phéromones fait l’objet d’un vif débat (Giorgi et al., 2000 ; Foltan et Sedy, 2009 ; Mast et Samuelsen, 2009). Chez de nombreuses espèces de vertébrés cet organe sensoriel est lié à la perception des phéromones pour sa reproduction ou le marquage de son territoire par exemple.
Troubles de l'odorat
Les troubles de l'odorat sont appelés dysosmies.
Anosmie et hyposmie
La perte de l'odorat est appelée anosmie, sa diminution substantielle est appelée hyposmie. Elle est le plus souvent due à des traumatismes, à certaines intoxications (saturnisme chronique par exemple pour les personnes âgées[47]) ou à un virus (SARS-CoV-2, responsable de la COVID-19)[48] - [49] ou à des infections mal soignées (rhinite aiguë[50]…), mais peut aussi être d'origine génétique ou congénitale ou faire suite à la prise de certains médicaments[51].
L'anosmie peut concerner toutes les odeurs ou seulement certaines d'entre elles (anosmies spécifiques). Elle est souvent accompagnée d'agueusie (son équivalent lié au goût), quoique cette diminution du goût soit constatée chez les gens ayant perdu l'odorat tardivement. Une perte d'odorat signale parfois que les sinus sont bouchés, notamment dans la maladie polypose naso-sinusienne.
L'anosmie est l'un des signes précurseurs de maladies neurodégénératives, telle la maladie d'Alzheimer ou la maladie de Parkinson, ou d'autres problèmes différents des pertes sensorielles « normales », liées au vieillissement[52]. Il a d'ailleurs été constaté, chez des souris de laboratoires modifiées pour produire naturellement des plaques amyloïdes, reproduisant ainsi ce qu'on observe chez l'homme dans le cas de maladie d'Alzheimer, que la première partie touchée par la dégénérescence du cerveau est celle qui est responsable de l'odorat de la souris (située entre le centre du cerveau et le museau)[52]. Les premiers symptômes sont une chute rapide et sensible de l'olfaction, détectés dès les premières plaques, vers 3 mois (chez la souris modifiée)[52]. Un test olfactif pourrait donc être une des alternatives aux méthodes plus coûteuses (scanner, etc.) de diagnostic précoce de la maladie d'Alzheimer »[52].
La perte d'odorat a des effets variés sur les gens qui en sont atteints : elle induit souvent une période de forte dépression, accompagnée de symptômes divers, dont un amoindrissement de l'appétit et de la libido et de l'excitation sexuelle notamment. Quand elle est sévère elle est associée à un risque accru d'accident domestique[53]
Un test efficace quels que soient l'âge et la culture du patient et n'impliquant pas les capacités de mémoire est basé sur l'inhalation de parfums très désagréables : Une personne normale bloque (par réflexe) sa respiration dès le début de l'inhalation, alors qu'un déficient olfactif inhalera plus longtemps avant de détecter l'odeur ou ne la détectera pas[54].
Hyperosmie
L'hyperosmie est une augmentation de la capacité olfactive, par exemple avoir la capacité d'identifier la dernière personne à avoir quitté une chaise grâce à son odeur. On retrouve ce symptôme chez les personnes atteintes d'algie vasculaire de la face, de migraines, ou d'insuffisance surrénalienne chronique primaire.
Cacosmie
Trouble de l'odorat qui amène les patients à aimer ou percevoir des odeurs fétides, putrides ou réputées désagréables. La cacosmie peut avoir une origine physiologique (rhinite, sinusite, tumorale) ou psychologique. Souvent confondu avec la cacostomie qui désigne l'exhalaison d'odeurs désagréables. Celles-ci proviennent de troubles fonctionnels (de la bouche ou du système digestif).
Parosmie
La parosmie est une distorsion d'une odeur vers une autre odeur, généralement désagréable.
Phantosmie
La phantosmie (ou fantosmie) est une odeur fantôme qui survient sans qu'une source d'odeur soit présente. Elle peut être agréable ou désagréable.
Utilisations particulières
En France, des opérations « Nez de Cléopâtre » demandant à des citoyens de noter leurs sensations olfactives à la fenêtre ou au balcon une fois par jour, ont permis de mieux suivre le trajet de certaines pollutions dans des villes industrielles (par exemple Calais), en cartographiant ces données, croisées avec celles de la météo[55].
Bioinspiration : Des chercheurs tentent de s'inspirer de l'olfaction animale pour développer un nez artificiel[56].
Notes et références
- Mark J.T. Sergeant (2010), Chapter Two – Female Perception of Male Body Odor ; Vitamins & Hormones ; Pheromones, Volume 83, 2010, Pages 25–45 (Résumé).
- Margret Schleidt, « Personal odor and nonverbal communication Original », Ethology and Sociobiology, vol. 1, no 3, , p. 225-231 (résumé)
- Richard L. Doty et E. Leslie Cameron, « Sex differences and reproductive hormone influences on human odor perception », Physiology & Behavior, vol. 97, no 2, , p. 213-228 (lire en ligne)
- Sex differences in physiology and behavior: focus on central actions of ovarian hormones, Edited By Kathleen Curtis and Eric Krause Physiology & Behavior, Volume 97, Issue 2, 25 May 2009, Pages 213–228 (résumé).
- C. Chrea, D. Valentin, C. Sulmont-Rossé, H. Ly Mai, D. Hoang Nguyen, H. Abdi (2004), Culture and odor categorization: agreement between cultures depends upon the odors ; Food Quality and Preference, Volume 15, Issues 7–8, October–December 2004, Pages 669-679 (résumé).
- Grigorij Krejdlin, « Le langage du corps et la gestuelle (kinésique) comme champs de la sémiotique non-verbale : idées et résultats », Cahiers slaves, no 9, , p. 5 (lire en ligne)
- Benoit Grison, « L'épineuse question du flair des oiseaux », Pour la science, hors-série no 119, , p. 100-106.
- Francesco Bonadonna et Marcel Lambrechts, « L'odorat des oiseaux », Pour la science, dossier no 34, (lire en ligne, consulté le ).
- SWEDEN: mercury sniffer dogs clean up Swedish schools (Article du , consulté le ).
- OCDE ; Politiques de l'environnement : quelles combinaisons d'instruments ? ; 2007 ;.
- Pietro Badia, Nancy Wesensten, William Lammers, Joel Culpepper et John Harsh (1990), Responsiveness to olfactory stimuli presented in sleep ; Physiology & Behavior Volume 48, Issue 1, July 1990, Pages 87–90 (résumé).
- Robert Soussignan, Benoist Schaal, Luc Marlier et Tao Jiang, « Facial and Autonomic Responses to Biological and Artificial Olfactory Stimuli in Human Neonates: Re-Examining Early Hedonic Discrimination of Odors », Physiology & Behavior, vol. 62, no 4, , p. 745–758 (résumé)
- (en) Cristy Ho et Charles Spence, « Olfactory facilitation of dual-task performance », Neuroscience Letters, vol. 389, no 1, , p. 35–40 (lire en ligne)
- Neil Campbell, Jane Reece, Biologie, 7e édition, 2007, (ISBN 978-2-7440-7223-9), p. 1147-1149.
- Bouchard N (2013) Le théâtre de la mémoire olfactive: le pouvoir des odeurs à modeler notre perception spatiotemporelle de l'environnement ; Mémoire en vue de l'obtention du M.Sc. Aménagement - - Université de Montréal
- (en) (en) Bergmann O, Liebl J, Bernard S, Alkass K, Yeung MS, Steier P, Kutschera W, Johnson L, Landén M, Druid H, Spalding KL et Frisén J., « The age of olfactory bulb neurons in humans », Neuron, vol. 74, no 4, , p. 634-639 (PMID 22632721, DOI 10.1016/j.neuron.2012.03.030, lire en ligne [PDF], consulté le ).
- BE Autriche numéro 146 (6/08/2012), « Les cellules nerveuses du bulbe olfactif ne se renouvellent pas », Ambassade de France en Autriche / ADIT, (consulté le ).
- Dale Purves, Neurosciences, De Boeck Supérieur, , p. 57.
- Voir par exemple les travaux de Richard Axel, de la Columbia University, et Linda Buck, du Fred Hutchinson Cancer Research, qui ont reçu un Nobel pour leur travaux sur les gènes et les récepteurs intervenant dans l'odorat.
- Peter H. Raven, Georges B. Johnson, Kenneth A. Mason, Jonathan B. Losos, Susan S. Singer, Biologie, De Boeck Supérieur, , p. 482.
- L'œil humain peut percevoir de 2,5 à 7,5 millions de couleurs différente, l'oreille 340 000 sons. Cependant, l'épithélium olfactif contient plus de 400 récepteurs olfactifs (en) différents codés par 400 gènes, soit plus que les récepteurs des autres sens, ce qui montre la très haute sensibilité de l'odorat, l'immense espace des odorants, et la discrimination très fine. Cf (en) Nak-Eon Choi, Jung H. Han, How Flavor Works : The Science of Taste and Aroma, John Wiley & Sons, (lire en ligne), p. 3.
- Jean-Louis Millot, Le discret pouvoir des odeurs, L'Harmattan, , p. 23
- (en) C. Bushdid, M. O. Magnasco, L. B. Vosshall, A. Keller, « Humans Can Discriminate More than 1 Trillion Olfactory Stimuli », Science, vol. 343, no 6177, , p. 1370-1372 (DOI 10.1126/science.1249168).
- « Placeholder - Antagonist », sur innovalor.com (consulté le ).
- Buck L. (1991) A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cells 65, 175–187|URL=https://www.cell.com/cell/pdf/0092-8674(91)90418-X.pdf?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2F009286749190418X%3Fshowall%3Dtrue
- (en) C. S. Sell, « On the Unpredictability of Odor », Angewandte Chemie International Edition, vol. 45, no 38, , p. 6254–6261 (ISSN 1433-7851 et 1521-3773, DOI 10.1002/anie.200600782, lire en ligne, consulté le )
- Jennifer C. Brookes, « Quantum effects in biology: golden rule in enzymes, olfaction, photosynthesis and magnetodetection », Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences, vol. 473, no 2201, , p. 20160822 (DOI 10.1098/rspa.2016.0822, lire en ligne, consulté le )
- (en) G. Malcolm Dyson, « The scientific basis of odour », Journal of the Society of Chemical Industry, vol. 57, no 28, , p. 647–651 (DOI 10.1002/jctb.5000572802, lire en ligne, consulté le )
- (en) R.H. Wright, « Odor and molecular vibration: Neural coding of olfactory information », Journal of Theoretical Biology, vol. 64, no 3, , p. 473–502 (DOI 10.1016/0022-5193(77)90283-1, lire en ligne, consulté le )
- (en) Luca Turin, « A Spectroscopic Mechanism for Primary Olfactory Reception », Chemical Senses, vol. 21, no 6, , p. 773–791 (ISSN 0379-864X et 1464-3553, DOI 10.1093/chemse/21.6.773, lire en ligne, consulté le )
- (en) J. Lambe et R. C. Jaklevic, « Molecular Vibration Spectra by Inelastic Electron Tunneling », Physical Review, vol. 165, no 3, , p. 821–832 (ISSN 0031-899X, DOI 10.1103/PhysRev.165.821, lire en ligne, consulté le )
- (en) Jennifer C. Brookes, Filio Hartoutsiou, A. P. Horsfield et A. M. Stoneham, « Could Humans Recognize Odor by Phonon Assisted Tunneling? », Physical Review Letters, vol. 98, no 3, , p. 038101 (ISSN 0031-9007 et 1079-7114, DOI 10.1103/PhysRevLett.98.038101, lire en ligne, consulté le )
- (en) Arash Tirandaz, Farhad Taher Ghahramani et Afshin Shafiee, « Dissipative vibrational model for chiral recognition in olfaction », Physical Review E, vol. 92, no 3, , p. 032724 (ISSN 1539-3755 et 1550-2376, DOI 10.1103/PhysRevE.92.032724, lire en ligne, consulté le )
- (en) Yoshiki Takai et Kazushige Touhara, « Enantioselective recognition of menthol by mouse odorant receptors », Bioscience, Biotechnology, and Biochemistry, vol. 79, no 12, , p. 1980–1986 (ISSN 0916-8451 et 1347-6947, DOI 10.1080/09168451.2015.1069697, lire en ligne, consulté le )
- (en) L.J.W Haffenden, V.A Yaylayan et J Fortin, « Investigation of vibrational theory of olfaction with variously labelled benzaldehydes », Food Chemistry, vol. 73, no 1, , p. 67–72 (DOI 10.1016/S0308-8146(00)00287-9, lire en ligne, consulté le )
- (en) Andreas Keller et Leslie B Vosshall, « A psychophysical test of the vibration theory of olfaction », Nature Neuroscience, vol. 7, no 4, , p. 337–338 (ISSN 1097-6256 et 1546-1726, DOI 10.1038/nn1215, lire en ligne, consulté le )
- (en) Simon Gane, Dimitris Georganakis, Klio Maniati et Manolis Vamvakias, « Molecular Vibration-Sensing Component in Human Olfaction », PLoS ONE, vol. 8, no 1, , e55780 (ISSN 1932-6203, PMID 23372854, PMCID PMC3555824, DOI 10.1371/journal.pone.0055780, lire en ligne, consulté le )
- (en) Maria Isabel Franco, Luca Turin, Andreas Mershin et Efthimios M. C. Skoulakis, « Molecular vibration-sensing component in Drosophila melanogaster olfaction », Proceedings of the National Academy of Sciences, vol. 108, no 9, , p. 3797–3802 (ISSN 0027-8424 et 1091-6490, PMID 21321219, PMCID PMC3048096, DOI 10.1073/pnas.1012293108, lire en ligne, consulté le )
- (en) Wulfila Gronenberg, Ajay Raikhelkar, Eric Abshire et Jennifer Stevens, « Honeybees ( Apis mellifera ) learn to discriminate the smell of organic compounds from their respective deuterated isotopomers », Proceedings of the Royal Society B: Biological Sciences, vol. 281, no 1778, , p. 20133089 (ISSN 0962-8452 et 1471-2954, PMID 24452031, PMCID PMC3906951, DOI 10.1098/rspb.2013.3089, lire en ligne, consulté le )
- (en) Eric Block, Seogjoo Jang, Hiroaki Matsunami et Sivakumar Sekharan, « Implausibility of the vibrational theory of olfaction », Proceedings of the National Academy of Sciences, vol. 112, no 21, , E2766–E2774 (ISSN 0027-8424 et 1091-6490, PMID 25901328, PMCID PMC4450420, DOI 10.1073/pnas.1503054112, lire en ligne, consulté le )
- (en) S. H. Lin et R. Bersohn, « Effect of Partial Deuteration and Temperature on Triplet‐State Lifetimes », The Journal of Chemical Physics, vol. 48, no 6, 15 mars 1968 (mis en ligne le 05 septembre 2003), p. 2732–2736 (ISSN 0021-9606 et 1089-7690, DOI 10.1063/1.1669507, lire en ligne, consulté le )
- Doug Funk & Shimon Amir (2000), Circadian modulation of Fos responses to odor of the red fox, a rodent predator, in the rat olfactory system ; Brain Research Volume 866, Issues 1–2, 2 June 2000, Pages 262–267 (résumé).
- Shimon Amir, Sean Cain, Jonathan Sullivan, Barry Robinson, Jane Stewart (1999), In rats, odor-induced Fos in the olfactory pathways depends on the phase of the circadian clock ; Neuroscience Letters Volume 272, Issue 3, 17 September 1999, Pages 175–178 (résumé).
- Ref : Smotherman, W. P. and Robinson, S. R.(1995). Tracing Developmental Trajectories Into the Prenatal Period. In: Fetal Development, J-P. Lecanuet, W. P. Fifer, N. A. Krasnegor, and W. P. Smotherman (Eds.), p. 15-32. Hillsdale, NJ: Lawrence Erlbaum.
- Schaal, B., Orgeur, P., and Rognon, C. (1995). Odor Sensing in the Human Fetus: Anatomical, Functional, and Chemeo-ecological Bases. In: Fetal Development: A Psychobiological Perspective, J-P. Lecanuet, W. P. Fifer, N. A., Krasnegor, and W. P. Smotherman (Eds.) p. 205-237. Hillsdale, NJ: Lawrence Erlbaum Associates.
- (en) T. Metin Önerci, Nasal Physiology and Pathophysiology of Nasal Disorders, Springer Science & Business Media, , p. 118.
- Grashow R, Sparrow D, Hu H, Weisskopf MG (2015) Cumulative lead exposure is associated with reduced olfactory recognition performance in elderly men : The Normative Aging Study.. Neurotoxicology. Jul; 49:158-64. Epub 2015 Jun 26.|résumé
- Reinhard A, Ikonomidis C, Broome M et Gorostidi F., « Anosmie et COVID-19 » [« Anosmia and COVID-19 »], Rev Med Suisse., vol. 16, nos 691-2, , p. 849-851 (PMID 32348051, lire en ligne [EPUB], consulté le )

- (en) Lao WP, Imam SA et Nguyen SA, « Anosmia, hyposmia, and dysgeusia as indicators for positive SARS-CoV-2 infection. », World J Otorhinolaryngol Head Neck Surg., vol. in press, (PMID 32313712, PMCID 7164874, DOI 10.1016/j.wjorl.2020.04.001, lire en ligne [EPUB], consulté le )

- Faulcon, P., Portier, F., Biacabe, B., & Bonfils, P. (1999). Anosmie secondaire à une rhinite aiguë: sémiologie et évolution à propos d'une série de 118 patients. In Annales d'oto-laryngologie et de chirurgie cervico-faciale (vol. 116, no 6, p. 351-357). Elsevier Masson.
- Norès, J. M., Biacabe, B., & Bonfils, P. (2000). Troubles olfactifs d’origine médicamenteuse: analyse et revue de la littérature. La Revue de médecine interne, 21(11), 972-977|résumé.
- NYU Langone Medical Center / New York University School of Medicine (). /releases/2010/01/100112171803.htm Loss of smell function may predict early onset of Alzheimer's disease. ScienceDaily. Consulté le .
- Bonfils P, Faulcon P, Tavernier L, Bonfils N.A & Malinvaud D (2008) Accidents domestiques chez 57 patients ayant une perte sévère de l’odorat. La Presse Medicale, 37(5), 742-745
- University of Cincinnati (). /releases/2007/04/070402153233.htm Get A Whiff Of This: Smell Test Could Sniff Out Serious Health Problems. ScienceDaily. Consulté le .
- 1992 : Réalisation d’une campagne d’évaluation de la gêne due aux odeurs sur le Littoral Calais - Dunkerque : « le nez de Cléopâtre ». Voir Fiche du CERDD, avec le SPPPI Cote d’Opale Flandres.
- Wang, P., Zhuang, L., Zou, Y., & Hsia, K. J. (2015). Future Trends of Bioinspired Smell and Taste Sensors. In Bioinspired Smell and Taste Sensors (p. 309-324). Springer Netherlands (résumé).
Voir aussi
Bibliographie
- Howes D (1986). Le sens sans parole: vers une anthropologie de l'odorat. Anthropologie et sociétés, 10(3), 29-45.
- Le Guérer A (1988), Les Pouvoirs de l'odeur, Paris, François Bourin, ; Odile Jacob, édition revue et augmentée, 2002, 320 p. (ISBN 978-2-7381-8085-8) (en ligne)
- André Holley, Éloge de l'odorat, Paris, Odile Jacob, coll. « Sciences », , 276 p. (ISBN 2-7381-0740-0, lire en ligne).
- Jaquet C (2010) Philosophie de l'odorat. Presses universitaires de France.
- Corbin A (2016). Le miasme et la jonquille: L'odorat et l'imaginaire social, XVIIe – XIXe siècles. Flammarion (lien google livre).
- Johannes Frasnelli (trad. de l'allemand par Louis Bouchard et Marie-Élisabeth Morf), Humer, flairer, sentir : Les pouvoirs insoupçonnés de l'odorat [« Wir riechen besser als wir denken »] [« Nous sentons mieux que nous ne le pensons »], MultiMondes, , 228 p. (ISBN 978-2-89773-258-5, 978-2-89773-259-2 et 978-2-89773-260-8)
Articles connexes
- Nez
- Nerf olfactif
- Odeur
- Arôme
- Flaveur
- parfum
- Pollution olfactive
- Olfactométrie (la mesure des odeurs)
- Classement thématique des neurosciences
- Phéromone
Liens externes
- Site pour les enseignants aux primaires sur le goût et l'odorat
- L'odorat et ses troubles, Site Olfaction, CNRS.
- Site du Centre de Recherche en Neurosciences de Lyon : Équipe CMO - Codage et Mémoire Olfactive et NEUROPOP - Neuroplasticité & Neuropathologie de la Perception Olfactive
- (en) ACS, Structure-Odor Relationships