Acétophénone
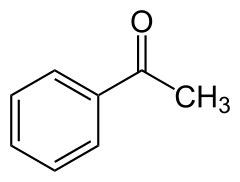
L'acétophénone est un composé organique de formule semi-développée C6H5COCH3. C'est la plus simple des phénones, les cétones aromatiques.
| Acétophénone | |
| |
| Identification | |
|---|---|
| Nom UICPA | phényléthanone |
| Synonymes |
1-phényléthanone |
| No CAS | |
| No ECHA | 100.002.462 |
| No CE | 202-708-7 |
| PubChem | 7410 |
| FEMA | 2009 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore ou cristaux blancs, d'odeur caractéristique[1] |
| Propriétés chimiques | |
| Formule | C8H8O [Isomères] |
| Masse molaire[2] | 120,148 5 ± 0,007 3 g/mol C 79,97 %, H 6,71 %, O 13,32 %, |
| Moment dipolaire | 3,02 ± 0,06 D [3] |
| Diamètre moléculaire | 0,610 nm [4] |
| Propriétés physiques | |
| T° fusion | 20 °C[1] |
| T° ébullition | 202 °C[1] |
| Solubilité | dans l'eau : faible[1] soluble dans l'éthanol, le diéthyléther, le benzène et le chloroforme[5] |
| Paramètre de solubilité δ | 21,7 MPa1/2 (25 °C)[6]; 20,8 J1/2·cm-3/2 (25 °C)[4] |
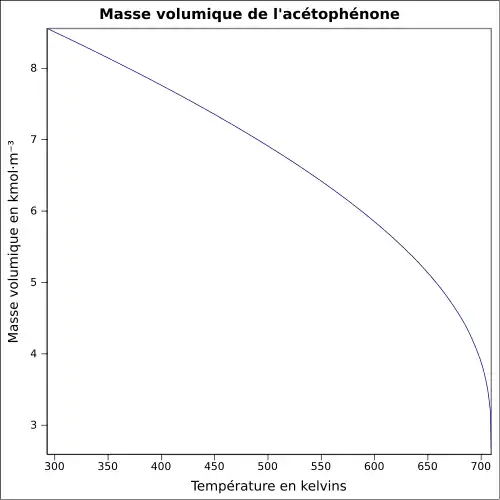
| Masse volumique | 1,03 g·cm-3[1]
|
| T° d'auto-inflammation | 571 °C[1] |
| Point d’éclair | 77 °C (coupelle fermée)[8] 82 °C (coupelle ouverte)[1] |
| Limites d’explosivité dans l’air | 1,1 vol.%, 55 g/m³, 70 °C[8] |
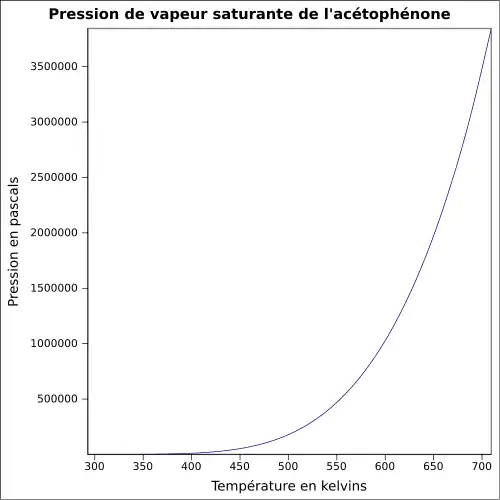
| Pression de vapeur saturante | 0,133 kPa à 15 °C : 0,133 kPa[1]
|
| Conductivité électrique | 3,1×10-7 S·m-1[9] - [8] |
| Thermochimie | |
| S0gaz, 1 bar | 372,88 J··mol−1·K−1[10] |
| ΔfH0gaz | −86,7 kJ·mol−1[11] |
| ΔfH0liquide | −142,5 kJ·mol−1[11] |
| ΔfusH° | 16,65 kJ·mol−1[12] |
| ΔvapH° | 43,63 kJ·mol−1[13] |
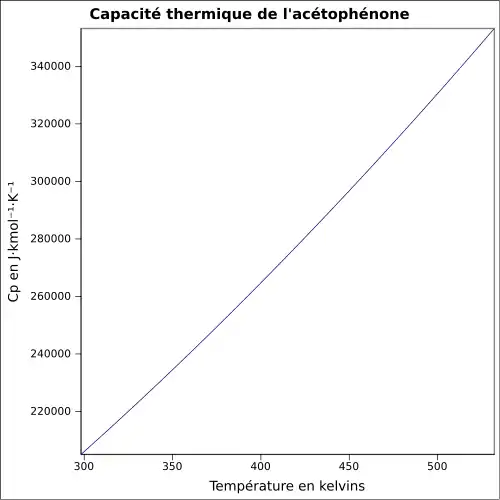
| Cp | |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P21/n [15] |
| Paramètres de maille | a = 10,256 Å b = 8,678 Å |
| Volume | 652,88 Å3 [15] |
| Propriétés optiques | |
| Indice de réfraction | 1,532 1 [4] 1,534 2 [16] |
| Précautions | |
| SGH[17] | |
 Attention |
|
| SIMDUT[18] | |
  B3, D2B, |
|
| NFPA 704 | |
| Écotoxicologie | |
| LogP | 1,58[1] |
| Seuil de l’odorat | bas : 0,17 ppm haut : 0,6 ppm[19] |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
L'acétophénone se présente sous la forme d'un liquide incolore à jaunâtre, dont l'odeur douce rappelle celle de la fleur d'oranger[5]. Sous pression normale, le composé bout à 202 °C. L'acétophénone forme un mélange azéotrope avec l'eau à 98 °C et une teneur en eau de 82 %[20]. Les vapeurs d'acétophénone forme avec l'air des mélanges inflammables à des températures plus élevées. Elle a un point d'éclair de 77 °C. Sa limite inférieure d'explosion est de 1,1 % en volume (55 g/m3), avec un point d'explosion inférieur à 70 °C[8]. Sa température d'auto-inflammation est de 535 °C[8] - [21], l'acétophénone appartient donc à la classe de température T1. Sa conductivité électrique est plutôt faible, à 3,1×10-7 S·m-1[8]
Occurrence
L'acétophénone est naturellement présente dans un grand nombre d'aliments, notamment la pomme, le fromage, l'abricot, la banane, la viande de bœuf et le chou-fleur. C'est un composant du castoréum, l'exsudat des sacs de ricin du castor adulte[22], ainsi que d'autres ingrédients et huiles essentielles utilises en parfumerie comme le labdanum ou Stirlingia latifolia. Elle est aussi présente dans le goudron de houille[5].
Synthèse
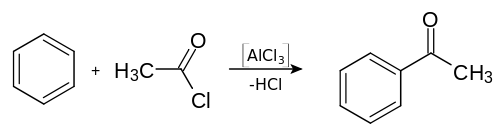
L'acétophénone a été découverte par Charles Friedel en 1857, lorsqu'il distilla un mélange d'acétate de chaux et de benzoate de chaux[23].
De nos jours, l'acétophénone s'obtient habituellement par une acylation de Friedel-Crafts du benzène avec de l'anhydride acétique ou encore avec le chlorure d'acétyle. Contrairement à ce qui se passe lors de l'alkylation de Friedel-Crafts, le chlorure d'aluminium (AlCl3) n'est pas utilisé comme catalyseur, mais est consommé comme un réactif à mettre en quantités stœchiométriques, qui, suite à l'hydrolyse du produit intermédiaire, conduit à la formation d'hydroxyde d'aluminium.
L'acétophénone est également un produit secondaire de l'oxydation de l'éthylbenzène en hydroperoxyde d'éthylbenzène. Ce dernier est un intermédiaire dans la production commerciale d'oxyde de propylène via le procédé de co-production oxyde de propylène - styrène[24]. L'hydroperoxyde d'éthylbenzène est principalement converti en 1-phényléthanol, mais le procédé produit aussi de petites quantités d'acétophénone. L'acetophénone est ensuite récupérée, ou hydrogénée en 1-phényléthanol qui est ensuite déshydraté pour produire du styrène[25].
Utilisations
Précurseur de résines
Des résines commercialement importantes peuvent être produites par le traitement de l'acétophénone par le formaldéhyde et une base. Les copolymères résultant de cette condensation aldolique sont généralement décrits par la formule [(C6H5COCH)x(CH2)x]n. Ces substances sont des composants de revêtements et d'encres. Des résines modifiées d'acétophénone-formaldéhyde sont produites par hydrogénationes des résines à cétones précédentes. Le polyol résultant peut ensuite être associé avec des diisocyanates[25]. Ces résines modifiées sont présentes dans des revêtements, des encres, et des adhésifs.
Usage de niche
L'acétophénone est un ingrédient dans certains parfums dont l'odeur rappelle l'amande, la cerise, le chèvrefeuille, le jasmin, ou la fraise. Elle est utilisée dans certains chewing-gums[26]. Elle fait partie des excipients approuvés par la FDA[27]. En outre, il peut être utilisé comme solvant à point d'ébullition élevé pour les peintures et les résines.
Réactif de laboratoire
Dans les laboratoires d'enseignement[28], l'acétophénone est convertie en styrène dans un processus à deux étapes pour illustrer la réduction des carbonyles en utilisant des hydrures et la déshydratation des alcools :
- 4 C6H5C(O)CH3 + NaBH4 + 4 H2O → 4 C6H5CH(OH)CH3 + NaOH + B(OH)3 → C6H5CH=CH2
Un procédé similaire 4 deux étapes est utilisés dans l'industrie, mais l'étape de réduction est produite par hydrogénation sur un catalyseur de cuivre[25] :
- C6H5C(O)CH3 + H2 → C6H5CH(OH)CH3
Du fait de sa prochiralité, l'acétophénone est aussi un substrat de test populaire pour les expériences d'hydrogénation asymétriques.
Composés pharmaceutiques
L'acétophénone est utilisée dans la synthèse de nombreux composés pharmaceutiques[29] - [30].
La réaction de Mannich de l'acétophénone avec la diméthylamine et le formaldéhyde donne la β-diméthylaminopropiophénone[31]. En utilisant la diéthylamine, on obtient l'analogue diéhylamino.
Précautions
L'acétophénone à l'état pur est nocive si elle est ingérée. Elle irrite les yeux et peut provoquer des dermatites si elle est appliquée sur une peau non protégée. Des gants appropriés doivent être portés comme protection contre les éclaboussures. À plus forte concentration, elle possède un effet hypnotique, d'où son le nom d'« hypnone » qui lui fut parfois donné. À une concentration de 80 ppm, les vapeurs produisent de forts symptômes d'empoisonnement après exposition pendant plus d'une heure. L'acétophénone est difficilement inflammable et peu volatile. Ses vapeurs sont beaucoup plus lourdes que l'air. De fortes réactions exothermiques peuvent se produire avec des agents oxydants puissants et des bases fortes. Au-delà de 300 °C, l'acétophénone se décompose, libérant notamment du benzène, du biphényle, du 1,4-diphénylbenzène, du monoxyde de carbone, du méthane, du dihydrogène, de l'éthylène ou du toluène.
Références
- (de)/(en) Cet article est partiellement ou en totalité issu des articles intitulés en allemand « Acetophenon » (voir la liste des auteurs) et en anglais « Acetophenone » (voir la liste des auteurs).
- ACETOPHENONE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (de) « Acetophenon », sur Römpp Online, Georg Thieme Verlag (consulté le )
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Entrée « Acetophenone » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 avril 2020 (JavaScript nécessaire)
- Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, (ISBN 978-3-86825-103-6).
- Stull D.R., Jr.: The Chemical Thermodynamics of Organic Compounds, Wiley, New York, 1969.
- Colomina, M.; Latorre, C.; Perez-Ossorio, R.: Heats of combustion of five alkyl phenyl ketones in Pure Appl. Chem. 2 (1961) 133–135.
- Luginin: Bull. Soc. Chim. Fr. 9 (1911) 223.
- Steele, W.V.; Chirico, R.D.; Knipmeyer, S.E.; Nguyen, A.: in J. Chem. Eng. Data 41 (1996) 1255–1268, DOI 10.1021/je9601117.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-859-4)
- « Acetophenone », sur www.reciprocalnet.org (consulté le )
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Acétophénone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Acetophenone », sur hazmap.nlm.nih.gov (consulté le )
- I.M. Smallwood: Handbook of organic solvent properties, Arnold London 1996, (ISBN 0-340-64578-4), S. 183–185.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- D. Müller-Schwarze et P. W. Houlihan, « Pheromonal activity of single castoreum constituents in beaver, Castor canadensis », Journal of Chemical Ecology, vol. 17, no 4, , p. 715–34 (PMID 24258917, DOI 10.1007/BF00994195)
- Pierre de Menten, Dictionnaire de chimie : Une approche étymologique et historique, De Boeck, , 395 p. (ISBN 978-2-8041-8175-8, lire en ligne), p.18
- « Archived copy » [archive du ] (consulté le )
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a15_077), « Ketones »
- George A. Burdock, Fenaroli's Handbook of Flavor Ingredients, CRC Press, (ISBN 0-8493-3034-3, lire en ligne [archive du ]), p. 15
- « Inactive Ingredient Search for Approved Drug Products » [archive du ]
- Samuel H. Wilen, Chester B. Kremer et Irving Waltcher, « Polystyrene—A multistep synthesis: For the undergraduate organic chemistry laboratory », J. Chem. Educ., vol. 38, no 6, , p. 304–305 (DOI 10.1021/ed038p304, Bibcode 1961JChEd..38..304W)
- Marshall Sittig, Pharmaceutical Manufacturing Encyclopedia, , 39,177 (ISBN 978-0-8155-1144-1)
- Kumar Gadamasetti et Tamim Braish, Process Chemistry in the Pharmaceutical Industry, Volume 2, , 142–145 p. (ISBN 978-0-8493-9051-7)
- Charles E. Maxwell, β-Dimethylaminopropiophenone Hydrochloride, Org. Synth. 23, coll. « vol. », , 30 p.