Chloroforme
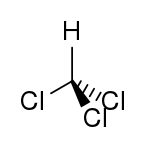
Le chloroforme ou trichlorométhane est un composé organochloré de formule brute CHCl3.
| Chloroforme | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | trichlorométhane | |
| No CAS | ||
| No ECHA | 100.000.603 | |
| No CE | 200-663-8 | |
| PubChem | 6212 | |
| ChEBI | 35255 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, volatil, d'odeur caractéristique[1] | |
| Propriétés chimiques | ||
| Formule | CHCl3 [Isomères] |
|
| Masse molaire[2] | 119,378 ± 0,007 g/mol C 10,06 %, H 0,84 %, Cl 89,09 %, |
|
| pKa | 15,5 à 25 °C[3] | |
| Moment dipolaire | 1,04 ± 0,02 D[4] | |
| Diamètre moléculaire | 0,502 nm[5] | |
| Propriétés physiques | ||
| T° fusion | −64 °C[1] | |
| T° ébullition | 62 °C[1] | |
| Solubilité | 10,62 g kg−1 d'eau à 0 °C 8,95 g kg−1 d'eau à 10 °C 8,22 g kg−1 d'eau à 20 °C 3,81 g kg−1 d'eau à 25 °C |
|
| Paramètre de solubilité δ | 19,0 MPa1/2 (25 °C)[6] ; 19,5 J1/2 cm−3/2 (25 °C)[5] |
|
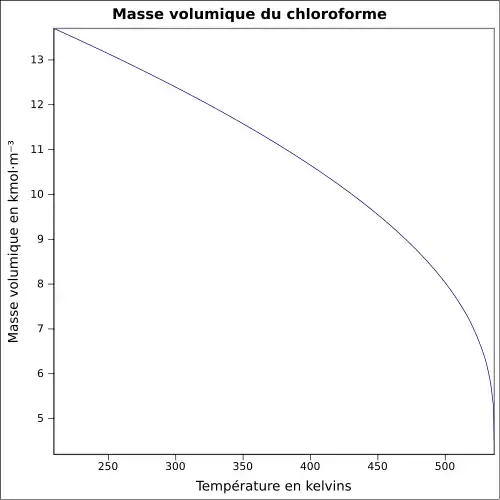
| Masse volumique | 1,489 2 g ml−1 à 20 °C (liquide) 1,479 8 g ml−1 à 25 °C (liquide) |
|
| T° d'auto-inflammation | ininflammable | |
| Point d’éclair | aucun | |
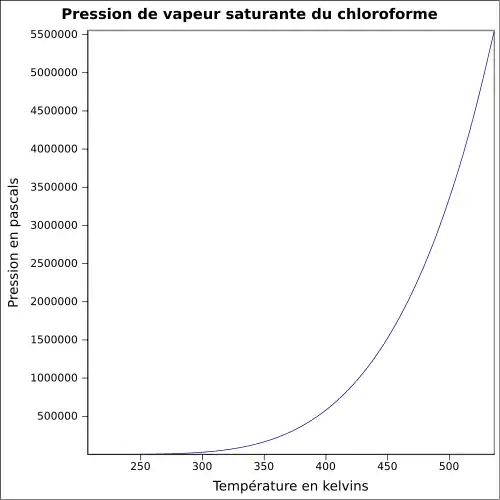
| Pression de vapeur saturante | à 20 °C : 21,2 kPa[1]
|
|
| Viscosité dynamique | 0,57 mPa s à 20 °C | |
| Point critique | 53,7 bar, 263,25 °C[8] | |
| Conductivité thermique | 0,145 4 W m−1 K−1 à 20 °C | |
| Vitesse du son | 987 m s−1 à 25 °C[9] | |
| Thermochimie | ||
| S0gaz, 1 bar | 295,61 J mol−1 K−1 | |
| ΔfH0gaz | −103,18 kJ mol−1 | |
| ΔfH0liquide | −134,3 kJ mol−1 | |
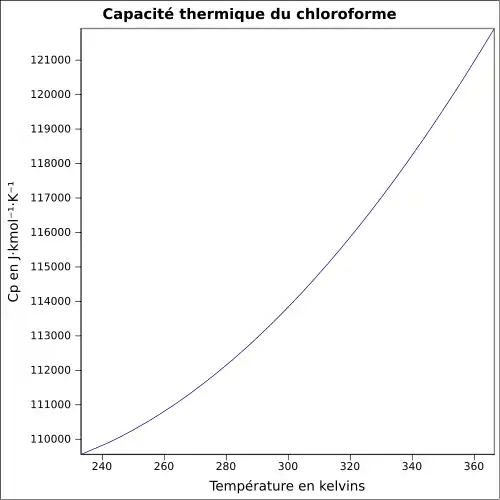
| Cp | 114,25 J mol−1 K−1 à 25 °C (liquide) |
|
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 11,37 ± 0,02 eV (gaz)[11] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,442[5] | |
| Précautions | ||
| SGH[12] | ||
  Danger |
||
| SIMDUT[13] | ||
 D1B, D2A, D2B, |
||
| NFPA 704 | ||
| Transport | ||
| Classification du CIRC | ||
| Groupe 2B : peut-être cancérigène pour l'homme[14] | ||
| Écotoxicologie | ||
| LogP | 1,97[1] | |
| Seuil de l’odorat | bas : 133 ppm haut : 276 ppm[15] |
|
| Composés apparentés | ||
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Fréquemment utilisé comme solvant, le chloroforme tend à être remplacé actuellement par le dichlorométhane, aux propriétés similaires mais moins toxique. Le chloroforme a autrefois été utilisé comme de l’anesthésique dans les blocs opératoires et comme conservateur pour la viande.
Histoire
Eugène Soubeiran (en France), Justus von Liebig (en Allemagne) et Samuel Guthrie (en Amérique) ont découvert en même temps le chloroforme, préparé pour la première fois en 1831. C'est à Édimbourg en 1847 que James Young Simpson utilise pour la première fois le chloroforme pour un accouchement, et le présente aux autres médecins. À l'époque, seul l'éther, qui présente de nombreux inconvénients, était utilisé et de nombreuses opérations se déroulaient sans anesthésie : le chloroforme est alors un grand progrès. Son usage comme anesthésiant décolle lors de la guerre de sécession, pour soigner les blessures sur le champ de bataille. La reine Victoria l'utilise en 1853 pour accoucher, ce qui rassure le grand public concernant l'utilisation du produit[16].
Propriétés physico-chimiques
Le chloroforme est un liquide hautement volatil. Toutefois les vapeurs de chloroforme ne forment pas de mélanges explosifs avec l'air.
Le chloroforme est un excellent solvant pour de nombreux matériaux organiques tels que graisses, huiles, résines et cires. Il est complètement miscible avec de nombreux solvants organiques et dissout le diiode et le soufre.
Le chloroforme forme de nombreux mélanges azéotropiques avec d'autres liquides tels que l'acétone, l'éthanol, l'eau et le méthanol.
Le chloroforme a une constante molale cryoscopique de 4,70 °C kg/mol et une constante molale ébullioscopique de 3,80 °C kg/mol.
Production et synthèse
La production de chloroforme est liée à celle d'autres composés organochlorés. En effet, le chloroforme est produit par chlorations successives du méthane ou de l'éthanol.
Un autre procédé utilise le méthanol comme réactif au lieu du méthane. Il s'agit d'un mélange de chloration/hydrochloration qui permet d'éviter la séparation de l'acide chlorhydrique du méthane lors du recyclage du réactif non utilisé.
Il peut être obtenu industriellement par réaction du fer et d'acide sur le tétrachlorométhane.
On peut aussi obtenir du chloroforme plus simplement en traitant l'acétone par le dichlore en présence d'une base. Il se forme par l'intermédiaire de la trichloracétone, substance que la base scinde facilement en chloroforme et en sel acétique :
- CH3COCH3 + 3Cl2 + 3KOH → CH3COCCl3 + 3KCl + 3H2O
- CH3COCCl3 + KOH → CH3COOK + CHCl3.
Néanmoins, cette dernière synthèse peut être assez dangereuse. En effet, il y a un risque de former du phosgène, un gaz très toxique voire mortel qui a été utilisé comme gaz de combat lors de la Première Guerre mondiale.
Sécurité

Au cours d'un stockage prolongé, en présence de dioxygène et sous l'action de la lumière, le chloroforme a tendance à se décomposer en donnant du chlorure d'hydrogène, du dichlore et de l'oxychlorure de carbone (phosgène) qui est un produit extrêmement toxique.
Absorbé ou inhalé à forte concentration, il peut conduire à un coma, voire entraîner des troubles respiratoires et cardiaques qui peuvent s'avérer mortels. Son utilisation en anesthésie a été abandonnée.
Dans la fiction
Dans diverses œuvres de fiction, le chloroforme est souvent employé par des criminels pour endormir leurs victimes. Une telle utilisation n'est pas crédible. En premier lieu parce que le chloroforme met plusieurs minutes, et non quelques secondes, avant de faire effet, ce qui laisse théoriquement le temps à la personne agressée de se débattre ou d'appeler à l'aide[17]. En outre, son effet n'est pas durable. Les anesthésistes qui l'utilisaient devaient régulièrement renouveler la dose pour maintenir leur patient inconscient.
Les rumeurs faisant état de malfaiteurs endormant leurs victimes avec du chloroforme caché dans un flacon de parfum dont ils aspergeraient leurs cibles n'ont pas plus de crédit. Le chloroforme est un gaz beaucoup trop volatil pour rester concentré dans l'air au point de faire perdre connaissance à quelqu'un[18].
Notes et références
- CHLOROFORME, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Chloroform », ChemicalBook.com.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 978-0-88415-858-5 et 978-0-88415-859-2).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- Fiche de sécurité Sigma-Aldrich (consultée le 28/09/2019).
- « Chloroforme » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérigènes pour l'homme », sur monographs.iarc.fr, CIRC, (consulté le ).
- « Chloroform », sur hazmap.nlm.nih.gov (consulté le ).
- Jake Rossen, « L’étrange histoire du chloroforme », sur Slate.fr, (consulté le ).
- « 7 faits violents qui n'ont rien à voir avec les films : mines, drogues, chloroforme… », sur hitek.fr (consulté le ).
- « Désintox. Agression au chloroforme par de faux vendeurs de parfums : une intox très ancienne », sur francetvinfo.fr, (consulté le ).
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- (en) International Union of Pharmacology
- (en) Medical Subject Headings
- (en) National Drug File
- (no + nn + nb) Store medisinske leksikon
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) Données physiques
- Informations toxicologiques [PDF], sur le site de l'INRS
- (en) ChemSub Online: Chloroforme
Bibliographie
- (en) O’Doherty, S. et al. (2001), In situ chloroform measurements at Advanced Global Atmospheric Gases Experiment atmospheric research stations from 1994 to 1998, J. Geophys. Res., 106, 20429–20444.