Chloral
Le chloral, également appelé trichloroacétaldéhyde et trichloroéthanal, est un composé organique de formule chimique Cl3CCHO. Cet aldéhyde se présente sous la forme d'un liquide incolore huileux à l'odeur piquante soluble dans une large gamme de solvants. Il réagit avec l'eau pour former de l'hydrate de chloral, autrefois très utilisé comme sédatif et hypnotique.
| Chloral | |
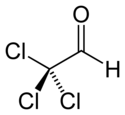
| |
| Structure du chloral | |
| Identification | |
|---|---|
| Nom UICPA | 2,2,2-trichloroacétaldéhyde |
| No CAS | |
| No ECHA | 100.000.829 |
| No CE | 200-911-5 |
| PubChem | 6407 |
| SMILES | |
| InChI | |
| Apparence | liquide huileux incolore à l'odeur piquante[1] |
| Propriétés chimiques | |
| Formule | C2HCl3O [Isomères] |
| Masse molaire[2] | 147,388 ± 0,008 g/mol C 16,3 %, H 0,68 %, Cl 72,16 %, O 10,86 %, |
| Propriétés physiques | |
| T° fusion | −57,5 °C[1] |
| T° ébullition | 97,8 °C[1] |
| Solubilité | soluble dans l'eau en formant de l'hydrate de chloral |
| Masse volumique | 1,51 g·cm-3[1] à 20 °C |
| Pression de vapeur saturante | 5,2 kPa[1] à 20 °C |
| Précautions | |
| SGH[1] | |
 Danger |
|
| Transport[1] | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[3] | |
| Écotoxicologie | |
| DL50 | 0,44 mg·kg-1[1] (souris, inhalation) |
| Unités du SI et CNTP, sauf indication contraire. | |
Production
Il est produit industriellement par chloration de l'acétaldéhyde en présence d'acide chlorhydrique, ce qui donne de l'hydrate de chloral. L'éthanol peut également être utilisé comme point de départ. Cette réaction est catalysée par le trichlorure d'antimoine :
L'hydrate de chloral est distillé du mélange de réaction. Le distillat est ensuite déshydraté avec de l'acide sulfurique concentré, après quoi la couche d'acide plus dense, qui contient l'eau, est éliminée :
- Cl3CCH(OH)2 → Cl3CCHO + H2O.
Le produit résultant est purifié par distillation fractionnée[4]. De faibles quantités d'hydrate de chloral sont présents dans l'eau chlorée.
Réactions
Le chloral tend à former des adduits avec l'eau et les alcools. C'est un précurseur du DDT lorsqu'on le fait réagir avec du chlorobenzène en présence d'acide sulfurique comme catalyseur :
- Cl3CCHO + 2 C6H5Cl → Cl3CCH(C6H4Cl)2 + H2O.
Cette réaction a été décrite par Othmar Zeidler (en) en 1874. Le méthoxychlore, dont la structure est très proche de celle du DDT, est également produit à partir du chloral.
L'action d'hydroxyde de sodium sur le chloral donne du chloroforme CHCl3 et le formiate de sodium HCOONa :
Le chloral est facilement réduit en trichloréthanol CCl3CH2OH, qui se forme dans le corps humain par métabolisation du chloral.
Sécurité
Le chloral et son hydrate ont des propriétés biologiques identiques dans la mesure où l'hydrate se forme rapidement à partir du chloral en milieu aqueux. Ce composé est toxique à haute dose, avec des effets neurologiques et irritants sur la peau et les muqueuses ; les vapeurs ont une CL50 sur 4 heures de 440 mg·m-3[4].
Références
- Entrée « Chloral » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 5 mai 2018 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur http://monographs.iarc.fr, CIRC, (consulté le )
- (en) Reinhard Jira, Erwin Kopp, Blaine C. McKusick, Gerhard Röderer, Axel Bosch et Gerald Fleischmann, « Chloroacetaldehydes », Ullmann's Encyclopedia of Industrial Chemistry, 1, (DOI 10.1002/14356007.a06_527.pub2, consulté le ).
